鳗鲡(Anguilla japonica)是东亚地区重要的经济养殖鱼类。据FAO报道,其2015年东亚地区产量达266 731 t,产值高达14亿美元,其养殖在世界水产业中也占有重要地位[1]。鳗鲡属降海产卵的洄游性鱼类,其生活史复杂[2],虽然日本已实现了人工繁殖,但苗种培育成本高,所以目前养殖用苗种依然完全依赖天然捕捞。弄清生物学特征被认为是突破人工繁殖难题的基础。
鳗鲡的人工繁殖研究已有80多年的历史,人工繁育技术已经取得一定进展,但目前普遍存在的问题是:亲鱼性腺发育差、精子/卵细胞质量差、受精率和孵化率低、初期仔鱼开口摄食难和死亡率高等,因此选择发育良好的鳗鲡亲鱼是保证鳗鲡人工繁殖的重要因素。目前我国鳗鲡人工繁殖中所用的亲鱼一般为10—12月从江河入海口捕捞的下海鳗鲡,体质量为300~800 g[3-4]。
已有研究表明,血液中的雌二醇、卵黄蛋白原、碱性磷酸酶、无机离子和脂类等能够反映鱼类的性别及发育时期[5-7]。因此,鱼类血液的生化指标能为其人工繁殖提供重要的参考依据[8]。但降海鳗鲡血液生化指标与性别的关系未见报道。在已有研究报道基础上,本实验主要研究了鳗鲡雌雄鱼血清中具有代表性的14种生化成分和卵黄蛋白原含量,旨在找出雌雄特异性较高的指标,并建立雌雄鱼的判别函数。
1 材料与方法 1.1 实验材料及分组实验用鳗鲡为2015年在长江口(约31°55″N, 120°12″E)捕获的降海野生鳗鲡,根据体长体质量,初步将鳗鲡分为雌雄鱼各100尾,分别养殖于上海海洋大学洋山海洋生态系统野外观测研究站的水泥池中。随机选取健康雌雄鱼各5尾,其中雌鱼平均体质量为(758±0.22) g,雄鱼平均体质量为(245±0.09) g,做好标记,尾静脉采血后放回养殖池。通过注射人绒毛膜促性腺激素[hCG, 300 IU/(kg·周)]和鲤鱼脑垂体[carp pituitary extract, CPE, 20 mg/(kg·周)]进行人工促熟,结合人工繁殖实验最终验证其性别。
1.2 血清样品采集将鳗鲡雌、雄鱼用麻醉剂MS-222(200 mg/L)进行麻醉。用5 mL无菌注射器和2号针头于臀鳍下方尾静脉抽血2 mL,血样于4 ℃静置2 h后,离心15 min (4 ℃,2 000 r/min),取上清,置于-20 ℃保存,用于血清生化成分分析。
1.3 样品分析 1.3.1 血清生化指标检测共检测了14项生化指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、总胆红素(T-bil,重氮盐法)、总蛋白(TP)、白蛋白(ALB)、肌酐(CREA)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、葡萄糖(Glu,葡萄糖氧化法)、钙离子(Ca2+)、无机磷(P),其含量全部采用迈瑞200全自动生化仪进行检测。
1.3.2 卵黄蛋白原含量检测采用酶联免疫法检测血清中的卵黄蛋白原含量。ELISA试剂盒进行反应,采用双抗体夹心法测定标本中鱼卵黄蛋白原(VTG)水平。用纯化的鲑鱼卵黄蛋白原抗体包被微孔板, 制成固相抗体, 往包被单抗的微孔中依次加入卵黄蛋白原, 再与辣根过氧化物酶(HRP)标记的卵黄蛋白原抗体结合, 形成抗体-抗原-酶标抗体复合物, 过彻底洗涤后加底物四甲基联苯胺(TMB)显色。TMB在HRP酶的催化下转化成蓝色, 并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的卵黄蛋白原呈正相关。用Labsystems Multiskan MS 352型酶标仪在450 nm波长下测定吸光度(OD值), 通过标准曲线计算样品中鱼卵黄蛋白原浓度(Biosense Laboratories AS鱼类卵黄蛋白原酶联免疫分析试剂盒)。
1.4 数据处理实验数据采用Excel处理,以平均值±标准差(Mean ±SD)表示,统计分析采用SPSS STATISTICS 18.0软件进行单因子方差分析(One-Way ANOVA), 并使用Duncan氏进行多重比较,以P < 0.05表示差异显著。采用判别分析法建立鳗鲡性别判定函数,其中通过逐步选择法对14项血清生化指标建立判别函数,全模型法对雌雄鱼具有显著性差异的生化指标建立判别函数。
2 结果与分析 2.1 鳗鲡雌、雄鱼血清中生化指标比较 2.1.1 血糖及代谢产物类含量比较从表 1中可以看出,鳗鲡血清中葡萄糖(Glu)的含量在雌雄鱼间有显著差异(P < 0.05),且雌鱼含量明显高于雄鱼;血清中总胆红素(T-bil)、肌酐(CREA)的含量在雌雄鱼间并无明显差异。
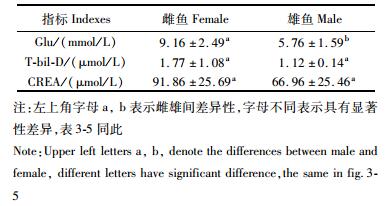
|
表 1 鳗鲡雌雄鱼血清中血糖及其代谢产物的含量比较 Tab.1 Comparison of the content of serum glucose and its metabolites of male and female Japanese eel |
由表 2可以看出,血清中,谷丙氨酸氨基转移酶(ALT, 谷丙转氨酶)、天门冬氨酸氨基转移酶(AST, 谷草转氨酶)、碱性磷酸酶(ALP)的含量在鳗鲡雌、雄鱼间均无显著差异(P>0.05)。

|
表 2 鳗鲡雌雄鱼血清中酶类含量比较 Tab.2 Comparison of the content of serum enzyme of male and female Japanese eel |
由表 3可以看出,鳗鲡雌、雄鱼血清中的总蛋白(TP)含量无明显差异(P>0.05),而雌鱼血清的白蛋白(ALB)含量显著高于雄鱼(P < 0.05)。

|
表 3 鳗鲡雌雄鱼血清中蛋白类含量比较 Tab.3 Comparison of the content of serum protein of male and female eel |
从表 4中可以看出,鳗鲡雄鱼血清中的甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)的含量显著高于雌鱼(P < 0.05),但高密度脂蛋白胆固醇(HDL-C)和总胆固醇(TC)的含量在雌、雄鱼间无明显差异(P>0.05)。
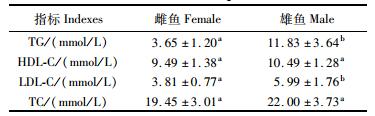
|
表 4 鳗鲡雌雄鱼血清中脂类含量比较 Tab.4 Comparison of content of serum lipid of male and female Japanese eel |
由表 5可以看出,鳗鲡雄鱼血清中钙离子(Ca2+)含量显著高于雌鱼(P < 0.05);而磷酸根离子(P)含量在雌雄鱼间并无显著差异(P>0.05)。

|
表 5 鳗鲡雌雄鱼血清中无机离子钙离子(Ca2+)和磷酸根离子(P)含量比较 Tab.5 Comparison of content of serum Inorganic ion calcium and Phosphate ion (P) of male and female Japanese eel |
图 1为鳗鲡雌、雄鱼血清中卵黄蛋白原含量比较。从图中可以看出,鳗鲡雌、雄鱼血清中卵黄蛋白原含量存在显著差异(P < 0.05),雌鱼的含量显著高于雄鱼。
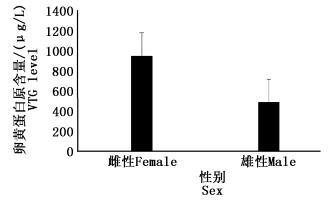
|
图 1 鳗鲡雌雄血清卵黄蛋白原
Fig. 1 Serum vitellogenin of male and female eel
|
根据2.1的实验结果,发现14项血液生化指标中,仅有5项生化指标具有雌雄显著性差异,其他9项指标在雌雄鱼之间无显著差异,所以需对这些生化指标采用逐步选择法进行筛选。本文采用向前选择的方式,利用F统计量决定对某一指标是选入还是剔除,以F>3.84作为选入的标准,以F < 2.71作为剔除的标准。共选出6项指标,根据Wilks ’ Lambda值,对性别判定能力的贡献为:TC>Glu>CREA>Ca>AST>P,与其含量是否在雌雄鱼间有显著差异无关,结果见表 6。
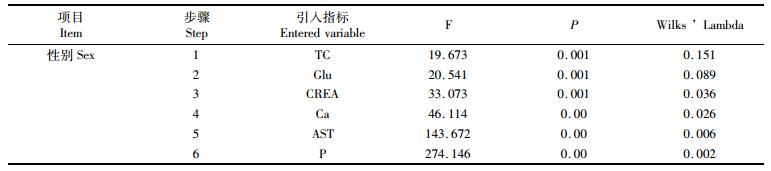
|
表 6 逐步判别筛选结果 Tab.6 Result of stepwise discriminant analysis |
根据筛选的6个生化指标TC、Glu、CREA、Ca、AST、P建立了鳗鲡雌雄鱼的性别判别函数:
雌鱼:YFemale=8.132X1+158.876X2+738.534X3+421.93X4+51.301X5-3316.019X6-4701.273
雄鱼:YMale=11.844X1+237.771X2+1063.886X3+611.186X4+73.818X5-4900.373X6-9494.139
X1=AST; X2=P; X3=Glu;X4=TC; X5=CREA; X6=Ca
将每尾待测鳗鲡的以上血清指标分别代入这两个函数公式,计算函数值Y,比较YFemale和YMale值,函数值较大的为该鳗鲡的性别。
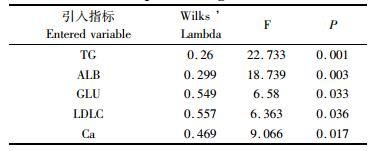
2.3.2 全模型法建立鳗鲡性别判定函数根据2.1的实验结果,发现TG, ALB, GLU, LDL-C, Ca这5项指标的含量在鳗鲡雌雄鱼间有显著差异。根据全模型法,将5项指标全部进入公式,而不考虑其贡献值大小。结果见表 7。
|
表 7 全模型法指标参数 Tab.7 Index parameters of entering independents together |
采用全模型法建立了以这5项指标为基础的性别判别函数:
雌鱼:YFemale=-5.928X1+28.624X2+9.391X3+3.054X4+205.891X5-532.830
雄鱼:YMale=-3.747X1+26.165X2+8.584X3+1.006X4+191.948X5-458.552
X1=TG; X2=ALB; X3=Glu; X4=LDLC; X5=Ca
将每尾待测鳗鲡的以上血清指标分别代入这两个函数公式,计算函数值Y,比较YFemale和YMale值,函数值较大的为该鳗鲡的性别。
3 讨论 3.1 血清生化指标在研究鱼类生理状态的应用血液生化指标可以作为诊断生物体所受压力和生理状况的有效手段,其含量受很多内因和外因的影响,比如温度、盐度、年龄、性别、成熟度等,为揭示鱼类生活环境的污染状况、年龄、性别、季节性和繁殖状况有一定的指示作用[9-11]。
3.1.1 血糖及代谢产物在鱼类生理状况评价中的应用鱼类雌雄鱼间的血糖含量水平并没有一致的规律。如短吻鲟(Acipenser brevirostrum)雌鱼血清中葡萄糖含量显著高于雄性[12],闪光鲟(Acipenser stellatus)雌雄鱼的血糖含量并无差异[13],欧鳇(Huso huso)雄鱼血清中的葡萄糖含量显著高于雌性[14]。本文中鳗鲡雌鱼的血糖含量明显高于雄鱼。血糖含量与鱼类的活动性有关,活动性强,血糖水平高。如鳗鲡血清中葡萄糖的含量稍低于欧洲鳗鲡(Anguilla anguilla)[15],这可能是鳗鲡降海时基本不摄食,导致血糖含量下降。
此外,血糖含量的差异应该与鱼类的代谢水平和渗透调节机制、代谢机制密切相关[16],如HRUBEC等[17]研究发现虹鳟(Oncorhynchus mykiss)雌鱼卵巢对葡萄糖的利用量比雄性任何一个组织都要高。本文中鳗鲡雌性血糖含量显著高于雄性也证实了这一点。降海洄游的鳗鲡,雌鱼发育早,体型大,需要维持基本生命活动的能量需求大,导致雌性血清中葡萄糖含量显著高于雄性。
3.1.2 酶类含量在不同性别鱼类间的差异分析谷丙转氨酶和谷草转氨酶是动物线粒体的重要氨基酸转氨酶,在有机体蛋白质代谢中起重要作用。酶活性与鱼类种属关系密切,与欧洲鳗鲡[15]相比,鳗鲡的谷草转氨酶,谷丙转氨酶含量稍低,但酶活性差异并不大;而与长丝鲈鱼(Osphronemas goramy)[18]、加州鲈鱼(Micropterus salmonides) [19]、黑鲷(Sparus macrocephlus) [20]等相比,鳗鲡的谷草转氨酶和谷丙转氨酶的酶活性差异较大。
性别影响鱼的酶活性,一般是雌鱼高于雄鱼,且与发育成熟度有关。如闪光鲟的AST,CK的酶活性雌性远远高于雄性[21]。鲑鱼(Oncorhynchus)和海鳟(Salmo trutta)在当年的4月份雌雄鱼的ALP含量无差异,到11月份时,雌鱼的ALP含量远高于雄鱼[6]。ALP活性的激活或失活受碳水化合物和其他大分子元素如蛋白质等的调控[22]。本文中鳗鲡雌雄鱼的ALP含量并无明显差异,可能是由于鳗鲡刚降海时,性腺未发育成熟,因此ALP含量并不高,且雌雄鱼间无差异。
3.1.3 蛋白类含量在不同性别鱼类间的差异分析不同种鱼血清中蛋白类物质含量基本相同,降海鳗鲡的总蛋白,白蛋白含量等与欧洲鳗鲡[15]相差不大。白蛋白是血浆中重要的类固醇激素的转运载体,其含量与鱼的种类、性别、性腺发育程度有一定关系。同种鱼雌雄鱼血清中蛋白类物质含量与性腺发育程度有关,如繁殖前丁鲷(Tinca tinca)雌鱼的总蛋白含量高于雄鱼,繁殖后雄鱼的总蛋白含量显著高于雌鱼[23]。闪光鲟雄鱼的白蛋白含量显著高于雌鱼[13]。即使是同一种鱼,不同研究者也有不同研究结果,如GHARAEI等研究欧鳇(Huso huso)发现ALB、TPO、CHO、TGL的含量在雌雄鱼间没差异[24],而ASADI等[14]研究欧鳇鳇属鲟发现,雄鱼的ALB高于雌鱼,这可能与研究的鲟鱼年龄、采样时间、地域差异有关。本文中鳗鲡雌鱼的白蛋白含量高于雄鱼,可能是由于雌鱼发育较早,需合成相对较多的类固醇激素,因而需要更多的白蛋白载体,将类固醇激素通过血液循环输送给性腺有关。
3.1.4 脂类含量在不同性别鱼类间的差异分析本文中鳗鲡血清中脂类含量雌鱼低于雄鱼,这意味着鳗鲡雌雄鱼性腺的发育程度在降海时是不一致的。在降海时,鳗鲡雌鱼的卵巢开始发育,卵细胞处于卵黄发育初期,胆固醇由低密度脂蛋白作为载体运输到卵巢,因此卵巢中集聚大量的胆固醇和低密度脂蛋白,导致血清中脂类物质浓度降低;野生日本鳗鲡在10—12月下海时,雄鱼的精母细胞还处于未成形阶段[4],雄性较雌性鳗鲡发育稍慢,脂类主要集中在血清中,因此,雄鱼血清中脂类物质浓度较高,施氏鲟、西伯利亚鲟雌雄鱼的血清中脂类物质含量呈现出相似规律[7, 25]。
3.1.5 无机离子类含量在鱼类性别以及性腺发育状况的差异分析血清中无机离子类的含量与鱼的种类、性别有关,如闪光鲟雌鱼的钠离子、磷酸根离子含量显著高于雄鱼[13],欧鳇雄鱼的磷酸根离子显著高于雌鱼[14],而本文中鳗鲡雄鱼的钙离子浓度显著高于雌鱼,磷酸根离子含量雌雄鱼间无差异。鱼类摄食过程中的有机磷经消化酶转化成无机磷,经消化道壁中的血管进入血液,血液中的磷用于维持身体组织合成、内环境的稳定,在脂类代谢过程中,以磷脂的形式参与脂类物质和脂溶性维生素的代谢过程,促进营养物质的吸收[26]。
卵细胞的发育有赖于卵黄蛋白原的合成[27],而钙离子可以促进卵细胞的发育和蛋白的吸收,因此钙离子的含量与卵黄蛋白原含量有一定关系,如大阪鲫(Carassius auratus cuvieri Temminck et Schlegel)血清中的钙离子浓度升高,伴随着卵黄蛋白原浓度的相应升高[28]。本文中,鳗鲡雌鱼的卵黄蛋白原显著高于雄性,研究表明成熟雌鱼在卵黄积累阶段,血浆中的Ca2+含量明显增加,首先肝脏合成的钙结合蛋白被血液输送到卵巢后生成卵黄[29]。降海鳗鲡处于性腺未成熟阶段,尤其雌性鳗鲡处于卵黄发育初期,此时钙以钙结合蛋白形式存在,导致血清中游离的钙离子含量相对较低,而鳗鲡雄鱼处于精细胞未成形阶段,钙离子聚集在血清中,所以含量相对较高。
3.2 不同性别鱼类的卵黄蛋白原含量分析鱼类的卵黄蛋白原是在雌二醇的作用下由肝细胞合成,释放到血液中的一种脂蛋白。卵黄蛋白原不仅能够转运金属离子,还能够转运甲状腺素、维生素A、核黄素和类胡萝卜素到卵母细胞,促进卵母细胞的生长和分化,因此其含量能指示卵巢的发育状况。如HEPPELL和SULLIVAN利用卵黄蛋白原的含量,判定小鳞喙鲈(Mycteroperca microlepis)雌鱼的成熟度[30]。GUZMA等发现塞内加尔鳎(Solea senegalensis Kaup)雌鱼的卵黄蛋白原含量在产卵前达到峰值[31]。
卵黄蛋白原含量在雌鱼中含量高,其含量随着性腺指数增加而增加,雄鱼的卵黄蛋白原含量低,因此其含量可作为性别鉴定和雌性发育阶段的灵敏指示器[32]。如根据卵黄蛋白原的含量不仅能鉴定出未成熟的斑狼鱼雄鱼(Anarhichas minor),而且能够检测成熟斑狼鱼雌鱼卵细胞的发育阶段[33]。CEAPA等[32]发现闪光鲟雌雄鱼的卵黄蛋白原含量有显著差异;POTTINGER等[6]通过测定卵黄蛋白原的浓度鉴定鲑鱼和海鳟鱼性别,发现雌鱼的卵黄蛋白原含量超过800 μg,而雄鱼的低于10 μg。KOHN等[34]利用卵黄蛋白原的含量鉴定成熟尖颌多锯鮨(Polyprion oxygeneios)性别,准确率为92%。
因此,性成熟的雌雄鱼血清中卵黄蛋白原的含量差异悬殊,在性腺发育成熟的雌鱼体内含量较高,本文中鳗鲡雌鱼的卵黄蛋白原含量显著高于雄性也证实了这一点。
3.3 判别分析法建立函数在鱼类性别判定中的应用通过建立函数来判定鱼类性别目前有一定的应用,如采用逐步判别分析,对西伯利亚鲟[7]和施氏鲟鱼[25](Acipenser schrenckii)的24项生化指标进行筛选,分别建立2个雌雄判定函数公式,其准确率分别为84%和82.35%。全模型法在鱼类判别中很少有报道,仅在灵长类猕猴(Macaca mulutta)中有性别鉴定的报道,其根据掌骨和蹠骨长度,建立的雌雄判定函数,准确率为91.7%[35]。本文对检测的14项鳗鲡血清生化指标,采用逐步选择法和全模型法分别建立了两个鳗鲡性别判定函数,将用于降海鳗鲡早期性别鉴定。
| [1] | FAO.Fishery and aquaculture statistics[M].FAO Yearbook Annuaire Anuarin, 2016. |
| [2] | TANAKA H, KAGAWA H, OHTA H. Production of leptocephali of Japanese eel (Anguilla japonica) in captivity[J]. Aquaculture, 2001, 201(1/2): 51–60. |
| [3] |
黄大明, 陈世群. 鳗鲡的生活史和人工育苗技术探讨[J].
生物工程进展, 1997, 17(2): 3–12.
HUANG D M, CHEN S Q. Exploring on the life cycle and artificial breeding of eel (Anguilla)[J]. Progress in Biotechnology, 1997, 17(2): 3–12. |
| [4] |
乔振国. 日本鳗鲡人工繁殖技术研究最新进展[J].
海洋渔业, 2007, 29(4): 360–364.
QIAO Z G. The latest progress on the technical study of the artificial propagation of Anguilla japonica Temminck & Schlegel[J]. Marine Fishery, 2007, 29(4): 360–364. |
| [5] |
蒋天宝, 刘利平, 高晓阳, 等. 鲤脑垂体和HCG诱导雌性日本鳗鲡性腺成熟过程中血清生化成分的变化[J].
水产学报, 2012, 36(6): 893–899.
JIANG T B, LIU L P, GAO X Y, et al. The changes of serum biochemical components during carp pituitary extract and HCG induced maturation of the female Japanese eel (Anguilla japonica)[J]. Journal of Fisheries of China, 2012, 36(6): 893–899. |
| [6] | POTTING T G, PULMAN K G T, CARRICK T R, et al. Evaluation of biochemical methods for the non-destructive identification of sex in upstream migrating salmon and sea trout[J]. Journal of Fish Biology, 2005, 67(6): 1514–1533. DOI:10.1111/jfb.2005.67.issue-6 |
| [7] |
张涛, 章龙珍, 赵峰, 等. 基于血液生化指标判别分析西伯利亚鲟性别及卵巢发育时期[J].
中国水产科学, 2007, 14(2): 236–243.
ZHANG T, ZHANG L Z, ZHAO F, et al. Determination of different sexes and ovarian development stages in cultured Acipenser baerii based on blood biochemical indices[J]. Journal of Fishery Sciences of China, 2007, 14(2): 236–243. |
| [8] | FILHO D W, EBLE G J, KASSNER G, et al. Comparative hematology in marine fish[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1992, 102(2): 311–321. DOI:10.1016/0300-9629(92)90141-C |
| [9] | PRADHAN S C, PATRA A K, SARKAR B, et al. Seasonal changes in hematological parameters of Catla catla (Hamilton 1822)[J]. Comparative Clinical Pathology, 2012, 21(6): 1473–1481. DOI:10.1007/s00580-011-1316-2 |
| [10] | GABRIEL U U, EZERI G, OPABUNMI O O. Influence of sex, source, health status and acclimation on the haematology of Clarias gariepinus (Burch, 1822)[J]. African Journal of Biotechnology, 2004, 3(9): 463–467. DOI:10.5897/AJB |
| [11] | BANIA A, TABARSA M, FALAHATKAR B, et al. Effects of different photoperiods on growth, stress and haematological parameters in juvenile great sturgeon Huso huso[J]. Aquaculture Research, 2009, 40(16): 1899–1907. DOI:10.1111/are.2009.40.issue-16 |
| [12] | MATSCHE M A, ROSEMARY K M, BRUNDAGE Ⅲ H M, et al. Hematology and plasma chemistry of wild shortnose sturgeon Acipenser brevirostrum from Delaware River, USA[J]. Journal of Applied Ichthyology, 2013, 29(1): 6–14. DOI:10.1111/jai.2012.29.issue-1 |
| [13] | SHAHSAVANI D, KAZERANI H R, KAVEH S, et al. Determination of some normal serum parameters in starry sturgeon (Acipenser stellatus Pallas, 1771) during spring season[J]. Comparative Clinical Pathology, 2010, 19(1): 57–61. DOI:10.1007/s00580-009-0899-3 |
| [14] | ASADI F, HALAJIAN A, POURKABIR M, et al. Serum biochemical parameters of Huso huso[J]. Comparative Clinical Pathology, 2006, 15(4): 245–248. DOI:10.1007/s00580-006-0632-4 |
| [15] |
周玉, 郭文场, 杨振国, 等. 欧洲鳗鲡血液某些生物化学指标的测定[J].
动物学杂志, 2002, 37(1): 50–52.
ZHOU Y, GUO W Y, YANG Z G, et al. Determination of some hematological and biochemical values of European eel, Anguilla anguilla[J]. Chinese Journal of Zoology, 2002, 37(1): 50–52. |
| [16] | MAYER S. A review of the scientific justification for maintaining cetaceans in captivity[R]. A report for the whale and dolphin conservation society, Bath (UK):WSCS, 1988. |
| [17] | HRUBEC T C, SMITH S A, ROBERTSON J L. Age-related changes in hematology and plasma chemistry values of hybrid striped bass (Morone chrysops × Morone saxatilis)[J]. Veterinary Clinical Pathology, 2001, 30(1): 8–15. DOI:10.1111/vcp.2001.30.issue-1 |
| [18] |
白东清, 魏东, 马树敏, 等. 长丝鲈血液部分生理生化指标测定[J].
安徽农业科学, 2010, 38(2): 755–757.
BAI D Q, WEI D, MA S M, et al. Determination of some blood physiological and biochemical parameters of Osphronemas goramy J[J]. Journal of Anhui Agricultural Sciences, 2010, 38(2): 755–757. |
| [19] |
余红卫, 薛良义. 加州鲈血液生理生化指标的测定[J].
水利渔业, 2004, 24(4): 41–42.
YU H W, XUE L Y. Measurement of physiological and biochemical parameters of Micropterus salmoides[J]. Reservoir Fisheries, 2004, 24(4): 41–42. |
| [20] |
刘颖, 乔伟亮, 魏东, 等. 黑鲷血清生化指标研究[J].
现代农业科技, 2010: 307–312.
DOI:10.3969/j.issn.1007-5739.2010.16.193 LIU Y, QIAO W L, WEI D, et al. Study on serum biochemical indexes of Sparus inacrocephalus[J]. Modern Agricultural Sciences and Technology, 2010: 307–312. DOI:10.3969/j.issn.1007-5739.2010.16.193 |
| [21] | SHAHSAVANI D, MOHRI M, KANANI H G. Determination of normal values of some blood serum enzymes in Acipenser stellatus Pallas[J]. Fish Physiology and Biochemistry, 2010, 36(1): 39–43. DOI:10.1007/s10695-008-9277-3 |
| [22] | DIANA J S. An experimental analysis of the metabolic rate and food utilization of northern pike[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1982, 71(3): 395–399. DOI:10.1016/0300-9629(82)90424-8 |
| [23] | SVOBODA M, KOUŘIL J, HAMÁČKOVÁ J, et al. Biochemical profile of blood plasma of tench (Tinca tinca L.) during pre-and postspawning period[J]. Acta Veterinaria Brno, 2001, 70(3): 259–268. DOI:10.2754/avb200170030259 |
| [24] | GHARAEI A, AKRAMI R, GHAFFARI M, et al. Determining age-and sex-related changes in serum biochemical and electrolytes profile of beluga (Huso huso)[J]. Comparative Clinical Pathology, 2013, 22(5): 923–927. DOI:10.1007/s00580-012-1501-y |
| [25] |
章龙珍, 张涛, 庄平, 等. 人工养殖施氏鲟性别鉴定和卵巢不同发育期血液生化指标差异与判别分析[C]//中国海洋湖沼学会鱼类学分会、中国动物学会鱼类学分会2012年学术研讨会论文摘要汇编. 兰州: 中国海洋湖沼学会, 中国动物学会, 2012.
ZHANG L Z, ZHANG T, ZHUANG P, et al. Sex identification of artificial breeding amur sturgeon and the difference of blood biochemical index in different developmental stages of ovarian and discriminant analysis[C]//Abstract Symposium on Assembly According to Chinese Society for Oceanology and Limnolog Fish Brunch and Chinese Zoological Society Fish Brunch in 2012. Lanzhou:China Institute of Oceanology and Limnology, Chinese Zoological Society, 2012. |
| [26] |
肖顺应. 饲料磷源、磷水平及酸化剂对草鱼生长、生理的影响[D]. 苏州: 苏州大学, 2011.
XIAO S Y. Effects of feed phosphorus source, phosphorus levels and acidifier on the growth and physiology of grass carp (Ctenopharyngodon idella)[D]. Suzhou:Soochow University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10285-1012285672.htm |
| [27] | SUN B, PANKHURST N W. Correlation between oocyte development and plasma concentrations of steroids and vitellogenin in greenback flounder Rhombosolea tapirina[J]. Fish Physiology and Biochemistry, 2003, 28(1/4): 367–368. |
| [28] |
李朝军, 刘荣臻, 王浩, 等. 大阪鲫卵黄蛋白原和钙离子关系的初步研究[J].
水产学报, 1993, 17(4): 297–303.
LI C J, LIU R Z, WANG H, et al. The initial study on the relationship between vitellogenin and calcium ion in Carassius auratus cuvieri[J]. Journal of Fisheries of China, 1993, 17(4): 297–303. |
| [29] |
林浩然. 鱼类生理学[M]. 广州: 中山大学出版社, 2011.
LIN H R. Fish Physiology[M]. Guangzhou: Sun Yat-Sen University Press, 2011. |
| [30] | HEPPELL S A, SULLIVAN C V. Gag (Mycteroperca microlepis) vitellogenin:purification, characterization and use for enzyme-linked immunosorbent assay (ELISA) of female maturity in three species of grouper[J]. Fish Physiology and Biochemistry, 1999, 20(4): 361–374. DOI:10.1023/A:1007730816797 |
| [31] | GUZMÁN J M, NORBERG B, RAMOS J, et al. Vitellogenin, steroid plasma levels and spawning performance of cultured female Senegalese sole (Solea senegalensis)[J]. General and Comparative Endocrinology, 2008, 156(2): 285–297. DOI:10.1016/j.ygcen.2008.02.002 |
| [32] | CEAPA C, WILLIOT P, LE MENN F, et al. Plasma sex steroids and vitellogenin levels in stellate sturgeon (Acipenser stellatus Pallas) during spawning migration in the Danube River[J]. Journal of Applied Ichthyology, 2002, 18(4/6): 391–396. |
| [33] | MALTAIS D, DUPONT-CYR B A, ROY R L, et al. Purification and partial characterization of vitellogenin from spotted wolffish (Anarhichas minor) and development of an enzyme-linked immunosorbent assay for the determination of gender and sexual maturity[J]. Fish Physiology and Biochemistry, 2014, 40(1): 279–294. DOI:10.1007/s10695-013-9843-1 |
| [34] | KOHN Y Y, LOKMAN P M, KILIMNIK A, et al. Sex identification in captive hapuku (Polyprion oxygeneios) using ultrasound imagery and plasma levels of vitellogenin and sex steroids[J]. Aquaculture, 2013, 384. |
| [35] |
赵晓进, 赵俊杰, 王耿, 等. 太行山猕猴掌骨和蹠骨长度的性别判别[J].
人类学学报, 2009, 28(1): 88–94.
ZHAO X J, ZHAO J J, WANG G, et al. Sex assessment in the lengths of metacarpals and metatarsals of Macaca mulutta living in the Taihang Mountains[J]. Acta Anthropologica Sinica, 2009, 28(1): 88–94. |
 2017,
Vol. 26
2017,
Vol. 26


