2. 福建省海洋生物增养殖与高值化利用重点实验室, 福建 厦门 361013;
3. 福建省海洋生物资源开发利用协同创新中心, 福建 厦门 361013
牡蛎是我国重要的海水经济贝类之一,福建沿海主要养殖品种有太平洋牡蛎(Crassostrea gigas)、僧帽牡蛎(Ostrea cucullata)、近江牡蛎(Crassostrea rivularis)等。牡蛎以其味道鲜美,对人体有营养和多种保健功能,备受消费者青睐。牡蛎为滤食性生物,生长位置相对固定,相关研究表明牡蛎体内有毒有害物质含量与周围海域的环境污染程度密切相关,它被当成反映海域污染状况的指示生物[1-3]。近年来随沿海工农业的发展,近海污染也随之加剧,牡蛎食用安全性日益受到人们的关注。国内有一些文章对不同海域牡蛎中污染物含量进行报道,并与相关质量标准的限量值进行比较,评价牡蛎食用安全性[4-6],这些文章主要是针对某项或某类指标进行评价,仅反映牡蛎部分食用健康风险状况。本文通过监测2015年福建闽南沿海养殖牡蛎中所有具有限量要求的有毒有害污染物含量,比较全面地评估牡蛎的食用健康风险,并通过比较分析各污染物的健康风险参数,得出当前闽南养殖牡蛎食用健康主要风险因子,对正确引导人们的食品安全意识、科学防范健康风险具有指导作用。
1 材料与方法 1.1 样品的来源与测定2015年5月至9月,在福建闽南沿海主要牡蛎生产区,按图 1所示的22个站位采集成体牡蛎,现场用海水冲洗后,带壳活体运送到实验室。将其软组织剥离,均质后-20 ℃保存。根据各海域养殖规模不同,共采集107个样品,每个样品50只以上,品种包括:太平洋牡蛎(Crassostrea gigas)、僧帽牡蛎(Ostrea cucullata)、近江牡蛎(Crassostrea rivularis)。泉州海域设立7个站位(1~7)、厦门海域设立2个站位(8~9)、漳州海域设立13个站位(10~22)。漳州海域的16号和17号站位同时采集了僧帽牡蛎和太平洋牡蛎,按品种分别检测。样品采集、运输按照《海洋监测规范》[7]进行。

|
图 1 采样站位示意图
Fig. 1 Sampling sites map
|
当前,国内与牡蛎相关的质量标准主要有:(1)NY 5073—2006《无公害食品水产品中有毒有害物质限量》[8],限量污染物包括:麻痹性贝类毒素、腹泻性贝类毒素、无机砷、甲基汞、铅、镉、铜、石油烃和多氯联苯(PCBs,以PCB28、PCB52、PCB101、PCB118、PCB138、PCB153和PCB180总和计);(2)GB 2763—2014《食品安全国家标准食品中农药最大残留限量》[9],限量农药包括:六六六(HCB,以α-六六六、β-六六六、γ-六六六和δ-六六六之和计)和滴滴涕(DDT,以p, p′-滴滴涕、o, p′-滴滴涕、p, p′-滴滴伊和p, p′-滴滴滴之和计);(3)农办质[2015]4号《农业部办公厅关于印发茄果类蔬菜等58类无公害农产品检测目录的通知》[10],限量污染物包括:甲基汞和无机砷。综合上述三个标准,确定本次监测目标污染物为:麻痹性贝类毒素、腹泻性贝类毒素、无机砷、甲基汞、铅、镉、铜、石油烃、多氯联苯(以PCB28、PCB52、PCB101、PCB118、PCB138、PCB153和PCB180总和计)、六六六(α-六六六、β-六六六、γ-六六六和δ-六六六之和计)、滴滴涕(以p, p′-滴滴涕、o, p′-滴滴涕、p, p′-滴滴伊和p, p′-滴滴滴之和计)。
国际上研究水产品石油烃污染对人体健康的影响,主要考察多环芳烃(PAHs)的致癌作用[11],本文对石油烃食用健康风险评估,也同样针对多环芳烃展开;麻痹性贝类毒素和腹泻性贝类毒素在本次所采集的样品中检测都呈阴性,因此这两个因子不列入本次评估范围,相关污染物检测方法见表 1。
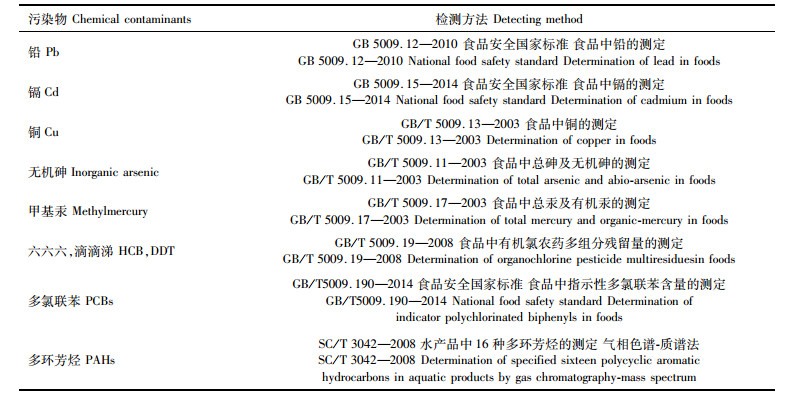
|
表 1 牡蛎中污染物检测方法 Tab.1 The detecting method of chemical contaminants in oyster |
食品中化学污染物对人体健康的风险评估主要包括:非致癌健康风险评估,评价指标为暴露边界值(Margin of Exposure,MOE)[12],按(1)式进行计算;致癌健康风险评估,评价指标为致癌风险指数(Carcinogenic Risk Index,CRI)[13],按(2)、(3)式进行计算。
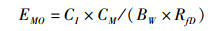 (1)
(1)
式中:EMO为暴露边界值;RfD(reference doses,RfD)为污染物的参考剂量[mg/(kg·day)],见表 2;CM为牡蛎日均消费量,采用水产品消费量大的厦门市,2014年人均年消费虾、贝、蟹类量为6.15 kg,折算每日人均消费量为0.016 8 kg;CI为牡蛎中污染物含量(mg/kg)、BW为平均人体体重,成年人取60 kg。
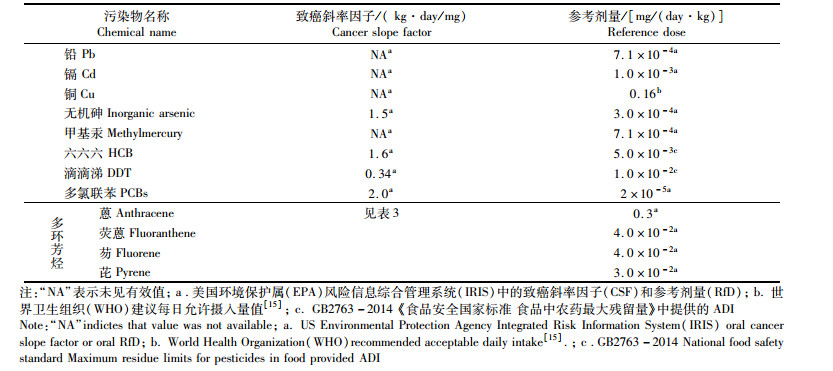
|
表 2 各污染物的致癌斜率因子(CSF)和参考剂量(RfD) Tab.2 Cancer slope factors (CSF) and reference doses (RfD) of chemical contaminants |
致癌风险指数先按(2)式计算每种致癌物的致癌风险指数,再按(3)式将所有致癌物的致癌风险指数加和得出总致癌风险指数。
 (2)
(2)
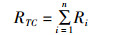 (3)
(3)
式中:Ri 为各污染物的致癌风险指数、RTC为牡蛎总致癌风险指数、FCS(Cancer Slope Factor,CFS)为致癌斜率因子(kg·day/mg),各污染物致癌斜率因子见表 2、表 3,其中多环芳烃各组分根据美国环境保护属(EPA)风险信息综合管理系统(IRIS, Integrated Risk Information System)提供的数据,以苯并(a)芘的致癌斜率因子FCS =7.30 (kg·day/mg)为基数,其他的多环芳烃组分根据等效因子进行换算[14]。暴露边界值MOE≤1认为该污染物在食品中非致癌健康风险可接受;对于致癌风险指数,美国环保局(EPA)提出了可接受风险的概念,根据不同地区的环境条件,科技和经济发展水平等,管理者和研究者提出不同的可接受风险,一般以总致癌风险指数RTC≤10-4认为致癌风险可接受[12-13]。

|
表 3 多环芳烃各组分的致癌斜率因子(CSF) Tab.3 Cancer solpe facetor (CSF) of the PAHs components |
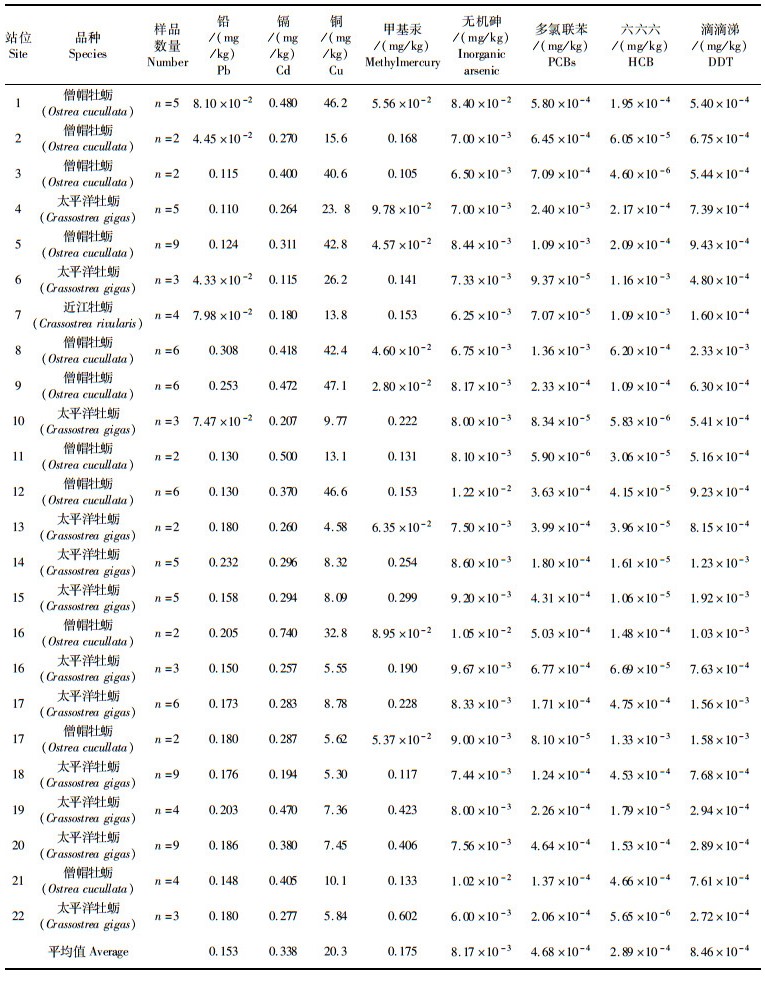
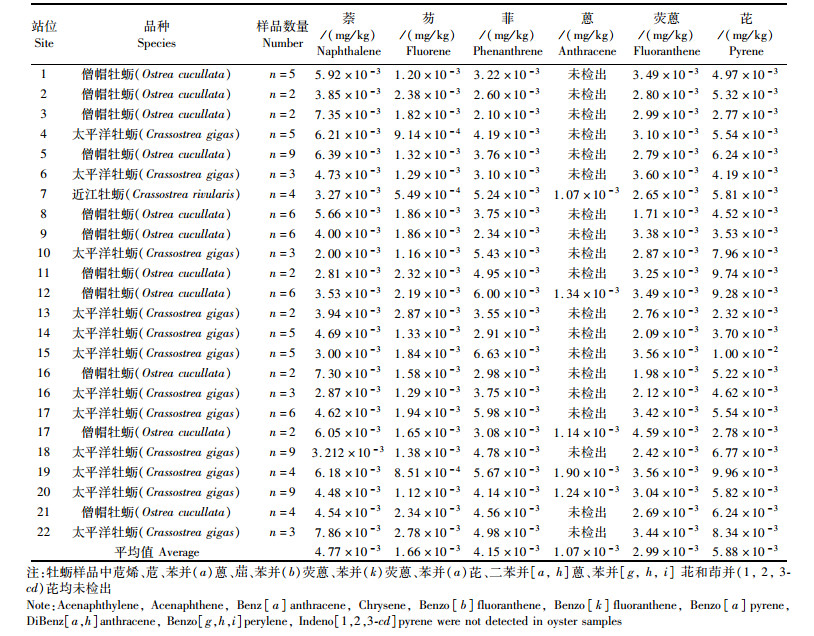
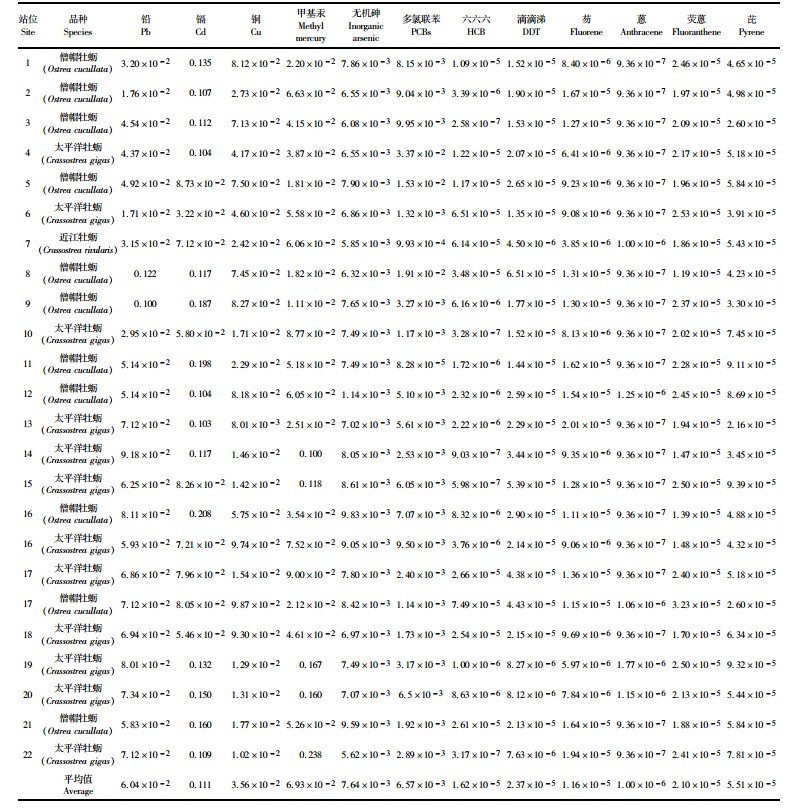
福建闽南沿海22个站位所采集的牡蛎样品检测结果见表 4和表 5。根据表 2各污染物的参考剂量,按(1)式计算暴露边界值(MOE),结果见表 6。铅、镉、铜、无机砷、甲基汞、六六六、DDT、多氯联苯和多环芳烃的4种组分的暴露边界值在1.00×10-6~0.111之间,均小于1,以此推测闽南沿海牡蛎各污染物的非致癌健康风险在可接受范围内。牡蛎样品中多环芳烃组分蒽大于60%的样品检测结果小于检测限,根据世界卫生组织(WHO)的推荐,在风险评估计算时,对未检出的样品应分别采用检测限和0值进行估算[16],先采用检测限进行计算,MOE值为1.00×10-6,远小于限量值1,因此不再讨论采用0值的计算评估结果。
|
表 4 牡蛎中污染物含量平均值 Tab.4 The average concentration of chemical contaminants in oyster |
|
表 5 牡蛎中多环芳烃各组分含量平均值 Tab.5 The average concentration of the PAHs components in oyster |
|
表 6 牡蛎中各污染物暴露边界值(MOE) Tab.6 The MOE of chemical contaminants in oyster |
通过对不同污染物MOE平均值比较(图 2),牡蛎体内污染物非致癌健康风险主要因子为:铅、镉、铜、甲基汞、无机砷和多氯联苯等6个因子,MOE平均值在6.57×10-3~0.111。其他几个因子的MOE平均值在1.00×10-6~5.51×10-5之间,远低于上述6个因子。总体上重金属的MOE平均值远高于持久性有机污染物,重金属MOE平均值在7.64×10-3~0.111之间、持久性有机污染物MOE平均值在1.00×10-6~6.57×10-3之间。牡蛎体内污染物非致癌健康风险主要因子中镉、甲基汞、铅的MOE值相对较高,平均值为0.111、6.93×10-2、6.04×10-2,应将这三种重金属作为食用健康风险监控的重点。

|
图 2 福建闽南沿海牡蛎中各污染物MOE平均值
Fig. 2 The average MOE of chemical contaminants in oyster along the southern coast of Fujian province in China
1.铅; 2.镉; 3.铜; 4.甲基汞; 5.无机砷; 6.多氯联苯; 7.六六六; 8.滴滴涕; 9.芴; 10.蒽; 11.荧蒽; 12.芘 1. Pb; 2. Cd; 3. Cu; 4. Methylmercury; 5. Inorganic arsenic; 6. PCBs; 7. HCB; 8. DDT; 9. Fluorene; 10. Anthracene; 11. Fluoranthene; 12. Pyrene |
牡蛎对重金属具有较强的累积作用。根据监测结果,几种重金属平均累积量大小依次为:铜>镉>甲基汞>铅>无机砷。牡蛎体内重金属主要来源于海水中悬浮颗粒和水体中溶解的重金属[17],其在牡蛎中的积累量,取决于金属进出牡蛎的相对速率[18]。牡蛎对铜富集能力强,排出速度慢,体内铜含量与水体中铜存在简单线性关系[19]。各站位采集牡蛎体内铜的平均含量在4.58~47.1 mg/kg之间,比其他几种重金属元素高1~2个数量级。由于铜是生命必须元素,有较高的允许摄入量,MOE平均值为3.56×10-2,与其他几种重金属相比,牡蛎体内铜的非致癌健康风险并不突出。牡蛎对水体中镉的吸收快,排出半衰期长,表现为净积累[18],因此在牡蛎组织中镉的含量较高。虽然镉参考剂量高于铅、无机砷、甲基汞,但其MOE平均值为0.111,明显高于其他污染物。牡蛎对水体中的汞和铅累积速度快,排出速度也快[20],因此自然环境中牡蛎体内的汞和铅浓度不高。监测结果表明,闽南沿海牡蛎中甲基汞和铅的浓度水平接近,由于这两种污染物的参考剂量相同,在牡蛎体内的非致癌健康风险也相近。海水中无机砷被浮游植物吸收后,转化成有机形态,通过滤食进入牡蛎体内[4]。无机砷在牡蛎体内存在平衡浓度,达到平衡值后体内无机砷和总砷都不再上升,这可能与牡蛎体内的金属硫蛋白(Metallothinein,MT)有关[21],牡蛎对无极砷的富集能力低于其他几种重金属,其非致癌健康风险也相应较低。
牡蛎对多氯联苯、六六六、滴滴涕、多环芳烃等持久性有机污染物的吸收和累积,一般认为是摄食了含有机污染物的藻类和有机碎屑,经酶转化、吸收,进一步在体内浓缩[22]。同时,有机污染物还可以通过海水进入生物体内,在血脂和其他类脂与海水之间建立某种化学平衡[23]。在所监测的几种持久性有机物中,多氯联苯MOE值比六六六、滴滴涕和多环芳烃等高2~3个数量级。其MOE值高并非牡蛎体内多氯联苯含量高,而是多氯联苯的参考剂量远低于其他几种持久性有机污染物。因此,多氯联苯应做为持久性有机污染物监控的重点。
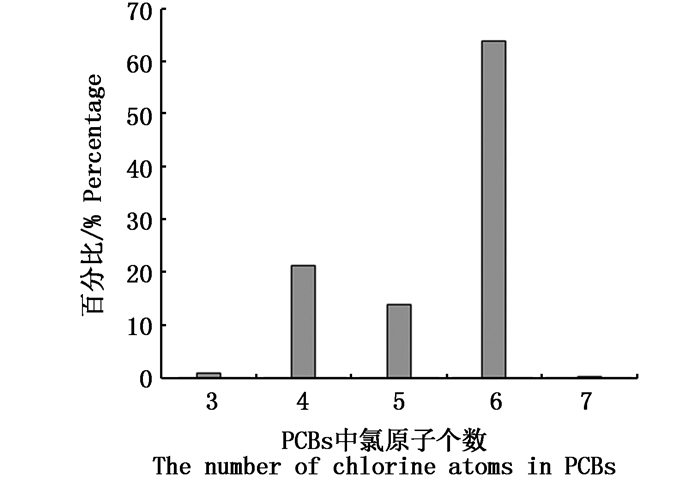
多氯联苯为人工合成有机物,其耐热性强、电绝缘性好,常作为热载体和绝缘液在工业中使用,环境中多氯联苯污染主要来源于使用多氯联苯工厂排出的废弃物。牡蛎样品体内PCBs各同系物的组成分布情况如图 3所示,其中六氯联苯占绝对优势,占总PCBs百分比为63.8%,其次是四氯和五氯联苯。三氯和七氯联苯含量很低,合计占1.09%。在牡蛎体内低氯取代物可代谢分解成二甲基砜等物质而快速分解[24]。相对于低氯取代物,四氯、五氯和六氯等中高氯原子个数的PCBs亲脂性高,更易富集于生物体内[25]。海洋环境中的PCBs在细菌作用下还原脱氯,高氯联苯会降解成五氯或六氯原子的PCBs[26]。同时,高氯原子的PCBs分子体积大,在透过生物细胞膜时受阻,以致生物体内积累少[27]。综上几个原因,四氯、五氯和六氯等PCBs在牡蛎体内富集程度高。
|
图 3 福建闽南沿海牡蛎体内PCBs组分所占比例
Fig. 3 The percentage of PCBs components in oyster along the southern coast of Fujian province in China
|
通过比较闽南沿海不同海域牡蛎体内非致癌健康风险主要因子的MOE值(图 4)可知:镉在不同海域牡蛎体内都是非致癌健康风险程度最高的因子;厦门海域牡蛎除甲基汞的MOE值低于其他海域外,铅、镉、铜、无机砷和多氯联苯等MOE值都较高;漳州海域牡蛎中甲基汞MOE值较高,铜和多氯联苯MOE值明显低于其他海域;泉州海域牡蛎中铅、铜、甲基汞的MOE值相近、无机砷和PCBs的MOE值相近。总体上闽南养殖牡蛎体内污染物非致癌健康风险呈现厦门海域高,漳州、泉州海域低的格局。牡蛎对污染物的富集取决于所处海洋环境中污染物的浓度,水体的含氧量、盐度、温度、pH等理化因素和自身的生理特性[28]。同时污染物间会产生如协同、拮抗等复杂作用,也会影响污染物在牡蛎中的富集程度[29]。因此, 不同海域牡蛎体内污染物浓度水平的差异,是多因素综合作用的结果。
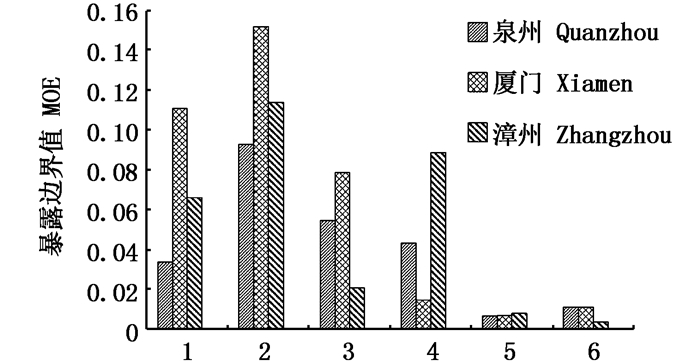
|
图 4 不同海域牡蛎中主要污染物MOE值
Fig. 4 The MOE of primary chemical contaminants in oyster at different sea area
1.铅; 2.镉; 3.铜; 4.甲基汞; 5.无机砷; 6.多氯联苯 1. Pb; 2. Cd; 3. Cu; 4. Methylmercury; 5. Inorganic arsenic; 6. PCBs |
本次监测漳州地区的12号、19号、20号和21号站位的牡蛎,分别于5月和9月进行两次采样。4个站位牡蛎体内铜和多氯联苯含量存在季节性差异,呈春季(5月)高,秋季(9月)低的趋势,其他几个污染物季节性差异不显著。牡蛎体内铜的季节性差异原因,笔者认为5月份适逢福建雨季,地表上的铜经雨水冲刷,随陆源淡水输入养殖区,导致养殖区海水中铜浓度升高。同时,大量淡水的输入也导致养殖区海水盐度降低,低盐度环境有利于牡蛎对铜的累积[19];多氯联苯季节性差异的原因,除了由于5月雨季,雨水冲刷地表和大气中多氯联苯的沉降量加大,导致牡蛎栖息环境中多氯联苯浓度升高外[22],春季牡蛎处于性腺成熟期, 肥满度高,秋季牡蛎精、卵排放后性腺萎缩, 肥满度低,牡蛎成熟的性腺脂肪含量高。水生动物体内多氯联苯累积量与脂肪含量呈正相关关系[30]。因此,牡蛎体内污染物季节性的变化不仅与牡蛎的生长周期有关,还与牡蛎栖息环境中不同季节环境因子变化和污染物的浓度水平有关。
2.2 致癌健康风险评估 2.2.1 牡蛎致癌风险指数计算与评估牡蛎中具有致癌风险的污染物包括:无机砷、多氯联苯、六六六、滴滴涕、多环芳烃等。采用(2)式和(3)式计算出各污染物的致癌风险指数和总致癌风险指数,结果见表 7。多环芳烃组分蒽大于60%的样品检测结果小于检测限,苊烯、苊、苯并(a)蒽、䓛、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、二苯并[a, h]蒽、苯并[g, h, i]苝和茚并(1, 2, 3-cd)芘等检测结果均低于方法检测限。根据WHO的推荐,在风险评估计算时分别采用检测限和0值进行计算[16]。采用检测限计算致癌风险指数结果见表 7。所采集的22个站位牡蛎总致癌风险指数RTC在2.88×10-5~3.16×10-5之间,均未超过可接受风险水平1×10-4,表明其致癌健康风险在可接受范围内。

|
表 7 牡蛎致癌风险指数 Tab.7 The carcinogenic risk indexes of oyster |
多环芳烃的某些组分如苯并(a)芘、二苯并[a, h]蒽,具有较强的致癌性,其致癌斜率因子分别为7.3 kg·day/mg和36.5 kg·day/mg,这些组分在牡蛎样品中均未检出。如果采用检测限计算致癌风险指数为4.10×10-6和2.05×10-5,此时多环芳烃对总致癌风险指数的贡献率超过80%。若以此分析主要风险因子将导致明显偏差。因此,在进行不同污染物致癌风险指数比较分析时,对多环芳烃未检出的组分采用0值参与计算。
从闽南沿海牡蛎各污染物致癌风险指数所占比例看(图 5),无机砷占比达86%,其他几个污染物的和仅占14%。因此,无机砷应作为牡蛎致癌风险主要监测对象。持久性有机物污染物中多氯联苯的致癌风险指数相对较高,也应在监测中加以关注。
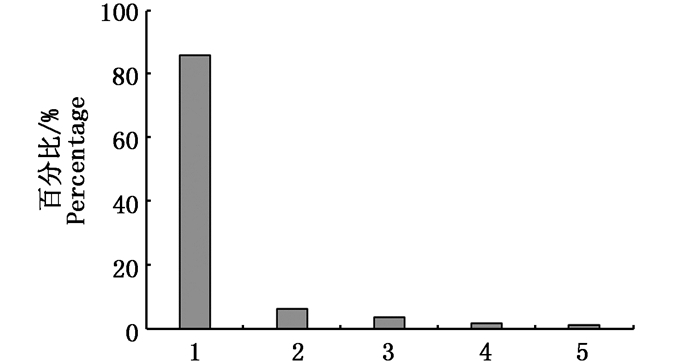
|
图 5 福建闽南沿海牡蛎样品中各污染物致癌风险指数Ri所占比例
Fig. 5 The percentage of chemical contaminants Ri in oyster along the southern coast of Fujian province in China
1.无机砷; 2.多氯联苯; 3.六六六; 4.滴滴涕; 5.多环芳烃 1. Inorganic arsenic; 2. PCBs; 3. HCB; 4. DDT; 5.PAHs |
泉州、厦门、漳州海域养殖牡蛎的平均总致癌风险指数分别为:3.81×10-6,3.94×10-6和4.08×10-6,绝对值差别小,因此闽南沿海养殖牡蛎体内污染物致癌健康风险基本相同。所监测具有致癌风险的污染物(多环芳烃除外)含量,在不同海域牡蛎中均存在显著性差异(P<0.05)。通过比较对不同海域各污染物致癌风险指数所占比例(图 6)可知:无机砷在不同海域牡蛎体内都是致癌健康风险的主要因子;漳州海域牡蛎体内无机砷致癌风险指数明显高于其他海域、多氯联苯致癌风险指数小于其他海域;厦门海域牡蛎体内滴滴涕致癌风险指数明显高于其他海域;各海域牡蛎体内六六六致癌风险指数虽然有显著性差异,但绝对值差别不大;多环芳烃致癌风险指数在各海域牡蛎中占总致癌风险指数比例较低,大约在1%,且不存在显著性差异。
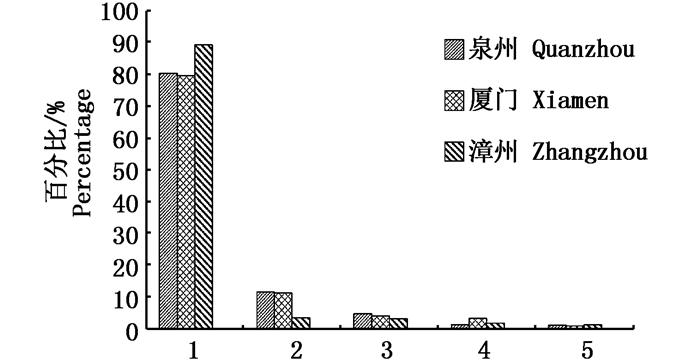
|
图 6 不同海域牡蛎中各污染物致癌风险指数Ri值所占比例
Fig. 6 The percentage of chemical contaminants Ri in oyster at different sea areas
1.无机砷;2.多氯联苯;3.六六六;4.滴滴涕;5.多环芳烃 1. Inorganic arsenic; 2. PCBs; 3. HCB; 4. DDT; 5.PAHs |
(1) 采用暴露边界值和致癌风险指数评估闽南沿海养殖牡蛎食用健康风险,按照我国现有的环境条件、科技和经济发展水平,其食用健康风险在可接受范围内。
(2) 闽南沿海养殖牡蛎食用健康风险主要来源于重金属,这与牡蛎对重金属的特征吸附有关。在所监测的几种重金属中镉、铅、甲基汞的暴露边界值较高;无机砷对总致癌风险指数贡献率大,因此,镉、铅、甲基汞和无机砷应是其食用健康风险监控的重点。
(3) 闽南沿海养殖牡蛎所监测的持久性有机污染物中,多氯联苯不仅暴露边界值远高于其他几种持久性有机污染物,其对总致癌风险指数的贡献也高于其他几种持久性有机污染物。因此,多氯联苯应是牡蛎体内持久性有机污染物监控的重点。
(4) 多环芳烃组分苯并(a)芘、二苯并[a, h]蒽,具有强烈的致癌性,按照目前国标检测方法,即使是以检测限计算其致癌风险指数,也已接近或超过1×10-5。若以此分析牡蛎食用健康风险的主要因子会导致明显偏差。应针对这些强致癌物开发出灵敏度比现行标准高2~3个数量级的检测方法,才能比较准确地进行分析判断。
| [1] |
杨小玲, 杨瑞强, 江桂斌. 用贻贝、牡蛎作为生物指示物监测渤海近岸水体中的丁基锡污染物[J].
环境科学, 2006, 25(1): 88–91.
YANG X L, YANG R Q, JIANG G B. Using Mytilus edulis and Pema viridis as bioindicators to monitor butyltins pollution along the Bohai coastal sites[J]. Environmental Chemistry, 2006, 25(1): 88–91. |
| [2] |
贾晓平, 蔡文贵, 林钦, 等. 广东沿海近江牡蛎体砷含量水平、地理分布特点和变化趋势[J].
中国水产科学, 1999, 6(2): 97–100.
JIA X P, CAI W G, LIN Q, et al. Levels, spatial distribution and variation tendency of arsenic in oysters from the coast of Guangdong province[J]. Journal of Fishery Sciences of China, 1999, 6(2): 97–100. |
| [3] |
陆超华, 谢文造, 周国君. 近江牡蛎作为海洋重金属镉污染指示生物的研究[J].
中国水产科学, 1998, 5(2): 79–83.
LU C H, XIE W Z, ZHOU G J. Studies on Crassostrea rivularis as a biological indicator of cadmium pollution[J]. Journal of Fishery Sciences of China, 1998, 5(2): 79–83. |
| [4] |
王增焕, 林钦, 王许诺, 等. 华南沿海牡蛎重金属含量特征及其风险评估[J].
水产学报, 2011, 35(2): 291–297.
WANG Z H, LIN Q, WANG X N, et al. The variation features of heavy metal contents in oyster samples from the coast of south china sea and their safety assessment[J]. Journal of Fisheries of China, 2011, 35(2): 291–297. |
| [5] |
甘居利, 贾晓平, 蔡文贵, 等. 南海北部沿岸近江牡蛎有机氯杀虫剂含量与食用安全性分析[J].
生态与农村环境学报, 2011, 27(2): 6–10.
GAN J L, JIA X P, CAI W G, et al. Organochlorine residue in oysters (Crassostrea rivularis) living along the Coast of northern south China sea and edible safety analysis[J]. Journal of Ecology and Rural Environment, 2011, 27(2): 6–10. |
| [6] |
王学锋, 贾晓平, 陈海刚, 等. 广东沿岸牡蛎体内总汞含量变动趋势及其健康风险评价[J].
农业环境科学学报, 2011, 30(12): 2408–2415.
WANG X F, JIA X P, CHEN H G, et al. Spatial-temporal trends and health risk assessments of total mercury in the oysters from Guangdong coastal bays, China[J]. Journal of Agro-Environment Science, 2011, 30(12): 2408–2415. |
| [7] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378-2007海洋监测规范[S]. 北京: 中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378-2007 The specification for marine monitoring[S]. Beijing:Standards Press of China, 2008. |
| [8] |
中华人民共和国农业部. NY 5073-2006无公害食品水产品中有毒有害物质限量[S]. 北京: 中国农业出版社, 2006.
The Ministry of Agriculture of the People's Republic of China. NY 5073-2006 Free-pollutant food limits of toxic and harmful substances in aquatic product[S]. Beijing:China Agricultural Press, 2006. |
| [9] |
中华人们共和国国家卫生和计划生育委员会, 中华人民共和国农业部. GB 2763-2014食品中农药最大残留限量[S]. 北京: 中国标准出版社, 2014.
National Health and Family Planning Commission of PRC, The Ministry of Agriculture of the People's Republic of China. GB2763-2014 National food safety standard-maximum residue limits for pesticides in food[S]. Beijing:Standards Press of China, 2014. |
| [10] |
中华人民共和国农业部. 农业部办公厅关于印发茄果蔬菜等58类无公害农产品检测目录的通知[S]. 农办质[2015] 4号. 北京: 农业部办公厅, 2015.
Ministry of Agriculture of the People's Republic of China. Office of the ministry of agriculture press announcement of fifty-eight category free-pollutant agricultural products detected catalogue[S]. Agriculture Office Quality [2015] No. 4. Beijing:Office of the Ministry of Agriculture, 2015. |
| [11] |
王群, 宋怿, 孟娣, 等. 石油烃对水产品质量安全影响及风险评估[J].
食品安全质量检测学报, 2014, 5(2): 628–633.
WANG Q, SONG Y, MENG D, et al. Impacts and risk assessments of petroleum hydrocarbon on aquatic product quality and safety[J]. Journal of Food Safety and Quality, 2014, 5(2): 628–633. |
| [12] | WATANABE K H, DESIMONE F W, THIYAGARAJAH A, et al. Fish tissue quality in the Lower Mississippi River and health risks from fish consumption[J]. The Science of the Total Environment, 2003, 302(1/3): 109–126. |
| [13] |
郑关超, 郭萌萌, 赵春霞, 等. 环渤海地区养殖水产品中多环芳烃(PAHs)污染残留及健康风险评估[J].
中国渔业质量与标准, 2015, 5(6): 20–26.
ZHENG G C, GUO M M, ZHAO C X, et al. Residue levels of PAHs in aquaculture products from Bohai Bay and their health risk assessment[J]. Chinese Fishery Quality and Standards, 2015, 5(6): 20–26. |
| [14] | NISBET I C T, LAGOY P K. Toxic equivalency factors (TEFs) for polycyclic aromatic hydrocarbons (PAHs)[J]. Regu-latory Toxicology and Pharmacolog, 1992, 16(3): 290–300. DOI:10.1016/0273-2300(92)90009-X |
| [15] |
尹乃毅, 罗飞, 张震南, 等. 土壤中铜的生物可给性及其对人体的健康风险评价[J].
生态毒理学报, 2014, 9(4): 670–677.
YIN N Y, LUO F, ZHANG Z N, et al. Bioaccessibility of soil copper and its health risk assessment[J]. Asian Journal of Ecotoxicology, 2014, 9(4): 670–677. |
| [16] |
罗祎. 食品安全风险分析:化学危害评估[M]. 北京: 中国质检出版社, 中国标准出版社, 2012: 133.
LUO Y. Food safety risk analysis:chemical hazard risk assessment[M]. Beijing: Quality Inspection Press of China, Standards Press of China, 2012: 133. |
| [17] |
翁焕新, PRESLEYB J. 重金属在牡蛎(Crassostrea virginica)中的生物积累及其影响因素研究[J].
环境科学学报, 1996, 16(1): 51–58.
WENG H X, PRESLEY B J. Bioaccumulation of heavy metals in oyster (Crassostrea virginica)[J]. Acta Scientiae Circumstantiae, 1996, 16(1): 51–58. |
| [18] |
王晓丽, 孙耀, 张少娜, 等. 牡蛎对重金属生物富集动力学特性研究[J].
生态学报, 2004, 24(5): 1086–1090.
WANG X L, SUN Y, ZHANF S N, et al. Experiment researches on the kinetic characteristics of bioconcentration of heavy metals in O. gigas Thunberg[J]. Acta Ecologica Sinica, 2004, 24(5): 1086–1090. |
| [19] |
陆超华, 谢文造, 周国君. 近江牡蛎作为海洋重金属Cu污染监测生物的研究[J].
海洋环境科学, 1999, 17(2): 17–23.
LU C H, XIE W Z, ZHOU G J. Study on Crassostrea rivularis as a biomonitor for copper pollution in sea water[J]. Marine Environmental Science, 1999, 17(2): 17–23. |
| [20] |
陈海刚, 林钦, 蔡文贵, 等. 3种常见海洋贝类对重金属Hg、Pb和Cd的积累与释放特征比较[J].
农业环境科学学报, 2008, 27(3): 1163–1167.
CHEN H G, LIN Q, CAI W G, et al. Comparisons on the accumulation and elimination characteristic of Hg, Pb and Cd in three kinds of marine bivalve molluscs[J]. Journal of Agro-Environment Science, 2008, 27(3): 1163–1167. |
| [21] |
李晓, 孙福新, 王颖, 等. 3种经济贝类无机砷生物富集的动力学特性研究[J].
海洋渔业, 2011, 33(3): 325–334.
LI X, SUN F X, WANG Y, et al. On bio-concentration and elimination of three kinds of economical shellfish to inorganic arsenic[J]. Marine Fisheries, 2011, 33(3): 325–334. |
| [22] |
钟硕良, 蔡玉婷, 董黎明, 等. 海水养殖贝类体中TPH和PCBs的分布和积累研究[J].
海洋水产研究, 2008, 29(2): 82–89.
ZHONG S L, CAI Y T, DONG L M, et al. Study on the distribution and accumulation of TPH and PCBs in maricultured bivalves[J]. Marine Fisheries Research, 2008, 29(2): 82–89. |
| [23] | KAWAI S, FUKUSHIMA M, MIYAZAKI N, et al. Relationship between lipid composition and organochlorine levels in the tissues of striped dolphin[J]. Marine Pollution Bulletin, 1988, 19(3): 129–133. DOI:10.1016/0025-326X(88)90709-6 |
| [24] | CHOI H G, MOON H B, CHOI M, et al. Mussel watch program for organic contaminants along the Korean coast, 2001-2007[J]. Environmental Monitoring and Assessment, 2010, 169(1/4): 473–485. |
| [25] | LOGANATHAN B G, KANNAN K. Global organochlorine contamination trends:an overview[J]. Ambio, 1994, 23(3): 187–191. |
| [26] |
孙成, 许士奋, 姚书春, 等. 香港海域翡翠贻贝(Perna viridis L.)中多氯联苯的研究[J].
环境化学, 2003, 22(2): 182–188.
SUN C, XU S F, YAO S C, et al. Study on PCBs in the green mussel (Perna viridis L.) samples in Hong Kong marine water[J]. Environmental Chemistry, 2003, 22(2): 182–188. |
| [27] |
何闪闪, 何闪英, 王晓宇. 浙江沿海海洋水产动物的多氯联苯检测分析[J].
水生态学杂志, 2010, 3(4): 96–101.
HE S S, HE S Y, WANG X Y. Detection and analysis of polychlorinated biphenyls in aquatic animals from Zhejiang coastal area[J]. Journal of Hydroecology, 2010, 3(4): 96–101. |
| [28] | PHILLIPS D J H. The common mussel Mytilus edulis as an indicator of pollution by zinc, cadmium, lead and copper. Ⅱ. Relationship of metals in the mussel to those discharged by industry[J]. Marine Biology, 1976, 38(1): 71–80. DOI:10.1007/BF00391487 |
| [29] | KARGIN F, ÇOǦUN H Y. Metal interactions during accumulation and elimination of zinc and cadmium in tissues of the freshwater fish Tilapia nilotica[J]. Bulletin of Environmental Contamination and Toxicology, 1999, 63(4): 511–519. DOI:10.1007/s001289901010 |
| [30] |
钱佐国, 孙明昆. 多氯联苯的海洋环境化学[J].
海洋科学, 1980: 23–29.
QIAN Z G, SUN M K. Polychlorinated biphenyls of marine environmental chemistry[J]. Marine Sciences, 1980: 23–29. |
2. Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province, Xiamen 361013, Fujian, China;
3. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, Xiamen 361013, Fujian, China
 2017,
Vol. 26
2017,
Vol. 26

