2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 远洋渔业协同创新中心, 上海 201306
目前,随着全球渔业资源的开发利用,头足类作为重要的海洋经济动物,被联合国粮农组织定为未来最有开发潜力的渔业资源种类之一[1]。毛里塔尼亚地区的头足类资源比较丰富,从上世纪90年代起我国开始在该地区进行头足类资源的渔业开发,其中乌贼为主要的捕捞对象[2]。个体繁殖力特性研究是对个体及种群繁殖潜能进行评估的基础[3],有助于正确评估种群生物量的变动规律,对合理可持续地利用和开发渔业资源群体具有重要的现实意义。因此,通过研究该海域的乌贼个体繁殖力特性,可为快速评估资源群体数量动态变化并为可持续开发提供重要的科学信息基础。
乌贼(Sepia officinalis),隶属于乌贼目(Sepioidea),乌贼科(Sepiidae),乌贼属(Sepia),为浅海性底层栖息属种,主要栖息在浅于200 m深的沙质和烂泥质底层,分布海域为东大西洋和地中海海域,具有明显的季节性洄游习性[4-5]。乌贼是大西洋乌贼科最重要的商业性渔业资源,因其肉质嫩美而备受日本、韩国、意大利和西班牙等消费者青睐,具有很高的市场价值,渔业产量逐年递增[6]。同时,因为乌贼对实验室环境适应能力强,也逐步成为头足类生物学、生物化学等研究的模式属种[7]。近年来,有关乌贼的研究主要以栖息地中海海域的群体为主,内容集中在栖息环境的变化影响[8-9]、群体结构的动态变化[10-11]、饵料生物的选择及其饲养配饵[12-13]、发育生物学特征[14-15]等方面,而对栖息在东大西洋海域的群体研究较少[8, 16],其繁殖生物学内容则更鲜有报道。本文对毛里塔尼亚外海乌贼的个体繁殖力及其生物学指标的关系进行研究,旨在掌握该群体在大西洋海域的生物学特性,丰富该属种的繁殖生物学内容,并为可持续开发利用该群体提供基础资料。
1 材料与方法 1.1 样品来源乌贼样本来源于我国远洋渔业公司在毛里塔尼亚外海作业期间的渔获个体,采集时间为2015年7月—8月,采集海域为北纬20°左右。渔业方式为底层拖网渔业,随船调查人员在海上随机采集样本,经冷冻保藏后运回实验室进行分析。
1.2 生物学测定与分析乌贼样本在实验室解冻后,进行生物学测定。分类特征参考JEREB等[4]和陈新军等[5]对乌贼的分类描述,简要描述如下:体型盾形,淡褐色,外套背部具有横斑纹,腹部末端无腺体和腺孔;鳍周生,两鳍末端分离;触腕穗镰刀形,吸盘5~6列;内壳长椭圆形,前端尖锐且收缩,后端钝圆,尾骨针短尖且外裹透明角质。本实验共测定乌贼雌性样本412尾,测定项目包括长度生物学指标(图 1):胴长(mantle length, ML)、胴宽(mantle width, MW)、头宽(head width, HW)、鳍长(fin length, FL)和鳍宽(fin width, FW),精确到1mm。质量生物学指标:体质量(body weight, BW)、净质量(eviscerated weight, EW)和头质量(head wight, HeW),精确到0.1 g。

|
图 1 乌贼长度生物学指标测量方法示意图
Fig. 1 Schematic illustration of biological indices measurement for Sepia officinalis
|
乌贼生殖系统发育划分:以国际海洋考察理事会(International Council for the Exploration of the Sea, ICES)[17]性腺成熟度划分为标准,共划分Ⅰ-Ⅴ期。其中,Ⅰ期为未发育期,卵巢、缠卵腺、卵管腺等小、半透明状,输卵管平直;Ⅱ期为开始发育期,卵巢较大,可见少量白色的卵母细胞,缠卵腺、卵管腺白色,输卵管可见褶痕;Ⅲ期为生理发育成熟期,卵巢淡黄色,可见表面网状的淡黄色卵黄卵母细胞;Ⅳ期为功能性成熟/产卵期,卵巢偏琥珀色,卵黄卵母细胞很多,并可见少量散落的琥珀色成熟卵子;Ⅴ期为衰败退化期,卵巢萎缩状、松弛,可见少量卵母细胞附着于中央组织。样本解剖后,共鉴别样本性腺成熟度Ⅱ期8尾、Ⅲ期50尾和Ⅳ期354尾。摘取卵巢组织,称取卵巢重(ovary weight, OW),精确到0.1 mg。
乌贼繁殖力的测定:随机选取成熟度Ⅱ期样本4尾、Ⅲ期12尾和Ⅳ期80尾,作为个体繁殖力的统计样本。采用重量法计数繁殖力[15],在解剖镜(1-5X)下观察并计数所有可见的卵母细胞。其中,Ⅱ期卵巢样品进行全部计数,即为潜在繁殖力(potential fecundity, PF);Ⅲ期和Ⅳ期样本则分离较大的卵黄卵母细胞和离散的成熟卵子,对其单独计数,然后切取20%~30%的卵巢重量(约2~5 g)计数卵母细胞个数,PF计算为样品卵母细胞数/样品重量×卵巢重量+卵黄卵母细胞数+成熟卵子数。个体相对繁殖力计算为潜在繁殖力与胴长或体质量的比值,即为单位胴长(mm)或单位体质量(g)的繁殖力,分别以PFML和PFBW表示。
1.3 数据处理头足类的繁殖力往往与个体大小密切相关,而不同种群的繁殖力-个体大小的函数关系存在一定差异[18-20]。同时,头足类的生长发育主要表现为快速生长的发育期和缓慢生长的繁殖期两个阶段,并且因为有限的能量积累和投入分配而表现出个体肌肉组织生长和性腺生长发育的不相协调性[4, 21]。因此,本文采用线性函数、幂函数、指数函数等数学模型对乌贼个体繁殖力(PF、PFML、PFBW)分别与各长度、质量生物学指标的关系进行拟合,选取相关系数(R2)最大者作为拟合函数关系。同时,为进一步找出乌贼繁殖力与生物学指标的综合效应关系,采用多元线性回归分析建立个体繁殖力与生物学指标的全回归方程关系,随后进行多元线性逐步回归分析,筛选出对个体繁殖力影响显著的指标,建立标准化回归方程。
此外,本文采用Kolmogorov-Smirnov非参数检验方法进行乌贼个体繁殖力(PF、PFML、PFBW)的正态型假设分布检验,采用方差检验方法进行乌贼个体胴长相对繁殖力(PFML)和体质量相对繁殖力(PFBW)的稳定性比较分析[22]。
采用统计学软件Origin 2015和SPSS 20.0等进行相关的数据处理。数据采用平均值±标准差表示。
2 结果 2.1 长度组成分析乌贼的胴长、胴宽、头宽、鳍长和鳍宽等长度生物学指标均呈单峰型区间分布(图 1)。其中,胴长范围为134~323 mm,平均胴长为(189.37±32.16) mm,优势胴长范围为160~230 mm,占比为81.64%;胴宽范围为80~260 mm,平均胴宽为(127.93±32.36) mm,优势胴宽范围为90~170 mm,占比为84.78%;头宽范围为35~130 mm,平均头宽为(76.35±12.12) mm,优势头宽范围为70~100 mm,占比为84.78%;头宽范围为35~130 mm,平均头宽为(76.35±12.12) mm,优势头宽范围为70~100 mm,占比为87.44%;鳍长范围为132~320 mm,平均鳍长为(183.96±31.83) mm,优势鳍长范围为150~230 mm,占比为82.85%;鳍宽范围为12~56 mm,平均鳍长为(25.71±5.75) mm,优势鳍长范围为30~40 mm,占比为64.25%。
2.2 质量组成分析与长度生物学指标一致,乌贼的体质量、净质量和头质量等质量生物学指标也呈单峰型区间分布(图 2)。其中,体质量范围为70~1 972 g,平均体质量为(620.16±297.51) g,优势体质量范围为350~750 g,占比为68.60%;净质量范围为89~791 g,平均净质量为(246.52±120.76) g,优势净质量范围为150~350 g,占比为77.54%;头质量范围为58~550 g,平均头质量为(158.63±76.98) g,优势头质量范围为100~250 g,占比为80.43%。

|
图 2 乌贼胴长、胴宽、头宽、鳍长和鳍宽等生物学指标组成分布
Fig. 2 The frequency distribution of biological indices of mantle length, mantle width, head width, fin length and fin width for Sepia officinalis
|
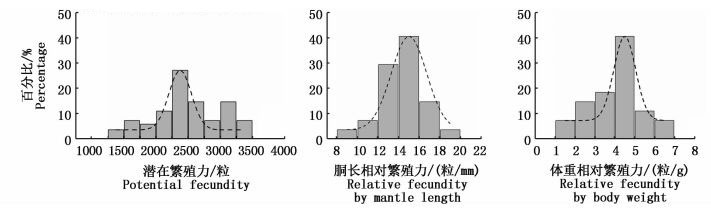
实验测得,乌贼的潜在繁殖力PF为1 306~3 375粒,平均为(2 466±545.9) 粒,个体潜在繁殖力随着性腺发育增加显著(ANOVA: F=20.125,P<0.001)(表 1)。其中,Ⅱ期时个体的平均潜在繁殖力为(1 561±225.3) 粒;Ⅲ期时,个体平均潜在繁殖力为(2 211±109.2) 粒,卵黄卵母细胞为(161±47.2) 粒;Ⅳ期时,个体平均潜在繁殖力为(2 758±378.4) 粒,卵黄卵母细胞和成熟卵子分别为(297±157.2) 粒、(13±4.3) 粒。同时,乌贼的胴长相对繁殖力PFML为8.70~18.56粒/mm,平均为(14.17±2.12) 粒/mm;体质量相对繁殖力PFBW为2.72~7.81粒/g,平均为(5.18±1.23) 粒/g。

|
表 1 乌贼个体不同性腺成熟度的繁殖力 Tab.1 Individual fecundities of Sepia officinalis at different sexual maturity |
繁殖力分布的统计假设检验显示,乌贼潜在繁殖力、胴长相对繁殖力和体质量相对繁殖力均接近正态分布(K-S test, PF:Z=0.887, P=0.411; PFML: Z=1.114, P=0.167; PFBW: Z=1.171, P=0.129)(图 3)。其中,潜在繁殖力分布的偏度为-0.234,峰度为-0.291;胴长相对繁殖力的偏度为-0.485,峰度为0.768;体质量相对繁殖力的偏度为-0.148,峰度为-0.180。此外,相对繁殖力稳定性的方差检验显示,胴长相对繁殖力的方差D(PFML)=4.498,体质量相对繁殖力的方差D(PFBW)=1.507。PFBW的方差小于PFML的方差值,可认为体质量相对繁殖力比胴长相对繁殖力稳定。

|
图 3 乌贼体质量、净质量和头质量等生物学指标组成分布
Fig. 3 The frequency distribution of biological indices of body weight, eviscerated weight and head weight for Sepia officinalis
|
乌贼个体繁殖力与单一生物学指标之间的关系,经线性函数、幂函数、指数函数等数学模型拟合分析,筛选出拟合度最高的函数关系结果显示(表 2),乌贼潜在繁殖力与胴长、胴宽、鳍长、净质量和头质量呈指数函数关系,与头宽、鳍宽呈线性函数关系,与体质量呈幂函数关系,其中,潜在繁殖力与鳍长的相关系数最高(R2=0.663),次之是与净质量的拟合相关系数(R2=0.654)。
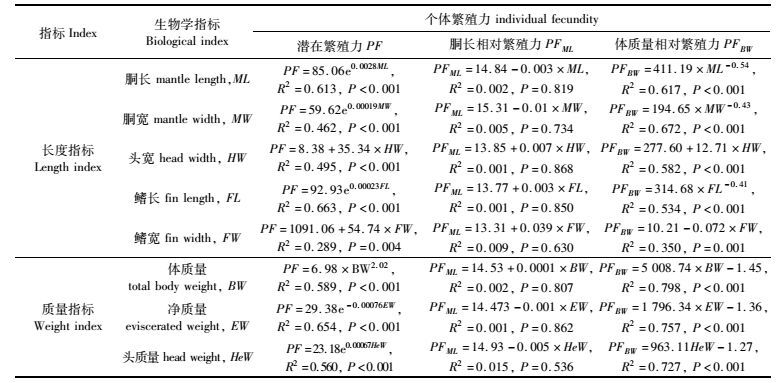
|
表 2 乌贼潜个体繁殖力与单一生物学指标回归方程 Tab.2 Optimal equations between individual fecundity and single biological index of Sepia officinalis |
乌贼胴长相对繁殖力与各单一生物学指标数学模型拟合度最好的函数是线性函数,然而拟合相关系数较低,并且函数关系不十分密切(P>0.05,表 2)。
乌贼体质量相对繁殖力与胴长、胴宽、鳍长、体质量、净质量和头质量呈幂函数关系,与头宽、鳍宽呈线性函数关系(表 2)。其中,体质量相对繁殖力与体质量的关系最为密切,拟合相关系数最高(R2=0.798),次之是与净质量的拟合关系(R2=0.757)。
|
图 4 乌贼潜在繁殖力和相对繁殖力的频率分布
Fig. 4 The frequency distribution of potential fecundity and relative fecundity of Sepia officinalis
|
为进一步探索乌贼个体繁殖力与各生物学体征之间的关系,建立乌贼个体繁殖力与胴长、胴宽、鳍长、鳍宽、头宽、体质量、净质量、头质量等8项生物学特征指标的多元线性回归方程。结果显示,乌贼潜在繁殖力与各项生物学指标之间回归分析的全回归方程为:PF=-1129.31+10.03ML+6.77MW+9.25FL+9.72FW+0.86HW-0.23BW+1.62EW-6.44HeW(R2=0.653,F=4.23,P=0.005)
标准化回归方程为:
PF=-1337.418+17.137×FL (R2=0.616, F= 40.08, P<0.001)
参选的8项生物学指标,潜在繁殖力仅与鳍长呈显著的正相关关系,其标准化影响系数最高,为0.785(表 3)。

|
表 3 乌贼个体繁殖力与多元特征的多元线性回归 Tab.3 Multivariable linear regression between fecundity and biological indices of Sepia officinalis |
乌贼胴长相对繁殖力与各项生物学指标之间回归分析的全回归方程为:
PFML=8.59-0.008ML+0.013MW+0.041FL+0.051FW+0.015HW+0.0001BW+0.011EW-0.40HeW(R2=0.153,F=0.41,P=0.902)
参选的8项生物学指标对胴长相对繁殖力的影响不显著,没有产生显著的相关关系。
乌贼体质量相对繁殖力与各项生物学指标回归分析的全回归方程为:
PFBW=6.69+0.032ML-0.024MW-0.011FL-0.006FW+0.006HW-0.007BW+0.006EW-0.006HeW(R2=0.641,F=4.01,P=0.007)
标准化回归方程为:
PFBW=7.258-0.004×BW (R2=0.589, F= 35.764, P<0.0001)
参选的8项生物学指标,体质量相对繁殖力仅与体质量呈显著的相关关系,但呈负相关关系,其标准化影响系数为-0.767(表 3)。
上述各式中,PF为潜在繁殖力,PFML为胴长相对繁殖力,PFBW为体质量相对繁殖力,ML为胴长,MW为胴宽,FL为鳍长,FW为鳍宽,HW为头宽,BW为体质量,EW为净质量,HEW为头质量。
3 讨论 3.1 乌贼个体生物学指标特性头足类属种生长快、寿命短,对栖息环境变化的灵敏性高于同一生境下的其他生物种类[4, 23]。因此,根据不同的栖息地理位置和个体大小结构等生物学形态特征,同一头足类属种可以划分为多个不同的地理种群[24-25]。如西南大西洋的阿根廷滑柔鱼(Illex argentinus),因其不同栖息水域、不同个体大小及其显著的繁殖季节而被划分为多个种群[21]。已有研究显示,乌贼的栖息水域横跨赤道,从设得兰群岛向南穿过地中海至非洲西北部,南限可至南非[4-5]。这种地理分布的跨越,以及不同海域的水温特点已经形成了乌贼属种的多个地理种群,具有栖息海域特殊性的个体大小结构[7, 15-16]。本研究结果显示,毛里塔尼亚外海乌贼个体的胴长、胴宽、头宽、鳍长和鳍宽等长度生物学指标,以及体质量、净质量和头质量等质量生物学指标均呈一个峰值区间分布,说明本实验样本来自于同一个聚群。
同时,本研究采集的毛里塔尼亚外海乌贼个体胴长范围为134~323 mm,优势胴长在160~230 mm之间。与其它海域乌贼个体大小相比较,毛里塔尼亚外海乌贼个体大小介于地中海海域和葡萄牙北部以北海域的种群之间,其中地中海海域的种群个体大小一般在25 cm以内[15, 26],葡萄牙外海及其北部海域种群个体大小基本在36 cm以上,再往北海域个体的大小甚至可达49 cm[7]。此外,不同海域乌贼种群的繁殖季节具有一定的相似性,如地中海海域种群的繁殖时间集中在春季和夏季,葡萄牙外海种群的繁殖盛期在6月—7月,英格兰海峡种群的繁殖时间从2月延至7月[7]。本研究随机采集的乌贼样本来自于7月—8月,并且85.6%以上的样本个体鉴定为性腺发育成熟期(Ⅳ期),表明该样本采集时期为该海域聚群的繁殖季节或正处于繁殖产卵期。因此,结合该属种生命周期短、终生一次繁殖的生活史特点[4],可以初步推测毛里塔尼亚外海的乌贼聚群为一个相对独立的地理种群,具体有待于进一步深入研究。
3.2 乌贼个体繁殖力特性繁殖力是物种或地理种群对栖息环境的适应性特征,生活在不同水域的属种或同属种不同地理种群的繁殖力有明显差异[19]。乌贼为浅海性底层栖息属种,喜好在5~60 m水深的浅海水域产卵,并与生长有海伞、海管类等植物的海底地质密切相关[8]。本研究的毛里塔尼亚外海乌贼个体潜在繁殖力在1 306~3 375粒,平均值为2 466粒,与MANGOLD-WIRZ[27]和BOLETZKY[28]等报道的饲养个体的繁殖力相一致。但是,该研究聚群的个体繁殖力低于加泰隆海聚群的平均繁殖力4 000粒[27],也低于爱琴海聚群的平均繁殖力5 871粒[15],表明乌贼属种不同栖息海域聚群之间的个体繁殖力相差较大,这可能与其浅海性底栖生活习性,以及栖息环境的水温及其相适应的营养状况等因素有关[13]。FORSYTHE等[29]即曾报道乌贼冬季群体的繁殖力要高于夏季群体的繁殖力,并且水温较低时个体平均繁殖力均大于3 000粒。
已有研究显示,乌贼个体的有效繁殖力(effective fecundity,即卵巢内卵黄卵母细胞和成熟卵子之和)比较低,一般为潜在繁殖力的1/3以内[13, 15, 28];繁殖期间分批次排卵,每次排卵量在4~82粒之间[8]。本研究也显示了相类似的结果:成熟个体卵巢内的卵黄卵母细胞数和卵子数占比比较低,前者约为潜在繁殖力的8%~30%,后者则仅为8-21粒。同时,本研究发现乌贼雌性个体的潜在繁殖力随着性腺发育显著增加,表明了乌贼雌性个体在性腺发育过程中持续发生卵母细胞,但是这些卵母细胞是分批发育成熟的。这可能与其间歇性的产卵策略[30]密切相关,通过分批次的少量排卵以选择适宜的环境条件来提高受精卵孵化率及其胚胎存活率[8]。
此外,本研究结果显示乌贼的体质量相对繁殖力比胴长相对繁殖力稳定,并且体质量相对繁殖力较高,平均为(5.18±1.23) 粒/g,表明该属种对单个卵子的生殖投入较高。LAPTIKHOVSKY等[31]也曾报道乌贼类对单个卵子的生殖投入较高,往往产下卵径大、卵数少的沉性卵,其体质量相对繁殖力一般在2~51粒/g之间。这有别于其它大洋性的枪乌贼类和柔鱼类,通过产下大量的、卵径小的浮性卵以维持种群数量的稳定,但是对单个卵子的生殖投入低,如大洋性阿根廷滑柔鱼的成熟卵子平均直径为0.96 mm,体质量相对繁殖力为高达42.8~103.6万粒/g,单个卵子获得生殖投入很低[19]。这可能是不同头足类属种对其栖息环境的一种繁殖策略的选择性适应所致,与大洋性种类相比较,乌贼类喜好于栖息在环境波动平缓的底层水域,这为受精卵的孵化及其胚胎发育提供了较为稳定的外界物理条件,而较高的生殖投入则进一步加强了胚胎发育及其存活率[32]。
3.3 乌贼个体繁殖力的生物学指标表达一般地,头足类属种因其终生一次繁殖产卵(除鹦鹉螺外)的生活史特点,繁殖力与产卵模式、摄食生长、个体生物学特征等密切相关[21]。如,面蛸(Opisthoteuthis agassizii)性腺发育成熟后多次产卵,繁殖力大小与产卵次数、产卵持续时间及其摄食生长密切相关[33];枪乌贼科、柔鱼科等属种的繁殖力与成熟个体大小特征密切相关,与个体胴长呈显著线性关系,性腺成熟个体越大、繁殖力越高[34-35]。本研究结果显示,基于繁殖力与单一生物学指标的数学模型拟合分析,毛里塔尼亚外海乌贼潜在繁殖力、体质量相对繁殖力与胴长、胴宽、鳍长、鳍宽、头宽等长度指标和体质量、净质量、头质量等质量指标均表现出显著的相关关系,说明乌贼的繁殖力大小与个体大小密切相关。MANGOLD-WIRZ[27]和EZZEDINE-NAJAI[18]等也曾报道,地中海海域的乌贼个体繁殖力是胴长的函数,个体越大、繁殖力越高。但是,相比较于胴长,毛里塔尼亚外海乌贼的潜在繁殖力与鳍长的相关性更为密切,体质量相对繁殖力与体质量的拟合相关系数最高。这可能与头足类在繁殖期保持个体身体的平衡性及其生殖投入的有效性密切相关,因为有效的个体活动和健康的身体状态更有利于求偶并完成繁殖交配及其随后产卵活动[21]。
为了更好地描述乌贼繁殖力的生物学指标表达关系,本研究进行毛里塔尼亚外海乌贼繁殖力与各项生物学指标综合的多元线性回归分析。结果进一步显示,鳍长对个体潜在繁殖力的标准化影响系数最高,并且呈显著的正相关关系;体质量则是衡量体质量相对繁殖力的可靠生物学指标,呈负相关关系,这可能与该属种繁殖产卵后逐渐停止摄食生长有关[30]。在今后的研究过程中,可以用鳍长与潜在繁殖力之间的关系来估算乌贼的种群繁殖力,用体质量与体质量相对繁殖力之间的关系来评估乌贼的生殖投入。
综上所述,毛里塔尼亚外海乌贼的潜在繁殖力、胴长相对繁殖力和体质量相对繁殖力等分布接近于正态分布,而体质量相对繁殖力比胴长相对繁殖力稳定。个体的长度生物学指标和质量生物学指标均可以很好地反映乌贼个体繁殖力,其中鳍长、体质量分别是衡量潜在繁殖力和体质量相对繁殖力的可靠生物学指标。此外,已有研究发现乌贼的繁殖力与产卵场的底质、水温等密切相关[13, 36]。因此,今后的研究需要进一步建立个体繁殖力与底质、水温、叶绿素等非生物因素的关系,以便全面了解该属种的繁殖力特性。
| [1] |
陈新军, 陆化杰, 刘必林, 等. 大洋性柔鱼类资源开发现状及可持续利用的科学问题[J].
上海海洋大学学报, 2012, 21(5): 831–840.
CHEN X J, LU H J, LIU B L, et al. Current exploitation and some scientific issues in the sustainable utilization of Ommastrephidae[J]. Journal of Shanghai Ocean University, 2012, 21(5): 831–840. |
| [2] |
黄宪忠. 中国与毛里塔尼亚渔业合作回顾和展望[J].
渔业信息与战略, 2013, 28(4): 307–311.
HUANG X Z. Review and outlook of fisheries cooperation between China and Mauritania[J]. Fishery Information & Strategy, 2013, 28(4): 307–311. |
| [3] |
李培伦, 刘伟, 王继隆, 等. 黑龙江乌苏里白鲑的个体繁殖力[J].
中国水产科学, 2015, 22(6): 1234–1242.
LI P L, LIU W, WANG J L, et al. Fecundity of Coregonus ussuriensis in the Heilongjiang River, China[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1234–1242. |
| [4] | JEREB P, ROPER C F E. Cephalopods of the World. An Annotated and Illustrated Catalogue of Cephalopod Species Known to Date. Volume 1. Chambered Nautiluses and Sepioids (Nautilidae, Sepiidae, Sepiolidae, Sepiadariidae, Idiosepiidae and Spirulidae)[M]. Rome: FAO, 2005: 269. |
| [5] |
陈新军, 刘必林, 王尧耕. 世界头足类[M]. 北京: 海洋出版社, 2009: 714.
CHEN X J, LIU B L, WANG Y G. The World Cephalopod[M]. Beijing: China Ocean Press, 2009: 714. |
| [6] | FAO. The State of World Fisheries and Aquaculture 2016: Contributing to Food Security and Nutrition for All[M]. Rome: FAO, 2016: 200. |
| [7] | GUERRA Á, ROBIN J P, SYKES A, et al. Sepia officinalis[R]//JEREB P, ALLCOCK A L, LEFKADITOU E, et al. Cephalopod Biology and Fisheries in Europe: Ⅱ. Species Accounts. ICES Cooperative Research Report No.325. Denmark: ICES, 2015: 53-72. |
| [8] | GUERRA Á, HERNÁNDEZ-URCERA J, GARCI M E, et al. Spawning habitat selection by the common cuttlefish Sepia officinalis in the Cíes Islands (Northwest Spain)[J]. Fisheries Research, 2016, 183: 44–54. DOI:10.1016/j.fishres.2016.04.023 |
| [9] | LE PABIC C, CAPLAT C, LEHODEY J P, et al. Trace metal concentrations in post-hatching cuttlefish Sepia officinalis and consequences of dissolved zinc exposure[J]. Aquatic Toxicology, 2015, 159: 23–35. DOI:10.1016/j.aquatox.2014.11.012 |
| [10] | BLOOR I S M, WEARMOUTH V J, COTTERELL S P, et al. Movements and behaviour of European common cuttlefish Sepia officinalis in English Channel inshore waters: First results from acoustic telemetry[J]. Journal of Experimental Marine Biology and Ecology, 2013, 448: 19–27. DOI:10.1016/j.jembe.2013.06.013 |
| [11] | KELLER S, VALLS M, HIDALGO M, et al. Influence of environmental parameters on the life-history and population dynamics of cuttlefish Sepia officinalis in the western Mediterranean[J]. Estuarine, Coastal and Shelf Science, 2014, 145: 31–40. DOI:10.1016/j.ecss.2014.04.016 |
| [12] | GRIGORIOU P, RICHARDSON C A. Effect of body mass, temperature and food deprivation on oxygen consumption rate of common cuttlefish Sepia officinalis[J]. Marine Biology, 2009, 156(12): 2473–2481. DOI:10.1007/s00227-009-1272-4 |
| [13] | SYKES A V, DOMINGUES P M, ANDRADE J P. Effects of using live grass shrimp (Palaemonetes varians) as the only source of food for the culture of cuttlefish, Sepia officinalis (Linnaeus, 1758)[J]. Aquaculture International, 2006, 14(6): 551–568. DOI:10.1007/s10499-006-9054-1 |
| [14] | ÖNSOY B, SALMAN A. Reproductive biology of the common cuttlefish Sepia officinalis L. (Sepiida: Cephalopoda) in the aegean sea[J]. Turkish Journal of Veterinary and Animal Sciences, 2005, 29(3): 613–619. |
| [15] | LAPTIKHOVSKY V, SALMAN A, ÖNSOY B, et al. Fecundity of the common cuttlefish, Sepia officinalis L. (Cephalopoda, Sepiida): a new look at an old problem[J]. Scientia Marina, 2003, 67(3): 279–284. DOI:10.3989/scimar.2003.67n3 |
| [16] | DUNN M R. Aspects of the stock dynamics and exploitation of cuttlefish, Sepia officinalis (Linnaeus, 1758), in the English Channel[J]. Fisheries Research, 1999, 40(3): 277–293. DOI:10.1016/S0165-7836(98)00223-9 |
| [17] | ICES. Report of the workshop on sexual maturity staging of cephalopods (wkmsceph)[R]. ICES CM 2010/ACOM: 49, Livorno: ICES, 2010: 97. http://www.ices.dk/sites/pub/Publication%20Reports/Expert%20Group%20Report/acom/2010/WKMSCEPH/WKMSCEPH%20Report.pdf |
| [18] | EZZEDINE-NAJAI S. Fecundity of the cuttlefish, Sepia officinalis L. (Mollusca: Cephalopoda), from the Gulf of Tunis[J]. Vie et Milieu, 1985, 35(3/4): 283–284. |
| [19] | LAPTIKHOVSKY V V, NIGMATULLIN C M. Egg size, fecundity, and spawning in females of the genus Illex (Cephalopoda: Ommastrephidae)[J]. ICES Journal of Marine Science, 1993, 50(4): 393–403. DOI:10.1006/jmsc.1993.1044 |
| [20] | LAPTIKHOVSKY V V. Fecundity and spawning in squid of families Enoploteuthidae and Ancistrocheiridae (Cephalopoda: Oegopsida)[J]. Scientia Marina, 1999, 63(1): 1–7. DOI:10.3989/scimar.1999.63n1 |
| [21] | BOYLE P, RODHOUSE P. Cephalopods: Ecology and Fisheries[M]. Oxford, UK: Wiley-Blackwell, 2005: 464. |
| [22] |
凌建忠, 程家骅, 任一平, 等. 东海带鱼主要体征与个体繁殖力的关系[J].
中国水产科学, 2004, 11(2): 116–120.
LING J Z, CHENG J H, REN Y P, et al. Relationships between main physical characters and individual fecundities of hairtail Trichiurus japonicus in the East China Sea[J]. Journal of Fishery Sciences of China, 2004, 11(2): 116–120. |
| [23] | QUETGLAS A, RUEDA L, ALÜAREZ-BERASTEGUI D, et al. Contrasting responses to harvesting and environmental drivers of fast and slow life history species[J]. PLoS One, 2016, 11(2): e0148770. DOI:10.1371/journal.pone.0148770 |
| [24] |
陈新军, 李建华, 刘必林, 等. 东太平洋不同海区茎柔鱼渔业生物学的初步研究[J].
上海海洋大学学报, 2012, 21(2): 280–287.
CHEN X J, LI J H, LIU B L, et al. Comparison of fishery biology for Dosidicus gigas from three different areas in the Eastern Pacific Ocean[J]. Journal of Shanghai Ocean University, 2012, 21(2): 280–287. |
| [25] |
刘必林, 陈新军, 陈海刚, 等. 秘鲁外海茎柔鱼繁殖生物学研究[J].
上海海洋大学学报, 2016, 25(3): 445–453.
DOI:10.12024/jsou.20150101319 LIU B L, CHEN X J, CHEN H G, et al. Reproduction of the Humboldt squid (Dosidicus gigas) off Peru[J]. Journal of Shanghai Ocean University, 2016, 25(3): 445–453. DOI:10.12024/jsou.20150101319 |
| [26] | BETTOSO N, BORME D, FARESI L, et al. New insights on the biological parameters of the exploited cuttlefish Sepia officinalis L. (Mollusca: Cephalopoda) in the northern Adriatic Sea in relation to the main fishing gears employed[J]. Mediterranean Marine Science, 2016, 171(1): 152–162. |
| [27] | MANGOLD-WIRZ K. Biologie des Céphalopodes Benthiques et Nectoniques de la Mer Catalane[M]. Paris: Hermann, 1963: 285. |
| [28] | BOLETZKY S V. Fecundity variation in relation to intermittent or chronic spawning in the cuttlefish, Sepia officinalis L. (Mollusca, Cephalopoda)[J]. Bulletin of Marine Science, 1987, 40(2): 382–387. |
| [29] | FORSYTHE J W, DERUSHA R H, HANLON R T. Growth, reproduction and life span of Sepia officinalis (Cephalopoda: Mollusca) cultured through seven consecutive generations[J]. Journal of Zoology, 1994, 233(2): 175–192. DOI:10.1111/jzo.1994.233.issue-2 |
| [30] | ROCHA F, GUERRA Á, GONZÁLEZ Á F. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 2001, 76(3): 291–304. DOI:10.1017/S1464793101005681 |
| [31] | LAPTIKHOVSKY V V, NIGMATULLIN C M, HOVING H J T, et al. Reproductive strategies in female polar and deep-sea bobtail squid genera Rossia and Neorossia (Cephalopoda: Sepiolidae)[J]. Polar Biology, 2008, 31(12): 1499–1507. DOI:10.1007/s00300-008-0490-4 |
| [32] | VILLANUEVA R, VIDAL E A G, FERNÁNDEZ-ÁLÜAREZ F Á, et al. Early mode of life and hatchling size in cephalopod molluscs: influence on the species distributional ranges[J]. PLoS One, 2016, 11(11): e0165334. DOI:10.1371/journal.pone.0165334 |
| [33] | VILLANUEVA R. Continuous spawning in the cirrate octopods Opisthoteuthis agassizii and O. vossi: features of sexual maturation defining a reproductive strategy in cephalopods[J]. Marine Biology, 1992, 114(2): 265–275. DOI:10.1007/BF00349529 |
| [34] | COLLINS M A, BURNELL G M, RODHOUSE P G. Reproductive strategies of male and female Loligo forbesi (Cephalopoda: Loliginidae)[J]. Journal of the Marine Biological Association of the United Kingdom, 1995, 75(3): 621–634. DOI:10.1017/S0025315400039059 |
| [35] | ROCHA F, GUERRA A. Signs of an extended and intermittent terminal spawning in the squids Loligo vulgaris Lamarck and Loligo forbesi Steenstrup (Cephalopoda: Loliginidae)[J]. Journal of Experimental Marine Biology and Ecology, 1996, 207(1/2): 177–189. |
| [36] | DOMINGUES P M, SYKES A, ANDRADE J P. The effects of temperature in the life cycle of two consecutive generations of the cuttlefish Sepia officinalis (Linnaeus, 1758), cultured in the Algarve (South Portugal)[J]. Aquaculture International, 2002, 10(3): 207–220. DOI:10.1023/A:1022148802078 |
2. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
4. Collaborative Innovation Center for Distant-water Fisheries, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


