2. 广州普麟生物制品有限公司, 广东 广州 510380
黄芪作为一种多年生草本补益类中药,味甘、性温,具有补气升阳、固表止汗、托毒排脓和生肌等功效。黄芪多糖(Astragalus polysaccharides,APS)是从黄芪根部提取的天然活性成分,其药理及免疫研究已有报道,能够不同程度地增强机体的非特异性免疫力[1-2]。通过刘润珍等[3]及刘春花等[4]的研究表明,黄芪多糖在长期使用情况下无任何毒副作用,安全、可靠。目前黄芪多糖作为免疫增强剂和抗病毒药物在畜禽养殖业中应用广泛[5-6],而在水产养殖业上的功效也逐步得到重视。草鱼(Ctenopharyngodon idellus)是我国淡水养殖的主要品种,生长迅速,肉质鲜美,投资回报较高,但是随着近年来养殖规模增大,养殖密度提高,养殖病害也频频发生,虽然市场上有多种鱼药供使用,但是往往只能作为草鱼发病以后的补救措施,大规模爆发的养殖病害给草鱼养殖农户带来了巨大经济损失。本文报道饲料中添加不同水平的黄芪多糖对草鱼非特异性免疫指标影响的实验结果,以期为草鱼病害防治和黄芪多糖在水产养殖业中的应用提供参考。
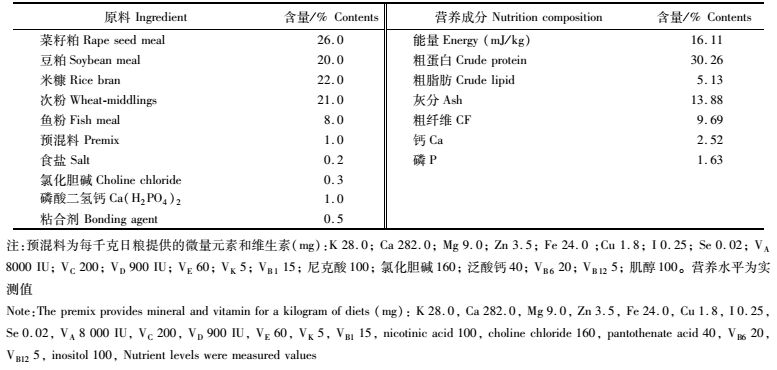
1 材料与方法 1.1 供试鱼及饲养在本研究中600尾实验草鱼来自珠江水产研究所高要良种基地,平均体质量为(100.64±5.47) g,经抽样检查发现实验鱼体格健壮、采食活跃、无病无伤、无寄生虫感染。将实验鱼随机分4组,设3个重复,各组50尾草鱼,以长1.8 m、宽1.2 m、深0.8 m水泥池饲养。实验开始前将草鱼驯养1周,投喂正常日粮,待供试鱼适应环境,并确认无疾病症状后,开始实验。实验期间饲养水温的变化范围为(28±1) ℃,每天排污、换水1/4,实验周期为29 d。基础饲料组成及营养水平见表 1。
|
表 1 基础饲料组成及营养水平(风干基础) Tab.1 Composition and nutrient levels of the basal feed (air-dry basis, %) |
黄芪多糖由北京生泰尔生物科技有限公司由黄芪根部提取,含量达67.9%~69.3%。根据各组实验鱼的总体质量,在饲料中添加黄芪多糖,制成含不同黄芪多糖含量的颗粒饲料,每天按3%体质量的投饵量分别投喂Ⅱ~Ⅳ组实验鱼,根据草鱼生长情况每7 d调整一次,使各组实验鱼每千克体质量每天投喂的黄芪多糖水平分别达到10.0、30.0、50.0 mg/ kg,第Ⅰ组对照草鱼投喂未添加黄芪多糖的颗粒饲料。连续饲喂28 d。
1.3 供试菌株的培养与制备金黄色葡萄球菌(Staphylococcus aureus)购自中国药品生物制品检定所,稀释成1.0×105 CFU/mL的菌液,经福尔马林灭活后,置4 ℃冰箱中保存备用。
攻毒用菌株为珠江水产研究所鱼病室保存的嗜水气单胞菌(Aeromonas hydrophila)。经复壮后,用灭菌生理盐水制备1.0×108 CFU/mL的菌液,保存于4 ℃冰箱,当天使用。
1.4 采血试验将开始投喂黄芪多糖的前一天记作DO, 分别从各组随机取草鱼3尾,经MS-222麻醉后进行尾静脉采血;试验开始后每隔7天,即D8、D15、D22、D29各采血一次。将所得的血液分为2份,其中1份以1%肝素抗凝,用于血液白细胞吞噬活性的测定,另1份于4 ℃静置1 h,以4 000 r/min离心10 min,收集血清,供测定血清中总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、溶菌酶(LSZ)。
1.5 血液白细胞吞噬活性的测定将0.2 mL抗凝血加入0.l mL金黄色葡萄球菌悬液,混匀,28 ℃孵育45 min,其间每10 min摇匀1次。用瑞士-吉姆萨染色液染色法观察,按公式(1) 和(2) 计算吞噬活性分别以吞噬百分比(Phagocytic percentage,PP)和吞噬指数(Phagocytic index,PI)表示:
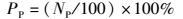 (1)
(1)
式中:PP表示吞噬百分比(%);NP表示100个吞噬细胞中参与吞噬的细胞数。
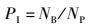 (2)
(2)
式中:NB表示吞噬细胞内的细菌总数;NP表示100个吞噬细胞中参与吞噬的吞噬细胞数。
1.6 血清相关指标测定血清相关指标包括总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和溶菌酶(LSZ),均采用南京建成生物技术研究所研制的试剂盒测定。
1.7 攻毒和保护率测定D29时,各组分别随机取鱼20尾,经腹腔注射嗜水气单胞菌液0.2 mL/尾,以评价投喂黄芪多糖后草鱼的抗病害能力。攻毒后观察7 d,对死亡的鱼体进行解剖、观察病症,并分离、纯化致病菌,通过ATB Expression自动细菌鉴定仪检测,判断是否由嗜水气单胞菌感染致死。根据公式(3) 计算免疫保护率(PR)。
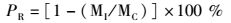 (3)
(3)
式中:PR表示免疫保护率(%);MI表示免疫组死亡率(%);MC表示对照组死亡率(%)。
1.8 数据分析及处理数据处理采用SPSS 17.0分析软件进行生物学统计,实验结果用平均值±标准差(Mean±SD)表示,用LSD法检验实验组与对照组之间的差异显著性。
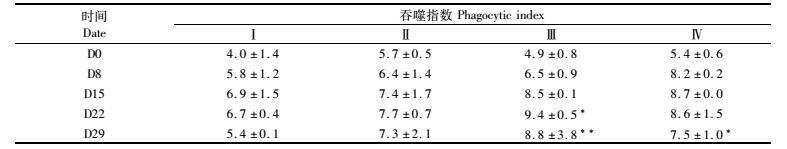
2 结果 2.1 血液白细胞吞噬活性的变化饲料中添加黄芪多糖可不同程度提高供试草鱼血液白细胞的吞噬活性,测定结果如表 2、3所示。投喂黄芪多糖的3个实验组草鱼与空白对照组相比,其血液白细胞的吞噬百分比(PP)增加(表 2),D8时,Ⅳ组PP相比于Ⅰ组增加极显著(P<0.01)。至D15时,Ⅱ~Ⅳ组PP比Ⅰ组分别增加了22.49%、23.00%、27.01%,均与组Ⅰ差异极显著(P<0.01);随着实验的进行,实验组草鱼PP增长渐缓,与对照组的差异基本为显著(P<0.05) 或极显著(P<0.01),其中第Ⅳ组有降低趋势。从表 3可知,实验组草鱼与空白对照组相比,其血液白细胞的吞噬指数(PI)也是增加的,第Ⅲ组的增幅最大,D29时第Ⅲ组比对照组Ⅰ极显著增加(P<0.01),组Ⅳ比组Ⅰ显著增加(P<0.05)。

|
表 2 黄芪多糖对草鱼血液白细胞吞噬百分比(PP)的影响 Tab.2 Effect of APS on phagocytic percentage (PP) of grass carp |
|
表 3 黄芪多糖对草鱼血液白细胞吞噬指数(PI)的影响 Tab.3 Effect of APS on phagocytic index (PI) of grass carp |
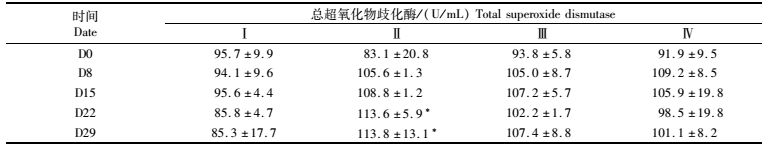
供试草鱼的血清中总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、溶菌酶(LSZ)测定结果如表 4、5、6所示,投喂黄芪多糖粉的草鱼与空白对照组相比,其血清中该3项酶活性都呈增加趋势。由表 4可知,D0-D8是实验组草鱼的T-SOD活性迅速增加阶段,第Ⅱ~Ⅳ组实验草鱼的血清T-SOD活性比第Ⅰ组对照草鱼分别增加了12.17%、11.58%和15.97%。随着实验的进行,T-SOD活性增加幅度降低,Ⅱ-Ⅳ组实验草鱼血清T-SOD活性的峰值出现时间分别是D29、D29、D8,其中第Ⅱ组的增幅最大,峰值水平高于其余各组。在整个实验期间,仅有第Ⅱ组草鱼在D22、D29时与第Ⅰ组差异显著(P<0.05)。
|
表 4 黄芪多糖对草鱼血清总超氧化物歧化酶(T-SOD)的影响 Tab.4 Effect of APS on the T-SOD activity in serum of grass carp |

|
表 5 黄芪多糖对草鱼血清过氧化氢酶(CAT)的影响 Tab.5 Effect of APS on the CAT activity in serum of grass carp |
|
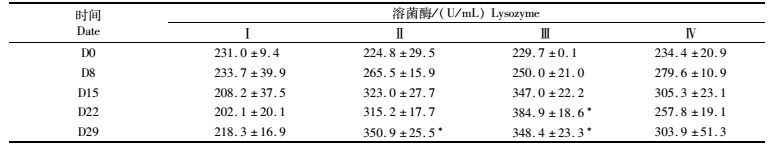
表 6 黄芪多糖对草鱼血清溶菌酶(LSZ)的影响 Tab.6 Effect of APS on the LSZ activity in serum of grass carp |
由表 5可知,实验期间实验草鱼的CAT活性持续增加,并达到稳定状态。D15时,组Ⅱ、Ⅳ比对照组Ⅰ极显著增加(P<0.01),组Ⅲ比组Ⅰ显著增加(P<0.05),D22起,各实验组均比组Ⅰ极显著增加(P<0.01)。
由表 6可知,投喂10.0、30.0 mg/kg浓度的黄芪多糖对草鱼血清LSZ活性的促进作用更明显。第Ⅱ组的LSZ活性在实验期间持续增加,D29时比对照组Ⅰ增加显著(P<0.05);第Ⅲ组的LSZ活性在实验D0-D22期间增长较快,D22时达最高值(P<0.05),D29时稍有回落(P<0.05);第Ⅳ组在D0-D8间增幅较大,增速大于第Ⅱ、Ⅲ组,至D15时达到最高值,随着实验时间的延长,LSZ活性呈震荡增减。
2.3 攻毒实验结果对照组及试验组草鱼经嗜水气单胞菌攻毒后,对死亡的鱼体进行解剖,观察病症与病原引起的症状相符,分离、纯化致病菌后,经ATB Expression自动细菌鉴定仪检测、判断是由嗜水气单胞菌感染致死。死亡率及免疫保护率的统计结果如表 7所示,投喂黄芪多糖一段时间后,实验草鱼均增强了免疫保护力,死亡率比空白对照组极显著降低(P<0.01),黄芪多糖对Ⅱ-Ⅳ组草鱼的免疫保护率分别为:54.3%±6.4%、52.9%±12.5%和44.2%±4.8%,低浓度组草鱼的抗病力高于高浓度组。

|
表 7 黄芪多糖对草鱼疾病抗性的影响 Tab.7 Effect of APS on disease resistance of grass carp |
白细胞是鱼类最重要的免疫活性细胞之一,在识别、吞噬外来病原微生物,处理和呈递抗原,激活淋巴细胞启动免疫应答以及分泌免疫因子等方面发挥着重要作用[7],其活性与功能是反映和评价鱼类免疫水平的重要指标,血液白细胞的吞噬作用对机体起着积极的保护作用[8]。虽然目前尚不明了黄芪多糖促进血液白细胞吞噬作用的机制,但本实验结果证明,黄芪多糖可提高吞噬细胞的吞噬活力,与已报道的对罗非鱼[9-10]、鲤鱼[11]、刺参[12]等拌饲投喂黄芪水提物或黄芪多糖粉的实验结果相同。本研究也发现,50.0 mg/kg的高剂量组草鱼血液白细胞吞噬百分比在D29时有所下降,与RONG[13]用含不同浓度黄芪的饲料饲喂罗非鱼的实验结果相似,实验3周后白血球吞噬活性显著提高,但到了第4周,0.5%和1.0%饲料组白血球吞噬活性则与对照组无显著性差异,这可能是因为黄芪多糖的活性成分诱导机体内cAMP水平升高,而cAMP水平的过量升高反而抑制吞噬率。
3.2 黄芪多糖对草鱼血清酶免疫作用的影响鱼类血浆相关酶活力的高低在其整个免疫防御系统中发挥着重要作用,实验室检测血清中的这些指标可以综合地判定生物机体的抗氧化与免疫情况[14],是衡量动物体非特异性免疫力的重要量化指标[15]。MARJA与ANTTI [16]认为, 在一定程度上, 血清中LSZ活性的变化与其循环系统中白细胞的数量变化呈正相关, T-SOD可以增强吞噬细胞的吞噬能力和促进免疫蛋白的产生。已有研究表明,日粮中添加黄芪多糖可不同程度地提高水产动物T-SOD、CAT和LSZ等酶的活力,其活性在一定浓度范围内均随着黄芪多糖添加水平的升高而增强, 但黄芪多糖对动物的免疫增强作用与其添加水平之间并不成直线关系[17-20]。本实验结果与此结论一致,拌饲投喂黄芪多糖对草鱼血清T-SOD、CAT、LSZ活力有明显的促进作用,随着黄芪多糖浓度的增加,血清酶活力增加不显著,T-SOD、LSZ活力增加幅度在10 mg/kg剂量组要高于30.0及50.0 mg/kg剂量组,这可能与免疫疲劳有关。
3.3 黄芪多糖对草鱼抗病能力的影响增强养殖鱼类自身免疫系统的功能,提高其抗病能力,是当前防治水产养殖动物疾病的重要途径。大量研究表明,投喂黄芪多糖可提高水产动物的抗感染能力,增强水产动物的机体免疫力水平。饲料中添加黄芪多糖长期投喂,使黄颡鱼获得了一定的免疫保护率,且与黄芪多糖添加水平存在一定的剂量关系[19];在基础饲料中添加0.8%的黄芪多糖可提高克氏原螯虾26.67%的存活率,对克氏原螯虾抗WSSV感染有很好的提高效果[21];对饲料中添加了黄芪多糖的刺参进行灿烂弧菌攻毒,发现实验组的发病率有所降低[12];以黄芪为主的复合型药用植物作为免疫增强剂按1.0%和1.5%剂量投喂鲤鱼,在攻毒实验中鲤鱼的存活率为93.3%,对照组累计死亡率达到75%[22]。本实验中,用嗜水气单胞菌攻毒实验草鱼后,3个实验组草鱼的死亡率比对照组极显著降低(P<0.01),通过长期投喂黄芪多糖草鱼获得了一定的免疫保护,低剂量组效果更佳。
3.4 黄芪多糖的作用时间对效果的影响中草药免疫增强剂的给药时间极其重要,它不同于抗生素用于疾病的发生时期或初期,免疫增强剂的主要作用在于调节或改善机体的免疫功能,即当机体的免疫功能下降或被抑制时,免疫增强剂就能提高机体的免疫能力,给药时间的长短也是免疫增强剂发挥作用的一个关键因素[22]。黄芪多糖的作用效果与时间存在相关性已在多个研究中报道,不同免疫指标在投喂黄芪多糖后,在不同时间达到峰值,而且维持峰值的时间也不尽相同[23]。采用饲喂方式给药,药物吸收慢,出现的效应时间较长,且这种给药途径在生产实践中较为实用[24]。研究发现,20 d的黄芪多糖饲喂时间能最有效地增强罗非鱼免疫相关酶的活力[17], 实验15 d、30 d时黄芪多糖对异育银鲫的非特异性免疫力有明显的促进作用,但45 d后作用效果不是很明显[19],在河蟹饲料中添加1%的含黄芪的中草药,30 d后组织中LSZ和SOD活性增幅最大,60 d后则LSZ活性趋于稳定,SOD活性达到最大[25]。本实验的研究也表明给药时间的长短是黄芪多糖发挥作用的一个关键因素,中、低剂量组草鱼的血液白细胞吞噬活性与血清酶活性随着实验时间的延长持续增加,但局限于实验仅维持29 d,未能证实这些非特异行免疫指标在此时达到最高值,还需通过进一步实验获得黄芪多糖的最佳饲喂时间。
3.5 黄芪多糖的给药剂量对效果的影响黄芪多糖的使用效果与剂量存在一定的依赖关系,但并非剂量越高越好,当添加量适宜时,多糖对免疫有促进作用,添加过量时,却会造成一定的免疫抑制现象,这与黄芪多糖的免疫调节机理和水产动物各免疫指标的作用机制有关[26],刘红柏等[27]认为黄芪多糖的双向免疫调节作用可能是黄芪多糖中总黄酮和总皂甙成分不同作用的结果,而SUNG等[28]则认为黄芪多糖浓度过高,渗透压导致机体组织调节负担过大,会使免疫力下降。张伟妮等[17]在对罗非鱼设计的500、1 000、1 500、2 000 mg/kg 4个黄芪多糖添加量中,1 000和1 500 mg/kg 2个添加量对5种免疫相关酶的作用效果均较好,过高的添加量反而会使免疫酶活性降低。向枭等[20]发现,齐口裂腹鱼的免疫能力在一定范围内随黄芪多糖的增加而增强,黄芪多糖添加水平为0.06%时,LSZ、SOD活性趋于稳定。本研究也发现了类似的规律,高剂量黄芪多糖能够在短时间内刺激鱼类免疫反应, 使鱼体非特异免疫力迅速增强,但随着时间延长并未持续增强或提升幅度较小,而中、低剂量组引起鱼类的免疫反应时间稍晚, 但在使用一段时间后, 草鱼的血液白细胞吞噬活性、血清酶T-SOD、LSZ活性及免疫保护率均比高剂量组要高,尤以10 mg/d剂量的作用效果更佳。
4 结论拌饲投喂黄芪多糖可增加草鱼血液白细胞的吞噬活性,提高T-SOD、CAT、LSZ等酶活性,降低草鱼的攻毒死亡率,使草鱼获得一定的免疫保护,总体上提升了草鱼非特异性免疫功能,尤其低剂量组的作用效果要优于高剂量组。根据以上实验结果,结合考虑饲料添加中的成本控制及拌饲投喂的流失可能性,黄芪多糖作为高效免疫增强剂应用于水产养殖业的推荐剂量为每千克鱼体质量添加10~30 mg/d。
| [1] |
李鹏飞, 杜海燕, 赵孟春. 黄芪多糖的化学和免疫学研究[J].
上海畜牧兽医通讯, 2005: 4–6.
LI P F, DU H Y, ZHAO M C. Studies on chemical and immunology of astragalus polusaccharides[J]. Shanghai Animal Husbandry and Veterinary Communications, 2005: 4–6. |
| [2] |
黄玉章, 林旋, 王全溪, 等. 黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响[J].
动物营养学报, 2010, 22(1): 108–116.
HUANG Y Z, LIN X, WANG Q X, et al. Effects of astragalus polysaccharide on structure of intestinal villus and intestinal immunocyte of tilapia[J]. Chinese Journal of Animal Nutrition, 2010, 22(1): 108–116. |
| [3] |
刘润珍, 李世雄, 姜力, 等. 黄芪多糖注射液毒理试验研究[J].
黑龙江畜牧兽医, 1996: 4–5.
LIU R Z, LI S X, JIANG L, et al. Studies on the toxicology experiment of astragalus polyose injection[J]. Animal Husbandry and Veterinary of Heilongjiang, 1996: 4–5. |
| [4] |
刘春花, 黄志斌, 石存斌, 等. 黄芪多糖对草鱼的安全性研究[J].
广东农业科学, 2012, 39(22): 142–145.
DOI:10.3969/j.issn.1004-874X.2012.22.047 LIU C H, HUANG Z B, SHI C B, et al. Effect of astragalus polysaccharides on safety of grass carp (Ctenopharyngodon idellus)[J]. Guangdong Agricultural Sciences, 2012, 39(22): 142–145. DOI:10.3969/j.issn.1004-874X.2012.22.047 |
| [5] |
李玉娟, 华颖, 邵庆均. 黄芪多糖在水产动物饲料中的应用[J].
中国饲料, 2013: 33–35.
DOI:10.3969/j.issn.1004-3314.2013.13.010 LI Y J, HUA Y, SHAO Q J. The application of astragalus polysaccharides in agriculture feed[J]. China Feed, 2013: 33–35. DOI:10.3969/j.issn.1004-3314.2013.13.010 |
| [6] |
许灵波. 黄芪多糖在动物生产中应用的研究进展[J].
中国畜牧杂志, 2015, 51(3): 84–87.
XU L B. The research progress of astragalus polysaccharides application in animal production[J]. Chinese Journal of Animal Science, 2015, 51(3): 84–87. |
| [7] | SECOMBES C J. Macrophage activation during experimental allergic orchitis in rainbow trout (Salmo gairdneri)[J]. Developmental & Comparative Immunology, 1986, 10(4): 539–546. |
| [8] | HAAPARANTA A, VALTONEN E T, HOFFMANN R, et al. Do macrophage centers in freshwater fishesreflect the differences in water quality?[J]. Aquatic Toxicology, 1996, 34(3): 253–272. DOI:10.1016/0166-445X(95)00042-3 |
| [9] |
林旋, 张伟妮, 王寿昆, 等. 黄芪多糖饲料添加剂对罗非鱼白细胞吞噬能力和免疫器官指数的影响[J].
福建农业学报, 2012, 27(1): 27–31.
LIN X, ZHANG W N, WANG S K, et al. Influence of astragalus polysaccharides on leukocyte phagocytosis activity and immune organs indexes of tilapia[J]. Fujian Journal of Agricultural Sciences, 2012, 27(1): 27–31. |
| [10] | ARDOL, YIN G J, XU P, et al. Chinese herbs (Astragalus membranaceus and Lonicera japonica) and boron enhance the non-specific immune response of Nile tilapia (Oreochromis niloticus) and resistance against Aeromonas hydrophila[J]. Aquaculture, 2008, 275(1/4): 26–33. |
| [11] | YIN G J, ARDO L, THOMPSON K D, et al. Chinese herbs (Astragalus radix and Ganoderma lucidum) enhance immune response of carp, Cyprinus carpio, and protection against Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2009, 26(1): 140–145. |
| [12] |
孙永新. 黄芪多糖促进刺参免疫力及生长性能的研究[D]. 大连: 大连理工大学, 2008.
SUN Y X. Improving effects of astragalus polysaccharides (APS) on non-specific immune responses and productive performanee of seacucumber (Apostichopus japonicus) [D]. Dalian: Dalian University of Technology, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10141-2009040456.htm |
| [13] | RONG K. Conspectus of immunopharmacology[M]. Hangzhou: Zhejiang Acdemic Press, 1987. |
| [14] |
黄玉章. 黄芪多糖对奥尼罗非鱼生长性能和免疫功能的影响[D]. 福州: 福建农林大学, 2009.
HUANG Y Z. Effects of astragalus polysaccharide on the growth performance and immune function of Oreochromis niloticus [D]. Fuzhou: Fujian Agriculture and Forestry University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10389-2009170349.htm |
| [15] |
黄峰, 张丽, 周艳萍, 等. 复合酶制剂对异育银鲫生长、SOD和溶菌酶活性的影响[J].
华中农业大学学报, 2008, 27(1): 96–100.
HUANG F, ZHANG L, ZHOU Y P, et al. Effects of Multi-enzyme Additive on the Growth Performance, SOD and Lysozyme Activity of Carassius auratus gibelio[J]. Journal of Huazhong Agricultural University, 2008, 27(1): 96–100. |
| [16] | MARJA M, ANTTI S. Changes in plasma lysozyme and blood leucocyte levels of hatchery-reared Atlantic Salmon (Salmo salar L.) and sea trout (Salmo trutta L.) during parr-smolt transformation[J]. Aquaculture, 1992, 106(1): 75–87. DOI:10.1016/0044-8486(92)90251-F |
| [17] |
张伟妮, 林旋, 王寿昆, 等. 黄芪多糖对罗非鱼非特异性免疫和胃肠内分泌功能的影响[J].
动物营养学报, 2010, 22(2): 401–409.
ZHANG W N, LIN X, WANG S K, et al. Effects of astragalus polysaccharide on nonspecific immunity and endocrine function in stomach and foregut of tilapia[J]. Chinese Journal of Animal Nutrition, 2010, 22(2): 401–409. |
| [18] |
白东清, 吴旋, 郭永军, 等. 长期投喂黄芪多糖对黄颡鱼抗氧化及非特异性免疫指标的影响[J].
动物营养学报, 2011, 23(9): 1622–1630.
BAI D Q, WU X, GUO Y J, et al. Effects of astragalus polysaccharide on antioxidant and nonspecific immune indices of yellow catfish (Pelteobagrus fulridraco) over long-term feeding[J]. Chinese Journal of Animal Nutrition, 2011, 23(9): 1622–1630. |
| [19] |
胡兵, 刘军, 侯永清, 等. 黄芪多糖对异育银鲫非特异性免疫力的影响[J].
水利渔业, 2008, 28(3): 108–111.
HU B, LIU J, HOU Y Q, et al. Effects of astragalus polysaccharide on nonspecific immunity of Carassius sauratus gibelio[J]. Reservoir Fisheries, 2008, 28(3): 108–111. |
| [20] |
向枭, 陈建, 周兴华, 等. 黄芪多糖对齐口裂腹鱼生长、体组成和免疫指标的影响[J].
水生生物学报, 2011, 35(2): 291–299.
XIANG X, CHEN J, ZHOU X H, et al. Effect of astragalus polysaccharides on growth, body composition and immune index in Schizothorax prenanti[J]. Acta Hydrobiologica Sinica, 2011, 35(2): 291–299. |
| [21] |
洪徐鹏, 陆宏达, 张庆华, 等. 黄芪多糖对克氏原螯虾抗白斑综合征病毒(WSSV)感染的效果研究[J].
上海海洋大学学报, 2014, 23(3): 423–428.
HONG X P, LU H D, ZHANG Q H, et al. Effect of astragalus polysaccharides on the anti-infection of white spot syndrome virus (WSSV) in Procambarus clarkia[J]. Journal of Shanghai Ocean University, 2014, 23(3): 423–428. |
| [22] |
简纪常, 吴灶和. 中草药对建鲤非特异性免疫功能的影响[J].
大连水产学院学报, 2002, 17(2): 115–119.
JI J C, WU Z H. Effects of Chinese herbal medicine on non-specific immuninty of Jian common carp (Cyprinus Carpio var. Jian[J]. Journal of Dalian Fisheries University, 2002, 17(2): 115–119. |
| [23] | ORTUNO J, CUESTA A, TODRIGUEZ A, et al. Oral administration of yeast, accharomyces cerevisiae, enhances the cellular innate immune response of gilthead seabream (Sparus aurata L)[J]. Veterinary Immunology and Immuopathology, 2002, 85: 41–50. DOI:10.1016/S0165-2427(01)00406-8 |
| [24] |
温周瑞, 裴家田, 王文博, 等. 一种中草药复方制剂对罗非鱼非特异免疫力的影响[J].
大连水产学院学报, 2009, 24(2): 136–140.
WEN Z R, PEI J T, WANG W B, et al. The effects of Chinese herb medicine on non-specific immunity in tilapia Oreochromis niloticus[J]. Journal of Dalian Fisheries University, 2009, 24(2): 136–140. |
| [25] |
李延友, 谢标, 陆波, 等. 中药添加剂对中华绒鳌蟹扣蟹非特异性免疫力影响的研究[J].
淡水渔业, 2005, 35(1): 3–6.
LI Y Y, XIE B, LU B, et al. Effects of Chinese herbal medicine on non-specific immunity of Chinese mitten-handed crab[J]. Freshwater Fisheries, 2005, 35(1): 3–6. |
| [26] |
李桂峰, 康裕财, 孙际佳, 等. 酵母多糖对赤眼鳟非特异性免疫机能的影响[J].
中山大学学报, 2003, 42(4): 55–58.
LI G F, KANG Y C, SUN J J, et al. The effects of yeast glucan on the Squaliobarbus curriculus non-specific immune response[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2003, 42(4): 55–58. |
| [27] |
刘红柏, 卢彤岩, 张春燕, 等. 黄芪对史氏鲟抗氧化能力及免疫力的影响[J].
大连水产学院学报, 2006, 21(3): 231–235.
LIU H B, LU Y T, ZHANG C Y, et al. Effects of the aqueous extract of astragalus root Astragalus membranaceus on immunity and antioxidation in amursturgeon (Acipenser schrencki Brandt)[J]. Journal of Dalian Fish University, 2006, 21(3): 231–235. |
| [28] | SUNG H H, KOUM G H, SONG Y L. Vibrosis resistance induced by glucan treatment in tiger shrimp (Penaeus monodon)[J]. Fish Pathology, 1994, 29(1): 11–17. DOI:10.3147/jsfp.29.11 |
2. Guangzhou Pulin Biological products Co., LTD, Guangzhou 510380, Guangdong, China
 2017,
Vol. 26
2017,
Vol. 26


