2. 国家海洋局东海环境监测中心, 上海 201206;
3. 海洋赤潮灾害立体监测技术与应用国家海洋局重点实验室, 上海 201206
石油作为现代社会主要的能源来源,全球石油贸易量为5 648万桶/日(2013),海上运输是其主要的运输方式。因触礁、装卸等人为原因造成的溢油事故以及开采过程中发生的溢油事故也日益增多[1-4]。对海洋环境造成的危害也引起了全球关注。
溢油污染对海洋生物的毒性效应的研究在国内已有许多文献报道。已有的结果表明原油水溶性组分(WAF, water-accommodated fractions)对不同的海洋生物有着显著生物毒性效应[5-6, 12]。但溢油对海洋生物的毒害不仅与水溶性组分有关,严重的海洋溢油事故会使得海水表面长期存在大范围油膜[1, 13]。油膜形成的直接后果就是阻断了海气交换,使得海水中的氧气更新速度变慢,有害气体不能及时排除[14]。随着油膜的扩展,油膜厚度变小,在风浪、湍流等作用下,开始溶解、乳化过程[15]。因而仅用原油WAF开展毒性实验并不能完全反应原油在海洋中的存在形式及其对海洋生物的毒性影响。而且低分子量的烷烃或芳香烃除蒸发进入大气外也容易经溶解乳化进入水体中[15-17],使得WAF中的毒性成分比例增加。因此,虽然国内对原油的生物毒性已有较多的研究,但溢油污染发生后形成的油污对海洋生物造成的毒性影响则需进一步地研究探索。
总体而言,国内对原油的生物毒性研究多集中于重质原油如胜利原油[5-6, 12],而利用轻质原油对海洋生物开展的毒性研究仍然较少[18]。因此本实验选用东海海域出产的轻质原油——平湖原油为受试油品,以东海区主要的几种重要经济种类,鲻鱼(Mugil cephalus)、脊尾白虾(Palaemon carincauda)、缢蛏(Sinonovacula constricta)、菲律宾蛤仔(Ruditapes philippinarum)为受试生物,进行原油及原油水溶性组分(WAF)两种存在形式下的急性毒性实验,比较毒性效应的差异,以期为确定溢油污染对海洋生态的损害评估以及赔偿提供一定依据。
1 材料与方法 1.1 材料实验所用原油为平湖原油,密度为0.766 g/cm3,按照20 ℃密度划分属于轻质原油(<0.851)。原油颜色为棕黑色,有一定透明性,流动性较好,运动粘度1.114 mm2/s,含硫0.023%。原油取自岱山石油储运分公司,产自东海平湖油气田。平湖油气田位于上海市东南约450 km处,所产原油经约300 km的海底输油管线输送至岱山岛中转站。
实验生物为鲻鱼幼鱼(体长2.2~2.8 cm,体质量0.14~0.29 g)、脊尾白虾(体长0.78~2.01 cm,体质量3.22~4.61 g),由中国水产科学研究院东海水产研究所提供;缢蛏(壳长5.9~6.4 cm、壳宽2.1~2.4 cm、壳高1.3~1.5 cm)和菲律宾蛤仔(壳长2.9~3.4 cm、壳宽2.1~2.4 cm、壳高1.3~1.4 cm)从张桥集贸市场购买。实验前在室内驯养一周,选择体质健康,行动灵活,大小相近的个体进行实验。实验海水为自然海水,经过滤后利用去离子水进行盐度调节。鲻鱼和脊尾白虾所用海水盐度为15,缢蛏和菲律宾蛤仔所用海水盐度为31,pH为7~8,溶解氧>6.0 mg/L。
1.2 方法 1.2.1 平湖原油水溶性组分(WAF)的制备参照贾晓平和林钦[19]、SINGER等[20]的方法,在密封的烧杯中,按V(平湖原油):V(过滤海水)=1:10配比,在黑暗中,使用磁力搅拌器低速搅拌24 h,搅拌时无可见涡度,减少油粒进入水体的可能性,最小化来自油粒的毒性作用,搅拌完成后静置3 h,分离下层水相,置于棕色玻璃瓶中保存。水相中石油烃浓度采用紫外分光光度法,按照海洋监测规范[21]中的操作方法进行测定。
1.2.2 实验设计依据周永欣和章宗涉[22]在《水生生物毒性实验方法》提供的急性毒性实验方法,并结合本实验目的,确定实验方法如下:
在原油急性毒性实验中,采用静水法,实验周期为96 h,实验开始前24 h停止投食,实验期间不投食、不充气。在预实验结果的基础上,每种受试生物设置5个浓度组,每个浓度组设3个平行。各浓度组分别设置为鲻鱼(0.467、0.842、1.541、2.793和5.113 g/L)、脊尾白虾(0.153、0.306、0.460、0.613和0.766 g/L)、菲律宾蛤仔(3.83、7.66、11.49、15.32和19.15 g/L, )、缢蛏(1.91、3.83、5.75、7.66和9.58 g/L)。以自然海水为对照组,每个实验容器内投放10尾受试生物。实验期间不定时观察并记录受试生物的异常行为、死亡数目后,及时将死亡生物从容器中捞出。对照组死亡率不超过10%。死亡判断标准:鱼鳃盖停止活动,鱼肚朝上漂浮于水面或沉底;脊尾白虾虾体泛白沉底,触碰尾部无反应;缢蛏和菲律宾蛤仔外壳张开无法闭合。分别统计受试生物在24 h、48 h、72 h和96 h时的死亡数量,计算每种受试生物的平均死亡率。
在WAF急性毒性实验中,同样在预实验的基础上设置5个浓度组,每个浓度组设3个平行,分别为鲻鱼(0.33、0.67、1.31、2.58、5.25 mg/L)、脊尾白虾(0.21、0.44、0.89、1.77、3.54 mg/L)、菲律宾蛤仔(1.32、2.65、5.31、7.96、10.62 mg/L, )、缢蛏(2.49、4.98、9.96、14.94、19.92 mg/L)。其他实验条件同原油急性毒性实验中的条件。
1.2.3 数据处理采用机率单位算法,使用SPSS 16.0软件对实验数据进行统计学分析,计算半致死浓度96 h LC50及95%置信区间。安全阈值的计算公式[23]为:安全阈值=96 h LC50×0.1。
2 结果 2.1 中毒症状鱼、虾类具有良好的移动能力,能在水中自由游动;而贝类移动性较差,基本在水中处于静止状态。且在实验中鱼、虾类和贝类的耐受性有着明显差异,因此对其中毒症状进行分开描述。
2.1.1 鲻鱼和脊尾白虾中毒症状暴露在原油中的鲻鱼和脊尾白虾在4~6 h内和对照组的行为并没有区别,都能够正常游动,对外界反应灵敏。约在12 h后,鲻鱼和脊尾白虾出现浮头的现象逐渐增多,从而与原油相接触的时间更多。24 h以后鲻鱼和脊尾白虾游动能力减弱,时常静伏于容器底部,游动时已有部分不能保持身体平衡,出现侧游,翻转打旋现象;对外界反应不灵敏,敲击容器壁,鱼虾并未游动回避。且随着时间延长脊尾白虾开始蜕皮,此时的脊尾白虾是最先出现死亡的,虾体色逐渐泛白。
暴露于2.58和5.25 mg/L WAF中的鲻鱼,2~3 h后即出现狂游、冲撞容器壁的现象,4 h后鲻鱼开始游动缓慢,侧游,打旋并随时间延长出现翻白肚现象或死亡下沉。在WAF中鲻鱼出现了浮头现象,这可能是由于WAF中的多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)等有毒物质造成了鲻鱼鳃部组织的感染发炎导致呼吸困难进而导致鲻鱼死亡[24-25]。
2.1.2 缢蛏和菲律宾蛤仔中毒症状除暴露在浓度分别为19.15 g/L和9.58 g/L原油中的菲律宾蛤仔和螠蛏外,其他浓度组在24 h内均未出现死亡,能够正常伸出水管和斧足,但随着原油浓度增大菲律宾蛤仔和螠蛏能正常伸出进出水管的数目逐渐减少。在较低浓度组中有的菲律宾蛤仔双壳打开,伸出斧足和水管,且斧足呈现正常肉色;缢蛏能够张开双壳将进出水管完全或部分伸出表现出较强活力。12 h后,有的菲律宾蛤仔(15.32 g/L、19.15 g/L)和螠蛏(7.66 g/L、9.58 g/L)闭壳肌逐渐松弛,双壳打开,但触碰后能够缓慢闭合双壳,对外界反应迟钝,并出现死亡现象,死亡的菲律宾蛤仔和螠蛏肌肉僵硬呈暗黄色,并散发出腥气。实验容器内的海水在24 h后出现浑浊,浑浊程度随浓度增加而加深。暴露于WAF中的菲律宾蛤仔和螠蛏的表现和暴露于原油中的表现基本相似。
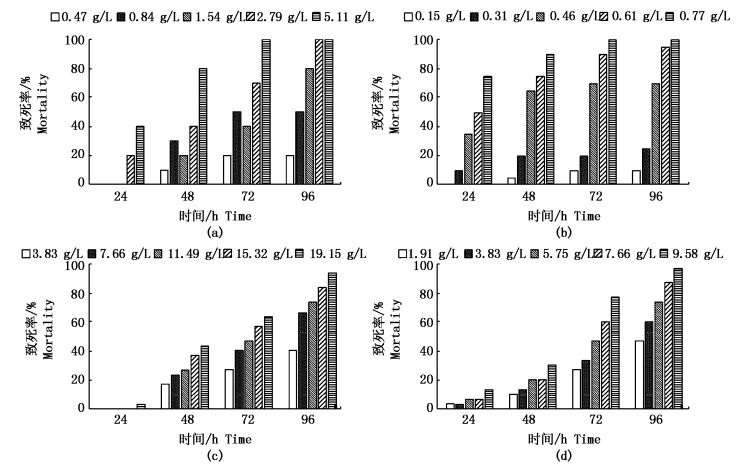
2.2 对海洋生物的急性毒性效应 2.2.1 平湖原油对海洋生物的急性毒性效应此次实验中在不同浓度的平湖原油以及原油的水溶性组分对4种海洋生物的死亡率随时间的变化如图 1所示。通过SPSS软件处理得出了平湖原油及原油的水溶性组分对鲻鱼、脊尾白虾、缢蛏、菲律宾蛤仔的剂量效应关系式、相关系数和96 h LC50(表 1)。
|
图 1 不同浓度平湖原油对鲻鱼(a)、脊尾白虾(b)、菲律宾蛤仔(c)和缢蛏(d)死亡率随时间的变化情况
Fig. 1 Mortality of M. cephalus(a), P. carincauda(b), R. philippinarum(c)and S.constrictain (d) exposed to different concentrations of Pinghu crude oil
|
|
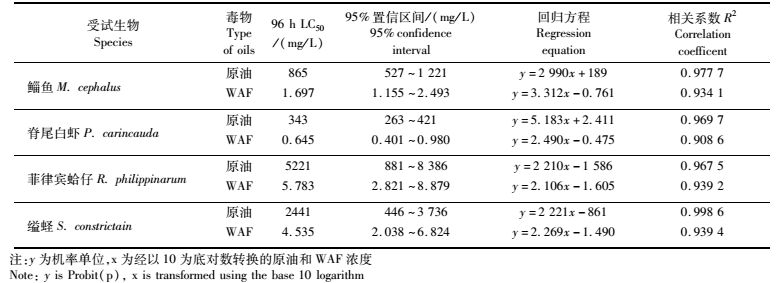
表 1 平湖原油及原油WAF对鲻鱼、脊尾白虾、菲律宾蛤仔和缢蛏的急性毒性 Tab.1 Actue toxicity of Pinghu crude oil and WAF on M. cephalus, P. carincauda, R. philippinarum and S.constricta |
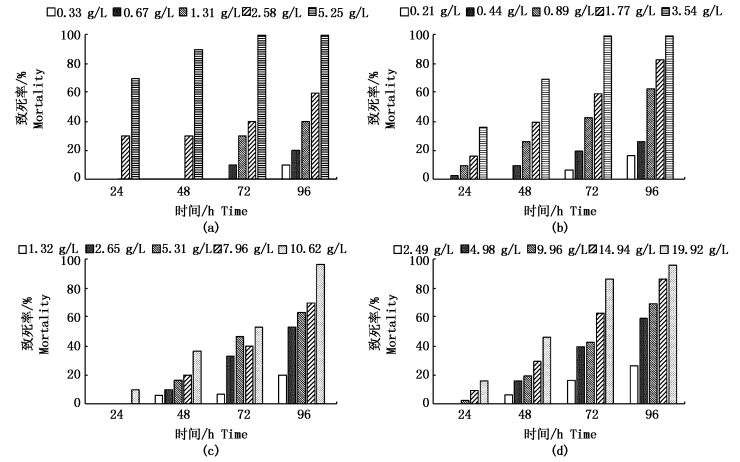
此次实验中不同浓度的原油的水溶性组分(WAF)对4种海洋生物的死亡率随时间的变化如图 2所示。通过SPSS软件处理得出了平湖原油及原油的水溶性组分对鲻鱼、脊尾白虾、缢蛏、菲律宾蛤仔的剂量效应关系式、相关系数和96 h LC50(表 1)。
|
图 2 不同浓度原油WAF对鲻鱼(a)、脊尾白虾(b)、菲律宾蛤仔(c)和缢蛏(d)死亡率随时间的变化情况
Fig. 2 Mortality of M. cephalus(a), P. carincauda(b), R. philippinarum(c) and S.constrictain (d) in different concentrations of Pinghu crude oil water-accommodated fractions
|
平湖原油及原油WAF对鲻鱼、脊尾白虾、缢蛏、菲律宾蛤仔的96 h LC50如表 1所示。平湖原油对鲻鱼、脊尾白虾、菲律宾蛤仔、缢蛏的96 h LC50为865 mg/L、343 mg/L、5 221 mg/L、2 441 mg/L,原油WAF对鲻鱼、脊尾白虾、菲律宾蛤仔、缢蛏的96 h LC50为1.697 mg/L、0.645 mg/L、4.535 mg/L、5.783 mg/L。
平湖原油对鲻鱼、脊尾白虾、缢蛏和菲律宾蛤仔的安全阈值分别为86.5 mg/L、34.3 mg/L、244.1 mg/L、522.1 mg/L;原油的水溶性组分(WAF)对鲻鱼、脊尾白虾、缢蛏和菲律宾蛤仔的安全阈值分别为0.169 7 mg/L、0.064 5 mg/L、0.453 5 mg/L和0.578 3 mg/L。
根据表 2所示的化学物质的急性毒性分级标准,原油的水溶性组分(WAF)对4种受试生物的毒性属于高毒性而平湖原油属于低毒性。但在溢油污染对海洋生物的损害评估中,通常采用的是WAF的LC50值[26]。

|
表 2 化学物质的急性毒性分级 Tab.2 Toxicity grading criteria of chemical material |
本实验结果表明,平湖原油对鲻鱼、脊尾白虾、缢蛏和菲律宾蛤仔都存在显著的剂量效应关系。在实验中,不同海洋生物对原油的耐受性也有明显不同,贝类>鱼类>虾类。这可能是因为鱼类及虾类具有游泳能力,在游动过程中与漂浮在海水表面的油膜相接触从而误食原油,而贝类作为底栖生物并不会与油膜有直接接触。贾晓平等的研究表明在暴油后鱼类和虾类消化道均能观察到油粒[10]。也可能是由于部分原油粘附在鱼虾的鳃部后导致缺氧死亡。但随着时间的延长,原油在水中溶解的低分子量烃类及多环芳烃的浓度升高[27],而PAHs对海洋生物有着显著毒性,且由于油膜的形成导致气体交换变差,海水中溶解氧的含量下降也会导致缺氧的发生[28]。因而造成位于容器底部的贝类死亡。
3.2 水溶性组分(WAF)对受试生物的毒性效应从表 1中可知,原油和WAF对鲻鱼的96 h LC50分别为865和1.697 mg/L;对脊尾白虾分别为343和0.645 mg/L;对缢蛏分别为2 441和4.535 mg/L;对菲律宾蛤仔分别为5 221和5.783 mg/L。以96 h LC50值为判别标准,对4种受试生物而言,原油的水溶性组分(WAF)的毒性大于原油本身对海洋生物的毒性。而造成这种情况的原因可能是由于WAF能够与海洋生物即刻发生接触,并产生毒害作用[29-30]。且WAF溶液通过机械搅拌增大了芳烃类物质在水相中的比例[31]。而毒性大小与低分子量组分和芳烃类化合物的组成比例及含量有着直接关系[32]。平湖原油是轻质油中的一种,而轻质油的组分中芳烃类等低分子量组分浓度较高,使得轻质油毒性高于重油类[18]。许多文献也得出了相同的结论,轻质油WAF的毒性高于重油的毒性[10, 33-34]。
3.3 不同受试生物的毒性效应比较从平湖原油及原油WAF的急性毒性试验中可以得出4种海洋生物对平湖原油和原油WAF的耐受能力总体表现出了相同顺序,贝类>鱼类>虾类。而贾晓平[19]和孙林宝等[7]的研究表明,对南海原油及柴油WAF的耐受力同样表现为贝类>鱼类>虾类。同样在沈新强等[32]的研究中也表现了相同的结果。在本实验中,除在最低浓度(1.32 mg/L)的WAF之外,其他浓度组中菲律宾蛤仔往往双壳紧闭,收回斧足及水管,减少或停止滤水滤食。而1.32 mg/L浓度的WAF中菲律宾蛤仔仅在8~12 h能够打开双壳,伸出水管,打开的数量也随时间慢慢减少直至全部闭合。而鱼类、虾类则会通过体表、鳃等组织与水体中的有毒物质持续接触,可能这种身体结构上的差异造成了贝类的耐受性较强。
4 结论平湖原油和原油WAF对4种海洋生物(鲻鱼、脊尾白虾、菲律宾蛤仔、缢蛏)均有明显毒性效应。平湖原油对鲻鱼、脊尾白虾、菲律宾蛤仔和缢蛏的96 h LC50(95%置信区间)为865 mg/L(527~1 221 mg/L)、343 mg/L(263~421 mg/L)、5 221 mg/L(881~8 386 mg/L)和2 441 mg/L(446~3 736 mg/L);WAF对鲻鱼、脊尾白虾、菲律宾蛤仔、缢蛏的96 h LC50为1.697 mg/L(1.155~2.493 mg/L)、0.645 mg/L(0.401~0.980 mg/L)、4.535 mg/L(2.821~8.879 mg/L)、5.783 mg/L(2.038~6.824 mg/L)
以96 h LC50值为判别标准,受试生物对平湖原油和原油WAF的耐受能力表现出了相同顺序,贝类>鱼类>虾类。
| [1] | SAMMARCO P W, KOLIAN S R, WARBY R A F, et al. Distribution and concentrations of petroleum hydrocarbons associated with the BP/Deepwater Horizon Oil Spill, Gulf of Mexico[J]. Marine Pollution Bulletin, 2013, 73(1): 129–143. DOI:10.1016/j.marpolbul.2013.05.029 |
| [2] | HUIJER K. Trends in oil spills from tanker ships 1995-2004[R]. London: The International Tanker Owners Pollution Federation (ITOPF), 2005. |
| [3] | PAN G C, QIU S Y, LIU X, et al. Estimating the economic damages from the Penglai 19-3 oil spill to the Yantai fisheries in the Bohai Sea of northeast China[J]. Marine Policy, 2015, 62: 18–24. DOI:10.1016/j.marpol.2015.08.007 |
| [4] |
温艳萍, 吴传雯. 大连新港"7.16溢油事故"直接经济损失评估[J].
中国渔业经济, 2013, 31(4): 91–96.
WEN Y P, WU C W. The direct economic damage assessment caused by the "7.16 oil spill accident"[J]. Chinese Fisheries Economic, 2013, 31(4): 91–96. |
| [5] |
田丽粉, 任仲, 崔毅, 等. 胜利原油对褐牙鲆仔稚鱼的急性毒性和幼鱼碱性磷酸酶的影响[J].
海洋水产研究, 2008, 29(6): 95–100.
TIAN L F, REN Z, CUI Y, et al. Acute toxicity of Shengli crude oil and its impact on AKP activity of Paralichthys olivaceus[J]. Marine Fisheries Research, 2008, 29(6): 95–100. |
| [6] |
夏斌, 陈碧鹃, 李传慧, 等. 胜利原油对半滑舌鳎肝脏超氧化物歧化酶和过氧化氢酶活性的影响[J].
渔业科学进展, 2011, 32(1): 53–59.
XIA B, CHEN B J, LI C H, et al. Effect of Shengli crude oil on the activities of superoxide dismutase and catalase in the liver of Tongue sole Cynoglossus semilaevis[J]. Progress in Fishery Sciences, 2011, 32(1): 53–59. |
| [7] |
张林宝, 孙伟, 黄南建, 等. 0#柴油水溶性成分对菲律宾蛤仔抗氧化防御系统的影响[J].
南方水产科学, 2015, 11(6): 65–72.
ZHANG L B, SUN W, HUANG N J, et al. Effect of No.0 diesel oil water-soluble fraction on antioxidant defense systems of Manila clam (Ruditapes philippinarum)[J]. South China Fisheries Science, 2015, 11(6): 65–72. |
| [8] |
李磊, 蒋玫, 王云龙, 等. 0#柴油和原油水溶性成分在黑鲷(Sparus macrocephlus)体内的富集动力学[J].
应用与环境生物学报, 2014, 20(2): 286–290.
LI L, JIANG M, WANG Y L, et al. Accumulation kinetics of water accommodated fraction in No.0 fuel oil and Pinghu crude oil in Sparus macrocephlus[J]. Chinese Journal of Applied & Environmental Biology, 2014, 20(2): 286–290. |
| [9] |
熊德琪, 刚锰, 吕福荣, 等. 0#柴油分散液对马粪海胆CAT活性的影响[J].
大连海事大学学报, 2010, 36(3): 112–115.
XIONG D Q, GANG M, LÜ F R, et al. Effects of No.0 diesel oil dispersion liquid on CAT activity of Hemicentrotus pulcherrimus[J]. Journal of Dalian Maritime University, 2010, 36(3): 112–115. |
| [10] |
贾晓平, 林钦, 蔡文贵, 等. 原油和燃油对南海重要海水增养殖生物的急性毒性试验[J].
水产学报, 2000, 22(1): 32–36.
JIA X P, LIN Q, CAI W G, et al. Toxicity of crude oil and fuel oils to important mariculture and multiplication organisms of South China Sea[J]. Journal of Fisheries of China, 2000, 22(1): 32–36. |
| [11] |
王振, 郑森林, 刘文华, 等. 原油水溶性成分对斜带髭鲷受精卵及仔鱼的急性毒性效应[J].
台湾海峡, 2010, 29(3): 367–372.
WANG Z, ZHENG S L, LIU W H, et al. Acute toxic effects of the water accommodated fraction of crude oil on Hapalogenys nitens zygotes and larvae[J]. Journal of Oceanography in Taiwan Strait, 2010, 29(3): 367–372. |
| [12] |
陈民山, 范贵旗. 胜利原油对海洋鱼类胚胎及仔鱼的毒性效应[J].
海洋环境科学, 1991, 10(2): 1–5.
CHEN M S, FAN G Q. Toxic effects of Shengli crude oil on marine fish embryos and larvae[J]. Marine Environmental Science, 1991, 10(2): 1–5. |
| [13] |
田立杰, 张瑞安. 海洋油污染对海洋生态环境的影响[J].
海洋湖沼通报, 1999: 65–69.
TIAN L J, ZHANG R A. The effect of offshore oil pollution on marine ecological environment[J]. Transactions of Oceanology and Limnology, 1999: 65–69. |
| [14] |
曲维政, 邓声贵. 灾难性的海洋石油污染[J].
自然灾害学报, 2001, 10(1): 69–74.
QU W Z, DENG S G. Disastrous ocean pollution of petroleum[J]. Journal of Natural Disasters, 2001, 10(1): 69–74. |
| [15] |
吴晓丹, 宋金明, 李学刚, 等. 海洋环境中的溢油风化过程[J].
海洋科学, 2010, 34(6): 104–110.
WU X D, SONG J M, LI X G, et al. Weathering processes of spilled oil in marine environments[J]. Marine Sciences, 2010, 34(6): 104–110. |
| [16] | DÍEZ S, JOVER E, BAYONA J M, et al. Prestige oil spill. Ⅲ. Fate of a heavy oil in the marine environment[J]. Environmental Science & Technology, 2007, 41(9): 3075–3082. |
| [17] |
杨庆霄, 徐俊英, 李文森. 海上溢油溶解过程的研究[J].
海洋学报, 1994, 16(3): 50–56.
YANG Q X, XU J Y, LI W S. Dissolution processes of spilled oil in ocean[J]. Acta Oceanologica Sinica, 1994, 16(3): 50–56. |
| [18] |
赵升, 周瑞佳, 刘一霆, 等. 重质原油和轻质原油对卤虫的毒理学研究[J].
现代农业科技, 2016: 199–200, 204.
ZHAO S, ZHOU R J, LIU Y T, et al. The toxicity research of heavy crude and light crude oil on artemia[J]. Modern Agricultural Science and Technology, 2016: 199–200, 204. |
| [19] |
贾晓平, 林钦. 南海原油和燃料油对仔虾和仔鱼的急性毒性试验[J].
热带海洋, 1998, 17(1): 93–98.
JIA X P, LIN Q. Toxicity of Nanhai crude oil and fuel oils to larval shrimps and larval fishes[J]. Tropic Oceanology, 1998, 17(1): 93–98. |
| [20] | SINGER M M, AURAND D, BRAGIN G E, et al. Standardization of the preparation and quantitation of water-accommodated fractions of petroleum for toxicity testing[J]. Marine Pollution Bulletin, 2000, 40(11): 1007–1016. DOI:10.1016/S0025-326X(00)00045-X |
| [21] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378. 4-2007海洋监测规范第4部分: 海水分析[S]. 北京: 中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378.4-2007 The specification for marine monitoring—Part 4: seawater analysis[S]. Beijing: China Standard Publishing House, 2008. |
| [22] |
周永欣, 章宗涉. 水生生物毒性试验方法[M]. 北京: 农业出版社, 1989: 192-200.
ZHOU Y X, ZHANG Z S. Toxicity Test Method of Aquatic Organism[M]. Beijing: Agriculture Press, 1989: 192-200. |
| [23] |
邱郁春. 水污染鱼类毒性实验方法[M]. 北京: 中国环境科学出版社, 1992: 60-62.
QIU Y C. Test Method for Toxicity of Water Contaminated Fish[M]. Beijing: China Environmental Science Press, 1992: 60-62. |
| [24] |
蒋闰兰, 肖佰财, 禹娜, 等. 多环芳烃对水生动物毒性效应的研究进展[J].
海洋渔业, 2014, 36(4): 372–384.
JIANG R L, XIAO B C, YU N, et al. Research advance in toxic effects of PAHs on aquatic animals[J]. Marine Fisheries, 2014, 36(4): 372–384. |
| [25] | BENTIVEGNA C S, COOPER K R, OLSON G, et al. Chemical and histological comparisons between Brevoortia sp. (menhaden) collected in fall 2010 from Barataria Bay, LA and Delaware Bay, NJ following the DeepWater Horizon (DWH) oil spill[J]. Marine Environmental Research, 2015, 112: 21–34. DOI:10.1016/j.marenvres.2015.08.011 |
| [26] |
沈新强, 袁骐. 溢油事故对水产养殖损害评估方法的探讨[J].
安全与环境学报, 2013, 13(3): 132–135.
SHEN X Q, YUAN Q. On the damage assessment of the oil spilling and leaking accidents for the aquaculture[J]. Journal of Safety and Environment, 2013, 13(3): 132–135. |
| [27] |
赵云英, 杨庆霄. 溢油在海洋环境中的风化过程[J].
海洋环境科学, 1997, 16(1): 45–52.
ZHAO Y Y, YANG Q X. Weathering processes of spilled oil in the marine environment[J]. Marine Environmental Science, 1997, 16(1): 45–52. |
| [28] | BELLAS J, SACO-ÁLÜAREZ L, NIETO Ó, et al. Evaluation of artificially-weathered standard fuel oil toxicity by marine invertebrate embryogenesis bioassays[J]. Chemosphere, 2013, 90(3): 1103–1108. DOI:10.1016/j.chemosphere.2012.09.015 |
| [29] | ENGELHARDT F R, WONG M P, DUEY M E. Hydromineral balance and gill morphology in rainbow trout Salmo gairdneri, acclimated to fresh and sea water. As affected by petroleum exposure[J]. Aquatic Toxicology, 1981, 1(3/4): 175–186. |
| [30] |
张爱君, 邹洁, 马兆党, 等. 石油污染对牡蛎超显微结构毒性效应的研究[J].
海洋环境科学, 2006, 25(s1): 6–10.
ZHANG A J, ZOU J, MA Z D, et al. Research on the toxic effect of petroleum pollution on ultramicroscopic structures of Pacific oyster (Crassostrea Gigas)[J]. Marine Environmental Science, 2006, 25(s1): 6–10. |
| [31] |
陈皓鋆, 房建孟, 印春生, 等. 经消油剂处理的石油水溶组分对刺参幼参的急性毒性研究[J].
海洋环境科学, 2012, 31(3): 414–417.
CHEN H Y, FANG J M, YIN C S, et al. Acute toxicity of chemical enhanced water accommodated fraction of dispersed oil to Apostichopus japonicas Juveniles[J]. Marine Environmental Science, 2012, 31(3): 414–417. |
| [32] |
沈新强, 蒋玫, 李磊. 溢油分散剂处理平湖原油对海洋生物的急性毒性效应[J].
农业环境科学学报, 2015, 34(12): 2272–2279.
DOI:10.11654/jaes.2015.12.004 SHEN X Q, JIANG M, LI L. Acute toxic effects of oil dispersant-treated Pinghu crude oil on marine organisms[J]. Journal of Agro-Environment Science, 2015, 34(12): 2272–2279. DOI:10.11654/jaes.2015.12.004 |
| [33] | EKANEM A P, ASUQUO F E, NDICK E J. Toxicity of crude oil to fresh water shrimp, Macrobrachium macrobrachion and Macrobrachium vollenhovenii from nigerian coastal water[J]. Bulletin of Environmental Contamination and Toxicology, 2011, 86(4): 394–397. DOI:10.1007/s00128-011-0229-8 |
| [34] | ANDERSON J M, NEFF J M, COX B A, et al. Characteristics of dispersions and water-soluble extracts of crude and refined oils and their toxicity to estuarine crustaceans and fish[J]. Marine Biology, 1974, 27(1): 75–88. DOI:10.1007/BF00394763 |
2. East China Sea Environmental Monitoring Center, SOA, Shanghai 201206, China;
3. Key Laboratory of Integrated Monitoring and Applied Technology for Marine Harmful Algal Blooms, SOA, Shanghai 201206, China
 2017,
Vol. 26
2017,
Vol. 26


