2. 上海海洋大学 水域环境生态上海高校工程研究中心, 上海 201306;
3. 中国科学院南海海洋研究所 热带海洋生物资源与生态重点实验室, 广东 广州 510301
近年来,随着海水养殖产业的迅猛发展,海水养殖海域污染日益严重,逐渐对近岸生态环境产生影响[1],造成近岸海洋生物多样性减少[2-3]。目前,近岸多采用高密度的投饵养殖方式,经过长期的大规模养殖,养殖过程中产生的残饵和养殖动物的代谢废物在养殖区大量积累,加之养殖环境封闭,水流交换缓慢等因素,更加速水体有机污染[4]和富营养化[5]。
目前针对富营养化水体的修复方法主要包括物理修复、化学修复和生物修复。其中,物理修复存在效果短暂、不稳定、治标不治本的缺点;化学修复一般是通过投放、泼洒化学物质对水体进行改善,费用较高且容易造成二次污染[6];目前应用较为广泛的为生物修复[7]。其中,大型海藻作为生物滤器技术从20世纪70年代逐渐发展起来,通过在海区栽培大型海藻如菊花心江蓠[8]、海带和紫菜[9]等大型海藻进行原位修复,利用大型海藻吸收水体营养盐进而达到改善水质的目的。目前在大型藻类与鱼[10-11]、虾[12-14]、贝类[15-16]等多种养殖生物[17]的综合养殖模式方面均有相关的研究报道。
碧海金沙围隔海域位于上海市奉贤区,杭州湾北岸,建成于2005年,是大型封闭性围隔海区。整个围隔全长3 834m,围海面积约2.30 km2,距海岸线平均距离600 m。该海域现主要用于海水养殖,养殖种类主要为斑节对虾(Penaeus monodon)、凡纳滨对虾(Litopenaeus vannamei)、拟穴青蟹(Scylla paramamosain)、海蜇(Rhopilema esculentum)和缢蛏(Sinonovacula constricta)等。由于高密度的养殖生产活动,碧海金沙围隔海域已经呈现严重的富营养化态势。
鉴于封闭围隔海域受外界影响较小,水体稳定,可以作为天然的实验围隔开展相关科学问题的研究。为此,本实验于2015年1—12月进一步开展了对碧海金沙围隔海水养殖海域水质评价研究,同时开展了底栖天然藻场群落结构及生物量的调查研究,评估其对海水养殖海域的水质修复能力。本文的研究结果将为近岸海水养殖海域海藻场构建及其对水质修复能力的评估提供参考,并为近岸海水养殖产业的可持续发展提供技术支撑。
1 材料与方法 1.1 研究区域站位设置碧海金沙围隔海域于每年的3月15日—25日在涨潮期间开启水闸,从东海引入海水,平均水位从(1.5±0.2) m涨至(3.2±0.2) m。于每年12月15—25日在退潮期间开启水闸,将围隔海域的海水排至外海,排水后深水区平均水深为(1.8±0.3) m,浅水区均干出。根据围隔海区的生境特征和养殖情况,设置12个采样点(图 1),于2015年1月—12月,每月在固定站点采集水样。

|
图 1 碧海金沙采样站位图
Fig. 1 The sketch map of sampling sites in enclosed bay
|
海水样品的采集、保存和运输按照《海洋调查规范》(GB12763.4—2007) 进行[18]。在每个调查站位应用Niskin采水器采集表层(水面下0.5~0.8 m)3个水样作为重复,迅速导入500 mL磨口玻璃瓶中,保存在4 ℃冰箱中备用,所有样品在24 h内完成测定。应用碘量法测定溶解氧(DO)含量,碱性高锰酸钾氧化法测定化学需氧量(COD),采用荷兰Skalar水质分析仪测定硝态氮(NO3-N)、亚硝态氮(NO2-N)、氨氮(NH4-N)和磷酸盐(PO4-P),本文以NO3-N、NO2-N和NH4-N之和作为溶解无机氮(DIN),以PO4-P作为溶解无机磷(DIP)。
1.2.2 水质评价方法采用有机物污染评价指数(A)和营养状态指数(E)对调查海域水质进行评价。
有机物污染评价指数公式如下[19]:
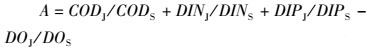 (1)
(1)
式中:A代表有机污染指数;CODJ、DINJ、DIPJ、DOJ分别代表COD、DIN、DIP和DO的一类海水水质标准值,其值分别为2.0 mg/L、0.20 mg/L、0.015 mg/L和6 mg/L,CODS、DINS、DIPS和DOS分别为各指标的实测浓度。有机污染分级:A<0,水质良好;A=0~1,水质较好;A=1~2,水质开始受到污染;A=2~3,水质属轻污染;A=3~4,水质属中污染;A>4,水质属重污染。
营养状态指数公式如下[20]:
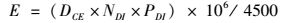 (2)
(2)
式中:E代表营养状态指数;DCE代表化学需氧量浓度(mg/L);NDI表示溶解无机氮浓度(mg/L);PDI表示PO4-P浓度(mg/L)。当E<0.5时,表明水体呈贫营养化;当0.5≤E<1.0时,表明水体呈中营养状态;当1.0≤E<3.0时,表明水体呈富营养状态;当E≥3.0时,表明水体呈现高富营养状态;E值越大,水体富营养化程度越严重。
1.3 藻种鉴定于2015年3月和12月,在各站位采集底栖藻类,洗净、沥干后带回实验室。选取结构较完整的鲜活藻体,观察藻体形状,并运用Olympus BX61显微镜观察藻体表面细胞排列、大小及内含物情况,然后运用ITS和5S rDNA分子鉴定技术进一步藻种分子鉴定。
1.4 藻体生物量和总氮磷含量测定 1.4.1 藻体生物量测定于2015年3月蓄水前和2015年12月放水后,用1 m×1 m样方沿西南-东北方向每隔200 m进行底栖藻体的采集,用过滤海水(0.45 μm醋酸纤维滤膜)洗净后分别称重(精确至0.01 kg)、测定长度(精确至0.1 cm),计算其生物量。
1.4.2 藻体总氮(TN)、总磷(TP)含量测定采集调查海区的底栖海藻样品,用过滤海水将表面的泥沙等污物冲洗干净,放于密封塑料袋中低温运回实验室,在实验室条件下,用蒸馏水冲洗3~5次,置于80 ℃烘箱中烘干至恒重,藻体中TN和TP的测定分别采用凯氏定氮法和磷-钒钼酸比色法[21],所得数据以实验材料的干重百分比(%,m/m)表示。
1.5 数据分析数据通过Excel 2010初步处理后运用Origin 7.0和Surfer 8.0软件进行作图分析。SPSS 16.0软件处理并进行单因素方差分析(ANOVA),当P<0.05时被认为差异显著,所得数据运用平均值±标准差表示。
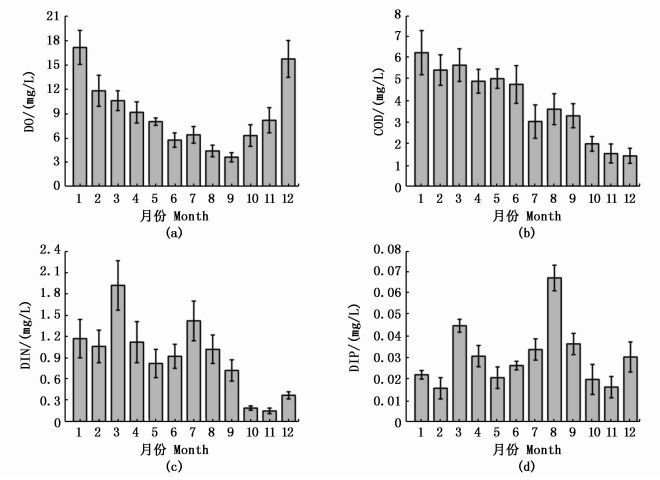
2 结果 2.1 碧海金沙全年水化指标变化由图 2可知,水体中DO、COD、DIN和DIP含量全年变化显著(P<0.05)。DO含量除8、9月份外,其他月份均大于5.00 mg/L,整体呈现先降低后升高的趋势。1月份水体中COD含量最高,之后全年整体呈下降趋势。DIN含量在1—4月份均高于1.00 mg/L,平均为(1.32±0.9) mg/L,11月份含量最低,为(0.15±0.03) mg/L。DIP和DIN整体变化趋势一致,DIP含量全年共3个月低于0.02 mg/L,在3月和8月份出现两个高峰,分别为(0.045±0.003) mg/L和(0.068±0.005) mg/L。
|
图 2 2015年奉贤碧海金沙水质主要指标变化
Fig. 2 Varitions of DO, COD, DIN and DIP in enclosed bay throughout 2015
|
调查发现,COD全年有5个月均处于劣Ⅳ类。DIN在1—7月份和12月份水质均处于劣Ⅳ类,而DIP全年6个月处于Ⅱ类,5个月处于Ⅲ类水质,在10—12月为Ⅰ~Ⅱ类水质。
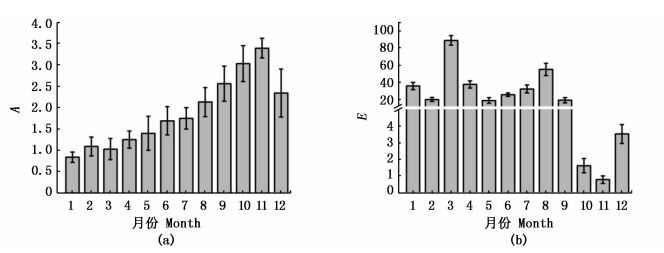
从图 3可以看出,碧海金沙全年富营养化情况变化显著(P<0.05)。有机污染指数A从1月至11月呈递增的趋势,变化较明显(P<0.05),2—7月围隔海域开始受到有机污染,10月和11月属于中度有机污染。富营养化指数E显示,1—9月份水质处于高富营养化状态,10—12月属于富营养化状态。
|
图 3 有机污染指数(A)和富营养化指数(E)变化情况
Fig. 3 The variations of organic pollution index and eutrophication index in enclosed bay
|
藻体深绿至黄绿色,管状膜质,高6~18 cm,单条或基部有少许分枝。主干直径0.7~1.0 mm,分枝与主干相似,藻体由下向上渐粗,下部管状或近似圆柱形,上部有时略为压扁,自基部到顶端细胞整齐纵列,体厚23 μm。切面观细胞在藻体的中央或略向外侧偏移,细胞表面观直径11~15 μm(图 4)。进一步应用ITS序列分析,建立系统发育树(图 5),可确定调查海域绿藻种类为曲浒苔(Ulva flexuosa)。
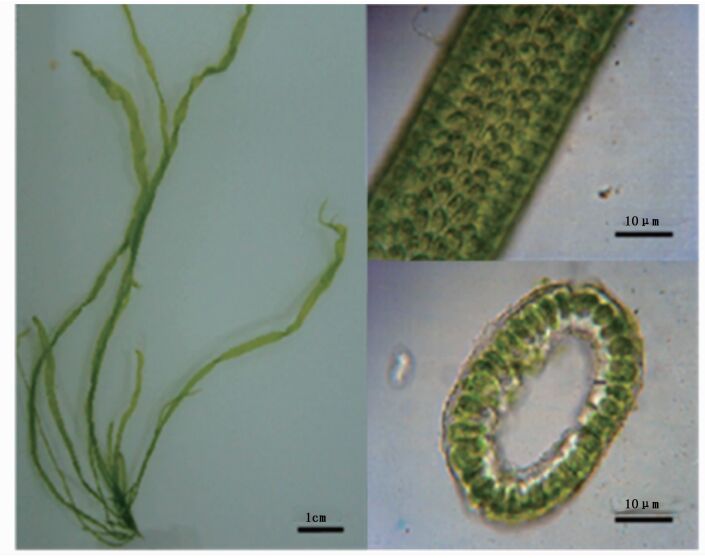
|
图 4 曲浒苔形态学特征
Fig. 4 The morphology characters of U. flexuosa
|

|
图 5 曲浒苔系统发育树
Fig. 5 The phylogenetic tree of U. flexuosa
|
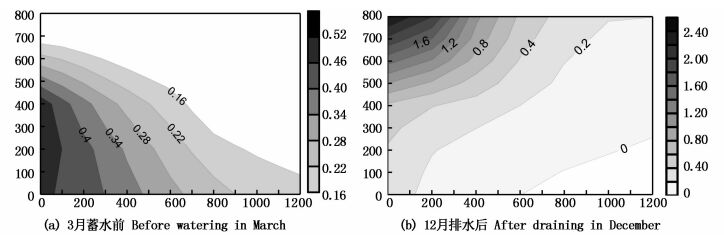
分别于2015年3月份蓄水前和12月份排水后,运用同样方法对围隔海域天然底栖藻场的生物量(表 1)和分布(图 6)进行调查。结果表明,整个养殖区蓄水前滩涂面积约为1.61 km2,经过1月至3月的干出,均无藻类生长。围隔深水区面积约为0.69 km2,底部有零散底栖的曲浒苔,单位面积生物量为(0.13±0.01) kg/m2。12月份排水后,无人机航拍显示,整个围隔海域均有底栖浒苔分布,在围隔西北角的下风处密度最大,单位面积生物量为(2.41±0.19) kg/m2。经测定,曲浒苔干物质含氮量为3.50%±0.02%,含磷量为0.13%±0.01%,曲浒苔的干湿比为8.31%±0.08%。结合对整个海域生物量的调查,可计算出通过一年的生长,底栖曲浒苔对整个围隔海域水中氮磷的吸收量分别为(4 354.90±46.78) kg和(161.75±1.74) kg。

|
表 1 碧海金沙底栖浒苔生物量统计 Tab.1 The biomass of benthic U. flexuosa in enclosed bay |
|
图 6 碧海金沙围隔海域底栖曲浒苔蓄水前和排水后的空间分布
Fig. 6 The spatial distribution of benthic U. flexuosa population before watering in March and after draining in December
横纵坐标为围隔海区长度和宽度(m);黑色代表藻体生物量(kg/m2) The vertical and horizontal coordinates are the length and width of the seabed area(m); The black represents the biomass of the U. flexuosa(kg/m2) |
合理利用海洋环境是实现海洋渔业资源及其可持续发展的重要保障,而海洋的富营养化是海水养殖对海洋环境污染的集中表现[22]。近海养殖多采用精养或网围等集约型的养殖模式,大量的残饵和养殖生物的排泄物是造成养殖海水富营养化最大的原因[23]。PAEZ-OSUNA等[24]通过研究养殖海域底泥中的物质平衡发现,在养殖过程中沉积在底泥中的TN、TP和颗粒物分别占饵料投入量的24%、84%和93%。此外,WALLIN和HAKASON[25]研究报道,投喂饲料中除15%~30%的磷被鱼利用外,其他51%~59%以颗粒形式存在,16%~26%溶解水中。本研究结果显示,奉贤碧海金沙3月份蓄水时DIN和DIP浓度均出现高峰,这与水源为外海杭州湾有关[26]。3—5月份未进行大规模养殖活动,且随着温度的升高,藻类加速生长并吸收水体中的营养盐,DIN和DIP浓度逐渐下降。5月中旬共投放海蜇20万个,共投喂冰鲜鱼饵料总量达15 t,投放鸡粪、牛粪等有机肥30 t。5月底投放斑节对虾约2 000万尾,凡纳滨对虾700万尾,先后投喂斑节对虾配合饲料3 t(配合饲料:粗蛋白≥42.0%,总磷≥1.0%)。水质监测结果显示,5—8月份DIN和DIP浓度上升。8—12月份没有投喂任何饲料,开始对养殖动物进行捕捞,DIN和DIP浓度缓慢下降。由于养殖海域为全封闭环境,蒸发、降水等活动带来的水质变化可忽略不计,故可认为除地理因素[27]、人工投饵、养殖动物代谢外,无其他的物质交换方式,据此推断,碧海金沙围隔海区水质变化与养殖活动密切相关。
大型藻类与养殖动物具有生态位上的互补性,利用大型海藻在生长过程中的光合作用吸收利用水中的无机碳(DIC)[28],同时吸收养殖动物排放到水体中代谢产物和残饵分解所释放的无机营养盐[29],达到净化养殖水体的作用。大量的营养盐会随着海藻的收获而转移至陆地,不仅可以作为对N、P等污染物有效的生物过滤器,成为富营养化海域生物修复的有效途径[30],还可以创造经济价值,弥补部分因投料残饵造成的经济损失。除此之外,大型海藻还能固碳、产生氧气,调节水体的pH,通过吸附作用提高水体透明度,从而达到对养殖环境的生物修复和生态调控作用[31]。本实验测得底栖藻类曲浒苔经过10个月的生长繁殖,总生物量增加了1 497.3 t,对养殖水体氮磷的吸收量分别为(4 354.90±46.78) kg和(161.75±1.74) kg。根据围隔海域水体的总体积和水体全年平均氮磷含量,可知碧海金沙围隔海域水体中氮磷总量为66 976.00 kg和2 281.60 kg,因此曲浒苔种群固定总氮磷量分别占围隔海区水体总氮磷量的6.50%和7.09%。而水质监测结果显示,养殖海域水质有机污染指数A值全年平均值为1.88±0.21,表明水体开始受到污染;富营养化指数E值全年平均值为29.95±1.18,属重度富营养化状态。因此,虽然碧海金沙自然底栖大型藻类对养殖水体的营养盐吸收起到了重要作用,但依靠系统本身大型藻类种类和生物量尚未达到对水质进行修复的需求,养殖水体富营养化仍较严重。据调查,碧海金沙围隔海域内生长的曲浒苔种群生物量并未进行人工收获,曲浒苔所同化的氮磷并未从环境中移出,最终仍会随着自身的消亡释放水中。
综合考虑碧海金沙特殊的地理位置和当地的养殖情况,目前的养殖模式不利于当地养殖产业的可持续发展。本文研究表明,近岸海水养殖海域底栖浒苔种群尚不能平衡由于海水养殖生产活动产生的营养负荷。因此,一方面可以具有高生长率的海藻进行底栖海藻场的构建,另一方面可筛选出经济价值较高、耐低盐、耐高温的大型海藻,开展多营养层次的综合养殖(Integrated Multi-trophic Aquaculture, IMTA),是治理近岸海域养殖富营养化水体和实现生态修复的重要途径[32]。
| [1] | YU J, YANG Y F. Physiological and biochemical response of seaweed Gracilaria lemaneiformis to concentration changes of N and P[J]. Journal of Experimental Marine Biology and Ecology, 2008, 367(2): 142–148. DOI:10.1016/j.jembe.2008.09.009 |
| [2] |
舒廷飞, 罗琳, 温琰茂. 海水养殖对近岸生态环境的影响[J].
海洋环境科学, 2002, 21(2): 74–79.
SHU T F, LUO L, WEN Y M. Effects of mariculture on coastal ecological environment[J]. Marine Environmental Science, 2002, 21(2): 74–79. |
| [3] |
高文胜, 刘宪斌, 张秋丰, 等. 渤海湾近岸海域浮游动物多样性[J].
海洋科学, 2014, 38(4): 55–60.
GAO W S, LIU X B, ZHANG Q F, et al. Species diversity of zooplankton in the coastal area of Bohai Bay[J]. Marine Sciences, 2014, 38(4): 55–60. |
| [4] |
董双林, 潘克厚, BROCKMANNU. 海水养殖对沿岸生态环境影响的研究进展[J].
青岛海洋大学学报, 2000, 30(4): 575–582.
DONG S L, PAN K H, BROCKMANN U. Review on effects of mariculture on coastal environment[J]. Journal of Ocean University of Qingdao, 2000, 30(4): 575–582. |
| [5] |
蔡继晗, 李凯, 郑向勇, 等. 水产养殖对环境的影响及其防治对策分析[J].
水产养殖, 2010, 31(5): 32–38.
CAI J H, LI K, ZHENG X Y, et al. The influences of aquaculture on environment and the prevention strategy analysis[J]. Journal of Aquaculture, 2010, 31(5): 32–38. |
| [6] |
柴召阳, 何培民. 我国海洋富营养化趋势与生态修复策略[J].
科学, 2013, 65(4): 48–52.
DOI:10.3969/j.issn.2095-6002.2013.04.011 CHAI Z Y, HE P M. Trends of marine eutrophication in China and ecological restoration strategy[J]. Science, 2013, 65(4): 48–52. DOI:10.3969/j.issn.2095-6002.2013.04.011 |
| [7] |
杨圣云, 许振祖. 优化养殖水域生态系统结构的若干途径[J].
海洋科学, 1997: 42–43.
YANG S Y, XU Z Z. Ways in optimizing structure of culture water ecosystem[J]. Marine Sciences, 1997: 42–43. |
| [8] |
汤坤贤, 游秀萍, 林亚森, 等. 龙须菜对富营养化海水的生物修复[J].
生态学报, 2015, 25(11): 3044–3051.
TANG K X, YOU X P, LIN Y S, et al. A study on bioremediation of eutrophication of mariculture waters by Gracilaria lemaneaformis[J]. Acta Ecologica Sinica, 2015, 25(11): 3044–3051. |
| [9] |
孙琼花. 大型海藻对养殖废水营养盐吸收及海区的生物修复[D]. 福州: 福建师范大学, 2013.
SUN Q H. Nutrients absorption of aquaculture wastewater and bioremediation of sea area by macroalgae[D]. Fuzhou: Fujian Normal University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10394-1013308376.htm |
| [10] | VANDERMEULEN H, GORDIN H. Ammonium uptake using Ulva (Chlorophyta) in intensive fishpond systems: mass culture and treatment of effluent[J]. Journal of Applied Phycology, 1990, 2(4): 363–374. DOI:10.1007/BF02180927 |
| [11] | CHOPIN T, YARISH C, WILKES R, et al. Developing Porphyra/salmon integrated aquaculture for bioremediation and diversification of the aquaculture industry[J]. Journal of Applied Phycology, 1999, 11(5): 463–472. DOI:10.1023/A:1008114112852 |
| [12] | NELSON S G, GLENN E P, CONN J, et al. Cultivation of Gracilaria parvispora (Rhodophyta) in shrimp-farm effluent ditches and floating cages in Hawaii: a two-phase polyculture system[J]. Aquaculture, 2001, 193(3/4): 239–248. |
| [13] |
王吉桥, 靳翠丽, 张欣, 等. 不同密度的石莼与中国对虾的混养实验[J].
水产学报, 2001, 25(1): 32–37.
WANG J Q, JIN C L, ZHANG X, et al. Polyculture of experiment Penaeus chinensis with various biomass of Ulva pertusavar[J]. Journal of Fisheries of China, 2001, 25(1): 32–37. |
| [14] | MARINHO-SORIANO E, MORALES C, MOREIRA W S C. Cultivation of Gracilaria (Rhodophyta) in shrimp pond effluents in Brazil[J]. Aquaculture Research, 2002, 33(13): 1081–1086. DOI:10.1046/j.1365-2109.2002.00781.x |
| [15] | EVANS F, LANGDON C J. Co-culture of dulse Palmaria mollis and red abalone Haliotis rufescens under limited flow conditions[J]. Aquaculture, 2000, 185(1/2): 137–158. |
| [16] |
郑辉, 李志伟. 贝藻混养生态系统模拟实验研究[J].
海洋科学, 2014, 38(10): 52–55.
DOI:10.11759/hykx20140427001 ZHENG H, LI Z W. Simulation of the polyculture ecosystem of scallop (Argopecten irradias) and kelp (Ulva pertusavar)[J]. Marine Science, 2014, 38(10): 52–55. DOI:10.11759/hykx20140427001 |
| [17] |
冯翠梅, 田相利, 董双林, 等. 两种虾、贝、藻综合养殖模式的初步比较[J].
中国海洋大学学报, 2007, 37(1): 69–74.
FENG C M, TIAN X L, DONG S L, et al. Comparative studies on two integrated culture patterns of shrimp with oyster and seaweeds[J]. Periodical of Ocean University of China, 2007, 37(1): 69–74. |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12763. 4—2007海洋调查规范第4部分: 海水化学要素调查[S]. 北京: 中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 12763. 4-2007 Specifications for oceanographic survey—Part 4: Survey of chemical parameters in sea water[S]. Beijing: China Standard Press, 2008. |
| [19] |
田家怡, 董景岳. 黄河口附近海域有机污染与赤潮生物的初步调查研究[J].
海洋环境科学, 1983, 2(1): 46–53.
TIAN J Y, DONG J Y. A preliminary investigation on the Yellow River estuary waters near the organic pollution and red tide organisms[J]. Marine Environmental Science, 1983, 2(1): 46–53. |
| [20] |
钱国栋, 汉红燕, 刘静, 等. 近30年胶州湾海水中主要化学污染物时空变化特征[J].
中国海洋大学学报, 2009, 39(4): 781–788.
QIAN G D, HAN H Y, LIU J, et al. Spatiotemporal changes of main chemical pollutants for the last thirty years in the Jiaozhou Bay[J]. Periodical of Ocean University of China, 2009, 39(4): 781–788. |
| [21] |
中国科学院南京土壤研究所. 土壤理化性质分析[M]. 上海: 上海科技出版社, 1987: 191-197.
Nanjing Institute of Soil Science Chinese Academy of Sciences. Analysis of Soil Physical and Chemical Properties[M]. Shanghai: Shanghai Science and Technology Press, 1987: 191-197. |
| [22] |
倪海儿, 王国良. 网箱养殖大黄鱼溃疡病的预报模型[J].
水产学报, 2009, 33(2): 334–341.
NI H E, WANG G L. The forecasting model for incidence of ulcer disease of large yellow croaker (Pseudosciaena crocea) in marine cage culture[J]. Journal of Fisheries of China, 2009, 33(2): 334–341. |
| [23] |
王福表. 网箱养殖水污染及其治理对策[J].
海洋科学, 2002, 26(7): 24–26.
WANG F B. The water pollution introduced by aquiculture using net-cage and countermeasures controling of IT[J]. Marine Sciences, 2002, 26(7): 24–26. |
| [24] | PÁEZ-OSUNA F. The environmental impact of shrimp aquaculture: a global perspective[J]. Environmental Pollution, 2001, 112(2): 229–231. DOI:10.1016/S0269-7491(00)00111-1 |
| [25] | WALLIN M, HAKANSON L. Nutrient loading models for estimating the environmental effects of marine fish farms[M]//MAKINEN T. Marine Aquaculture and Environment. Copenhagen: Nordic Council of Ministers, 1991, 22: 39-55. |
| [26] |
李俊龙, 郑丙辉, 张铃松, 等. 中国主要河口海湾富营养化特征及差异分析[J].
中国环境科学, 2016, 36(2): 506–516.
LI J L, ZHENG B H, ZHANG L S, et al. Eutrophication characteristics and variation analysis of estuaries in China[J]. China Environmental Science, 2016, 36(2): 506–516. |
| [27] |
姚婷, 张蓬, 赫春香, 等. 大连湾和杭州湾表层沉积物中多氯联苯和有机氯农药及风险评价[J].
海洋科学, 2014, 38(7): 47–56.
DOI:10.11759/hykx20130728001 YAO T, ZHANG P, HE C X, et al. Distribution and ecological risk assessment of polychlorinated biphenyls and organochlorine pesticides in marine sediments of Dalian Bay and Hangzhou Bay[J]. Marine Science, 2014, 38(7): 47–56. DOI:10.11759/hykx20130728001 |
| [28] |
何培民, 刘媛媛, 张建伟, 等. 大型海藻碳汇效应研究进展[J].
中国水产科学, 2015, 22(3): 588–595.
HE P M, LIU Y Y, ZHANG J W, et al. Research progress on the effects of macroalgae on carbon sink[J]. Journal of Fishery Sciences of China, 2015, 22(3): 588–595. |
| [29] |
邹定辉, 夏建荣. 大型海藻的营养盐代谢及其与近岸海域富营养化的关系[J].
生态学杂志, 2011, 30(3): 589–595.
ZOU D H, XIA J R. Nutrient metabolism of marine macroalgae and its relationship with coastal eutrophication: A review[J]. Chinese Journal of Ecology, 2011, 30(3): 589–595. |
| [30] |
毛玉泽, 杨红生, 王如才, 等. 大型藻类在综合海水养殖系统中的生物修复作用[J].
中国水产科学, 2005, 12(2): 225–231.
MAO Y Z, YANG H S, WANG R C, et al. Bioremediation capability of large-sized seaweed in integrated mariculture ecosystem: A review[J]. Journal of Fishery Sciences of China, 2005, 12(2): 225–231. |
| [31] | HALLING C, AROCA A, CIFUENTE M, et al. Comparison of spore inoculated and vegetative propagated cultivation methods of Gracilaria chilensis in an integrated seaweed and fish cage culture[J]. Aquaculture International, 2005, 13(5): 409–422. DOI:10.1007/s10499-005-6977-x |
| [32] |
蒋增杰, 方建光, 毛玉泽, 等. 海水鱼类网箱养殖的环境效应及多营养层次的综合养殖[J].
环境科学与管理, 2012, 37(1): 120–124.
JIANG Z J, FANG J G, MAO Y Z, et al. Environmental effect of marine fish cage aquaculture and integrated multi-trophic aquaculture[J]. Environmental Science and Management, 2012, 37(1): 120–124. |
2. Water Environment and Ecology Engineering Center of Shanghai Institute of Higher Education, Shanghai 201306, China;
3. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, Guangdong, China
 2017,
Vol. 26
2017,
Vol. 26


