2. 中国水产科学研究院长江水产研究所, 湖北 武汉 430223
鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus-2, CyHV-2) 感染养殖鲫引起的鲫造血器官坏死症是近年来我国新发生与流行的高度传染性疾病,死亡率高达90%以上,给鲫鱼养殖业带来了巨大的经济损失[1-2]。目前,预防水产养殖动物传染性疾病特别是病毒性疾病最为有效的方法是疫苗免疫,而鱼类病毒性疾病疫苗研制与免疫预防技术研究依赖于病毒病原敏感细胞系的建立。2015年,MA等首次建立了支持鲤疱疹病毒Ⅱ型稳定复制的异育银鲫脑组织细胞系(GiCB),为研究鲤疱疹病毒Ⅱ型的感染机理与防治技术提供了重要基础材料[3]。ZHANG等在GiCB细胞上利用细胞瓶贴壁法制备了鲤疱疹病毒Ⅱ型灭活疫苗[4],研究了疫苗的免疫保护效果与应答规律。但利用细胞瓶贴壁培养方式大规模培养细胞和病毒,不仅耗时耗力,且产量有限,质量稳定性控制困难。利用微载体规模化培养细胞与病毒,是20世纪九十年代发展起来的技术[5-7],其具有细胞贴壁表面积大、产量高等优点,克服了传统细胞与病毒大规模培养的缺陷,为细胞、病毒大规模培养以及疫苗制备技术的进一步发展作出了重要贡献。在鱼类细胞培养中,叶雪平等[8]和陈志宏等[9]利用GT-2微载体和生物反应器分别对草鱼的吻端细胞ZC-7901和胚胎细胞CP-80以及草鱼呼肠孤病毒的培养条件进行了研究。刘秋凤等[10]利用微载体细胞培养技术规模化培养草鱼肾脏细胞和草鱼呼肠孤病毒并制备了草鱼出血病疫苗,为草鱼出血病的有效防控奠定了基础。
本文研究了微载体规模化培养鲫脑组织细胞和鲤疱疹病毒Ⅱ型的工艺,确定了间歇搅拌条件、血清浓度、微载体浓度、细胞接种密度以及搅拌速度等最适培养条件或参数,并通过病毒感染试验,利用微载体悬浮培养的GiCB细胞规模化培养了CyHV-2,为规模化制备CyHV-2疫苗奠定了基础。
1 材料与方法 1.1 细胞系与病毒鲫脑组织细胞系(GiCB)由本实验室建立[3]。培养条件:含10%新生牛血清的M199,pH 7.0~7.2,温度28 ℃。鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2,CyHV-2) 由本实验室分离鉴定[3]。
1.2 试剂与仪器主要试剂与仪器:M199培养基(Sigma);血清(浙江省杭州四季青生物工程材料有限公司);胰蛋白酶(Sigma);PBS(Sigma);Cephodex微载体(山东省滨州贝尔凯瑞生物技术有限公司),直径100~150 μm;双侧臂细胞培养搅拌瓶(Wheaton,USA),容积为4 L;Micro-Stir低速磁力搅拌器(Wheaton,USA);倒置显微镜(Nikon,日本);离心机(Sigma 3K-15,德国)。
1.3 种子细胞与病毒培养T-75 cm2细胞培养瓶(Croning, USA)以1:2传代培养种子细胞。以感染复数(Multiplicity of Infection,MOI)为0.2的CyHV-2病毒接种GiCB细胞,当细胞病变效应(Cytopathic effect,CPE)至90%左右时收获细胞培养物,-80 ℃反复冻融3次,4 ℃ 4 500 r/min离心30 min,去除细胞碎片,将病毒上清置于-80 ℃保存备用。
MOI值的计算:
 (1)
(1)
式中:VV为接种病毒的体积;Xm为接种病毒时的细胞量。
1.4 Cephodex微载体预处理工作体积为400 mL,分别按3、6、9 g/L的微载体浓度称取后,置于盛有150 mL无Ca2+、Mg2+ PBS(50~100 mL/g Cephodex)的洁净烧杯中,充分搅拌使其在PBS中分散混悬,并用新鲜的100 mL PBS(30~50 mL/g Cephodex)溶液重复清洗2次,微载体经水化后于121 ℃高压蒸汽灭菌30 min,置4 ℃冰箱备用。
1.5 间歇搅拌条件对GiCB细胞贴壁的影响细胞在上球贴附阶段采用间歇搅拌方式进行培养,贴附时间为8 h。实验分组见表 1。
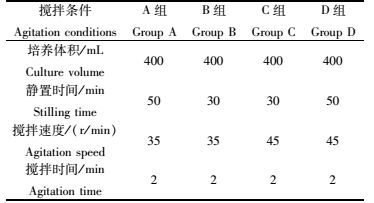
|
表 1 贴壁期间歇搅拌条件 Tab.1 Agitation conditions during cell attachment |
细胞贴壁率的计算公式[11]:
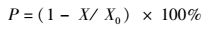 (2)
(2)
式中:X为培养液中的游离细胞数; X0为细胞接种数。
空球率的计算:取样至于载玻片上,显微镜观察并计算100个以上微载体中空球所占的比例。
1.6 血清浓度对GiCB细胞贴壁的影响细胞贴附期间,分别用含0%、5%、10%、15% FBS浓度的M199培养液进行培养,每30 min间歇搅拌2 min,贴附8 h后取样,测定细胞贴壁率。
1.7 最适微载体用量的确定微载体用量设置3个浓度,分别为3、6和9 g/L,细胞接种密度为2.5×105 cells/mL,血清浓度为10%,在28 ℃培养箱中以转速35 r/min,每静置30 min搅拌2 min的间歇搅拌方式促进贴壁,8 h后以45 r/min的转速连续搅拌生长,每天取样观察GiCB细胞在微载体上的生长情况,并进行细胞计数,绘制生长曲线。
1.8 最适细胞接种密度的确定微载体用量为6 g/L, 血清浓度为10%,以1.0×105 cells/mL、2.5×105 cells/mL、4.0×105 cells/mL的密度接种细胞,培养总体积400 mL,培养条件如1.7所述,每天取样观察GiCB细胞在微载体上的生长情况,并进行细胞计数,绘制生长曲线。
1.9 最适搅拌速度的确定微载体的用量为6 g/L,血清浓度为10%,细胞接种密度为2.5×105 cells/mL,细胞经8 h间歇搅拌后进行连续搅拌,转速分别为35、45、55 r/min,每天取样,观察微载体上细胞生长和增殖情况,并用台盼蓝计数法计数细胞,绘制生长曲线,确定最适搅拌速度。
1.10 细胞形态观察与计数细胞贴附8 h后,在均匀悬浮状态下定时取样2 mL静置,去上清,PBS清洗,1 000 r/min离心5 min,弃上清后加入1 mL 0.25%的胰酶溶液消化细胞,并用等量的10%的M199培养基终止消化,吸管吹打直至细胞从微载体上脱落,台酚蓝法计数细胞;同样方法取样,在倒置显微镜下观察细胞在微载体表面的生长状态。
1.11 病毒感染及电镜观察采用最优的工艺条件培养GiCB细胞,工作体积为400 mL,待形成微载体细胞单层后,静置3~5 min,弃培养液,以MOI为0.2的CyHV-2病毒液接种细胞,每15 min摇晃一次促进病毒吸附,1 h后,加入血清浓度2%的M199维持液至终体积400 mL,低速磁力搅拌器上以40 r/min的转速连续搅拌。在接种病毒后24、36、48、60、72、96和120 h取微载体细胞样,用PBS清洗两次后,2.5%的戊二醛固定2 h,经脱水、干燥等处理后,将制好的样品在扫描电子显微镜上观察微载体细胞病变情况。
1.12 病毒增殖曲线测定在1.11的培养条件下,分别在接种病毒后1、12、24、48、60、84、108和120 h时取细胞培养液2 mL,于-80 ℃反复冻融3次,4 ℃ 5 000 r/min离心30 min去除细胞碎片,用Reed-Muench法进行TCID50(半数组织培养感染剂量)的测定[12],设3次重复测定试验,绘制病毒增殖动态曲线。Reed-Muench TCID50公式计算:
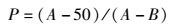 (3)
(3)
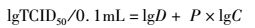 (4)
(4)
式中:P为距离比例;A为高于50%CPE率;B为低于50%CPE率;D高于50%的稀释度;C稀释系数。
1.13 病毒增殖曲线测定所有的实验至少重复3次。数据以平均值±标准偏差的形式表示,采用Welch校正的非配对t检验。P≥0.05认为无显著性差异,用“ns”表示;P<0.05认为差异显著,用“*”表示;P<0.01认为差异非常显著,用“**”表示;P<0.001认为差异极显著,用“***”表示。
2 结果 2.1 GiCB细胞静置培养的形态及病变效应正常GiCB细胞在培养瓶中静置培养,其轮廓清晰,形态均一,为成纤维样细胞,传代后3~5d可长满单层,细胞单层稳定(图版Ⅰ-1)。CyHV-2接种GiCB后2d细胞开始病变,5d左右可见明显的细胞病变效应(CPE)。与正常细胞相比,病变的细胞收缩、变圆,折光度增加,细胞碎片增多,细胞拉长,最后细胞单层崩解呈破渔网状(图版Ⅰ-2)。

|
图版Ⅰ 静置培养条件下CyHV-2感染GiCB细胞的细胞病变效应 PlateⅠ Cytopathic effect of CyHV-2 infected GiCB cells during stilling culture 1.正常GiCB细胞;2.病毒感染5 d后的GiCB细胞 1. normal GiCB cells; 2. cytopathic effect in GiCB cells after CyHV-2 infection at 5 d post-infection |
不同的间歇搅拌条件(A、B、C、D组)对细胞的贴壁率的影响见图 1。B组GiCB细胞贴壁率最高,为90%左右,D组其次,C组细胞贴壁率最低。倒置显微镜下观察,D组GiCB细胞在微载体上分布很不均匀,与A组均呈现部分细胞抱团生长的现象,且间歇搅拌时微载体细胞不能均匀的悬浮在培养基中;C组GiCB细胞空球现象明显,空球率近50%;B组GiCB细胞较均匀分布在每个微载体上,细胞空球率最低,约5%左右。因此确定B组为GiCB细胞贴附期的最适间歇搅拌条件。

|
图 1 间歇搅拌条件对GiCB细胞贴壁率的影响
Fig. 1 Effects of stirring method on the attachment efficiency of GiCB cells
P≥0.05认为无显著性差异,用“ns”表示;P<0.05认为差异显著,用“*”表示;P<0.01认为差异非常显著,用“**”表示,图 2同 ns indicate there was no significant difference between two groups (P≥0.05); * indicate there was a significant difference between two groups (P < 0.05); ** indicate there was a very significant difference between two groups(P<0.01), the same in fig. 2 |

|
图 2 不同血清浓度对GiCB细胞贴壁率的影响
Fig. 2 Effects of different FBS concentrations on GiCB attachment efficacy
|
细胞经过8 h的间歇搅拌贴附期后,不同血清浓度对细胞贴壁率的影响见图 2。血清浓度为0%时,细胞贴壁率显著低于其他组;血清浓度为5%时,细胞贴壁速度较慢且贴壁率相对较低;血清浓度为10%和15%时,细胞贴壁率相近,均为90%左右,且在倒置显微镜下观察细胞在微载体上的贴附状态和铺展状况无显著差异。考虑到细胞在后期生长过程中对营养成分的需求以及血清成本因素,选择细胞贴壁期合适的血清浓度为10%。
2.4 微载体浓度对细胞生长的影响固定细胞接种浓度为2.5×105 cells/mL,不同的微载体浓度随时间的变化对细胞密度的影响不同(图 3)。随着微载体浓度的升高,最大细胞密度也随之升高。当微载体浓度为3 g/L时,细胞密度在72 h时达到最大后随之下降。微载体浓度为6 g/L和9 g/L时,60 h内细胞的生长趋势相近,在84 h左右细胞密度达到最大,分别是1.93×106 cells/mL和2.05×106 cells/mL;但84 h后,浓度为9 g/L组细胞密度下降较6 g/L组明显。综合考虑,最适微载体浓度选择6 g/L。
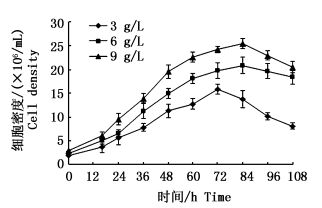
|
图 3 不同Cephodex浓度下GiCB细胞生长曲线
Fig. 3 Growth curves of GiCB cells with different Cephodex concentrations
|
不同的细胞接种密度对细胞在微载体上生长曲线见图 4。当接种密度为1.0×105 cells/mL时,微载体的空载较高,细胞增殖速度缓慢,能达到的最大细胞密度最低。细胞接种密度为4.0×105 cells/mL时,倒置显微镜下观察微载体上分布的细胞数量高,但在84 h后出现了多个微载体聚集、细胞团聚的现象,此后部分细胞开始出现脱落,108 h细胞密度下降明显。在2.5×105 cells/mL的接种密度下,细胞在微载体表面分布较均匀,达到稳定期的时间与细胞密度和4.0×105 cells/mL的接种密度时相近,微载体上细胞单层稳定。因此,选择微载体培养GiCB细胞时的最佳接种密度为2.5×105 cells/mL。

|
图 4 不同细胞接种密度对GiCB细胞生长的影响
Fig. 4 Effects of inoculated cell densities on the growth of GiCB cells
|
固定细胞接种浓度为2.5×105 cells/mL,不同搅拌速度下对细胞在微载体上生长曲线见图 5。当转速为35 r/min时,细胞在培养液中不能充分悬浮,易引发细胞团的聚结、汇合,显微镜下观察细胞在微载体表面分布不均匀;当转速为55 r/min时,84 h后微载体上的细胞开始脱落,细胞团崩解,上清液中可见有少量细胞团的存在,细胞生长状态一般;当转速为45 r/min时,细胞的生长密度有所增加,且在96 h时细胞仍保持良好的生长状态。因此选择GiCB细胞生长期的最佳搅拌速度为45 r/min。
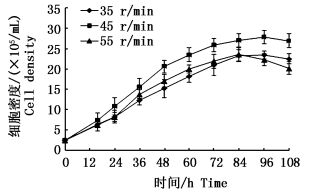
|
图 5 不同搅拌速度下GiCB细胞生长曲线
Fig. 5 Growth curves of GiCB cells at different stirring speeds
|
按优化后的培养条件进行微载体细胞培养, 分别在接种后12、24、48和72 h后取样, 用倒置显微镜和扫描电子显微镜进行观察(图版Ⅱ),结果均显示GiCB细胞在Cephodex微载体上生长良好。在接种12 h后细胞大部分贴附在微载体表面(图版Ⅱ-2),但只有部分细胞开始铺展;24 h后贴附的细胞迅速分裂增殖,在微载体空白表面延伸包覆,以类似于方瓶培养的形式单层生长, 细胞开始在微载体之间迁移(图版Ⅱ-4);48 h后细胞已基本长满微载体表面,细胞的轮廓开始模糊,部分细胞已贴附于首层细胞之上生长(图版Ⅱ-3,5);72 h后90%以上的细胞在微载体上呈现多层生长的状态,微载体之间出现了多“架桥”的现象(图版Ⅱ-6)。

|
图版Ⅱ GiCB细胞在Cephodex微载体表面的形态观察 PlateⅡ Morphology of GiCB cells growth on Cephodex microcarriers 倒置显微镜观察:(1) 空载体,(2)12 h,(3)48 h;扫描电镜观察:(4)24 h,(5)48 h,(6)72h,细胞“架桥” Inverted microscopy: (1) Empty microcarriers; (2)12 h; (3)48 h; Scan electron microscopy: (4)24 h; (5)48 h; (6)72 h, cell "bridge" |
在最优的工艺条件下接种CyHV-2,分别在倒置显微镜与扫描电镜下观察微载体上细胞的病变情况,可看到明显的CPE(图版Ⅲ)。在病毒感染后36 h,微载体细胞单层被破坏(图版Ⅲ-1),微载体间的细胞“架桥”断裂,细胞出现皱缩变圆凝集,病变细胞之间的空隙增大,此时60%的粘连微载体已解离成单个微载体,96 h后细胞裂解并从微载体表面脱落下来(图版Ⅲ-4,5),在微载体上留下因细胞脱落后膜碎片形成的痕迹或细胞碎片,120 h时微载体上的细胞病变脱落率达90%(图版Ⅲ-2,3),此时收集培养病毒。于96孔微量培养板(Coming,USA)上进行收集病毒滴度的测定,按照Reed-Muench方法计算收获液的病毒滴度为106.50±0.30 TCID50/mL。
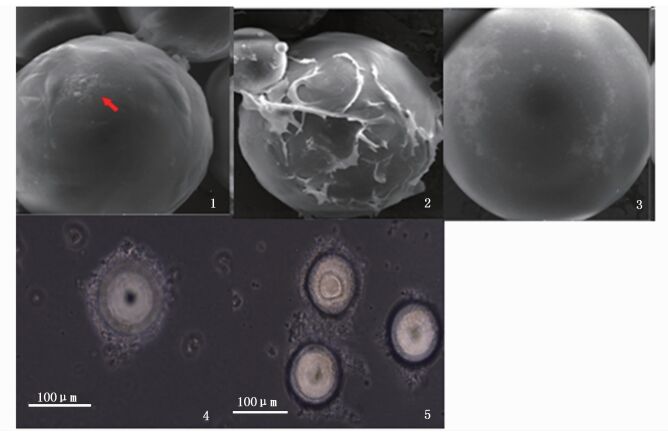
|
图版Ⅲ GiCB细胞在Cephodex微载体表面的细胞病变效应 PlateⅢ Cytopathie effects of GiCB cells on microcarrier infected with CyHV-2 扫描电镜观察:(1)36 h, (2)60 h, (3)120 h;倒置显微镜下观察:(4)48 h, (5)96 h Scan electron microscopy: (1)36 h, (2)60 h, (3)120 h; Inverted microscopy: (4)48 h, (5)96 h |
微载体培养条件下CyHV-2的增殖动态如图 6。病毒接种细胞12 h后,病毒滴度开始上升,24 h后病毒增殖进入对数生长期,96 h后病毒增殖减慢,108 h左右病毒滴度达到最大,之后趋于稳定,经计算病毒滴度(TCID50/mL)可达106.50±0.30。
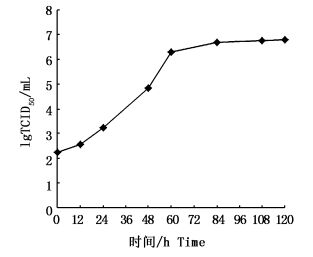
|
图 6 CyHV-2在微载体培养条件下的增殖动态
Fig. 6 Proliferation dynamics of CyHV-2 in microcarrier culture system
|
微载体悬浮培养技术具有单位表面积大、细胞培养密度高、成本低廉等优点,是疫苗规模化生产工艺的发展方向[13-14]。微载体细胞培养是否成功很大程度上决定于细胞贴壁率的高低[15-16]。本研究发现间歇搅拌时的静置时间和搅拌速度对细胞贴壁效率影响较大。静置时间的长短影响细胞在微载体上分布的均匀性,静置时间越长,分布越不均匀;反之细胞贴壁不牢或未贴壁的细胞越多。搅拌速度的增加可提高微载体表面细胞分布的均匀性,但当转速过大时(>65 r/min)细胞贴壁率却降低甚至造成细胞的死亡,可能是高转速产生的剪切力和湍流涡旋力对刚贴壁的细胞造成了破坏。经研究选择以转速35 r/min,每静置30 min搅拌2 min的间歇搅拌方式贴壁效果最佳。比较在不同血清浓度(0%、5%、10%、20%)下GiCB细胞在微载体上的贴壁情况,无血清(0%)浓度下细胞贴壁率低,可能原因在于血清成分和生物学作用复杂,浓度过小情况下黏附因子、扩展因子、结合蛋白等物质缺失,贴附基本靠物理吸附作用[17],进而造成细胞附着性降低、贴壁困难等[18],而5%、10%、15%血清浓度对细胞均有较强的促进贴壁作用,但其浓度与微载体细胞的贴壁率也并非成正比。蒋丹丹等和杨琴等对不同微载体悬浮培养的研究中却证实降低血清浓度有利于提高贴壁率[17, 19-20],可见血清浓度的高低对不同微载体培养细胞时的影响效果不同。因此,在微载体细胞培养时,根据不同微载体的特性和细胞的生长状态类型选择合适的血清浓度对于提高细胞的贴壁率意义重大。
许多研究表明,合适的微载体浓度和细胞接种密度对细胞微载体悬浮培养阶段的细胞生长有密切的关系[21-23]。3 g/L微载体浓度下最大细胞密度仅为1.5×106 cells/mL,且达到最大密度后细胞数量迅速下降,可能是由于微载体表面贴附面积有限,细胞生长空间不足导致;9 g/L微载体浓度下达到的最大细胞密度为2.6×106 cells/mL,但相对较高的细胞密度下微载体利用率仅为45%,且过多的微载体用量并未使细胞密度成比例的增加,这与何锡忠等[24]在微载体培养PK-15细胞条件优化研究中有同样发现,微载体浓度与最大细胞密度仅有一定程度的相关性[25],推测原因可能与在转瓶系统中培养环境的溶氧性、pH、细胞之间的碰撞摩擦、细胞毒性效应等因素有关。1.0×105 cells/mL、2.5×105 cells/mL、4.0×105 cells/mL的接种密度下,达到的最大细胞密度比为1:1.9:2.2,说明提高接种密度后微载体的表面利用率增加,扩增倍数增加,但高接种密度仅使最大细胞密度提高了13.6%,细胞间的接触抑制作用明显。为提高载体利用率以及细胞培养效率,选择6 g/L的微载体浓度,2.5×105 cells/mL的细胞接种密度培养细胞。
微载体悬浮培养时,当搅拌速度过低(0~30 r/min),微载体细胞悬浮不均匀,培养瓶底部有微载体颗粒沉降堆积;当搅拌速度过大(>65 r/min)时,机械搅拌产生的湍流、层流和涡流等流体作用力加大了对细胞的损伤,使细胞从微载体上脱落,培养基中有大量可见的细胞团。因此本研究选择45 r/min的搅拌转速,使微载体细胞恰好均匀悬浮生长且增殖较好。
本文通过研究确定了规模化培养鲫脑组织细胞GiCB及病毒的多项基本工艺参数,表明利用微载体培养系统规模化制备鲤疱疹病毒Ⅱ型疫苗具有极大的应用潜力。但因实验中尚未测定细胞培养过程中代谢产物等是否会引起培养液中血清蛋白、无机元素、细胞因子、pH等的变化对细胞和病毒增殖的影响,因此仍需进一步深入探索微载体悬浮培养GiCB细胞和鲤疱疹病毒Ⅱ型的的工艺条件。
| [1] | WANG L, HE J Q, LIANG L Q, et al. Mass mortality caused by Cyprinid Herpesvirus 2 (CyHV-2) in Prussian carp (Carassius gibelio) in China[J]. Bulletin-European Association of Fish Pathology, 2012, 32(5): 164–173. |
| [2] | XU J, ZENG L B, ZHANG H, et al. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp, Carassius auratus gibelio in China[J]. Veterinary Microbiology, 2013, 166(1/2): 138–144. |
| [3] | MA J, JIANG N, LAPATRA S E, et al. Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2 (CyHV-2)[J]. Veterinary Microbiology, 2015, 177(3/4): 315–325. |
| [4] | ZHANG L L, MA J, FAN Y D, et al. Immune response and protection in gibel carp, Carassius gibelio, after vaccination with β-propiolactone inactivated cyprinid herpesvirus 2[J]. Fish & Shellfish Immunology, 2016, 49: 344–350. |
| [5] | GOORHA R M. Preparation and assay of vesicular stomatitis virus[J]. Methods in Enzymology, 1981, 78: 309–312. DOI:10.1016/0076-6879(81)78134-5 |
| [6] | CRESPI C L, THILLY W G. Continuous cell propagation using low-charge microcarriers[J]. Biotechnology and Bioengineering, 1981, 23(5): 983–993. DOI:10.1002/(ISSN)1097-0290 |
| [7] | VAN WEZEL A L. Growth of cell-strains and primary cells on micro-carriers in homogeneous culture[J]. Nature, 1967, 216(5110): 64–65. DOI:10.1038/216064a0 |
| [8] |
叶雪平, 杨广智, 罗毅志, 等. 草鱼出血病细胞培养灭活疫苗生产工艺的比较[J].
中国兽药杂志, 1998, 32(4): 9–12.
YE X P, YANG G Z, LUO Y Z, et al. Studies on technology of grass carp haemorrhage inactive vaccine production[J]. Chinese Journal of Veterinary Drug, 1998, 32(4): 9–12. |
| [9] |
陈志宏, 陈因良, 施源, 等. 生物反应器微载体系统大规模培养草鱼细胞及病毒[J].
华东理工大学学报, 1991, 17(4): 416–420.
CHEN Z H, CHEN Y L, SHI Y, et al. Large-scale microcarrier culture of fish cells and viruses in Bioreactor[J]. Journal of East China University Science and Technology, 1991, 17(4): 416–420. |
| [10] |
刘秋凤, 曾令兵, 周勇, 等. 微载体规模化培养草鱼细胞与病毒的工艺及优化[J].
淡水渔业, 2013, 43(4): 69–75.
LIU Q F, ZENG L B, ZHOU Y, et al. Technique and optimization for large-scale culture of grass carp cells and reovirus by microcarrier[J]. Freshwater Fisheries, 2013, 43(4): 69–75. |
| [11] | Uppsala Pharmacia Fine Chemicals. Microcarrier Cell Culture:Principles and Methods[M]. Sweden: Pharmacia Fine Chemicals, 1981: 1-107. |
| [12] |
殷震, 刘景华. 动物病毒学[M]. 第二版. 北京: 科学出版社, 1997.
YIN Z, LIU J H. The Animal Virus[M]. 2nd ed. Beijing: Science Press, 1997. |
| [13] |
刘苹, 李平, 周元国, 等. 血清浓度对TGF-β1刺激成纤维细胞增殖的影响[J].
西南军医, 2008, 10(5): 1–3.
LIU P, LI P, ZHOU Y G, et al. The proliferate effect of fibroblast with different concentration serum induced by TGF-β1[J]. Journal of Military Surgeon in southwest China, 2008, 10(5): 1–3. |
| [14] | PERRIN P, MADHUSUDANA S, GONTIER-JALLET C, et al. An experimental rabies vaccine produced with a new BHK-21 suspension cell culture process:use of serum-free medium and perfusion-reactor system[J]. Vaccine, 1995, 13(13): 1244–1250. DOI:10.1016/0264-410X(94)00022-F |
| [15] | REISINGER K S, BLOCK S L, IZU A, et al. Subunit influenza vaccines produced from cell culture or in embryonated chicken eggs:comparison of safety, reactogenicity, and immunogenicity[J]. Journal of Infectious Diseases, 2009, 200(6): 849–857. DOI:10.1086/599178 |
| [16] | FORESTELL S P, KALOGERAKIS N, BEHIE L A, et al. Development of the optimal inoculation conditions for microcarrier cultures[J]. Biotechnology and Bioengineering, 1992, 39(3): 305–313. DOI:10.1002/(ISSN)1097-0290 |
| [17] | CHUN B H, CHUNG S I. Attachment characteristics of normal human cells and virus-infected cells on microcarriers[J]. Cytotechnology, 2001, 37(1): 1–12. DOI:10.1023/A:1016196220750 |
| [18] |
章静波, 张世馥, 黄东阳. 组织和细胞培养技术[M]. 北京: 人民卫生出版社, 2002.
ZHANG J B, ZHANG S Y, HUANG D Y. Tissue and Cell Culture Techniques[M]. Beijing: People's Medical Publishing House, 2002. |
| [19] |
蒋丹丹, 胡静波, 周燕, 等. 兔骨髓间充质干细胞在Cytodex3微载体悬浮培养系统中的贴附条件优化[J].
生物医学工程学杂志, 2007, 24(4): 884–888.
JIANG D D, HU J B, ZHOU Y, et al. Optimization of attachment conditions for rabbitt mesenchymal stem cells in cytodex 3 microcarrier culture system[J]. Journal of Biomedical Engineering, 2007, 24(4): 884–888. |
| [20] |
杨琴, 张兴晓, 杨灵芝. 3种细胞培养流感病毒的比较[J].
动物医学进展, 2009, 30(11): 76–79.
DOI:10.3969/j.issn.1007-5038.2009.11.019 YANG Q, ZHANG X X, YANG L Z. Comparison of cultureing influenza virus in three kinds of cell lines[J]. Progress in Veterinary Medicine, 2009, 30(11): 76–79. DOI:10.3969/j.issn.1007-5038.2009.11.019 |
| [21] | BOCK A, SCHULZE-HORSEL J, SCHWARZER J, et al. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology Progress, 2011, 27(1): 241–250. DOI:10.1002/btpr.v27.1 |
| [22] | HU W S, MEIER J, WANG D I C, et al. A mechanistic analysis of the inoculum requirement for the cultivation of mammalian cells on microcarriers[J]. Biotechnology and Bioengineering, 1985, 27(5): 585–595. DOI:10.1002/(ISSN)1097-0290 |
| [23] | HU A Y C, WENG T C, TSENG Y F, et al. Microcarrier-based MDCK cell culture system for the production of influenza H5N1 vaccines[J]. Vaccine, 2008, 26(45): 5736–5740. DOI:10.1016/j.vaccine.2008.08.015 |
| [24] |
何锡忠, 李春华, 倪建平, 等. 微载体培养PK-15细胞试验条件的优化[J].
动物医学进展, 2010, 31(8): 20–23.
HE X Z, LI C H, NI J P, et al. Optimization of condition for culture of PK-15 cell by microcarrier[J]. Progress in Veterinary Medicine, 2010, 31(8): 20–23. |
| [25] | GENZEL Y, OLMER R M, SCHÄFER B, et al. Wave microcarrier cultivation of MDCK cells for influenza virus production in serum containing and serum-free media[J]. Vaccine, 2006, 24(35/36): 6074–6087. |
2. Yangtze River Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, Hubei, China
 2017,
Vol. 26
2017,
Vol. 26


