追踪鱼类配子细胞的细胞谱系发现,精细胞与卵细胞都来自于原始生殖细胞[1](primordial germ cells, PGCs)。PGCs在胚胎早期发育阶段由体细胞分化而来,是鱼类胚胎发育早期最早出现的生殖细胞。PGCs分化后受到趋化因子的作用迁移到生殖嵴,两者共同形成原始性腺。PGCs在原始性腺内持续地分裂、增殖和分化后[2], 逐步形成成熟的精子或卵子。随着两性配子的结合而产生新个体,保证了物种的延续和进化[3]。
Vasa基因源自DEAD-box家族,许多研究表明其编码的蛋白为一类RNA解旋酶[4-5]。DEAD-box家族与多个重要的细胞进程有关[6-7],如RNA剪切、修饰及代谢处理和mRNA的启动、核外转运及降解[8],且家族成员享有8个特异性基序序列。SCHUPBACH等于1986年指出,Vasa基因在果蝇(Drosophila melanogaster)中属母源基因,是该物种生殖细胞发育和腹节形成过程中必不可少的成分之一[9-10]。在鱼类中,Vasa是PGCs的第一个分子标记[11],同时也是生殖细胞的特异性分子标记。目前,国内外学者已在多种无脊椎动物和脊椎动物中克隆得到了Vasa的同源基因,并深入研究了Vasa对早期胚胎发育、原始性腺分化、性腺发育和两性配子发生中的作用[9],如斑马鱼[12-13](Danio rerio)、尼罗罗非鱼[14](Oreochromis niloticus)、青鳉[15](Oryzias latipes)和南方鲇[16](Silurus meridionalis)。至今,人们已经从超过50种鱼类中获得Vasa的cDNA序列,但有关七彩神仙鱼Vasa基因的研究尚未见报道。
七彩神仙鱼(Symphysodon haraldi),又名铁饼鱼,隶属于鲈形目(Perciformes)、慈鲷科(Cichlidae),是原生于南美洲亚马逊河流域的热带观赏鱼[17-19]。自20世纪70年代引入中国后,七彩神仙鱼以其绚丽的色彩、美不胜收的花纹和别具一格的体型获得了众多水族爱好者的喜爱,素有“热带鱼之王”的美称[20-21]。七彩神仙鱼早期性别鉴定困难,但同批性成熟的个体雌雄间有生长差异,雄性个体体型一般较雌性个体的大。人们一般根据体型大小鉴定其性别,这使得七彩神仙鱼的配对需要耗费大量的人力物力,也加长了七彩神仙鱼的繁殖周期。而利用特异的分子遗传标记进行雌雄的鉴别,尤其是早期鉴别,将是七彩神仙鱼育种的关键。
本研究以人工养殖的七彩神仙鱼为研究对象,在克隆该鱼Vasa基因的cDNA全长的基础上,研究了该基因在成鱼各组织中的表达情况;并应用荧光定量RT-PCR技术对其在早期胚胎发育时期、仔鱼阶段以及繁殖前后性腺组织的表达模式进行研究,为该鱼早期性别鉴定、单性育种和性别决定机制的研究奠定了基础。
1 材料与方法 1.1 材料实验所用材料为上海海洋大学观赏水族养殖实验室繁育的七彩神仙鱼。2015年12月至2016年3月,在胚胎发育时期进行连续取样,每期各取25粒;仔鱼阶段1~50日龄内,每5天取样1次;实验用成鱼共8尾,1龄,体长(14.49±0.47) cm,体质量(84.7±9.1) g。取脑、鳃、心脏、肝脏、肾脏、胃、肠道、食道、皮肤、肌肉及性腺组织,所有样品均设置3个重复。样品取后放于1.5 mL离心管中,迅速冻于液氮,实验室-80 ℃保存。
1.2 引物设计根据已验证的七彩神仙鱼性腺转录组文库的注释信息(林睿涓等,未发表),提取出Vasa基因的不完整cDNA片段,根据该基因的保守区设计本实验所需引物。以β-actin作为内参基因,除定量表达引物采用AlleleID 6,其余引物均采用Primer 5.0设计。
1.3 总RNA的提取及cDNA的合成根据Trizol试剂使用说明书提取其总RNA。1.5%的琼脂糖凝胶电泳,紫外分光光度仪检测RNA质量。参考SMARTer® RACE 5′/3′Kit试剂盒说明将RNA反转录成cDNA。用上述设计的引物,Vasa-F和Vasa-R,以cDNA为模板,扩增获得Vasa基因片段。反应条件为:94 ℃ 5 min,94 ℃ 30 s,60 ℃ 40 s,72 ℃ 45 s,72 ℃ 10 min, 30个循环。经凝胶电泳检测,割胶回收纯化目的片段。产物连接到pGM -T载体中,利用DH5α感受态细胞进行转化。挑取阳性克隆进行测序[生工生物工程(上海)股份有限公司]。
1.4 3′和5′ RACE扩增以上一步得到的cDNA为模板,5′RACE扩增以Vasa5 adaptor为正向引物,Vasa5-1、Vasa5-2、Vasa5-3、Vasa5-4、Vasa5-5分别为反向引物。3′RACE扩增以Vasa3-1、Vasa3-2、Vasa3-3、Vasa3-4、Vasa3-5为正向引物,Vasa3 adaptor+oligo(T)为反向引物(表 1)。RACE步骤参考SMARTer® RACE 5′/3′ Kit试剂盒说明书。1.5%的琼脂糖凝胶电泳检测PCR产物,胶回收目的片段后进行连接转化,挑阳性菌株送生物公司测序。

|
表 1 本试验所用引物名称及序列 Tab.1 Names and sequences of primers used in this study |
用DNAStar软件对测序片段进行拼接、翻译氨基酸序列,并在GenBank上进行同源性比对。根据克隆得到的七彩神仙鱼Vasa基因序列,用Clustal X软件进行氨基酸多重序列分析以及应用MAGA 5.0构建NJ(Neighbor-Joining)系统进化树。所用物种的Vasa氨基酸序列均从GenBank下载。
1.6 Vasa基因在各组织中表达取1龄成熟七彩神仙鱼各组织的RNA 2 μL,参照PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒说明将其反转录成cDNA。以Vasa-F和Vasa-R为特异性引物,研究Vasa基因在各组织中的表达情况,扩增条件同上。琼脂糖凝胶电泳检测PCR结果,凝胶成像系统成像。
1.7 荧光定量RT-PCR取七彩神仙鱼胚胎发育各个时期、仔鱼样本和繁殖前后性腺组织的总RNA,根据上述试剂盒说明进行反转录,并调整样品总cDNA质量浓度至100 ng/μL。以V7-F和V7-R为目的基因引物,β12-F和β12-R为内参引物,配制12.5 μL反应体系,检测Vasa基因在胚胎发育各时期及仔鱼阶段的表达情况。反应条件:95 ℃ 10 min; 95 ℃15 s; 60 ℃ 15 s; 72 ℃ 20 s,40个循环。所有检测样品均设置3个生物学重复,每个样品的Vasa基因和β-actin基因分别进行4次技术重复。随后查看溶解曲线并分析每个样品是否反应正常。本实验数据处理采用2-ΔΔCt值的方法[22]计算Vasa基因的表达水平。
2 结果与分析 2.1 Vasa cDNA全长序列和分析通过RACE技术克隆得到七彩神仙鱼Vasa基因(GenBank登录号:KU945273)。结果显示,七彩神仙鱼Vasa cDNA序列全长2 370 bp,其中有123 bp是5′端非翻译区,编码655个氨基酸的开放阅读框长1 968 bp,3′端非翻译区长279 bp。cDNA全长序列中,46.2%为A+T,53.8%是G+C。预测Vasa的氨基酸序列发现N端存在8个RGG盒、10个RG重复和1个甘氨酸富集区[23](G-rich);N末端起始密码子及C末端终止密码子附近有Vasa保守结构常见的色氨酸(W)残基[23-25],并包含了DEAD-box家族蛋白特有的8个保守基序(图 1)。

|
图 1 七彩神仙鱼Vasa编码的氨基酸序列分析
Fig. 1 Amino acid sequence analysis of Vasa gene in discus fish
方框指示DEAD-box家族蛋白共有的8个保守基序 Boxes correspond to the eight conserved motifs of the DEAD-box protein family |
七彩神仙鱼Vasa基因编码的蛋白质由654个氨基酸组成,分子质量为70 384,理论等电点PI为5.19。此外,Vasa编码的酸性氨基酸比例占14.1%,碱性氨基酸占11.6%。七彩神仙鱼Vasa氨基酸序列与尼罗罗非鱼的同源性为80%, 和人类(Homo sapiens)的同源性较低,为67%(图 2)。根据其他物种的Vasa基因氨基酸序列,构建系统进化树(图 3)。结果显示,七彩神仙鱼与尼罗罗非鱼亲缘关系最近,聚为一支,与人的亲缘关系最远,与其他鱼类的亲缘关系介于两者之间。
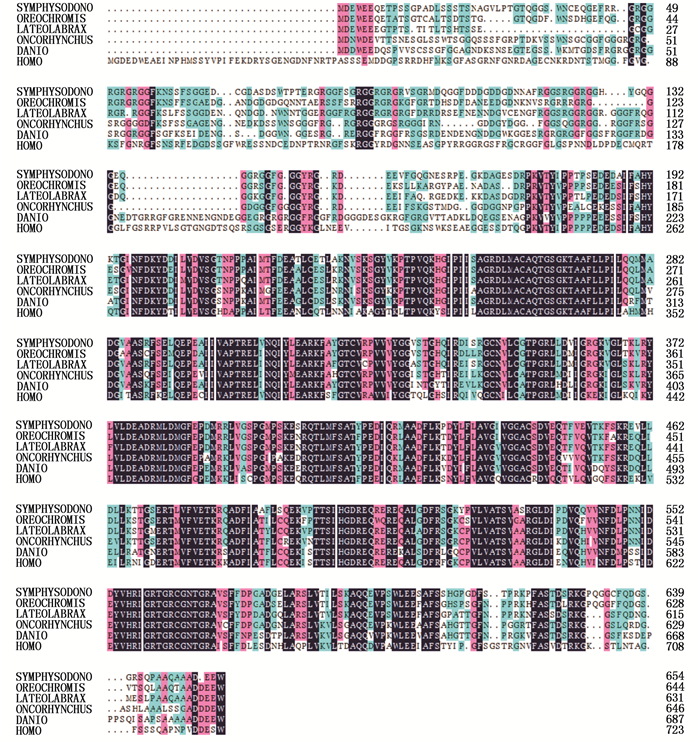
|
图 2 七彩神仙鱼与其他物种Vasa氨基酸序列比较
Fig. 2 Alignment of the amino acid sequences of Vasa gene in discus fish with others species
阴影表示氨基酸相同;“..”表示氨基酸缺失 Shadow region indicates identical amino acid; ".."indicates amino acid deletion Symphysodon:Symphysodon harldi; Oreochromis:Oreochromis niloticus; Homo:Homo sapiens; Lateolabrax:Lateolabrax japonicus; Oncorhynchus:Oncorhynchus mykiss; Danio:Danio rerio |

|
图 3 Vasa基因氨基酸序列的NJ系统树
Fig. 3 The NJ phylogenetic tree by amino acid sequence of Vasa gene
|
采用RT-PCR方法来研究Vasa在七彩神仙鱼成鱼组织中的表达情况,以β-actin为内参。结果显示,Vasa mRNA在性腺组织中特异性表达,并且卵巢的表达量要高于精巢,而在其余组织中均无表达信号显示(图 4)。
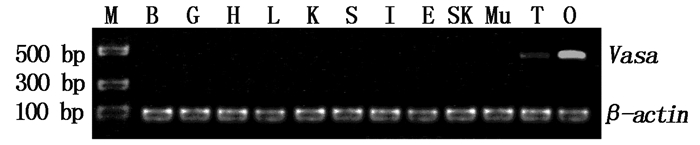
|
图 4 Vasa基因半定量电泳结果
Fig. 4 RT-PCR electrophoresis results of Vasa
M.Maker;B.脑;G.鳃;H.心脏;L.肝脏;K.肾;S.胃;I.肠;E.食道;Sk.皮肤;Mu.肌肉;T.精巢;O.卵巢 M.DNA molecular weight marker; B.brain; G.gill; H.heart; L.liver; K.kidney; S.stomach; I.intestine; E.esophagus; Sk.skin; Mu.muscle; T.testis; O.ovaries |
荧光定量RT-PCR结果显示,七彩神仙鱼胚胎发育时期,从受精卵至出膜,均能检测到Vasa基因的存在。从受精卵到原肠胚期间有较高的表达量,从神经胚到出膜时期表达量较低。并且出膜期表达量较微弱,囊胚期的表达量最高,其次是桑葚胚,分别为出膜期的12.75倍和11.30倍(图 5a)。在仔鱼阶段,从出膜后到25日龄,Vasa的表达量较低;在30日龄至40日龄期间的表达量较高,后期阶段表达量均维持在较低水平。并且在第40日龄的表达水平最高,为对照的3.5倍(图 5b)。
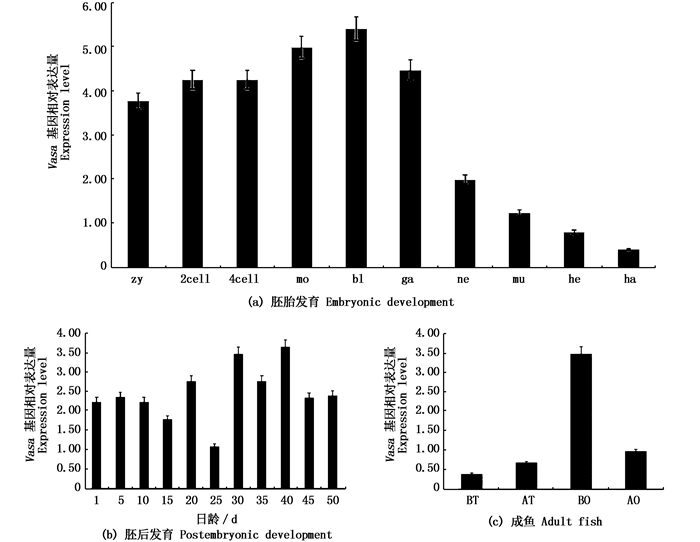
|
图 5 Vasa基因荧光定量RT-PCR结果
Fig. 5 The real-time fluorescence quantification on RT-PCR results of Vasa
Zy.受精卵;2cell.二细胞期;4cell.四细胞期;mo.桑椹胚;bl.囊胚期;ga.原肠胚;ne.神经胚;mu.肌肉效应;he.心跳期;ha.出膜期;BT.繁殖前的精巢;AT.繁殖后的精巢;BO.繁殖后的卵巢;AO.繁殖后的卵巢 Zy. Fertilized egg; 2cell.Two cell stage; 4cell.Four cell stage; mo. Morula stage; bl.Blastula stage; ga. Gastrula stage; ne. Neurula stage; mu. Muscle effect stage; he. Heart beat stage; ha. Hatch out stage; BT. Testis before reproduction; AT. Testis after reproduction; BO. Ovary before reproduction; AO. Ovary after reproduction |
取繁殖前与繁殖后的七彩神仙鱼的卵巢和精巢检测,荧光定量PCR结果显示:在精巢中, 繁殖前Vasa基因的表达水平比繁殖后的低;在卵巢中,则出现了相反的情况(图 5c),且繁殖前的表达水平约是繁殖后的3.5倍。
3 讨论本研究完成了Vasa基因的克隆与表达分析,七彩神仙鱼Vasa基因的cDNA与其他物种相似。说明Vasa在进化上较为保守,这些保守基序与结构可能在维持Vasa蛋白的基础结构和生理功能[23]方面有重要的作用。
Vasa基因仅在成熟七彩神仙鱼的卵巢及精巢中表达,与部分物种的组织表达模式研究结果一致[26-27],如太平洋蓝鳍金枪鱼[28](Thunnus orientalis)和栉孔扇贝[29](Chlamys farreri)。这表明Vasa与七彩神仙鱼生殖细胞的发育有关。但张远青等的研究结果表明,Vasa除了在半滑舌鳎(Cynoglossus semilaevis Günther)的卵巢和精巢中表达外,在心脏中有微量表达[9]。另外,鼠(Mus musculus)的肾上腺和中肾组织中Vasa基因也有微量表达[30]。这表明Vasa在更高等的物种中与组织特异性细胞类型的特化和分化有关[31]。
周倩如等研究结果显示,Vasa mRNA最早存在于中国明对虾(Fenneropenaeus chinensis)的2细胞期,且在后面各期胚胎均有表达信号[7],但表达信号呈现逐渐降低趋势,且自出膜后开始无表达信号显示[32]。斑马鱼Vasa基因相关研究结果表明:在发育早期所有细胞中都有母源性的Vasa mRNA分布, 而后其在形成生殖质的区域逐渐聚集[33]。斑马鱼胚胎中Vasa的表达贯穿于整个胚胎发育过程[34],Vasa mRNA是组成斑马鱼生殖质的重要成分[35-36]。至于七彩神仙鱼,自受精卵开始到出膜期,均能检测到Vasa基因的表达。Vasa基因从受精卵开始稳定表达且逐渐增加,Vasa mRNA在囊胚期含量达到最大,随后表达量逐渐降低。这可能是因为Vasa mRNA为母系遗传[35, 37-38],在卵子中就已存在,随后在配子中被分配到生殖质。并且在囊胚期发生细胞分化,产生了体细胞系与生殖细胞(即PGCs)系[39]。Vasa表达于PGCs中,随着生殖细胞的数量增加,Vasa的表达量也达到高峰。随后从原肠胚到出膜阶段,胚胎发育至形成各个器官,使得体细胞大量分裂,而生殖细胞维持在一定数量,生殖细胞占总细胞的数量减少,故Vasa的表达量降低。同时,这项结果表明,七彩神仙鱼的原始生殖细胞可能在囊胚期形成。
在仔鱼阶段,PGCs将穿过各种胚胎组织(体细胞组织),抵达正在形成的原始生殖基, 即性原基[3]。一旦迁移到性原基,PGCs便携同周围体细胞形成一个完整的生殖腺[3]。PGCs在分化为卵原细胞或精原细胞的过程中,生殖腺也会随之分化成卵巢或精巢。荧光定量RT-PCR检测得出,七彩神仙鱼繁殖前后的性腺都有Vasa mRNA;这说明Vasa基因与生殖细胞的产生以及发育有关。并且,无论哪个阶段,卵巢的Vasa表达量都要比精巢的高;繁殖前的精巢组织中含有大量成熟的精子,但其Vasa表达量却低于繁殖后的精巢组织,这进一步验证了Vasa为母源性物质的结论。半滑舌鳎和革胡子鲶的相关实验亦表明,在精母细胞增殖期, Vasa mRNA的表达信号较弱; 在精子细胞增殖期时表达信号显著增强,在精子成熟期又呈现出较低水平[9, 40]。在七彩神仙鱼的卵巢中,繁殖前的Vasa mRNA含量远高于繁殖后的含量。这是因为卵母细胞在生长和发育过程中开始合成并积累大量的母源性RNA以满足早期胚胎发育的需要。卵巢中储备了大量的成熟卵子,使得繁殖前的卵巢中有较大的Vasa积累量。在罗非鱼的研究中,也出现了相似的结果[16]。
七彩神仙鱼1~50日龄的仔鱼中都有Vasa基因的转录本。且在dph1~dph20日龄的表达量维持稳定,在dph25的表达量最低。这可能是因为随着受精作用的开始,母源性的RNA的蛋白质被激活,而发育的推进,迫使仔鱼必须依赖于鱼体自身基因组的调控,也就是需要新的RNA,从而母源性的Vasa mRNA消耗降解;仔鱼逐渐自身合成Vasa mRNA。因此dph30至dph40,Vasa的表达量较高,后期皆维持一个稳定的水平。故而推测出七彩神仙鱼在30~40日龄阶段,PGCs在分子水平可能已经开始分化[41-42], 性腺也将分化成精巢或卵巢。但Vasa在这一阶段的表达是否真的与PGCs分化有关还需要更进一步的验证。
| [1] |
胡翔. 阿特拉津对ICR小鼠卵母细胞发育潜能的影响[D]. 济南: 山东师范大学, 2015.
HU X. The effect of atrazine on ICR mice's oocyte development ability[D]. Ji'nan:Shandong Normal University, 2015. |
| [2] |
代丽. 稀有(鱼句)鲫原始生殖细胞的起源、迁移和分化及卵巢发育和卵子发生研究[D]. 重庆: 西南大学, 2013.
DAI L. Studies on the PGCs' origin migration and differentiation of gobiocypris rarus and its ovarian development and oogenesis[D]. Chongqing:Southwest University, 2013. |
| [3] |
徐红艳, 李名友, 桂建芳, 等. 鱼类生殖细胞[J].
中国科学:生命科学, 2010, 40(2): 124–138.
XU H Y, LI M Y, GUI J F, et al. Fish germ cells[J]. Science China Life Science, 2010, 40(2): 124–138. |
| [4] |
霍继革. 单环刺螠(Urechis unicinctus)vasa基因及β-actin基因的克隆与表达分析[D]. 青岛: 中国海洋大学, 2006.
HUO J G. Cloning and expression of vasa and β-actin gene from Urechis unicinctus[D]. Qingdao:Ocean University of China, 2006. |
| [5] |
吴晓萌. 牙鲆vasa基因的克隆、表达分析及其启动子调控的GFP报告载体构建[D]. 青岛: 中国海洋大学, 2013.
WU X M. Cloning of Vasa gene in Japanese flounder (Paralichthys olivaceus) and construction of GFP reporter vectors driven by vasa promoter[D]. Qingdao:Ocean University of China, 2013. |
| [6] | TANNER N K, LINDER P. DExD/H box RNA helicases:from generic motors to specific dissociation functions[J]. Molecular Cell, 2001, 8(2): 251–262. DOI:10.1016/S1097-2765(01)00329-X |
| [7] |
张远青, 温海深, 何峰, 等. 半滑舌鳎Vasa基因cDNA克隆及其在繁殖周期的表达[J].
水产学报, 2012, 36(1): 1–8.
ZHANG Y Q, WEN H S, HE F, et al. Cloning of Vasa and expression analysis during the reproductive cycle in Cynoglossus semilaevis Günther[J]. Journal of Fisheries of China, 2012, 36(1): 1–8. |
| [8] | LVKING A, STAHL U, SCHMIDT U. The protein family of RNA helicases[J]. Critical Reviews in Biochemistry & Molecular Biology, 2008, 33(4): 259–296. |
| [9] | HAY B, JAN L Y, JAN Y N. A protein component of Drosophila polar granules is encoded by vasa and has extensive sequence similarity to ATP-dependent helicases[J]. Cell, 1988, 55(4): 577–587. DOI:10.1016/0092-8674(88)90216-4 |
| [10] |
陈玉冬, 邹志华, 王艺磊, 等. vasa基因研究进展[J].
动物学杂志, 2010, 45(4): 173–180.
CHEN Y D, ZOU Z H, WANG Y L, et al. Progress in studies of vasa gene[J]. Chinese Journal of Zoology, 2010, 45(4): 173–180. |
| [11] | LASKO P F, ASHBURNER M. The product of the Drosophila gene vasa is very similar to eukaryotic initiation factor-4A[J]. Nature, 1988, 335(6191): 611–617. DOI:10.1038/335611a0 |
| [12] | YOON C, KAWAKAMI K, HOPKINS N. Zebrafish vasa homologue RNA is localized to the cleavage planes of 2-and 4-cell-stage embryos and is expressed in the primordial germ cells[J]. Development, 1997, 124(16): 3157–3165. |
| [13] | KRØVEL A V, OLSEN L C. Sexual dimorphic expression pattern of a splice variant of zebrafish vasa during gonadal development[J]. Developmental Biology, 2004, 271(1): 190–197. DOI:10.1016/j.ydbio.2004.04.004 |
| [14] | KOBAYASHI T, KAJIURA-KOBAYASHI H, NAGAHAMA Y. Differential expression of vasa homologue gene in the germ cells during oogenesis and spermatogenesis in a teleost fish, tilapia, Oreochromis niloticus[J]. Mechanisms of Development, 2000, 99(1/2): 139–142. |
| [15] | HERPIN A, ROHR S, RIEDEL D, et al. Schartl M. Specification of primordial germ cells in medaka (Oryzias latipes)[J]. BMC Developmental Biology, 2007, 7(1): 1–10. DOI:10.1186/1471-213X-7-1 |
| [16] |
胡重江, 吴风瑞, 刘智皓, 等. 南方鲇Vasa基因两种亚型cDNA的克隆及其表达[J].
动物学报, 2008, 54(6): 1051–1060.
HU C J, WU F R, LIU Z H, et al. Molecular cloning and expression of two isoforms of Vasa gene in Southern catfish Silurus meridionalis[J]. Acta Zoologica Sinica, 2008, 54(6): 1051–1060. |
| [17] |
张诚仪, 陈再忠. 七彩神仙鱼同工酶表达的组织差异性分析[J].
上海海洋大学学报, 2010, 19(6): 744–750.
ZHANG C Y, CHEN Z Z. Tissue divergence of isoenzyme expression in Symphysodon spp.[J]. Journal of Shanghai Ocean University, 2010, 19(6): 744–750. |
| [18] |
于永亮, 李坚明, 高建忠, 等. 5种七彩神仙鱼5S rDNA序列的比较[J].
吉林农业大学学报, 2015, 37(1): 97–102.
YU Y L, LI J M, GAO J Z, et al. Sequence analysis of 5S rDNA in 5 strains of discus fish Symphysodon[J]. Journal of Jilin Agricultural University, 2015, 37(1): 97–102. |
| [19] |
刘晓东, 陈再忠. 七彩神仙鱼皮肤色素细胞观察及类胡萝卜素组分分析[J].
上海水产大学学报, 2008, 17(3): 339–343.
LIU X D, CHEN Z Z. Study on the chromatophores and the carotenoid components in the skin of discus fish (Symphysodon spp.)[J]. Journal of Shanghai Fisheries University, 2008, 17(3): 339–343. |
| [20] |
徐亚飞, 陈再忠, 高建忠, 等. 人工养殖七彩神仙鱼性腺发育的研究[J].
安徽农业大学学报, 2015, 42(1): 115–123.
XU Y F, CHEN Z Z, GAO J Z, et al. Gonadal development of artificially-cultured discus fish (Symphysodon spp.)[J]. Journal of Anhui Agricultural University, 2015, 42(1): 115–123. |
| [21] |
徐亚飞. 七彩神仙鱼的性腺发育及17α-甲基睾丸酮对其性腺发育影响的初步研究[D]. 上海: 上海海洋大学, 2014.
XU Y F. Studies on gonadal development of discus fish and effect of 17α-Methyltestosterone on its gonadal development[D]. Shanghai:Shanghai Ocean University, 2014. |
| [22] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [23] |
胡重江. 罗非鱼和南方鲇生殖细胞几种分子标记的克隆和表达研究[D]. 重庆: 西南大学, 2008.
HU C J. Molecular cloning and expression of several germ cell markers of the Nile tilapia, Oreochromis niloticus and Southern catfish, silurus meridionalis[D]. Chongqing:Southwest University, 2008. |
| [24] | CASTRILLON D H, QUADE B J, WANG T Y, et al. The human VASA gene is specifically expressed in the germ cell lineage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(17): 9585–9590. DOI:10.1073/pnas.160274797 |
| [25] | FUJIWARA Y, KOMIYA T, KAWABATA H, et al. Isolation of a DEAD-family protein gene that encodes a murine homolog of Drosophila vasa and its specific expression in germ cell lineage[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 91(25): 12258–12262. |
| [26] | YE D, LV D Y, SONG P, et al. Cloning and characterization of a rice field eel vasa-like gene cDNA and its expression in gonads during natural sex transformation[J]. Biochemical Genetics, 2007, 45(3/4): 211–224. |
| [27] | KILEDJIAN M, DREYFUSS G. Primary structure and binding activity of the hnRNP U protein:binding RNA through RGG box[J]. EMBO Journal, 1992, 11(7): 2655–2664. |
| [28] | NAGASAWA K, TAKEUCHI Y, MIWA M, et al. cDNA cloning and expression analysis of a vasa-like gene in Pacific bluefin tuna Thunnus orientalis[J]. Fisheries Science, 2009, 75(1): 71–79. DOI:10.1007/s12562-008-0021-9 |
| [29] |
邵明瑜. 栉孔扇贝生殖相关基因DEAD-box家族和boule的cDNA克隆及其发育表达图式[D]. 青岛: 中国海洋大学, 2007.
SHAO M Y. cDNA cloning and developmental expression patterns of reproduction-related DEAD-box family and boule genes from Chlamys farreri[D]. Qingdao:Ocean University of China, 2007. |
| [30] | ZAMBONI L, UPADHYAY S. Germ cell differentiation in mouse adrenal glands[J]. Journal of Experimental Zoology, 1983, 228(2): 173–193. DOI:10.1002/(ISSN)1097-010X |
| [31] | IKENISHI K, TANAKA T S. Spatio-temporal expression of Xenopus vasa homolog, XVLG1, in oocytes and embryos:The presence of XVLG1 RNA in somatic cells as well as germline cells[J]. Development, Growth & Differentiation, 2000, 42(2): 95–103. |
| [32] |
周倩如. 中国明对虾(Fenneropenaeus chinensis)两个DEAD-box家族基因Fc-vasa和Fc-PL10α的克隆和表达分析[D]. 青岛: 中国海洋大学, 2007.
ZHOU Q R. cDNA cloning and expression analysis of two DEAD-box family genes, Fc-vasa and Fc-PL10a, from Fenneropenaeus chinensis[D]. Qingdao:Ocean University of China, 2007. |
| [33] |
周倩如, 邵明瑜, 张志峰. Vasa基因编码蛋白的结构特征和应用展望[J].
海洋湖沼通报, 2007: 129–134.
ZHOU Q R, SHAO M Y, ZHANG Z F. Structure characterization and application prospects of vasa protein[J]. Transactions of Oceanology and Limnology, 2007: 129–134. |
| [34] | BRAAT A K, VAN DE WATER S, GOOS H, et al. Vasa protein expression and localization in the zebrafish[J]. Mechanisms of Development, 2000, 95(1/2): 271–274. |
| [35] | KNAUT H, PELEGRI F, BOHMANN K, et al. Zebrafish vasa RNA but not its protein is a component of the germ plasm and segregates asymmetrically before germline specification[J]. The Journal of Cell Biology, 2000, 149(4): 875–888. DOI:10.1083/jcb.149.4.875 |
| [36] |
刘晓奕, 张雁, 喻佩, 等. Kin17基因在斑马鱼胚胎发育过程中的表达特性分析[J].
吉林农业大学学报, 2015, 37(1): 103–110.
LIU X Y, ZHANG Y, YU P, et al. Expression pattern analysis of Kin17 gene in zebrafish embryonic development[J]. Journal of Jilin Agricultural University, 2015, 37(1): 103–110. |
| [37] | BREITWIESER W, MARKUSSEN F H, HORSTMANN H, et al. Oskar protein interaction with Vasa represents an essential step in polar granule assembly[J]. Genes & Development, 1996, 10(17): 2179–2188. |
| [38] | WOLKE U, WEIDINGER G, KÖPRUNNER M, et al. Multiple levels of posttranscriptional control lead to germ line-specific gene expression in the zebrafish[J]. Current Biology, 2002, 12(4): 289–294. DOI:10.1016/S0960-9822(02)00679-6 |
| [39] |
许莉佳, 张薪, 伍莎, 等. 鱼类生殖细胞移植的研究进展[J].
生命科学, 2012, 24(3): 280–286.
XU L J, ZHANG X, WU S, et al. Progress on research of germ-cell transplantation in fish[J]. Chinese Bulletin of Life Sciences, 2012, 24(3): 280–286. |
| [40] | RAGHUVEER K, SENTHILKUMARAN B. Cloning and differential expression pattern of vasa in the developing and recrudescing gonads of catfish, Clarias gariepinus[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 157(1): 79–85. |
| [41] | OHMURO-MATSUYAMA Y, MATSUDA M, KOBAYASHI T, et al. Expression of DMY and DMTR1 in various tissues of the Medaka (Oryzias latipes)[J]. Zoological Science, 2003, 20(11): 1395–1398. DOI:10.2108/zsj.20.1395 |
| [42] |
李林, 梁宏伟, 李忠, 等. 黄颡鱼DMRT1基因cDNA全长克隆及其表达分析[J].
华中农业大学学报, 2012, 31(2): 220–226.
LI L, LIANG H W, LI Z, et al. Cloning and expression analysis of DMRT1 gene in Pelteobagrus fulvidraco[J]. Journal of Huazhong Agricultural University, 2012, 31(2): 220–226. |
 2017,
Vol. 26
2017,
Vol. 26


