海藻场内大型海藻生长、衰退以及摄食过程产生大量碎屑,使得大型海藻对海域生态服务功能又以碎屑的形式参与到海域的能流循环,海胆和螺类等植食性动物数量增加致使大型海藻被大量啃食而大面积快速丧失,并加速海藻向碎屑的转换效率,改变所在海域的初级生产力结构;一方面海藻碎屑作为饵料基础补充至碎屑食物链中,丰富了岛礁海域饵料基础[1];另一方面,海藻碎屑又通过自溶或者微生物作用分解进入水环境中,碎屑的分解依赖于微生物,SMITH等发现微生物将藻体碎屑腐烂分解至消失的时间跨度为6~70 d,改变生产力的循环过程,对海域营养盐尤其是氮磷营养盐的贡献作用[2-4]。海藻碎屑对海域生产力循环过程有重要价值。
大型海藻碎屑进入水环境中的同时也受水环境中光照强度、温度、溶解氧等因素控制其分解效率,从而对水体氮、磷、硅营养盐贡献度产生差异。GARCIA-PAUSAS等[5]发现温度和水热条件对植物体分解速率和物质循环过程影响较显著; 在一些水体浊度较大的海域,光照的穿透力受水体悬浮物影响,光线是控制水体生物量的主要因子,光照强度能刺激底栖微生物对氨氮的硝化作用,同时光照强度对底栖微生物群落结构产生较大影响[6-7];据LOVATO等研究发现海藻生物量增大的过程伴随溶解氧降低[8];环境条件是影响植物分解过程的重要因素,对植物残体的分解速率和营养盐释放速率起决定作用[9]。据调查测得海藻场不同水深海域溶氧浓度分布范围为3.74~7.81 mg/L,本研究设定在低氧(1~4 mg/L)和好氧(5~9 mg/L)两个氧浓度状态下进行海藻碎屑分解实验。由此来探究海藻场溶解氧浓度差异对海藻碎屑分解影响以及海藻碎屑对水体营养盐贡献度。
1 材料与方法 1.1 样品采集与处理方法根据海藻场大型海藻腐烂衰落期为6—7月份[10],于2015年6月在枸杞岛(30°42.82′~30°43.00′N,122°46.78′~122°47.09′E)后头湾马尾藻场[11],采用SCUBA潜水采集瓦氏马尾藻碎屑, 表面经海水清洗后放在60 ℃烘箱中烘干至恒重。网袋规格:140目网眼孔径,长×宽为10 cm ×10 cm。每个尼龙网袋装海藻碎屑的干物质量为(2.000±0.001) g,再将网袋放入到500 mL培养瓶中,加入原样海水。分别置于不同温度和光照强度的培养箱中进行培养,培养到碎屑干重损失量达一半以上的时间周期。实验用水铵态氮(NH4+-N)为(0.040±0.017) mg/L,硝态氮(NO3--N)为(0.250±0.014) mg/L,亚硝态氮(NO2--N)为(29.210±0.107)μg/L,正磷酸盐(PO42-)为(0.060±0.028) mg/L,活性硅酸盐为(0.080±0.005) mg/L。
1.2 实验设计根据现场海域调查的溶解氧差异,在室内通过使用不透气薄膜以及曝气泵24 h不间断曝气这两种方式用以控制溶解氧浓度,用以模拟水环境中的低氧(1~4 mg/L)和富养(5~9 mg/L)条件[13],。低氧状态(DDO)是采用不透气薄膜覆盖在容器口,同时由于植物碎屑分解消耗水体中的氧气,外界无氧补充,使得容器内水体溶解氧始终维持在低氧状态;而好氧状态(FDO)是通过24 h不间断向容器中曝氧,使容器中溶氧状态始终维持在5~9 mg/L浓度范围内;两种情况下均设计3个平行处理,在25 ℃条件的生化培养箱进行实验。在实验的初期第0天到第7天连续取水样,初期水质营养盐变化剧烈,随后第9、16、22、27、32、37天各取一次水样,每次取完水样补充相等体积的海水;每个两周取一包海藻碎屑测定碎屑损失量,每天测定水体溶解氧浓度以及pH。
1.3 氮、磷测定方法及瓦氏马尾藻碎屑分解速率计算方法海洋浮游植物和藻类直接利用的是溶解无机氮(DIN)和溶解无机磷(DIP)[14],氮与磷的比值不是水体中浮游植物受磷或氮限制的重要指标,近年来也有研究者指出硅可能是限制因子[15]。采用Clever-Chem 380营养盐分析仪测定各项营养盐,硝态氮NO3--N(镉柱还原)和亚硝态氮(NO2--N)含量采用N-(1-萘基) -乙二胺光度法测定,正磷酸盐(PO42-)采用钼蓝法,氨氮(NH4+-N)采用苯酚法[16]。分解速率采用Olsen的指数衰减模型计算:
 (1)
(1)
式中:W0为海藻碎屑初始干重;Wt为分解t时间后剩余海藻碎屑干重;t为分解时间;k为分解速率(/d)[17]。
单位累积释放量
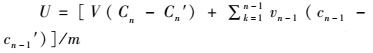 (2)
(2)
式中:U为单位累积释放量(mg/g);V为烧杯中溶液总体积(L);n为采样次数;Cn为第n次采样时实验组中DIN/DIP浓度(mg/L);Cn′为第n次采样时空白组浓度DIN/DIP(mg/L);Vn为取样体积(L);m为浸泡植物的初始干重(g)[18]。
1.4 数据分析采用SPSS 18.0和Excle 2010软件进行数据统计分析,采用单因素方差分析(one-way ZNOVA)和LSD方法进行方差分析和差异显著性检验(P<0.05)。
2 结果 2.1 不同溶氧水平下海藻碎屑损失率在整个培养时间内海藻碎屑在低氧浓度条件下的失重率和分解速率始终小于好氧条件,溶解氧浓度高低对海藻碎屑失重率影响显著(P<0.05)。海藻碎屑在一个月的培养周期内失重率都高于50%,且在好氧条件下,实验初期(第0~14天)海藻碎屑失重率就已经达到80%(图 1),远高于低氧状态(DDO)失重率60%;由图 2可见海藻碎屑分解速率随培养时间的延长而逐渐降低,好氧条件(FDO)下测得实验初期分解速率为0.110/d,而低氧条件下初期海藻碎屑分解速率仅为0.041/d与好氧浓度下的实验末期分解速率0.049/d相当。海藻碎屑在氧充足的条件下更利于分解并释放营养元素进入水体。

|
图 1 不同溶解氧条件下海藻碎屑随时间失重率变化
Fig. 1 Under the condition of two kinds of dissolved oxygen algae clastic weight lessness rate changes over time
|

|
图 2 不同溶解氧条件下海藻碎屑分解速率
Fig. 2 Two kinds of algae detritus decomposition rate of dissolved oxygen condition
|
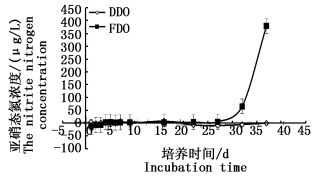
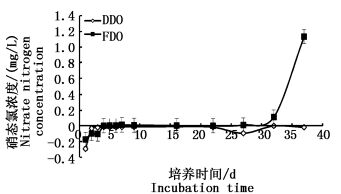
瓦氏马尾藻碎屑在低氧浓度下亚硝态氮释放量一直处于<10 μg/L,释放量和释放趋势不显著,一直趋于平稳的低释放量状态, 且随时间推移释放状态转为负值吸收状态趋势;而在好氧条件下,瓦氏马尾藻碎屑初期释放量平缓,没有明显的增长趋势,随时间的推移释放量逐渐增大,一个月后释放量明显有增大的趋势,由5 μg/L上升到65 μg/L(图 3)。在整个海藻碎屑培养期间,低氧和好氧浓度条件对亚硝态氮的释放影响不显著(P>0.05)。海藻碎屑在低氧和好氧条件下释放硝态氮趋势与亚硝态氮相似,在大约前十天的培养期间,无论好氧还是低氧条件下海藻碎屑对硝态氮是处于吸收状态,随着培养时间的延长,好氧条件下海藻碎屑释放硝态氮呈上升趋势,并在一个月左右时间后释放的硝酸盐浓度由0.110 mg/L增长到1.132 mg/L,而在低氧浓度下,海藻碎屑释放硝态氮一直处于较低状态,培养期间以负值吸收状态占主导(图 4)。两种氧环境状态下对海藻碎屑释放硝态氮影响也不显著(P>0.05)。
|
图 3 不同溶解氧条件下对海藻碎屑分解释放亚硝态氮的影响
Fig. 3 Algae detritus decomposition under the conditions of different dissolved oxygen release of nitrite nitrogen
|
|
图 4 不同溶解氧条件下海藻碎屑分解释放硝态氮的影响
Fig. 4 Algae detritus decomposition under the conditions of different dissolved oxygen release of nitrate nitrogen
|
氨氮变化趋势与硝态氮和亚硝态氮完全相反,在低氧(1~4 mg/L)和好氧(5~9 mg/L)两项实验条件下,海藻碎屑在实验初期0~10 d内氨氮释放较大,随时间延长释放量降低。实验初期,低氧条件下,海藻碎屑释放氨氮量明显大于好氧,10 d后,海藻碎屑在好氧状态下更易于释放氨氮,要大于低氧条件下氨氮释放量;好氧条件下海藻碎屑释放氨氮量较平稳,都处于0~1 mg/L,而在低氧状态下,海藻碎屑由初期释放量6.383 mg/L逐渐降低到<1 mg/L(图 5)。从总的释放量说,低氧条件下氨氮更易于由海藻碎屑释放,海藻碎屑在低氧和好氧条件下对氨氮释放影响显著(P<0.05)。

|
图 5 不同溶解氧条件下海藻碎屑分解释放氨氮的影响
Fig. 5 Algae detritus decomposition under the conditions of different dissolved oxygen release ammonia nitrogen
|
海藻碎屑在低氧和好氧条件下释放正磷酸盐趋势较一致,呈现随培养时间的延长释放量降低,并且整个培养期间,好氧条件下正磷酸盐释放量始终高于低氧状态,正磷酸盐在前10天的自溶阶段海藻碎屑分解释放占主导。因此,溶解氧浓度对海藻碎屑分解释放正磷酸盐产生显著影响(P<0.05),从图 6中可发现,在好氧状态下海藻碎屑分解更易正磷酸盐的产生, 随培养时间的延长磷酸盐释放量降低,由实验初期3.70 mg/L降低到实验末期的1.64 mg/L。

|
图 6 海藻碎屑在不同氧环境条件下正磷酸盐释放规律
Fig. 6 Algae detritus under different oxygen and phosphate release rule
|
硅酸盐在海藻碎屑分解期间总体呈现上升趋势,在分解初期10天内硅酸盐释放不稳定,在10天后逐渐趋于平稳上升状态;在缺氧浓度条件下,海藻碎屑由开始吸收转变为释放状态,且释放量为0.05~0.65 mg/L,始终低于好氧条件下海藻碎屑释放量(0.86~1.93 mg/L),海藻碎屑更易于在好氧状态下分解释放硅酸盐(图 7)。溶解氧浓度大小对海藻碎屑分解释放硅酸盐影响显著(P<0.05)。

|
图 7 海藻碎屑在不同氧环境下硅酸盐释放规律
Fig. 7 Algae detritus under different oxygen and silicate release rule
|
海藻碎屑在室内培养周期内,单位海藻碎屑累积释放量见表 1,实验结果显示在低氧浓度条件下溶解无机氮(DIN)单位累积释放量高于好氧状态,而溶解无机磷(DIP)和硅酸盐(SiO42-)释放量在低氧浓度条件下要低于好氧状态,且硅酸盐在好氧条件下累积释放量是低氧条件的4倍高,在好氧条件下,DIP和SiO42-在海藻碎屑分解过程中释放较占优势,与DIN、SiO42-相比,无论在低氧条件还是好氧条件下DIP释放量最大,好氧浓度条件下单位累积释放量达10.143 mg/g,溶解无机氮DIN释放量在低氧状态最大为3.811 mg/g,低于硅酸盐的最大累积释放量4.777 mg/g。

|
表 1 海藻碎屑单位累积释放量 Tab.1 Seaweed clastic unit cumulative release amount |
瓦氏马尾藻碎屑在不同溶氧水平下失重率有明显差异,在低氧浓度条件下海藻碎屑剩余物质干重高于好氧条件,可能是由于好氧型纤维菌在低氧浓度中生长和繁殖受到抑制,好氧型纤维菌对水生植物分解起重要作用[19]。本实验海藻碎屑在分解初期14 d内失重率达到60%且平均分解速率为0.079 5/d;曾从盛等[20]发现互花米草和芦韦在分解初期的90 d内失重率分别为20.77%和15.03%,直到120 d内干物质失重率分别为38.23%和49.03%;WELSCH等[21]发现千屈菜茎和宽叶香蒲叶在分解初期(一年内)失重率分别为50%和40%;CHIMNEY等[22]对比4种湿地植物的分解速率实验,结果显示平均分解速率依次为:金鱼藻(0.056 8/d)>大薸(0.050 8/d)>凤眼莲(0.019 1/d)>香蒲沉水部分(0.005 9/d)>香蒲地上部分(0.000 8/d);对比本实验结果可见,大型海藻分解速率大于湿地植物分解速率,一方面是由于大型海藻分解完全在水环境中进行,会加快分解过程;另一方面是由于大型海藻易分解组分所占百分含量较高,导致分解较快[23]。
当植物体分解时大量的氮是以无机氮形式释放出来,王博等[24]研究测得黑藻低氧组氨氮含量有1.1 mg/L,而好氧组仅0.02 mg/L,本实验研究测得氨氮在低氧组浓度最高有6.383 mg/L,在好氧条件大多处于0~0.500 mg/L较低浓度范围内,在第16天达到最低仅0.029 mg/L,在实验末,好氧浓度条件下氨氮仅为0.413 mg/L,这是由于在好氧条件下硝化作用较强,从而促使氨氮向硝态氮转化的过程,使得硝态氮浓度在实验后期慢慢增大,因此好氧条件下氨氮含量低于低氧条件。在实验初期前10天内低氧条件下硝化作用较弱,实验后期硝化作用慢慢变大使得后期氨氮含量略低于好氧条件下的氨氮含量, 氨氮释放总量是高于好氧状态。由于硝化过程需要有氧条件,溶解氧浓度大小是控制硝化过程的重要因素,若溶解氧低于一定值,硝化作用会受到抑制,TANNER研究认为[25]溶解氧浓度高于2 mg/L就可以进行硝化作用,也有研究认为溶解氧高于1 mg/L也能够进行硝化作用[26]。本实验溶解氧浓度高于1 mg/L,但好氧浓度下硝态氮含量始终高于低氧条件,并且实验后期好氧条件下硝态氮浓度明显高于低氧条件下硝态氮浓度。
不同溶解氧水平下,海藻碎屑分解释放无机营养盐对水体的活性磷酸盐贡献量最大,好氧条件下磷的释放量是低氧条件下的1.314倍,同时,好氧条件下硅的释放量是低氧条件下的4.379倍。因此,溶解氧对瓦式马尾藻碎屑分解过程中硅酸盐影响最大。
3.2 大型海藻碎屑分解释放营养盐的累积贡献量本团队前期研究发现大型海藻生物量为474.617 g DW/m2,瓦氏马尾藻占大型海藻生物量的60.87%,大型海藻碎屑占沉积物来源的53.71%,估算得瓦氏马尾藻碎屑量约为155.168 g DW/m2,本研究实验测得单位海藻碎屑累计释放溶解无机氮1.508~3.811 mg/g,活性磷酸盐7.721~10.143 mg/g,活性硅酸盐1.091~4.777 mg/g,由此估算得现场海域瓦氏马尾藻碎屑对水体溶解无机氮累积贡献量范围为0.166~0.591 g, 溶解无机磷累积贡献量范围为1.198~1.574 g,活性硅酸盐累积贡献量范围为0.169~0.740 g。杜立刚等[18]对三峡库区狗牙根、牛鞭草、狗尾草、稗草和马唐这5种水生植物分解释放TN最大单位累积释放量为0.50~3.23 mg/g,TP最大单位累积释放量为0.54~2.69 mg/g。对比本实验结果,大型海藻分解释放氮磷贡献量要高于湿地挺水植物分解释放量。
瓦氏马尾藻碎屑分解释放活性磷酸盐贡献量最大,活性硅酸盐贡献量次之,溶解无机氮贡献量最低。李文朝等[23]以东太湖优势种的茎叶为实验材料分析氮、磷的消减过程,结果表明生物质所包含的磷优先释放出来。海藻碎屑受海域溶解氧差异影响,不同程度上改变了海域的能流循环和对海域氮、磷、硅等营养盐的贡献作用。
| [1] |
周曦杰, 章守宇, 王旭, 等. 枸杞岛海藻场角蝾螺夏季摄食选择性及其生态学意义[J].
水产学报, 2015, 39(4): 511–519.
ZHOU X J, ZHANG S Y, WANG X, et al. The feeding behaviour and ecological function during summer of one herbivore on seaweed bed in Gouqi Island:the gastropod, Turbo cornutus Solander[J]. Journal of Fisheries of China, 2015, 39(4): 511–519. |
| [2] |
沈志良. 长江口海区理化环境对初级生产力的影响[J].
海洋湖沼通报, 1993: 47–51.
SHEN Z L. The effects of the physic-chemical environment on the primary productivity in the Yangtze River estuary[J]. Marine Limnetic Bulletin, 1993: 47–51. |
| [3] |
杨东方, 高振会, 孙培艳, 等. 胶州湾水温和营养盐硅限制初级生产力的时空变化[J].
海洋科学进展, 2006, 24(2): 203–212.
YANG D F, GAO Z H, SUN P Y, et al. Spatial and temporal variations of the primary production limited by nutrient silicon and water temperature in the Jiaozhou Bay[J]. Advances in Marine Science, 2006, 24(2): 203–212. |
| [4] | SMITH B D, FOREMAN R E. An assessment of seaweed decomposition within a southern Strait of Georgia seaweed community[J]. Marine Biology, 1984, 84(2): 197–205. DOI:10.1007/BF00393005 |
| [5] | GARCIA-PAUSAS J, CASALS P, ROMANYÀ J. Litter decomposition and faunal activity in Mediterranean forest soils: effects of N content and the moss layer[J]. Soil Biology and Biochemistry, 2004, 36(6): 989–997. DOI:10.1016/j.soilbio.2004.02.016 |
| [6] |
李兵. 不同光照和水流条件下底泥释放氮磷规律的研究[D]. 成都: 成都理工大学, 2013.
LI B. The release of nitrogen and phosphorus in the sediment on different light and hydrodynamics conditions[D]. Chengdu: Chengdu University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10616-1013263561.htm |
| [7] |
徐彬, 刘敏, 侯立军, 等. 光照对长江口潮滩沉积物-水界面可溶性硅和无机氮通量的影响[J].
环境科学研究, 2009, 22(3): 327–331.
XU B, LIU M, HOU L J, et al. Influence of simulative light on silicon and nitrogen diffusion fluxes across sediment-water interface in tidal flats of the Yangtze estuary[J]. Research of Environmental Sciences, 2009, 22(3): 327–331. |
| [8] | LOVATOT, CIAVATTA S, BRIGOLIN D, et al. Modelling dissolved oxygen and benthic algae dynamics in a coastal ecosystem by exploiting real-time monitoring data[J]. Estuarine, Coastal and Shelf Science, 2013, 119: 17–30. DOI:10.1016/j.ecss.2012.12.025 |
| [9] |
郭剑芬, 杨玉盛, 陈光水, 等. 森林凋落物分解研究进展[J].
林业科学, 2006, 42(4): 93–100.
GUO J F, YANG Y S, CHEN G S, et al. A review on litter decomposition in forest ecosystem[J]. Scientia Silvae Sinicae, 2006, 42(4): 93–100. |
| [10] |
曾呈奎. 中国常见海藻志[M]. 北京: 科学出版社, 1983: 212.
ZENG C K. Common algae in China[M]. Beijing: Science Press, 1983: 212. |
| [11] |
王蕾, 章守宇, 汪振华, 等. 枸杞岛近岸3种生境鱼类群落组成及岩礁区底栖海藻对鱼类群落结构的影响[J].
水产学报, 2011, 35(7): 1037–1049.
WANG L, ZHANG S Y, WANG Z H, et al. Constitution of fish assemblages in three nearshore habitats and the effect of benthic macroalgae on fish assemblages in Gouqi Island[J]. Journal of Fisheries ofChina, 2011, 35(7): 1037–1049. |
| [12] | BioSonicsInc. Pioneering scientific echosounder solutions[EB/OL]. [2011-05-25].http://www.Biosonicsinc.com. |
| [13] |
步青云. 浅水湖泊溶解氧变化对沉积物磷、氮的影响[D]. 北京: 中国环境科学研究院, 2006.
BU Q Y. Effects of dissolved oxygen concentration on phosphorus and nitrogen in the sediments from shallow lakes[D]. Beijing: China Environmental Science Research Institute, 2006. http://cdmd.cnki.com.cn/Article/CDMD-82405-2007035535.htm |
| [14] |
陈慈美, 包建军, 吴瑜端. 纳污海域营养物质形态及含量水平与浮游植物增殖竞争关系—Ⅰ.磷的效应[J].
海洋环境科学, 1990, 9(1): 6–12.
CHEN C M, BAO J J, WU Y D. Sea nutrients, form and content level and competitive relationship—Ⅰ phytoplankton proliferation. The effect of phosphorus[J]. Marine Environmental Science, 1990, 9(1): 6–12. |
| [15] | DUGDALE R C, WILKERSONF P, MINASH J. The role of a silicate pump in driving new production[J]. Deep Sea Research Part I: Oceanographic Research Papers, 1995, 42(5): 697–719. DOI:10.1016/0967-0637(95)00015-X |
| [16] |
金相灿, 屠清瑛. 湖泊富营养化调查规范[M]. 2版. 北京: 中国环境科学出版社, 1990.
JIN X C, TU Q Y. The Standard Methods in Lake Eutrophication Investigation[M]. 2nd ed. Beijing: China Environmental Science Press, 1990. |
| [17] | OLSON J S. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 1963, 44(2): 322–331. DOI:10.2307/1932179 |
| [18] |
杜立刚. 三峡库区消落带植被淹水碳氮磷释放及消落带氮磷交换通量研究[D]. 重庆: 重庆大学, 2013.
DU L G. Carbon, nitrogen and phosphorus release from the vegetation and flux of nitrogen, phosphorus of WLFZ in the Three Gorges Reservoir[D]. Chongqing: Chongqing University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10611-1013043863.htm |
| [19] | REJMÁNKOVÁ E, SIROVÁ D. Wetland macrophyte decomposition under different nutrient conditions: relationships between decomposition rate, enzyme activities and microbial biomass[J]. Soil Biology and Biochemistry, 2007, 39(2): 526–538. DOI:10.1016/j.soilbio.2006.08.022 |
| [20] |
曾从盛, 张林海, 王天鹅, 等. 闽江河口湿地植物枯落物立枯和倒伏分解主要元素动态[J].
生态学报, 2012, 32(20): 6289–6299.
ZENG C S, ZHANG L H, WANG T E, et al. Nutrient dynamics of the litters during standing and sediment surface decay in the Min River estuarine marsh[J]. Acta Ecologica Sinica, 2012, 32(20): 6289–6299. |
| [21] | WELSCH M, YAVITT J B. Early stages of decay of Lythrumsalicaria L. and Typhalatifolia L. in a standing-dead position[J]. Aquatic Botany, 2003, 75(1): 45–57. DOI:10.1016/S0304-3770(02)00164-X |
| [22] | CHIMNEY M J, PIETRO K C. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA)[J]. Ecological Engineering, 2006, 27(4): 301–321. DOI:10.1016/j.ecoleng.2006.05.016 |
| [23] |
李文朝, 陈开宁, 吴庆龙, 等. 东太湖水生植物生物质腐烂分解实验[J].
湖泊科学, 2001, 13(4): 331–336.
DOI:10.18307/20010407 LI W C, CHEN K N, WU Q L, et al. Experimental studies on decomposition process of aquatic plant material from East Taihu Lake[J]. Journal of Lake Sciences, 2001, 13(4): 331–336. DOI:10.18307/20010407 |
| [24] |
王博, 叶春, 李春华, 等. 不同氧环境中黑藻腐解过程及对水体-底泥碳、氮、磷的影响[J].
应用与环境生物学报, 2013, 19(3): 484–488.
WANG B, YE C, LI C H, et al. The process of nutrition release during decomposition of Hydrilla verticillata in different dissolved oxygen conditions[J]. Chinese Journal of Applied & Environmental Biology, 2013, 19(3): 484–488. |
| [25] | TANNER C C, KADLEC R H, GIBBS M M, et al. Nitrogen processing gradients in subsurface-flow treatment wetlands—influence of wastewater characteristics[J]. Ecological Engineering, 2002, 18(4): 499–520. DOI:10.1016/S0925-8574(02)00011-3 |
| [26] | KADLEC R H, TANNER C C, HALLY V M, et al. Nitrogen spiraling in subsurface-flow constructed wetlands: implications for treatment response[J]. Ecological Engineering, 2005, 25(4): 365–381. DOI:10.1016/j.ecoleng.2005.06.009 |
 2017,
Vol. 26
2017,
Vol. 26


