2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 贵州大学 动物科学学院, 贵州 贵阳 550025
嗜水气单胞菌 (Aeromonas hydrophila) 是革兰氏阴性菌,隶属气单胞菌科、气单胞菌属[1]。该菌广泛存在于所有的内陆水环境、水底沉积物和水生生物体中,有致病性和非致病性菌株之分。致病性嗜水气单胞菌频繁地威胁到鱼类健康,尤其是在密集投饵的高密度水产养殖中。它是养殖鱼类潜在的致病菌,能引起包括赤皮病、细菌性败血症等鱼类疾病[2]。在我国,此菌曾引起南方各省鲫、草鱼、鲢、鳙等鲤科鱼类爆发败血症,给养殖户带来极大经济损失[3]。
嗜水气单胞菌存在多种毒力因子,这些毒力因子与该菌的致病性存在密切关系。已知的毒力因子有溶血素[4]、气溶素[5]、胞外蛋白酶[6]、外膜蛋白[7]等。溶血素 (AHH-1) 是嗜水气单胞菌的主要毒力因子之一[8],能引起幼鼠肠道积液,并通过产生功能性孔洞从而破坏红细胞[9]。研究表明,温度、pH等许多因素可影响溶血素基因的表达,从而影响致病菌嗜水气单胞菌的毒力[10]。气溶素 (AerA) 作为嗜水气单胞菌的主要毒性物质,因存在种属特异性而成为致病性菌株的象征[11]。研究表明AerA缺失株对小鼠的半致死量是野生株的20倍以上[12]。气溶素具有溶血性、肠毒素毒性以及细胞毒性,抗胰酶,不耐热[13]。气溶素与红细胞表面的特定糖蛋白受体结合,通过聚合作用形成毒素六聚体,插入到红细胞的脂质双分子层中,形成孔洞,增强细胞膜渗透性,导致细胞破裂死亡[14]。弹性蛋白酶 (ahyB) 是嗜水气单胞菌的重要毒力因子,能够水解弹性蛋白,且与其他的金属蛋白酶具有高度的序列相似性,ahyB突变株的半致死量比野生株高100倍以上[15]。
在一定条件下,碳酸氢钠能抑制细菌生长[16],已有研究表明碳酸氢钠对大肠杆菌、乳酸菌、金黄色葡萄球菌、假单胞菌等病原菌有抑制作用[16-17]。前期实验证明碳酸氢钠达到特定浓度后能有效抑制嗜水气单胞菌生长。在水产养殖生产中,碳酸氢钠被用做治疗某些细菌性疾病的辅助药物[18],这除了与致病菌生长有关,是否还与其毒性相关?其主要毒力相关的基因表达有何变化?为探究碳酸氢钠对嗜水气单胞菌毒力基因表达的影响,本实验用不同浓度的碳酸氢钠培养嗜水气单胞菌,采用荧光定量PCR技术对嗜水气单胞菌编码溶血素、气溶素、弹性蛋白酶等3种主要毒力因子的基因进行相对表达分析,以期能初步了解碳酸氢钠对嗜水气单胞菌毒力因子的影响规律。
1 材料与方法 1.1 实验材料 1.1.1 菌株及其复壮嗜水气单胞菌 (菌株编号:ATCC7966) 来源于ATCC。菌株接种于LB培养基,28 ℃、200 r/min培养24 h,再接种到绵羊血平板培养基复壮,28 ℃培养24 h后挑选溶血圈大的单个菌落接种于LB培养基,培养24 h接种到1%脱脂奶蔗糖胰蛋白胨培养基,28 ℃培养24 h后挑选溶蛋白圈大的单个菌落接种于LB培养基,做复壮菌种 (具溶血性和胞外蛋白酶活性),甘油保存于-80 ℃冰箱备用。
1.1.2 培养基LB培养基、1%脱脂奶蔗糖胰蛋白胨培养基分别参照文献[19-20]自行配置。若无特殊说明,实验所用培养基均为液体培养基。绵羊血平板,杭州百思生物技术有限公司生产。细菌总RNA提取试剂盒由Omega公司生产。
1.2 实验方法 1.2.1 总RNA的提取以分别添加0.024、0.048、0.072、0.096和0.120 mol/L碳酸氢钠培养的嗜水气单胞菌为实验组,未添加碳酸氢钠的为对照组,于28 ℃恒温摇床中培养至对数期,4 ℃条件下8 000 r/min离心5 min,去除上清,收集菌体。利用细菌总RNA提取试剂盒 (Omega公司) 提取RNA,操作步骤按试剂盒提供的方法进行。
所有提取的RNA样本均使用16S rRNA-F/16S rRNA-R进行PCR检测,均未发现扩增产物,说明提取的RNA中无基因组DNA污染。
1.2.2 荧光定量PCR使用PrimeScript RT reagent Kit with gDNA Eraser试剂盒进行第一链cDNA的合成,其步骤参照试剂盒使用说明。实验所用内参基因为16S rRNA。
采用软件PrimerPremier 6.0设计引物,具体引物序列见表 1。所用引物均由宝生物工程 (大连) 有限公司合成。

|
表 1 目的基因与内参基因的引物 Tab.1 Primers of target and internal control genes |
荧光定量PCR采用SYBR Premix Ex Taq Ⅱ (Tli RNaseH Plus) 试剂盒进行。使用2 μL的反转录产物用于PCR反应。在PCR管中加入下列成分:SYBR Premix Ex Taq Ⅱ (2×)12.5 μL,Primer F (10 μmol/L)1 μL,Primer R (10 μmol/L)1 μL,反转录产物2 μL,dH2O 8.5 μL。
反应条件:95 ℃变性30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环,溶解温度85 ℃。
1.2.3 碳酸氢钠浓度与嗜水气单胞菌致病性关系的研究将ATCC7966株在碳酸氢钠浓度为0.024、0.048、0.072和0.096 mol/L的培养基中培养至对数期后,4 ℃条件下8 000 r/min离心5 min,弃上清,用灭菌生理盐水悬浮,0.024、0.048和0.072 mol/L组做10倍稀释菌体浓度至2.4×105 cfu/mL、0.096 mol/L组5倍稀释至4.8×105 cfu/mL。每个稀释浓度0.6 mL,分别注射于健康斑马鱼腹腔,每组30尾,10尾一个平行。观察并记录48 h内死亡数,并根据直线内插法计算半致死量 (LD50)。实验所用斑马鱼均购自广州市威记鱼行,暂养一周,鱼的死亡率不超过10%可用于人工感染实验。
1.2.4 数据处理实验采用2-ΔΔCt方法对不同碳酸氢钠浓度下嗜水气单胞菌样品基因的表达水平进行相对定量分析。实验数据采用平均值±标准差 (Mean±SD) 表示,利用单因素方差分析检测组间差异。按照线性回归法计算LD50。实验数据使用IBM SPSS Statistics V20.0、excel进行分析。
2 结果与分析 2.1 不同碳酸氢钠对嗜水气单胞菌毒力基因表达的影响5个实验组AHH-1的表达与对照组之间均存在显著性差异 (P<0.05),0.024 mol/L组和0.048、0.072、0.096、0.120 mol/L组均存在显著性差异,0.048 mol/L组和0.072、0.096、0.120 mol/L组均存在显著差异,但0.072、0.096、0.120 mol/L组之间差异不显著。除碳酸氢钠浓度为0.048 mol/L的实验组,另外4个实验组AHH-1的表达量随着碳酸氢钠浓度的增加而降低。随着碳酸氢钠浓度的增加,AHH-1的表达量呈现逐渐下调趋势 (图 1a)。
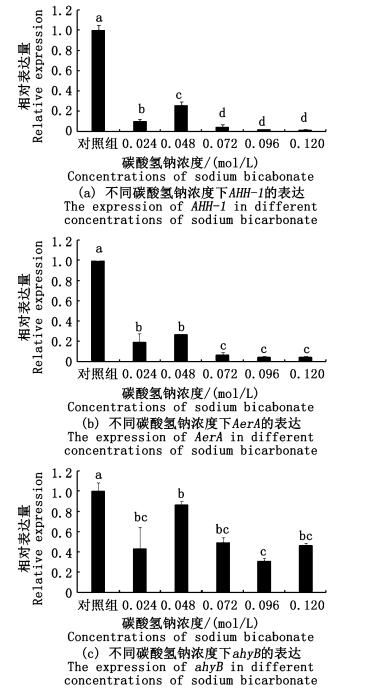
|
图 1 不同碳酸氢钠浓度下嗜水气单胞菌毒力因子的表达
Fig. 1 The expression of virulence factors in A. hydrophila growing in different concentrations of sodium bicarbonate
不同小写字母表示差异显著 (P<0.05) Different lowercases means significant differences at P < 0.05 |
5个实验组AerA的表达与对照组之间均存在显著性差异 (P<0.05),0.024 mol/L组与0.048 mol/L组之间差异不显著,0.024 mol/L与0.072、0.096、0.120 mol/L组之间差异显著,0.048 mol/L组与0.072、0.096、0.120 mol/L组之间差异显著,0.072、0.096、0.120 mol/L组之间差异不显著 (图 1b)。
添加了碳酸氢钠的嗜水气单胞菌的ahyB表达量均显著低于对照组的表达量。0.048 mol/L组与0.096 mol/L组之间差异显著,其他各实验组之间差异均不显著 (图 1c)。
2.2 碳酸氢钠浓度与嗜水气单胞菌致病性的关系由图 2可知,相比于对照组的嗜水气单胞菌,添加了碳酸氢钠培养的嗜水气单胞菌对斑马鱼的半致死量明显比对照组高,即碳酸氢钠浓度范围在0.024~0.096 mol/L时能降低嗜水气单胞菌的毒力;而且随着碳酸氢钠浓度的增加,嗜水气单胞菌对斑马鱼的半致死量呈现逐渐加大的趋势,即毒力逐渐减小。
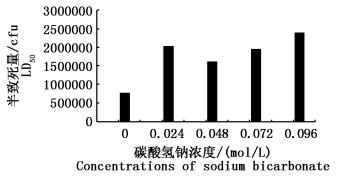
|
图 2 不同碳酸氢钠浓度添加下嗜水气单胞菌的半致死量
Fig. 2 LD50 of A. hydrophila in different concentration of NaHCO3
|
本研究表明,碳酸氢钠对嗜水气单胞菌的AHH-1、AerA和ahyB基因表达具有一定影响。碳酸氢钠浓度在0.024~0.120 mol/L范围时,5个实验组的AHH-1、AerA和ahyB基因表达量均显著低于对照组。且随着碳酸氢钠浓度的增加,实验组基因表达量呈递减趋势,与嗜水气单胞菌人工感染斑马鱼的实验结果相符。由此可推测碳酸氢钠可能是通过降低嗜水气单胞菌的溶血活性及分解弹性蛋白的能力,降低细菌毒性。
AHH-1、AerA和ahyB都是嗜水气单胞菌重要的毒力因子,在细菌致病过程中起重要的作用。嗜水气单胞菌的感染过程包括:利用粘附因子粘附宿主,借助外膜蛋白和孔蛋白入侵宿主,依靠胞外蛋白酶固定在宿主破损的部位;合成分泌溶血素等外毒素减轻宿主的免疫反应以及破坏红细胞;夺取寄主的营养成分,导致溶血和出血,引起宿主死亡[22]。在整个感染过程中,嗜水气单胞菌的外毒素和胞外蛋白酶在对宿主的入侵、溶血和菌体本身的营养供应等方面起着极其重要的作用。本次实验结果表明添加碳酸氢钠后溶血素基因、气溶素基因和弹性蛋白酶基因的表达显著下调。结合嗜水气单胞菌对斑马鱼的感染过程推测碳酸氢钠可能是通过降低嗜水气单胞菌的溶血活性和分解弹性蛋白的能力来降低细菌毒性。在今后的研究中,可在此研究基础上继续对嗜水气单胞菌的溶血素和气溶素进行提纯和溶血特性分析,以及对弹性蛋白酶进行提纯分析。
到目前为止,碳酸氢钠对细菌毒力影响的报道不多,已有的研究表明,细菌中的某些蛋白质能够感应环境中的碳酸氢钠,诱导某些毒力基因表达,从而提高细菌的毒力和杀伤力[23-24]。BASEL等[25]证实碳酸氢钠可以诱导霍乱弧菌的毒力基因表达。本研究的结果和前人的研究结果存在差异,究其原因可能是由于细菌的种类不同,对碳酸氢钠的反应应答也不相同。研究表明,气单胞菌可以根据不同的宿主和外部环境生长条件,迅速调整和适应宿主的内部环境。同时,在不同的条件下,还必须沉默一些基因, 精确的基因沉默和基因激活是气单胞菌致病性所必需的。不同的基因对不同的环境信号做出响应,或在多个信号同时出现时做出响应。许多环境信号可以调节毒力基因的表达。毒力基因往往也受多种条件的调控。这允许不同的基因对几种不同的环境信号做出单独的响应,或对各种不同的信号同时出现时做出应答。环境因子可在多种层次上调节毒力基因的表达,包括转录的起始和终止、mRNA的转换、翻译的起始以及翻译后的修饰、蛋白质的转化和DNA的结构[22]。另外,碳酸氢钠属弱碱性盐,加入液体培养基后能升高其pH。碳酸氢钠使嗜水气单胞菌的毒力基因表达下调,可能受到pH的影响。研究表明,在碱性条件下 (pH=9.0),只有溶血素基因才能表达,气溶素、外膜蛋白、粘附素等毒力基因的表达减弱或停止[26]。储卫华和陆承平也证实,pH过高不利于胞外蛋白酶的产生[27]。碳酸氢钠对嗜水气单胞菌毒力基因表达的减弱作用是否与pH有关,仍需进一步研究。
| [1] | MARTINEZ-MURCIA A J, BENLLOCH S, COLLINS M D. Phylogenetic interrelationships of members of the genera Aeromonas and Plesiomonas as determined by 16S ribosomal DNA sequencing:lack of congruence with results of DNA-DNA hybridizations[J]. International Journal of Systematic and Evolutionary Microbiology, 1992, 42(3): 412–421. |
| [2] |
陆承平. 致病性嗜水气单胞菌及其所致鱼病综述[J].
水产学报, 1992, 16(3): 282–288.
LU C P. Pathogenic Aeromonas hydrophila and the fish diseases caused by it[J]. Journal of Fisheries of China, 1992, 16(3): 282–288. |
| [3] |
陈怀青, 陆承平. 家养鲤科鱼暴发性传染病的病原研究[J].
南京农业大学学报, 1991, 14(4): 87–91.
CHEN H Q, LU C P. Study on the pathogen of epidemic septicemia occurred in cultured cyprinoid fishes in southeastern China[J]. Journal of Nanjing Agricultural University, 1991, 14(4): 87–91. |
| [4] | HOWARD S P, GARLAND W J, GREEN M J, et al. Nucleotide sequence of the gene for the hole-forming toxin aerolysin of Aeromonas hydrophila[J]. Journal of Bacteriology, 1987, 169(6): 2869–2871. DOI:10.1128/jb.169.6.2869-2871.1987 |
| [5] | HIRONO I, AOKI T. Nucleotide sequence and expression of an extracellular hemolysin gene of Aeromonas hydrophila[J]. Microbial Pathogenesis, 1991, 11(3): 189–197. DOI:10.1016/0882-4010(91)90049-G |
| [6] | CHANG T M, LIU C C, CHANG M C. Cloning and sequence analysis of the gene (eprA1) encoding an extracellular protease from Aeromonas hydrophila[J]. Gene, 1997, 199(1/2): 225–229. |
| [7] | GRYLLOS I, SHAW J G, GAVIÍN R, et al. Role of flm locus in mesophilic Aeromonas species adherence[J]. Infection and Immunity, 2001, 69(1): 65–74. DOI:10.1128/IAI.69.1.65-74.2001 |
| [8] |
蒋启欢, 叶应旺, 胡王, 等. 嗜水气单胞菌毒力因子及病害控制技术研究进展[J].
现代农业科技, 2012: 324–327.
JIANG Q H, YE Y W, HU W, et al. Research progresses of virulence factors and control technologies in Aeromonas hydrophila[J]. Modern Agricultural Sciences and Technology, 2012: 324–327. |
| [9] | AOKI T, HIRONO I. Cloning and characterization of the haemolysin determinants from Aeromonas hydrophila[J]. Journal of Fish Diseases, 1991, 14(3): 303–312. DOI:10.1111/jfd.1991.14.issue-3 |
| [10] |
熊焰, 周煜, 汪开毓. 影响嗜水气单胞菌溶血素产生的因素[J].
中国兽医科技, 1997, 27(7): 25.
XIONG Y, ZHOU Y, WANG K Y. Influence factors of hemolysin production in Aeromonas hydrophila[J]. Chinese Journal of Veterinary Science and Technology, 1997, 27(7): 25. |
| [11] |
李文艳, 张伟伟, 马秀娟, 等. 嗜水气单胞菌相关毒力基因的研究进展[J].
安徽农业科学, 2011, 39(9): 5060–5061.
LI W Y, ZHANG W W, MA X J, et al. Research progress of relevant virulence genes of Aeromonas hydrophila[J]. Journal of Anhui Agricultural Sciences, 2011, 39(9): 5060–5061. |
| [12] | CHAKRABORTY T, HUHLE B, HOF H, et al. Marker exchange mutagenesis of the aerolysin determinant in Aeromonas hydrophila demonstrates the role of aerolysin in A. hydrophila-associated systemic infections[J]. Infection and Immunity, 1987, 55(9): 2274–2280. |
| [13] | HOWARD S P, BUCKLEY J T. Protein export by a gram-negative bacterium:production of aerolysin by Aeromonas hydrophila[J]. Journal of Bacteriology, 1985, 161(3): 1118–1124. |
| [14] |
李莲瑞, 罗红斌, 卢强, 等. 嗜水气单胞菌Aer毒素的研究进展[J].
塔里木农垦大学学报, 2004, 16(3): 46–51.
LI L R, LUO H B, LU Q, et al. Studies on Aeromonas hydrophlia Aer toxin[J]. Journal of Tarim University of Agricultural Reclamation, 2004, 16(3): 46–51. |
| [15] | CASCÓN A, YUGUEROS J, TEMPRANO A, et al. A major secreted elastase is essential for pathogenicity of Aeromonas hydrophila[J]. Infection and Immunity, 2000, 68(6): 3233–3241. DOI:10.1128/IAI.68.6.3233-3241.2000 |
| [16] | CORRAL L G, POST L S, MONTVILLE T J. Antimicrobial activity of sodium bicarbonate[J]. Journal of Food Science, 1988, 53(3): 981–982. DOI:10.1111/jfds.1988.53.issue-3 |
| [17] | GUTIÉRREZ-HUANTE M, MARTÍNEZ H, BUSTAMANTE V H, et al. Bicarbonate enhances the in vitro antibiotic activity of kanamycin in Escherichia coli[J]. Letters in Applied Microbiology, 2015, 60(5): 440–446. DOI:10.1111/lam.2015.60.issue-5 |
| [18] |
冯小鹿. 鱼病防治常用药物简介[J].
当代畜禽养殖业, 2010: 51–52.
FENG X L. Brief introduction of common medicines in fish disease control[J]. Modern Animal Husbandry, 2010: 51–52. |
| [19] | SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning:a laboratory manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989. |
| [20] |
陆承平, 陈怀青. GB/T 18652-2002, 致病性嗜水气单胞菌检验方法[S]. 北京: 中国标准出版社, 2002.
LU C P, CHEN H Q. GB/T 18652-2002, Methods for detection of pathogenic Aeromonas hydrophila[S]. Beijing:Standards Press of China, 2002. |
| [21] | WANG G H, CLARK C G, LIU C Y, et al. Detection and characterization of the hemolysin genes in Aeromonas hydrophila and Aeromonas sobria by multiplex PCR[J]. Journal of Clinical Microbiology, 2003, 41(3): 1048–1054. DOI:10.1128/JCM.41.3.1048-1054.2003 |
| [22] |
范腾飞. 气单胞菌的毒力基因检测及环境因子对毒力基因表达的影响[D]. 合肥: 合肥工业大学, 2013.
FAN T F. Detection of virulence genes in Aeromonas strains and the influence of environmental factors on virulence genes expression[D]. Hefei:Hefei University of Technology, 2013. |
| [23] | WILSON A C, SOYER M, HOCH J A, et al. The bicarbonate transporter is essential for Bacillus anthracis lethality[J]. PLoS Pathogens, 2008, 4(11): e1000210. DOI:10.1371/journal.ppat.1000210 |
| [24] | YANG J, TAUSCHEK M, HART E, et al. Virulence regulation in Citrobacter rodentium:the art of timing[J]. Microbial Biotechnology, 2010, 3(3): 259–268. DOI:10.1111/mbt.2010.3.issue-3 |
| [25] | ABUAITA B H, WITHEY J H. Bicarbonate induces Vibrio cholerae virulence gene expression by enhancing ToxT activity[J]. Infection and Immunity, 2009, 77(9): 4111–4120. DOI:10.1128/IAI.00409-09 |
| [26] |
胡靖, 李爱华, 胡成钰, 等. 温度和pH值对嗜水气单胞菌毒力基因表达的影响[J].
南京理工大学学报, 2006, 30(3): 375–380.
HU J, LI A H, HU C Y, et al. Effects of temperature and pH on expression of virulence factors from Aeromonas Hydrophila[J]. Journal of Nanjing University of Science and Technology, 2006, 30(3): 375–380. |
| [27] |
储卫华, 陆承平. 培养条件对嗜水气单胞菌胞外蛋白酶合成与分泌的影响[J].
南京农业大学学报, 2001, 24(3): 65–68.
CHU W H, LU C P. Effects of culture conditions on the production of Aeromonas hydrophila extracellular protease[J]. Journal of Nanjing Agricultural University, 2001, 24(3): 65–68. |
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. College of Animal Sciences, Guizhou University, Guiyang 550025, Guizhou, China
 2017,
Vol. 26
2017,
Vol. 26


