2. 上海水产养殖工程技术研究中心, 上海 201306;
3. 上海高校知识服务平台上海海洋大学水产动物育种中心, 上海 201306
由于鱼类的代谢特性,只能够利用饲料中25%左右的氮元素,不能被鱼类有效利用的氮元素将会残留在养殖水体中[1],既污染水体,影响鱼类生长,也是对饲料资源的严重浪费。生物絮凝技术(Biofloc Technology,BFT)就是通过添加有机碳源的方式调节养殖水体碳氮比(C/N>15),促进异养细菌的优势生长,形成可被重新利用的生物絮体[2-6]。基于生物絮凝技术的水产养殖模式能够有效提高饲料蛋白的利用率和净化养殖水环境,被认为是解决当前水产养殖集约化生产面临的资源和环境问题的有效方法之一[7-8], 近年来已经广泛地应用于罗非鱼、草鱼和虾等的养殖中[9-12]。关于生物絮凝罗非鱼养殖技术,已有研究开展了原位式生物絮凝技术养殖罗非鱼[9],在养殖过程中极易受到溶氧、有机碳源、絮体的活性及营养成分等因素的影响[8],水质的波动性也比较大[13],迫切需要一种新的养殖模式来改善这些问题,因此有必要开展异位式生物絮凝技术养殖罗非鱼。异位式生物絮凝技术的优势在于将养殖区域和培养絮体的区域分开,通过对絮体培养区域的调控来达到预期目的,避免了直接在养殖区域操作对鱼类造成的不利影响,为扩大养殖对象的范围,增加生物絮凝养殖的应用面提供可能。本研究比较了原位式BFT和异位式BFT养殖罗非鱼的养殖效果,通过测试分析了水质、生物絮体、鱼体的生长性能和肌肉的营养成分以及消化酶活力等因素,希望能对生物絮凝技术在生产实践上的应用和完善起到一定的指导作用。
1 材料与方法 1.1 实验鱼及实验设施实验用鱼(吉富品系罗非鱼GIFT Oreochromis niloticus)为同一批次孵化的鱼苗(购自江门市新会吉海水产有限公司)。运回后在上海海洋大学循环水养殖系统中暂养至10 g /尾以上,挑选健康无病、大小均匀的480尾作为实验用鱼。实验用鱼全长为(9.72±0.33) cm,体长为(7.88±0.31) cm,体质量为(20.33±3.74) g,体高为(3.22±0.08) cm,体宽为(1.57±0.02) cm,初始放养密度为(2.71±0.2) kg /m3。
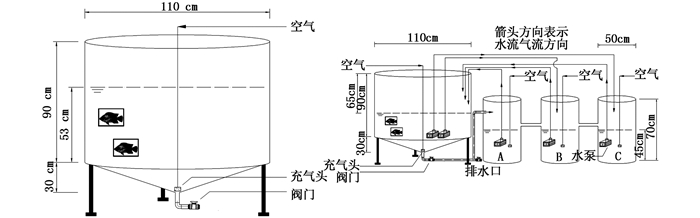
实验选用上柱体下锥体的养殖缸和柱状的净水桶,其中养殖缸直径110 cm,全高120 cm,锥体高30 cm,有效水体积为600 L(图 1)。椎体底部设排水管,用于排水。同时设置了一个U型管与生物絮凝培养槽A相连,平衡水位。生物絮凝体培养槽为桶状,高70 cm,桶底部直径为50 cm,可以蓄水90 L。养殖系统由一个养殖缸和生物絮凝体培养槽(A,B,C)构成,以控制絮凝体的培养时间。除了养殖缸和生物絮凝体培养槽A通过水泵(50 W,2 000 L/h)和U型管完成水体交换,养殖缸与培养槽B和C通过2个水泵完成水体交换,连接处安装止逆阀,控制水流从养殖槽中流向生物絮凝体培养槽。同时配合一个时控开关,以控制絮体培养槽中水力停留时间。养殖缸和生物絮凝体培养槽底部均放置曝气石。生物絮凝体培养槽另设一出水管,用于排出多余絮凝体。
|
图 1 原位缸和异位缸的结构图
Fig. 1 Structure of situ type and non-situ type
|
实验按不同的生物絮凝BFT养殖模式设计了原位组(对照组)和异位组(实验组),实验组为水力停留时间HRT 4 h,每组设置3个平行。实验前将收集好的罗非鱼的粪便于养殖缸中曝气培养絮体,培养15 d至总悬浮固体物(total suspended solids,TSS)浓度值50 mg/L,以微生物合成的可生物降解材料聚-β-羟丁酸(poly-β-hydroxybutyrate acid,PHB,购自宁波天安生物材料有限公司)挂袋的方式提供反应过程中所需碳源,每个养殖系统中各150 g,分装成3袋。原位组养殖缸中在离水面30 cm、50 cm、80 cm的深度各挂一袋;实验组养殖缸中不挂袋,在外置的3个培养槽中30 cm处各挂一袋。
实验开始于2015年6月28日,实验周期120 d。整个暂养阶段和实验期间投喂的饲料是通威股份有限公司生产的海水鱼膨化配合饲料8920,其中水分≤12.0%,粗蛋白≥40.0%,粗脂肪≥4.0%,粗纤维≤7.0%,粗灰分≤16.0%,总磷≥1.20%,赖氨酸≥2%。通过适应阶段对实验鱼摄食情况的观察,将日投饵率定为3%,在8:30和17:30分2次投喂。养殖期间,各养殖缸内保持DO > 4 mg/L。实验期间使用1台750 W罗茨式鼓风机提供DO和混合强度。各养殖缸内的pH通过NaHCO3调节,保持在6~8之间。实验启动阶段,采用罗非鱼粪便作为氮源,PHB作为碳源,培养絮体,培养20 d,使水质稳定。调控各养殖缸内初始TSS为50 mg/L,将实验鱼放入。在整个养殖过程中,絮体需要定期的去除,将部分絮体混合物泵出至备用空桶内,沉淀1 h,之后将上清液泵回到养殖缸中,收集剩下的絮体。实验期间不换水,只补充因采样和蒸发损失的水。
1.3 测试方法 1.3.1 水质测试方法每天下午1:00用手持式多参数水质仪(WTW Multi 3430,德国)检测养殖水体的温度、pH、盐度、溶氧;水样经0.45 μm滤膜过滤后进行氨氮(TAN)、亚硝氮(NO2--N)、硝态氮(NO3--N)、总氮(TN)、总磷(TP)、活性磷(PO43--P)、溶解性有机碳(DOC)的测定。TAN测定采用水杨酸-次氯酸钠光度法(分光光度计型号752S06017,上海棱光技术有限公司生产,下同),NO2--N测定采用盐酸萘乙二胺比色法,NO3--N测定采用N-(1-萘基)-紫外分光光度法,TN测定采用过硫酸钾氧化-紫外分光光度法,TP、PO43--P采用钼锑抗分光光度法测定,DOC使用多功能C/N分析仪(Multi N/C 2100,德国)测定。
1.3.2 实验鱼取样及消化酶指标的测定实验鱼在样品采集前需饥饿处理24 h,每个养殖缸取3条实验鱼,使用苯氧乙醇对鱼体进行麻醉,于冰袋上解剖取胃、全肠和肝胰腺,低温生理盐水清洗后用滤纸拭干、称重,加入不同体积的低温生理盐水进行组织匀浆,在4 ℃条件下4 000 r/min离心10 min,取上清液待测。胃蛋白酶、脂肪酶、胰蛋白酶由南京建成购买的试剂盒测试。
1.3.3 絮体、肌肉的组成成分采用称重法测定TSS[14];用英霍夫式锥形管取1 L水样静置5 min的方法测定絮体5 min的沉降体积比FV-5 min[6]。絮体在60 ℃下使用烘箱烘干,肌肉经过冷冻干燥机(ilShinBioBase,FD5508) 中冻干,于干燥器中保存以便后续测试。粗蛋白测定:采用元素分析仪(elmenter ELMENTAR VARIO MAX,德国)测其N元素量[15];粗脂肪测定:采用氯仿甲醇萃取法;灰分测定:依据GB/T6438—92,取干燥恒重后的样品在马弗炉(SR-JX3-9箱式电炉)中灼烧5 h至恒重[16]。
1.3.4 鱼的生长性能实验每隔30 d,从每个养殖缸随机各取出3尾实验鱼,称量其体长、体质量。实验结束时,逐尾测量鱼体质量并记录尾数。测定的数值及实验鱼的摄食量用于计算以下的指标:
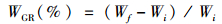 (1)
(1)
式中:WGR表示增重率;Wi、Wf分别为实验开始、结束时实验鱼体质量(g)。
 (2)
(2)
式中:SGR表示特定生长率;Wi、Wf分别为实验开始、结束时实验鱼体质量(g);d为饲养天数。
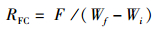 (3)
(3)
式中:RFC表示饲料转化系数;F为饲料摄入总量(g);Wi、Wf分别为实验开始、结束时实验鱼体质量(g)。
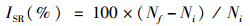 (4)
(4)
式中:ISR表示成活率;Ni、Nf为实验开始、结束时实验鱼存活的条数。
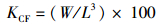 (5)
(5)
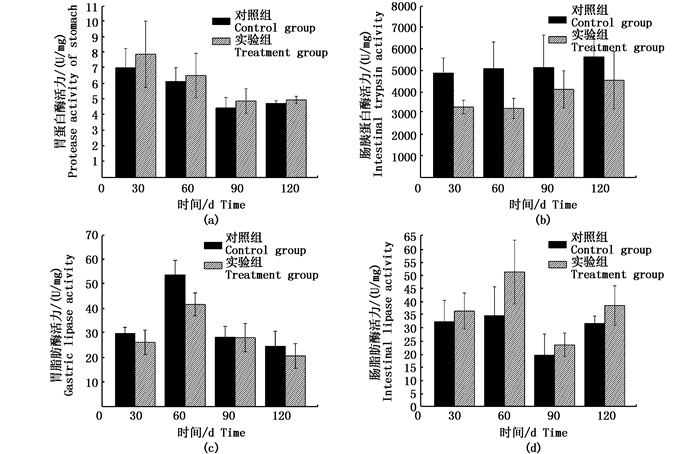
式中:KCF表示肥满度(g/cm3);W为实验鱼体质量(g);L为实验鱼体长(cm)。
1.4 数据分析实验数值用平均值±标准差(Mean±SD)形式表示,采用SPSS 17.0统计软件对数据进行ANOVA单因素方差分析,并结合Duncan氏法进行多重比较,P < 0.05为差异性显著。实验结果用Origin处理成图表。
2 结果 2.1 水质整个实验阶段,水温保持在23~30 ℃,DO控制在4 mg/L以上,pH在6~8之间波动。如图 2所示,对照组和实验组的三态氮及总氮浓度变化趋势大体一致。第33天时对照组和实验组中的氨氮浓度都达到峰值,但对照组[(11.85±2.20) mg/L]要高于实验组[(9.78±4.12) mg/L],无显著性差异(P > 0.05),在56 d之后氨氮浓度基本稳定在3 mg/L以下(图 2a)。亚硝氮浓度在37 d时达到峰值,在53 d之后亚硝氮浓度基本稳定在2 mg/L以下(图 2b)。硝氮浓度一直呈现上升趋势,对照组和实验组大体一致(图 2c)。

|
图 2 氨氮(a)、亚硝氮(b)、硝氮(c)及总氮(d)浓度变化趋势
Fig. 2 The ammonia nitrogen(a), nitrite nitrogen (b), nitrate nitrogen(c) and total nitrogen(d) concentration dynamics in the culture cycle
|
由图 3可见对照组和实验组的磷酸盐浓度大体上呈上升趋势,整个生物絮凝过程对照组和实验组对磷酸盐的利用均不明显。
|
图 3 磷酸盐(a)和总磷(b)的浓度变化趋势
Fig. 3 The phosphate(a)and total phosphorus (b)concentration dynamics in the culture cycle
|
实验鱼的生长性能及饲料转化率等情况如表 1所示。实验末期实验组的密度、体质量、肥满度均大于对照组,但无显著性差异(P > 0.05),且较对照组体色偏暗。

|
表 1 实验鱼的生长性能 Tab.1 The tilapia growth performance |
从图 4a可知,实验中对照组和实验组的TSS变化趋势一致,到实验后期TSS达到1 000 mg/L。图 4b可知,对照组的FV-5min在72 d之前均高于实验组,在72 d之后实验组高于对照组。本实验中对照组的生物絮体颜色比实验组颜色深,实验组中呈现淡黄色。

|
图 4 TSS(a)和FV-5min(b)的变化趋势
Fig. 4 The TSS(a)and FV-5min(b)dynamics in the culture cycle
|
从图 5a中可以看出,第30天时絮体粗蛋白含量达到30%,第60天时达到40%。从图 5b中可以看出,两组絮体第60天时粗脂肪含量达到最高。实验末期对照组和实验组絮体的粗脂肪含量都有不同程度的降低,分别为4.61%±0.34 %和5.22%±0.08 %,均无显著性差异(P > 0.05)。从图 5c中可以看出,整个实验过程中,两组絮体的粗灰分含量都在不断的增长,最终分别达到31.01%±0.11 %、25.27%±0.15 %,对照组含量高于实验组。

|
图 5 各时期絮体粗蛋白(a)、粗脂肪(b)和粗灰分(c)含量的变化
Fig. 5 The biofloc crude protein (a), crude lipid (b) and crude ash (c) content dynamics in the culture cycle
|
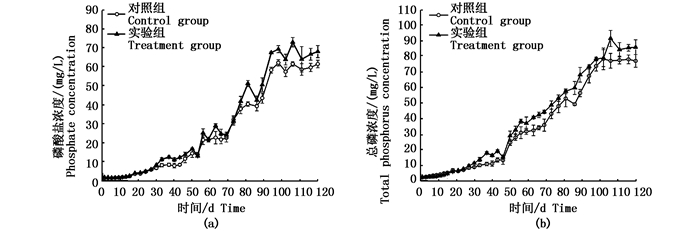
由图 6a中可知,在养殖期间对照组和实验组的实验鱼冷冻干燥后肌肉的粗蛋白含量没有显著差异,末期分别为89.37%±0.25%和85.12%±1.42%,测试的冷冻干燥后全鱼的粗蛋白含量也基本相同,初始含量为59.97%±1.95%,实验末对照组粗蛋白含量为60.09%±2.78%,实验组为59.77%±2.63%。由图 6b中可知,两组实验鱼冷冻干燥后肌肉的粗脂肪含量在15%左右;终末全鱼的粗脂肪要略高于初始全鱼的粗脂肪。
|
图 6 各时期肌肉粗蛋白(a)和粗脂肪(b)含量变化
Fig. 6 The mucles crude protein (a) and crude lipid (b) content dynamics in the culture cycle
|
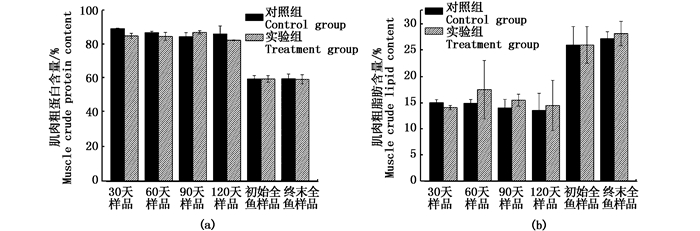
对照组和实验组鱼体的胃蛋白酶的活力无显著差异(P > 0.05),终末胃蛋白酶活力要小于初始活力,呈现一个下降的趋势(图 7a)。对照组鱼体肠组织中的胰蛋白酶活力在整个养殖期间都高于实验组,除了第30天时存在显著差异(P < 0.05) 外,其他均无显著差异(P > 0.05),终末活力略高于初始活力,实验末期分别达到(5 632.30±946.01) U/mg、(4 541.06±134.50) U/mg(图 7b)。两组鱼体胃脂肪酶活力均呈现一个先上升后下降的趋势,第60天时活力最高,达到(53.96±5.89) U/mg和(41.85±4.69) U/mg。终末胃脂肪酶活力比初始活力略低,对照组在各时期均高于实验组(图 7c)。图 7d中两组肠脂肪酶在整个实验过程中虽然有上下的波动,但120 d时活力与30 d时活力基本相同,实验组活力略高于对照组。
|
图 7 胃蛋白酶(a)、肠胰蛋白酶(b)、胃脂肪酶(c)和肠脂肪酶(d)活力变化
Fig. 7 The stomach protease activity (a), intestinal trypsin activity (b), gastric lipase activity (c) and intestinal lipase activity (d) dynamics in the culture cycle
|
氨氮的主要来源是微生物对有机质和鱼类代谢物质的降解。而生物絮凝养殖水体中的氮素转化存在两种途径,一种是自养硝化细菌硝化作用将氨氮转化为亚硝氮和硝氮,另一种是异养细菌同化作用将氨氮同化吸收形成菌体蛋白。从氨氮和亚硝氮浓度变化情况判断,53 d时生物絮凝系统构建完成。亚硝氮浓度的峰值较氨氮浓度的峰值有一定的延后,说明在这个过程中对照组和实验组中的氨氮部分被转化为了亚硝氮,其中对照组的亚硝氮峰值达到(12.33±1.85) mg/L,与氨氮浓度的峰值相当,自养硝化细菌的硝化作用扮演着主要作用;而实验组的亚硝氮峰值显著低于对照组,说明异养细菌的同化作用承担了其中一部分的氨氮转化。而在系统构建完成之后,虽然氨氮的浓度也有所波动,但亚硝氮浓度基本稳定在较低水平,说明硝化作用受到了抑制,异养细菌的同化作用吸收了部分的氨氮转化为自身蛋白。硝氮的浓度一直呈现上升趋势,实验后期水体中的无机氮大部分以硝氮的形式存在,可能因为养殖水体中缺乏转化硝氮的细菌或是以PHB作为碳源细菌转化硝氮的能力较弱。
异养细菌能在较高的碳氮比和溶氧下发生同化作用,将氨氮转化为自身的生物量,在本实验系统中PHB所释放的碳源在系统稳定后完全满足异养细菌的消耗,将碳氮比维持在15以上[17]。在整个养殖实验过程中,氨氮、亚硝氮和硝氮的波动都较大,说明生物絮凝技术中氮素的释放和对无机氮的利用是在同步进行的。
整个生物絮凝过程对照组和实验组对磷酸盐的利用均不明显。磷酸盐浓度在实验开始的53 d内一直保持稳定,说明微生物在对数生长期消耗了一定量的磷酸盐用于细胞的生长和增殖,53 d之后磷酸盐积累速度明显变快,这与53 d时系统构建完成相吻合。可见磷酸盐浓度的波动可能只是微生物增殖和生长的正常需求,在生物絮凝系统中需求量不大。
3.2 絮体性质及营养成分分析本实验启动阶段采用投喂粗蛋白含量为30%的罗非鱼粪便作为氮源,所培养的絮体粗蛋白含量只有25.3%。本实验投喂了粗蛋白含量40%的饲料。养殖过程中所产生的絮体粗蛋白含量不断增长,可见絮体的粗蛋白含量与投喂的饲料粗蛋白含量有着密切的关系。罗非鱼只能利用投喂饲料中25%左右的粗蛋白,其他的会继续存在于养殖环境中,异养细菌会把一部分粗蛋白固定在絮体中供鱼类摄食。对照组第60天时粗蛋白含量达到最高,在后两个月中有所下降;而实验组中絮体粗蛋白含量一直保持在40%的状态。这可能与絮体中的菌体蛋白有一定关系,在水质分析中曾指出,在第53天时,BFT系统已经基本构建完成,异养细菌的增长从生长期进入稳定期,将系统中的氨氮转化为自身的菌体蛋白,增加了絮体中的粗蛋白含量。而实验组较对照组在BFT系统构建完成后并没有下降,实验组实验末期絮体和水混合物中的微生物浓度(62.00 ng/μL)高于对照组(42.8 ng/μL)(数据来源安诺基因DNA样品检测报告,浓度检测:Qubit荧光光度计)。
粗灰分主要为矿物质氧化物或盐类等无机物质,有时还含有少量泥沙,密度较大,投入的饲料中的粗灰分在不断积累,对照组的粗灰分含量均高于实验组,其中细菌对粗灰分的利用很少或者基本不利用,那么从实验组的装置可以看出,它较对照组底面积更大,在实验过程中较对照组更多的粗灰分沉积难以避免,减少了粗灰分在絮体中的比例。罗非鱼在鱼苗及鱼种阶段对蛋白质的需求量为30%~35%,成鱼阶段>25%;粗脂肪的最适含量为10%左右,最低需要量为5%[18]。因此,絮体配合饲料作为罗非鱼的饵料,完全能满足鱼体对营养成分的需求,对于罗非鱼的生长起到非常重要的作用,能在极大程度上降低饲料系数。
3.3 鱼的生长及肌肉成分分析实验组和对照组的养殖产量均大于30 kg/m3,均高于LITTLE等[19]在室内和室外BFT系统中10~28 kg/m3的产量,其中实验组养殖密度达到(37.99±2.34) kg/m3,高于对照组。本实验中实验鱼的成活率较高,说明生物絮凝系统确实适合罗非鱼的生存生长。
两组实验鱼冷冻干燥后肌肉的粗蛋白含量无显著差异,粗脂肪含量在15%左右;终末全鱼的粗脂肪要略高于初始全鱼的粗脂肪,在解剖过程中发现鱼体内的油脂在养殖期间有不同程度的增多,与测试结果相吻合。其中对照组鱼体的活动水体为600 L,而实验组只有330 L,随着养殖密度的增加,鱼体的活动范围随之减小,活动量减少,可能是导致实验组粗脂肪含量高于对照组的原因之一。
3.4 消化酶活性鱼类消化酶的活性是反映其消化性能的重要指标。KAWAI等[20]实验证明了鱼类消化酶活性可以随着食物性质的改变而改变。本实验中实验鱼以饲料配合絮体作为食物,饲料无差别,但实验鱼的消化酶却有所不同,这可能与实验鱼对絮体的摄食有密切的关系,絮体微生物被摄食后进入胃和肠道,会干扰已经平衡的、产生或诱导产生消化酶的微生物菌群[21]。脂肪酶是动物消化脂肪的重要酶类,其分泌量和活力与动物对脂肪的消化、吸收、利用有关,其中第60天的絮体粗脂肪含量增高,同时脂肪酶的活力也相应的上升;第120天的絮体粗脂肪含量有所降低,同时脂肪酶的活力也相应地降低,鱼体内的微生物菌群发生变动又重新回复平衡状态。其中对照组的胃脂肪酶活力略高于实验组,而肠脂肪酶活力却略低于实验组,可能与不同生物絮凝模式下产生的絮体性质及组成絮体的微生物存在差异有关。
4 结论异位式生物絮凝模式下养殖的产量并没有显著提高,然而该模式为扩大养殖对象的范围,增加生物絮凝养殖的应用面提供了一个新的思路。虽然在养殖过程中增加了部分成本,但解决部分原位式生物絮凝养殖过程的稳定性、可控性不高的问题,从而使养殖过程安全性更高,管理更便捷。可见异位式的生物絮凝模式养殖罗非鱼是可以继续探寻的道路,尝试对环境要求更苛刻的新的经济养殖对象是一个新方向。在后续的研究中,找到合适的HRT和如何节约能源降低成本成为急需解决的问题。另外,养殖水体水质变化中硝氮的积累原因也尚不明确,有待进一步研究。
| [1] | CRAB R, AVNIMELECH Y, DEFOIRDT T, et al. Nitrogen removal techniques in aquaculture for a sustainable production[J]. Aquaculture, 2007, 270(1/4): 1–14. |
| [2] | ZHAO P, HUANG J, WANG X H, et al. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus[J]. Aquaculture, 2012, 354-355: 97–106. DOI:10.1016/j.aquaculture.2012.03.034 |
| [3] | GAO L, SHAN H W, ZHANG T W, et al. Effects of carbohydrate addition on Litopenaeus vannamei intensive culture in a zero-water exchange system[J]. Aquaculture, 2012, 342-343: 89–96. DOI:10.1016/j.aquaculture.2012.02.022 |
| [4] | CRAB R, KOCHVA M, VERSTRAETE W, et al. Bio-flocs technology application in over-wintering of tilapia[J]. Aquacultural Engineering, 2009, 40(3): 105–112. DOI:10.1016/j.aquaeng.2008.12.004 |
| [5] | AZIM M E, LITTLE D C. The biofloc technology (BFT) in indoor tanks:Water quality, biofloc composition, and growth and welfare of Nile tilapia (Oreochromis niloticus)[J]. Aquaculture, 2008, 283(1/4): 29–35. |
| [6] | AVNIMELECH Y. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds[J]. Aquaculture, 2007, 264(1/4): 140–147. |
| [7] | AVNIMELECH Y. Bio-filters:the need for an new comprehensive approach[J]. Aquacultural Engineering, 2006, 34(3): 172–178. DOI:10.1016/j.aquaeng.2005.04.001 |
| [8] | DE SCHRYVER P, CRAB R, DEFOIRDT T, et al. The basics of bio-flocs technology:the added value for aquaculture[J]. Aquaculture, 2008, 277(3/4): 125–137. |
| [9] |
王潮辉, 高启, 谭洪新, 等. 生物絮凝系统构建过程对吉富罗非鱼免疫酶和生长的影响[J].
中国水产科学, 2015, 22(4): 707–715.
WANG C H, GAO Q, TAN H X, et al. Effects of initial establishment of a biofloc technology system on the growth and immune enzyme activity of GIFT tilapia (Oreochromis niloticus)[J]. Journal of Fishery Sciences of China, 2015, 22(4): 707–715. |
| [10] | LUO G Z, GAO Q, WANG C H, et al. Growth, digestive activity, welfare, and partial cost-effectiveness of genetically improved farmed tilapia (Oreochromis niloticus) cultured in a recirculating aquaculture system and an indoor biofloc system[J]. Aquaculture, 2014, 422-423: 1–7. DOI:10.1016/j.aquaculture.2013.11.023 |
| [11] |
张楠, 罗国芝, 谭洪新, 等. 生物絮凝技术中碳源的添加策略——以养虾为例[J].
水产科技情报, 2013, 40(6): 302–306.
ZHANG N, LUO G Z, TAN H X, et al. Carbon source add policy of biofloc technology-In Case of shrimp[J]. Fisheries Science & Technology Information, 2013, 40(6): 302–306. |
| [12] | BURFORD M A, THOMPSON P J, MCLNTOSH R P, et al. Nutrient and microbial dynamics in high-intensity, zero-exchange shrimp ponds in Belize[J]. Aquaculture, 2003, 219(1/4): 393–411. |
| [13] | NOOTONG K, PAVASANT P, POWTONGSOOK S. Effects of organic carbon addition in controlling inorganic nitrogen concentrations in a biofloc system[J]. Journal of the World Aquaculture Society, 2011, 42(3): 339–346. DOI:10.1111/j.1749-7345.2011.00472.x |
| [14] |
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
State Environmental Protection Administration of China. Methods of Monitoring and Analyzing for Water and Wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002. |
| [15] |
钟国才, 陈威, 吴军辉, 等. 利用元素分析仪测定大米粗蛋白含量的方法探讨[J].
食品工业, 2014, 35(2): 158–160.
ZHONG G C, CHEN W, WU J H, et al. The elemental analyzer method for determination of crude protein content in rice[J]. The Food Industry, 2014, 35(2): 158–160. |
| [16] |
张英. 饲料分析及饲料质量检测技术[M]. 北京: 中国农业大学出版社, 2003.
ZHANG Y. Detection Technology of Analysis of Feed and Feed Quality[M]. Beijing: China Agricultural University Press, 2003. |
| [17] |
钟文文. 微生物絮凝剂产生菌的筛选及其培养条件优化的研究[J].
环境工程学报, 2007, 1(8): 140–144.
ZHONG W W. Screening of bioflocculant-producing strains and study on optimization of their cultural conditions[J]. Chinese Journal of Environmental Engineering, 2007, 1(8): 140–144. |
| [18] |
张楠, 罗国芝. 生物絮凝技术在罗非鱼养殖中的应用[J].
渔业现代化, 2014, 41(3): 30–35.
ZHANG N, LUO G Z. Application of biofloc technology in farming tilapia[J]. Fishery Modernization, 2014, 41(3): 30–35. |
| [19] | LITTLE D C, MURRAR F J, AZIM E, et al. Options for producing a warm-water fish in the UK:limits to "Green Growth"[J]. Trends in Food Science & Technology, 2008, 19(5): 255–264. |
| [20] | KAWAI S I, IKEDA S. Studies on digestive enzymes of fishes-Ⅱ effect of dietary change on the activities of digestive enzymes in carp intestine[J]. Nippon Suisan Gakkaishi, 1972, 38(3): 265–270. DOI:10.2331/suisan.38.265 |
| [21] | XU W J, PAN L Q. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J]. Aquaculture, 2012, 356-357: 147–152. DOI:10.1016/j.aquaculture.2012.05.022 |
2. Shanghai Aquacultural Engineering Research Center, Shanghai 201306, China;
3. Aquatic Animals Breeding Center of Shanghai Ocean University, Shanghai University Knowledge Service Platform, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


