鳗鲡 (Anguilla japonica),隶属于硬骨鱼纲 (Osteichthyes)、鳗鲡目 (Anguilliformes)、鳗鲡科 (Anguillidae)、鳗鲡属 (Anguilla),是亚洲重要的经济鱼类。鳗鲡养殖所需要的苗种全部依赖自然,然而,由于过度捕捞和生存环境的恶化导致鳗鲡苗种资源持续减少[1]。因此,开展鳗鲡的人工繁殖和资源保护研究非常有必要。
目前已经知晓,鱼类的性腺发育由多种激素共同促进[2],其中性类固醇激素对性腺发育有重要影响。NAGAHAMA等[3]发现在鱼体内促性腺激素 (gonadotropic hormone,GtH) 能刺激雌二醇的产生,促进肝脏合成卵黄蛋白原,使卵母细胞大量积累卵黄;MATSBARA[4]认为11-酮基睾酮 (11-Ketotestosterone, 11-KT) 可以使卵黄形成前期的卵母细胞油滴增加,并在卵母细胞核仁生长后期直接刺激其生长;温海深等[5]认为雌二醇、雌三醇和雌酮均可能对卵母细胞的最后成熟时间起促进作用。国内外对鳗鲡属鱼类人工繁殖的探索已近一个世纪,林浩然等[6-11]对鳗鲡的发育调控做了大量开创性工作,主要集中在内分泌系统的下丘脑-脑垂体-性腺轴 (Hypothalamus-Pituitary-Gonad,HPG) 的研究。在最近十几年,鳗鲡繁殖取得了较大的进展,日本学者曾于2010年宣称成功培育出子二代[12]。但仔鱼成活率极低,柳叶鳗阶段时间过长,并未实现鳗苗的商业化生产。
在鳗鲡的人工繁殖过程中,存在亲鱼发育缓慢、卵子或精子质量差、受精率和孵化率低、仔鱼畸形率和死亡率高等现象,这些现象是否与人工促熟过程中鳗鲡亲鱼体内激素含量变化有关联?研究清楚亲鱼激素水平与性成熟之间的关系对完善鳗鲡人工繁殖技术有指导意义。本文通过注射外源激素,促使鳗鲡性腺发育,研究了雄鱼成熟时以及排精10 d时,精巢组织结构以及脑垂体中GtH分泌细胞的超微结构变化,同时监测了其性腺和血液中性类固醇激素含量的变化,旨在探索人工诱导雄性鳗鲡发育过程中内分泌的调控作用机理,为早日实现鳗鲡的人工繁殖提供理论依据。
1 材料与方法 1.1 试验材料试验在上海海洋大学大洋山生态观测站进行。雄性鳗鲡[体长 (50.32±1.31) cm,体质量 (0.15±0.02) kg]于2013年10月购自江苏省靖江市的水产经销商,共计80尾。暂养于10 m×3 m×2 m的水泥池,海水盐度20,自然水温。
1.2 激素注射随机挑取10尾雄性鳗鲡为对照组,不进行激素注射;其余雄鱼于3月下旬开始注射人绒毛膜促性腺激素[hCG,300 IU/(kg·周)]和鲤鱼脑垂体匀浆液[carp pituitary extract,CPE,20 (mg/kg·周)],经7~8次注射后雄鱼性腺发育成熟,轻压腹部可见白色精液流出。取成熟的雄鱼和人工授精排精后10 d的雄鱼作为试验组。
1.3 样品收集与处理血液样品:用0.5%MS-222麻醉雄鱼,断尾取血,血样保存于-80 ℃,用于检测雄性鳗鲡成熟时以及排精后10 d时血液中性类固醇激素的变化。
精巢样品:解剖雄鱼,取出精巢,取0.5 g组织用波恩氏液固定;余下部分保存于-80 ℃,用于检测精巢中性类固醇激素的变化。
脑垂体:取鳗鲡脑垂体,用2.5%戊二醛于4 ℃保存备用。
1.3.1 精巢组织学观察精巢组织块用波恩氏液固定24 h后,放入70%乙醇中保存。用乙醇梯度脱水后透蜡,再用石蜡包埋切片,切片厚度7 μm,用苏木精-伊红 (H.E.) 染色,光镜下观察并拍照。性腺的分期参照林鼎和林浩然[8]分期标准。鳗鲡精巢发育分为6个时期,即精原细胞前增殖期、精原细胞增殖期、精母细胞生长成熟期、精子开始出现期、精子完全成熟期和精子退化吸收期。
1.3.2 脑垂体GtH分泌细胞超微结构观察脑垂体用2.5%戊二醛 (4 ℃) 固定24 h,用1%锇酸 (4 ℃) 固定2 h,经乙醇和丙酮梯度脱水,然后用丙酮-环氧树脂梯度渗透,环氧树脂650聚合包埋样品,用Leica EM UC7超薄切片机切成1 μm厚切片,切片用1%甲苯胺蓝染色5 s。显微镜下观察定位,再切成40~60 nm超薄切片,3%醋酸铀和柠檬酸铅染色30 min,用Tecnai G2 spirit Biotwin型透射电镜观察。
1.3.3 UPLC-MS/MS检测血液和精巢中类固醇激素类固醇激素的提取参照林静等[13]的方法。分别取1 mL血液和5 g精巢组织于50 mL D-SPE1试管A和B (多激素萃取净化Supertech Q R1A) 中,各加20 mL乙腈匀浆 (10 000 r/min)2~3 min,并用乙腈清洗刀口,定容至50 mL。将试管A和B震荡10 min,超声匀浆10 min后再离心5 min (4 ℃,4 700 r/min),静置24 h后,取40 mL上清液快速过滤 (三角漏斗加1 cm脱脂棉) 至100 mL鸡心瓶,在45 ℃下旋转蒸发近干,用1.5 mL 75%乙腈清洗,将洗出液转移到D-SPE2(多激素萃取净化Supertech QM1),振荡5 min后离心取上清,经微孔滤膜 (0.22 μm,特富龙) 过滤保存到1.5 mL进样瓶,即为精巢组织和血液中类固醇激素的提取物,上机测定。
鱼类的性类固醇激素主要有睾酮 (testosterone, T)、孕酮 (progesterone, P)、雌酮 (estrone, E1)、雌二醇 (17β-estradiol, E2)、雌三醇 (estriol, E3)、17α, 20β-二羟基-4-孕烯-3-酮 (17α, 20β-dihydroxy-4-pregnen-3-one, DHP) 和17α-羟基孕酮 (17α-hydroxyprogesterone, 17α-OHP)7种。本文对这7种性类固醇激素进行了检测,其标准品均购自美国Sigma-Aldrich公司。分别将标准品配成浓度为1 mg/mL的标准液,配置混标浓度梯度分别为1、5、25、50、100、200 ng/mL,制作混合标准曲线。
1.4 数据处理用Excel软件处理数据,用SPSS软件作Duncan氏t检验,以P﹤0.05作为差异显著。
2 结果 2.1 不同时期精巢的组织学变化从图版Ⅰ-1可以看出,精巢中有大量精子,少量次级精母细胞;精巢生精囊壁变薄,结缔组织明显减少,中空消失;精子活力强,海水激活后立即开始快速游动。此时精巢处于第Ⅴ期:精子完全成熟。此期的鳗鲡胸鳍呈黑色,腹部饱满,轻压腹部有乳白色精液流出。解剖时发现性腺大且肥厚,精小叶呈乳白色,小叶间有白色精液。
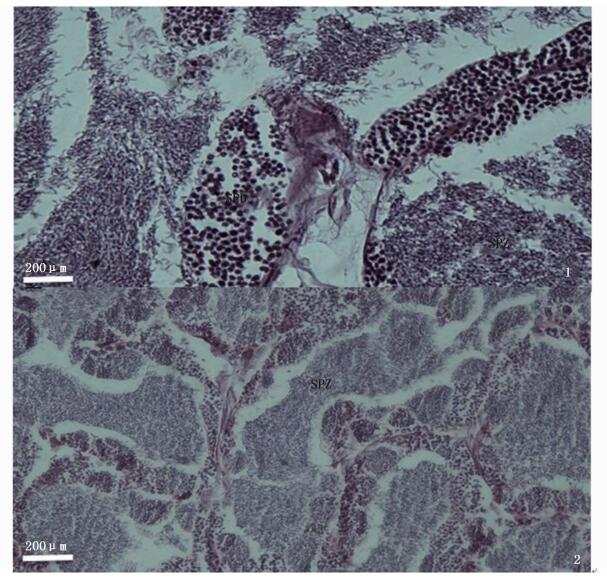
|
图版Ⅰ 鳗鲡不同发育时期的精巢组织切片 Plate1 Histological sections of testis of Japanese eel 1.性成熟期 (Ⅴ期);2.退化吸收期 (第Ⅵ期);SPD.精母细胞;SPZ.精子 1. testis at stageⅤ; 2.testis at stage Ⅵ; SPD. spermatids; SPZ.spermatozoa |
图版Ⅰ-2为排精10 d时鳗鲡的精巢组织切片图。此时精巢内仍充盈精子,但精子数量少,精巢处于第Ⅵ期:退化吸收期。此时的鳗鲡体侧及腹部出现黑色斑点,腹部软塌,挤压腹部少见精液,偶尔有少量黄色液体流出。
2.2 不同发育时期鳗鲡脑垂体GtH分泌细胞的超微结构从图 1可以看出,雄性鳗鲡脑垂体形似平碟状,由神经垂体和腺垂体组成。腺垂体又分为前腺垂体、中腺垂体和后腺垂体,GtH分泌细胞位于中腺垂体中 (图 1中meso所示)。
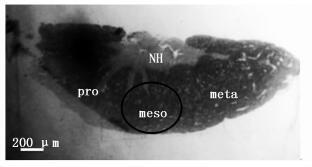
|
图 1 雄性鳗鲡脑垂体结构组成
Fig. 1 Histological sections of pituitary gland of male Japanese eel
NH.神经垂体;pro.前腺垂体;meso.中腺垂体;meta.后腺垂体;圆圈表示GtH分泌细胞的分布范围 NH. neurohypophysis; pro.proadenohypophysis; meso. mesoadenohypophysis; meta.metaadenohypophysis; GtH cells distributed in the circle |
由图版Ⅱ可见GtH分泌细胞呈梨型,长径约为9 μm,短径约为5 μm;细胞核大,近似椭圆型,核直径为4~5 μm;内质网、高尔基体、线粒体均清晰可见;细胞中还有较多的电子密度不同的分泌小球 (体积较大) 和分泌颗粒 (体积较小)。
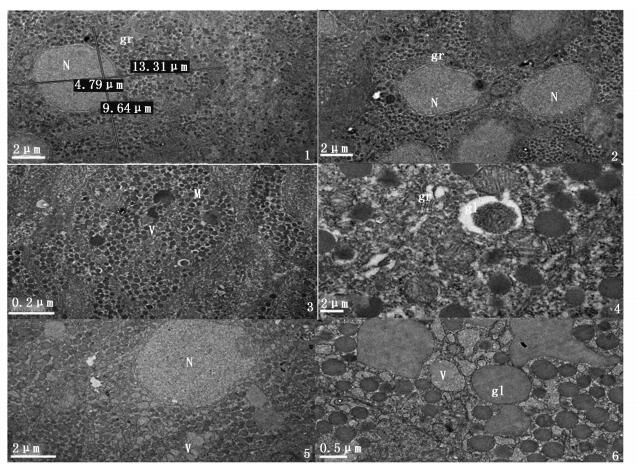
|
图版Ⅱ 雄性鳗鲡脑垂体GtH分泌细胞的超微结构 Plate2 Ultrastructure of pituitary GtH Cells in Japanese eel at different maturation stages 1、2为对照组; 3、4为成熟组; 5、6为性腺退化组。N.细胞核;M.线粒体;gr.分泌颗粒;gl.分泌小球;V.空泡 1, 2. control group; 3, 4. Pituitary cells of mature male eel; 5, 6. Pituitary cells of gonad deteriorating male eel. N. Nucleus; M. Mitochondria; gr. granules; gl. globulus; V. Vacuole |
图版Ⅱ-1, 2为未注射外源激素的鳗鲡脑垂体GtH分泌细胞的超微结构图。此时的GtH分泌细胞中有大量的分泌颗粒,分泌小球较少,无空泡,线粒体不多,内质网和高尔基体也不明显,表明细胞的代谢活动微弱。
从图版Ⅱ-3, 4可见,成熟的雄性鳗鲡脑垂体GtH分泌细胞中分泌小球增多,直径变大,部分外排形成空泡。细胞中线粒体数量多,内质网多且明显,表明细胞代谢活动旺盛。
图版Ⅱ-5, 6为排精10 d时脑垂体GtH分泌细胞结构图。此时的GtH分泌细胞中内分泌小球融合成圆形或块状,细胞内出现大量大小不等的空泡,线粒体减少,内质网不明显,表明细胞代谢减弱。
2.3 不同发育时期鳗鲡性腺和血液中类固醇激素含量变化 2.3.1 UPLC-MS/MS联用方法检测性腺和血液中类固醇激素含量的标准曲线、回收率和检测限研究发现T、P、E1、E2、E3、DHP、17α-OHP 7种性类固醇激素在x-Bridge C18色谱柱上得到良好分离,在0~200 ng/mL范围内的标准曲线分别为:
yT=2494.36x+5315.96(r=0.99)
yP=765.325x + 1153.15(r=0.99)
yE1=8.08631x + 129.165(r=0.92)
y17β-E2=6.77958x+49.8399(r=0.94)
yE3=8.72133x+173.643(r=0.97)
yDHP=597.937x + 197.45(r=0.99)
y17α-OHP=1126.94x + 13428(r=0.98)
以上各标准曲线的相关系数均在0.9以上,表明用此方法检测这7种性类固醇激素有较好的线性关系,结果可靠。
对50 ng/g和1 ng/g混合标准品样品进行分析,测得T、P、E1、E2、E3、DHP、17α-OHP定量离子对 (Transition 1) 分别为289.3>97.1、315.4>97、269.3 > 143、271.3>145.2、287.2>145.1、333.4>97.1、331.3>97.1,信噪比S/N分别为17、18、16、16、17、17、15(S/N≥10,检测限分别为0.1、0.2、0.1、0.1、0.1、0.2、0.2 ng/g;回收率为85%~95%)。因此,本方法能精确的检测鱼类的性类固醇激素。
2.3.2 不同发育时期鳗鲡精巢中类固醇激素的变化结果表明,鳗鲡精巢中仅检测到T、DHP和17α-OHP 3种激素,其他4种激素 (P、E1、E2、E3) 低于检测限。从图 2a可以看出,睾酮的含量在成熟鳗鲡中显著高于对照组 (P﹤0.05);图 2b则显示成熟鳗鲡精巢中的17α-OHP显著高于对照组 (P﹤0.05) 和排精后10 d组 (P﹤0.05)。成熟的鳗鲡精巢中DHP的含量达 (8.24±2.47) ng/g,但在对照组和性腺退化组中均未检测出 (图 2c)。

|
图 2 不同时期鳗鲡精巢中性类固醇激素的含量变化
Fig. 2 The variations of gonadal steroid hormones at different stages of the male eels during artificial induced maturation
a、b、c表示差异性显著 (P﹤0.05) a, b, c means the significance (P﹤0.05) |
检测发现,雄性鳗鲡的血液中只检测到T、DHP和17α-OHP 3种激素,其他4种激素 (P、E1、E2、E3) 的含量低于检测限。图 3为成熟和排精后10 d鳗鲡血液中T、DHP和17α-OHP 3种激素的变化情况。从图 3得知,成熟雄鱼血液中T、17α-OHP和DHP的含量均显著高于对照组 (P﹤0.05),且成熟雄鱼17α-OHP的含量显著高于排精后10 d的含量 (P﹤0.05)。
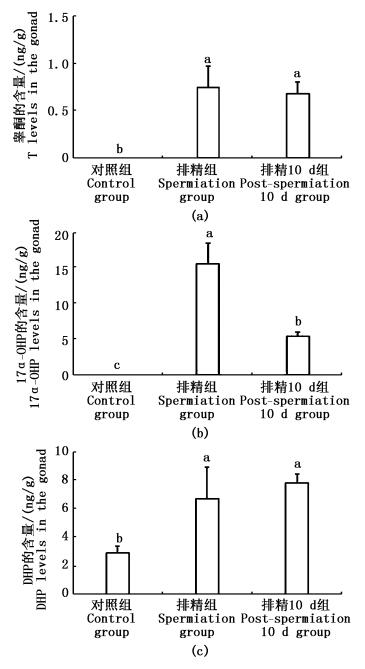
|
图 3 雄性鳗鲡血液中激素含量变化
Fig. 3 The variations of blood steroid hormones at different stages of the male eels during artificial induced maturation
a、b、c表示差异性显著 (P﹤0.05) a, b, c means the significance (P﹤0.05) |
鳗鲡精巢发育成熟过程中,脑垂体GtH分泌细胞的代谢活动明显加强,但GtH分泌细胞中有少量空泡出现,可能是因为性类固醇激素对于GtH分泌的负反馈调节作用[9],本文中成熟的雄性鳗鲡血液与精巢中性类固醇激素睾酮 (T)、DHP和17α-羟孕酮 (17α-OHP) 含量均较高也证实了这一点 (图 2~3)。在人工催熟鳗鲡的过程中,可以通过研究鳗鲡体内类固醇激素的含量来预测精巢的成熟状况,以得到高质量的精子。
3.2 注射外源激素后雄性鳗鲡体内类固醇激素含量变化鱼体内类固醇激素会参与调解性别分化、新陈代谢、免疫应答、渗透调节、繁殖等一系列活动。鳗鲡繁殖受下丘脑-脑垂体-性腺轴 (Hypothalamus-Pituitary-Gonad,HPG) 的调控[8-11, 14]。外界水温、光照、盐度、压力等环境因素的变化被鳗鲡感觉器官感受,刺激下丘脑分泌促性腺激素释放激素 (GnRH) 和一些神经分泌因子;刺激脑垂体释放促性腺激素:卵泡刺激素 (FSH) 和促黄体生成素 (LH),并控制性腺合成分泌类固醇激素[15-16]。在硬骨鱼精巢中,11-酮基睾酮可由11-羟基-睾酮转化,血液中11-酮基睾酮的含量会发生季节性变化,在性腺成熟阶段逐步增加并达到峰值,在精子形成后会下降[17-18]。
本文在雄性鳗鲡的血液和精巢中检测到较多的睾酮、DHP和17α-羟孕酮,P、E1、E2和E3几乎检测不到,表明后4种雌激素可能不参与鳗鲡精巢后期的发育。孕酮在鳗鱼体内是由胆固醇—孕烯醇酮—孕酮途径转化,E1的合成前体是雄烯二酮,E1在羟类固醇脱氢酶作用下转化为E2。E2和E3都是鱼类重要的雌激素,林静等[13]通过实验发现此二种激素是花鳗鲡卵巢发育的关键激素,并在鳗鲡雌鱼性腺中检测到这两种激素[19]。在鳗鲡雌鱼体内E2可由雌酮和睾酮分别转化,E2不仅是卵巢发育的重要激素,它还与卵巢的分化有着重要关系[20]。本实验中并未检测到雌二醇,这与林浩然等[21]研究一致。在鳗鲡体内雌酮是E2和E3的合成前体[20],本实验中无法检测出雌酮含量,因此雌二醇和雌三醇的含量极少。MIURA等[22]认为E2主要是在鳗鲡精巢发育前期起作用,参与调控精原细胞的更新和增殖。本文鳗鲡处于性腺未发育期和精巢成熟期,该时期可能不需要鱼类产生E2来促进或维持性腺的发育状况,因此含量较少。由此可以看出P、E1、E2和E3这4种雌激素对雄性鳗鲡精巢后期发育并不起决定作用。
和对照组相比,成熟和排精10 d后组鳗鲡的性腺和血液中睾酮、DHP和17α-羟孕酮含量较高,并在排精时达到峰值,10 d后含量逐渐降低。表明这3种激素对精巢的发育及排精都起着重要调控作用。鳗鲡体内睾酮的合成主要有3条途径:(1) 胆固醇—孕烯醇酮—孕酮—17α-羟孕酮—雄烯二酮—睾酮;(2) 胆固醇—孕烯醇酮—17α-羟基孕烯醇酮—17α-羟孕酮—雄烯二酮—睾酮;(3) 胆固醇—孕烯醇酮—17α-羟基孕烯醇酮—脱氢表雄酮—雄烯二酮—睾酮[20]。本文中孕酮几乎检测不到,说明在雄鳗体内睾酮的合成可能不经孕酮,是由后2条途径合成的。
鳗鲡体内17α-羟孕酮的合成有2条代谢途径:(1) 胆固醇—孕烯醇酮—孕酮—17α-羟孕酮;(2) 胆固醇—孕烯醇酮—17α-羟基孕烯醇酮—17α-羟孕酮[20]。由于本文没有检测出孕酮,因此雄性鳗鲡体内17α-羟孕酮的合成途径应该为第2条。雄性鳗鲡性腺和血液中17α-羟孕酮的含量与睾酮和DHP含量一致,这是因为鱼类体内17α-羟孕酮是睾酮和DHP的合成前体,转化途径分别为17α-羟孕酮—DHP,17α-羟孕酮—雄烯二酮—睾酮[19]。由于睾酮和DHP是精巢发育和排精的重要激素,而17α-羟孕酮又是二者的合成前体,因此在性腺成熟的雄性鳗鲡精巢和血液中有大量的17α-羟孕酮。性成熟雄性鳗鲡的性腺和血液中DHP含量最高,说明DHP对于精子的最终成熟和排出有着非常重要的作用。在精子成熟后期,脑垂体释放LH,会刺激DHP产生,研究表明DHP能够激活体内的碳酸酐酶,此酶可以改变精液pH,从而激活精子[23-25]。此外,DHP不仅对雄鱼精子的成熟有重要作用,它还是一种重要的催产剂,能很好地诱导雌鳗顺利产卵[19, 26-30]。综合前人研究及本文结果,总结了鳗鲡体内HPG轴激素生成和转化的可能途径 (图 4)。
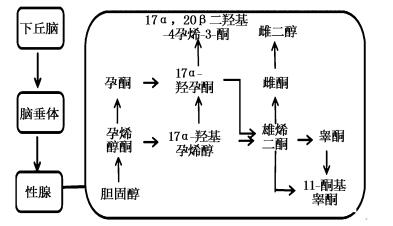
|
图 4 雄性鳗鲡体内激素转化网络
Fig. 4 Pathway of steroidogenesis in male Japanese eel
|
总之,鱼类和其他脊椎动物一样,在促性腺激素 (GtH) 的作用下,由性腺特化的组织和细胞分泌多种性类固醇激素,影响幼鱼的性腺发育和成鱼的性周期。探究这些物质在性腺发育过程中的变化规律,对于鳗鲡的人工繁殖成功有着十分重要的意义。
| [1] |
黄大明, 陈世群. 鳗鲡的生活史和人工育苗技术探讨[J].
动物学杂志, 1997, 32(3): 39–48.
HUANG D M, CHEN S Q. Exploring on the life cycle and artificial breeding of eel (Anguilla)[J]. Chinese Journal of Zoology, 1997, 32(3): 39–48. |
| [2] | HUERTAS M, SCOTT A P, HUBBARD P C, et al. Sexually mature European eels (Anguilla anguilla L.) stimulate gonadal development of neighbouring males:possible involvement of chemical communication[J]. General and Comparative Endocrinology, 2006, 147(3): 304–313. DOI:10.1016/j.ygcen.2006.01.017 |
| [3] | NAGAHAMA Y. 17α, 20β-dihydroxy-4-pregnen-3-one, a maturation-inducing hormone infish oocytes:mechanisms of synthesis and action[J]. Steroids, 1997, 62(1): 190–196. DOI:10.1016/S0039-128X(96)00180-8 |
| [4] | MATSUBARA M, LOKMAN P M, SENAHA A, et al. Synthesis and possible function of 11-ketotestosterone during oogenesis in eel (Anguilla spp.)[J]. Fish Physiology and Biochemistry, 2003, 28(1/4): 353–354. |
| [5] |
温海深, 董双林. 硬骨鱼类雌激素受体及其在生殖调节中的作用研究[J].
中国海洋大学学报, 2008, 38(3): 367–370.
WEN H S, DONG S L. Studies on oestrogen receptors and their physiological functionin the reproductive regulation of teleosts[J]. Periodical of Ocean University of China, 2008, 38(3): 367–370. |
| [6] |
林鼎, 林浩然, 黄奕华, 等. 鳗鲡 (Anguilla japonica Temminck & Schlegel) 繁殖生物学研究Ⅰ.下海鳗鲡雌雄性状差异和鉴别[J].
水生生物学集刊, 1977, 6(2): 177–188.
LIN D, LIN H R, HUANG Y H, et al. Studies on the breeding biology of the eel (Anguilla japonica Temminck & Schlegel)Ⅰ.External characteristics and sex distinction of male and female eels at seaward migrating periods[J]. Acta Hydrobiologica Sinica, 1977, 6(2): 177–188. |
| [7] |
林浩然, 林鼎. 鳗鲡繁殖生物学研究Ⅱ.下海雌鳗脑垂体超显微构造的研究[J].
水生生物学集刊, 1983, 8(1): 33–344.
LIN H R, LIN D. Studieson the breeding biology of the eel (Anguilla japonica Temminck & Schlegel)Ⅱ. Ultrastructural study of pituitary of female eels at seaward migrating periods[J]. Acta Hydrobiologica Sinica, 1983, 8(1): 33–344. |
| [8] |
林鼎, 林浩然. 鳗鲡繁殖生物学研究Ⅲ.鳗鲡性腺发育组织学和细胞学研究[J].
水生生物学集刊, 1984, 8(2): 157–164.
LIN D, LIN H R. Studieson the breeding biology of the eel (Anguilla japonica Temminck & Schlegel) Ⅲ. Histological and cytological studies on the gonadal development of ee[J]. Acta Hydrobiologica Sinica, 1984, 8(2): 157–164. |
| [9] |
林浩然, 张梅丽, 张素敏, 等. 鳗鲡繁殖生物学研究Ⅳ.人工催熟过程中下海鳗鲡的GtH分泌活动、性腺发育状况和脑垂体GtH细胞的超显微结构[J].
水生生物学集刊, 1987, 11(4): 320–328.
LIN H R, ZHANG M L, ZHANG S M, et al. Studies on the breeding biology of the eel (Anguilla japonica Temminck & Schlegel) Ⅳ. The gonadotropin secretion, gonadal development and ultrastructure of gonadotropic cell of the eel during process of induced maturation[J]. Acta Hydrobiologica Sinica, 1987, 11(4): 320–328. |
| [10] |
林浩然, 张梅丽, 张素敏, 等. 鳗鲡繁殖生物学研究Ⅴ.性类固醇激素诱导雌鳗促性腺激素 (GtH) 分泌和卵巢发育的作用[J].
水生生物学学报, 1994, 18(3): 272–279.
LIN H R, ZHANG M L, ZHANG S M, et al. Studies on the breeding biology of the eel (Anguilla japonica Temminck & Schlegel)Ⅴ. Effects of sex steroids on gonadotropin synthesis and secretion, as well as ovarian development in female silver eel[J]. Acta Hydrodiologica Sinica, 1994, 18(3): 272–279. |
| [11] |
汪小东, 林浩然. 鳗鲡繁殖生物学研究Ⅵ.鳗鲡17α, 20β-双羟孕酮的生成和作用[J].
动物学报, 1999, 45(3): 317–322.
WANG X D, LIN H R. Studies on the breeding biology of the eel (Anguilla japonica Temminck & Schlegel) Ⅵ. The production and function of 17α, 20β-dihydroxy-4-pregnen-3-one in eel[J]. Acta Zoologica Sinica, 1999, 45(3): 317–322. |
| [12] | IJIRI S, TSUKAMOTO K, CHOW S, et al. Controlled reproduction in the Japanese eel (Anguilla japonica), past and present[J]. Aquaculture Europe, 2011, 36(2): 13–17. |
| [13] |
林静, 湛嘉, 帅滇, 等. 人工诱导花鳗鲡成熟过程中卵巢内6种性类固醇激素的含量及变化[J].
水产学报, 2015, 39(9): 1341–1349.
LIN J, ZHAN J, SHUAI D, et al. Quantification of 6 sexual steroid hormones in the ovary of marbled eel Anguilla marmorata during artificial induced maturation[J]. Journal of Fisheries of China, 2015, 39(9): 1341–1349. |
| [14] |
张洁明, 柳凌, 郭峰, 等. 人工诱导日本鳗鲡性腺发育组织学研究[J].
中国水产科学, 2007, 14(4): 593–601.
ZHANG J M, LIU L, GUO F, et al. Histological study on artificial induction of gonadal development in Japanese eel Anguilla japonica[J]. Journal of Fishery Sciences of China, 2007, 14(4): 593–601. |
| [15] | NAGAHAMA Y, YAMASHITA M. Regulationof oocyte maturation in fish[J]. Development, Growth & Differentiation, 2008, 50(S1): S195–S219. |
| [16] | SCHULZR W, De FRANÇA L R, LAREYRE J J, et al. Spermatogenesis in fish[J]. General and Comparative Endocrinology, 2010, 165(3): 390–411. DOI:10.1016/j.ygcen.2009.02.013 |
| [17] | BORG B. Androgens in teleost fishes[J]. Comparative Biochemistryand Physiology Part C:Pharmacology, Toxicology and Endocrinology, 1994, 109(3): 219–245. DOI:10.1016/0742-8413(94)00063-G |
| [18] | MOORER K, SCOTT A P, COLLINS P M. Circulating C-21 steroids in relation toreproductive condition of a viviparous marine teleost, Sebastes rastrelliger (grass rockfish)[J]. General and Comparative Endocrinology, 2000, 117(2): 268–280. DOI:10.1006/gcen.1999.7422 |
| [19] | TOKARZ J, MÖLLER G, DE ANGELIS M H, et al. Steroids in teleost fishes:a functional point of view[J]. Steroids, 2015, 103: 123–144. DOI:10.1016/j.steroids.2015.06.011 |
| [20] | KAZETO Y, TOSAKA R, MATSUBARA H, et al. Ovarian steroidogenesis and the role of sex steroid hormones on ovarian growth and maturation of the Japanese eel[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2011, 127(3/5): 149–154. |
| [21] |
林浩然. 鱼类生理学[M]. 广州: 中山大学出版社, 2011: 327-435.
LIN H R. Fish physiology[M]. Guangzhou: Sun Yat-sen University Press, 2011: 327-435. |
| [22] | MIURA T, MIURA C, OHTA T, et al. Estradiol-17β stimulates the renewal of spermatogonial stem cells in males[J]. Biochemical and Biophysical Research Communications, 1999, 264(1): 230–234. DOI:10.1006/bbrc.1999.1494 |
| [23] | MIURA T, YAMAUCHI K, TAKAHASHI H, et al. Involvement of steroid hormones in gonadotropin-induced testicular maturation in male Japanese eel (Anguilla japonica)[J]. Biomedical Research, 1991, 12(4): 241–248. DOI:10.2220/biomedres.12.241 |
| [24] | MIURA T, YAMAUCHI K, TAKAHASHIH, et al. The role of hormones in the acquisition of sperm motility in salmonidfish[J]. Journal of Experimental Zoology, 1992, 261(3): 359–363. DOI:10.1002/(ISSN)1097-010X |
| [25] | MIURA T, KASUGAI T, NAGAHAMA Y, et al. Acquisition of potential for sperm motility in vitro in Japanese eel Anguilla japonica[J]. Fisheries Science, 1995, 61(3): 533–534. |
| [26] |
蒋天宝, 刘利平, 高晓阳, 等. 日本鳗鲡人工繁育研究的进展[J].
水产科技情报, 2011, 38(3): 121–127.
JIANG T B, LIU L P, GAO X Y, et al. advances in artificial propagation of Japanese eel Anguilla japonica[J]. Fisheries Science & Technology Information, 2011, 38(3): 121–127. |
| [27] | BHANDARI R K, DEEM S L, HOLLIDAY D K, et al. Effects of the environmental estrogenic contaminants bisphenol A and 17a-ethinyl estradiol on sexual development and adult behaviors in aquatic wildlife species[J]. General and Comparative Endocrinology, 2015, 214: 195–219. DOI:10.1016/j.ygcen.2014.09.014 |
| [28] | SCOTTAP, SUMPTER J, STACEY N. The role of the maturation-inducing steroid, 17, 20β-dihydroxypregn-4en-3-one, in male fishes:a review[J]. Journal of Fish Biology, 2010, 76(1): 183–224. DOI:10.1111/jfb.2010.76.issue-1 |
| [29] | MAÑANóSE, DUNCAN N, MYLONAS C C. Reproduction and control of ovulation spermiation and spawning in cultured fish[M]//CABRITA E, ROBLES V, HERRÁEZ M P. Methods in Reproductive Aquaculture:Marine and Freshwater Species. Boca Raton:CRC Press, 2008:3-80. |
| [30] | CHEN S X, BOGERD J, GARCÍA-LÓPEZ Á, et al. Molecular cloning and functional characterization of a zebrafish nuclear progesterone receptor[J]. Biology of Reproduction, 2010, 82(1): 171–181. DOI:10.1095/biolreprod.109.077644 |
 2017,
Vol. 26
2017,
Vol. 26


