2. 上海水产养殖工程技术研究中心, 上海 201306;
3. 水产动物遗传育种上海市协同创新中心, 上海 201306
水产养殖的迅速发展引发了一系列的环境问题,特别是集约化高密度养殖大量投喂外源性饲料,进而产生大量的残饵和粪便,给水环境和养殖对象造成不利影响。水产养殖通常采用换水、循环水养殖系统(Recirculating Aquaculture System,RAS)等方法控制养殖水环境[1]。但是,换水需要消耗大量水资源,养殖1 kg对虾要消耗20 t的洁净水,养殖1 kg的鱼大约消耗(2~10) t的洁净水资源[2]。
常用的水产养殖废水处理方法有生物过滤、人工湿地、硝化反硝化法等[3]。生物絮凝技术(Biofloc Technology,BFT)利用异养细菌的同化作用将养殖水体的颗粒有机物、溶解有机物和无机氮转化为细菌的生物量[4],这些絮体能够被一些鱼类、虾类摄食再次利用,从而提高营养物质的利用效率。SCHNEIDER等的研究表明利用悬浮反应器可以有效生产生物絮体[5]。生物絮体可部分替代养殖动物的饵料蛋白源已被实践证实。
本文运用序批式(Sequencing batch reactor,SBR)生物絮凝反应器进行中试试验,研究不同混合液悬浮固体浓度(Mixed liquid suspended solid,MLSS)对RAS养殖水处理效果和生物絮体营养组成、细菌群落结构的影响,旨在为水产养殖废水的处理与资源化利用提供参考。
1 材料与方法 1.1 实验装置实验采用3个圆柱形聚乙烯SBR生物絮凝反应器,反应器内径1.2 m,高1.2 m,有效工作容积1 000 L。反应器内置空气搅拌器,搅拌速率1 400 r/min。搅拌器由上至下不断将压缩空气带入反应器内进行气液混合,使反应器水体搅拌充分,并提供足够的溶解氧。

|
图 1 生物絮凝反应器示意图
Fig. 1 Diagram of the biofloc reactor
1.空气搅拌器;2.排料口;3.底阀 1. stirring apparatus; 2. discharge gate; 3. bottom valve |
实验用废水取自上海市水产养殖工程技术研究中心的一套RAS系统。RAS有6个圆形养殖池(有效容积2 m3)、一个转鼓式固液分离机、一个流化床生物滤器(长190 cm×宽100 cm×高120 cm)、一个微珠滴滤式生物滤器(直径115 cm、高220 cm)和离心泵组成(南京雅亿环境科技有限公司,中国)。RAS放养吉富罗非鱼(GIFT Oreochromis niloticus),个体质量(27.17±4.13) g,密度34.05 kg/m3。罗非鱼每日投喂3次,日投喂量为鱼体质量的1.5%。饲料为罗非鱼膨化配合饲料(981,3#,漳州日高饲料有限公司),主要成分如下:粗蛋白30.0%,粗脂肪4%,粗灰分13%,粗纤维12%,水分10%,赖氨酸1.25%,总磷0.6%~2.2%。
按照罗国芝等[6]的方法预先培养絮体,获得的成熟生物絮体MLSS 9.77 g/L,混合液挥发性悬浮固体浓度(MLVSS)8.46 g/L,絮体体积指数(SVI5)88.55 mL/g,粗灰分13.38%。
1.3 实验设计与运行实验设有3个SBR生物絮凝反应器,每个反应器作为一个处理组,3个反应器预先分别接种成熟的生物絮体153 L、307 L、512 L,加曝气后的自来水至1 000 L,控制MLSS分别为1 500 mg/L、3 000 mg/L和5 000 mg/L。
SBR反应器每周期时间为12 h,每日运行2个周期,具体周期运行参数为:进水期0.5 h、反应期(好氧搅拌)10.5 h、沉淀期0.5 h、上清液排水期0.5 h。每周期进水750 L,体积交换比为75%。以葡萄糖作为碳源,在反应器每次进、出水后,按溶解性有机碳/溶解性无机氮(DOC/DIN)大于15添加葡萄糖,每日2次,以保证反应过程中所需的碳源。实验期间控制温度(T)为(25±1)℃,溶氧(DO)保持在(6~8) mg/L,pH 7.0~8.6。实验共运行20个周期。
1.4 实验方法 1.4.1 水质指标测定方法每日08:30和20:30从反应器中取上清液,测定总氮(TN)[7]。水样经离心,滤膜(0.45 μm)抽滤后,测定DOC、氨氮(TAN)、亚硝氮(NO2--N)、硝氮(NO3--N)。TAN测定采用纳氏试剂法,NO2--N测定采用盐酸萘乙二胺比色法,NO3--N测定采用N-(1-萘基)-紫外分光光度法[7]。反应器内水质pH、DO、T使用多参数水质测量仪(Multi 3430,德国WTW公司)测定。DIN为TAN、NO2--N和NO3--N之和。
1.4.2 生物絮体群落结构及多样性分析生物絮体经0.22 μm滤膜抽滤后,干冰冻存,送至上海美吉生物医药科技有限公司,采用Illumina高通量测序技术通过Misep测序平台对16S rRNA基因序列进行分析。利用mothur version v.1.30.1软件,在cutoff=0.03、相似水平97%条件下,根据序列相似性,将抽平后的样品优化序列归为多个操作分类单元(Operational taxonomic unit,OUT),通过与Silva库比对,对样品序列进行聚类分析和分类学分析,比较生物絮体菌群结构及多样性。
1.4.3 生化指标测定方法在实验最后3个周期,从SBR反应器内取絮体浑浊液,用尼龙袋(10 μm)过滤收集,-20 ℃贮存待测。65 ℃干燥至恒重后,分别测定干燥絮体的蛋白质、粗脂肪和粗灰分。蛋白质采用Lowry法测定[8],粗脂肪测定采用氯仿-甲醇[V(氯仿):V(甲醇)=2:1]抽提法[9],粗灰分通过马福炉550 ℃灼烧4 h后测定[10]。
1.5 去除率计算方法TAN的去除率(RRTAN)、NO2--N的去除率(RRNitrite)、NO3--N的去除率(RRNitrate)和DIN的去除率(RRDIN)根据公式(1)、(2)、(3)、(4)计算;
 (1)
(1)
 (2)
(2)
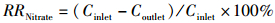 (3)
(3)
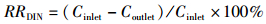 (4)
(4)
TAN的体积去除负荷(VRTAN)、NO2--N的体积去除负荷(VRNitrite)、NO3--N的体积去除负荷(VRNitrate)和DIN的体积去除负荷(VRDIN)采用计算公式(5)、(6)、(7)、(8)计算:
 (5)
(5)
 (6)
(6)
 (7)
(7)
 (8)
(8)
式中:Cinlet表示每日反应器实际进水浓度,Coutlet表示反应器出水浓度,d表示天数。
1.6 数据分析实验结果采用平均值±标准差(X±SD)表示,用SPSS 17.0软件进行单因素方差分析(One-way ANOVA),当差异显著时采用Duncan氏法进行多重比较,显著水平取P<0.05。
2 结果 2.1 三态氮的处理效果从图 2中可以看出,实验进水TAN浓度、NO2--N浓度、NO3--N浓度分别为(0.77~2.44) mg/L、(0.06~0.39) mg/L、(9.08~53.44) mg/L。3组反应器出水TAN浓度变化相似,前4天3组出水TAN浓度逐渐降低,第4天后出水TAN浓度基本稳定在0.2 mg/L左右。1 500 mg/L组反应器出水TAN浓度低于3 000 mg/L和5 000 mg/L组,3组差异不显著。系统运行期间3组反应器出水NO2--N浓度较低,没有出现NO2--N的累积现象(图 2b)。系统稳定之后,反应器3组出水NO3--N浓度不断下降,并且小于10 mg/L (图 2c),表明BFT可以同步去除TAN和NO3--N。
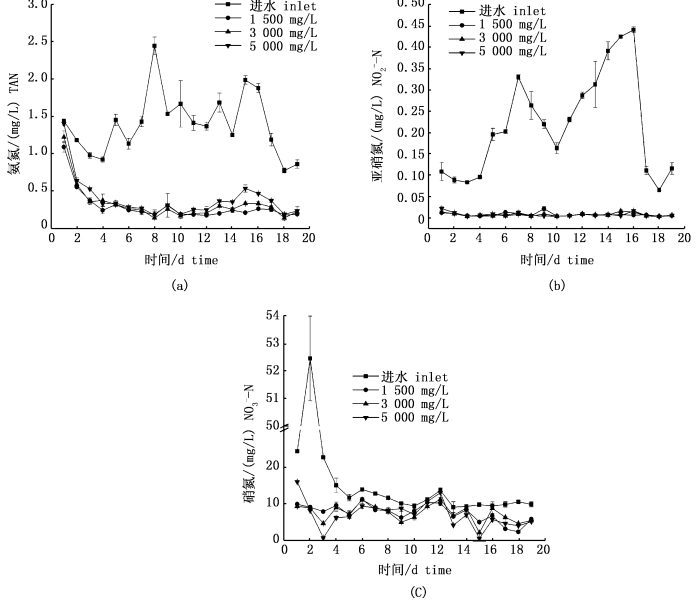
|
图 2 SBR生物絮凝反应器TAN (a)、NO2--N (b)和NO3--N (c)的出水浓度
Fig. 2 Total ammonia nitrogen (TAN, a), nitrite (NO2--N, b) and nitrate (NO3--N, c) in the experimental group, 1 500 mg/L, 3 000 mg/L and 5 000 mg/L throughout the experiment period
|
如图 3所示,实验期间,反应器进水TN浓度为(11.08~56.28) mg/L、进水DIN浓度(10.84~53.71) mg/L。反应器3组出水TN变化趋势一致,无显著性差异(P>0.05,图 3a)。3组出水DIN浓度均保持在10 mg/L以下(图 3b)。

|
图 3 实验期间TN (a)和DIN (b)的浓度变化
Fig. 3 Concentration changes of TN (a) and DIN (b) throughout the experiment period
数据表示为每个实验组(1 500、3 000和5 000 mg/L)三个重复的平均值±标准偏差。 Values are the means (±standard deviation) of the three replications in each experimental group, 1 500, 3 000 and 5 000 mg/L. |
由表 1可以看出,随着MLSS浓度升高,反应器对TAN去除率(RRTAN)逐渐下降,3组TAN平均RRTAN分别为86.20%±3.56%、85.20%±3.11%和82.20%±4.15%,各组之间无显著差异(P>0.05)。反应器对NO2--N的去除率(RRNitrite)较高,反应器3组NO2--N的平均RRNitrite高于98%。NO3--N的去除率(RRNitrate)和DIN去除率(RRDIN)略有下降,3 000 mg/L组反应器出水RRNitrate、RRDIN分别为38.40%±0.78%、43.20%±1.64%,低于1 500 mg/L组和5 000 mg/L组出水RRNitrate、RRDIN,3组反应器之间差异不显著(P>0.05)。

|
表 1 实验阶段不同MLSS组三态氮和DIN平均去除率 Tab.1 The removal rate of TAN、NO2--N, NO3--N and DIN |
由表 2可以看出,1 500 mg/L组、3 000 mg/L和5 000 mg/L组反应器TAN体积去除负荷(VRTAN)分别为(2.64±0.29) g/(m3·d)、(2.60±0.27) g/(m3·d)和(2.51±0.29) g/(m3·d),反应器MLSS浓度升高,VRTAN下降,三组之间差异不显著(P>0.05)。三组反应器的出水NO2--N的体积去除负荷(VRNitrite)相同,均为(0.56±0.08) g/(m3·d)。反应器对出水NO3--N的体积去除负荷(VRNitrite)和DIN体积去除负荷(VRDIN)与其去除率相似,3 000 mg/L组反应器出水VRNitrite、VRDIN较低,分别为(8.52±1.14) g/(m3·d)、(10.25±0.77) g/(m3·d),且VRDIN显著低于其他两组(P<0.05)。
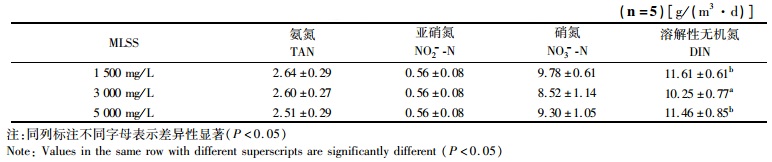
|
表 2 实验阶段不同MLSS组三态氮和DIN平均去除速率 |
反应器中,絮体蛋白质、粗脂肪和粗灰分的含量(DW)如表 3所示。1 500 mg/L组、3 000 mg/L和5 000 mg/L组絮体蛋白质含量分别为30.00%±1.32%、29.87%±0.67%、31.00%±0.75%,3组之间无显著差异(P>0.05)。絮体粗脂肪含量分别为9.51%±0.94%、4.37%±0.42%、3.65%±0.22%,MLSS 1 500 mg/L组显著高于其他两组(P<0.05)。
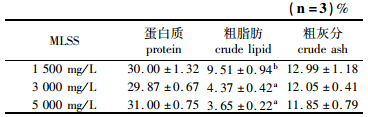
|
表 3 生物絮体的营养组分含量 Tab.3 Nutritional quality of bioflocs produced from sequencing batch reactors |
生物絮体聚类分析结果表明,1 500 mg/L组有21个菌门,3 000 mg/L组和5 000 mg/L组各有22个菌门。优势菌为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),二者平均相对丰度分别为44.66%、44.51%、44.29%和13.89%、13.98%、14.07%。其他相对丰度较高的菌门还有疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、绿菌门(Chlorobi)、放线菌门(Actinobacteria),相对丰度低于1%的菌门合并为“Others”(图 4a)。
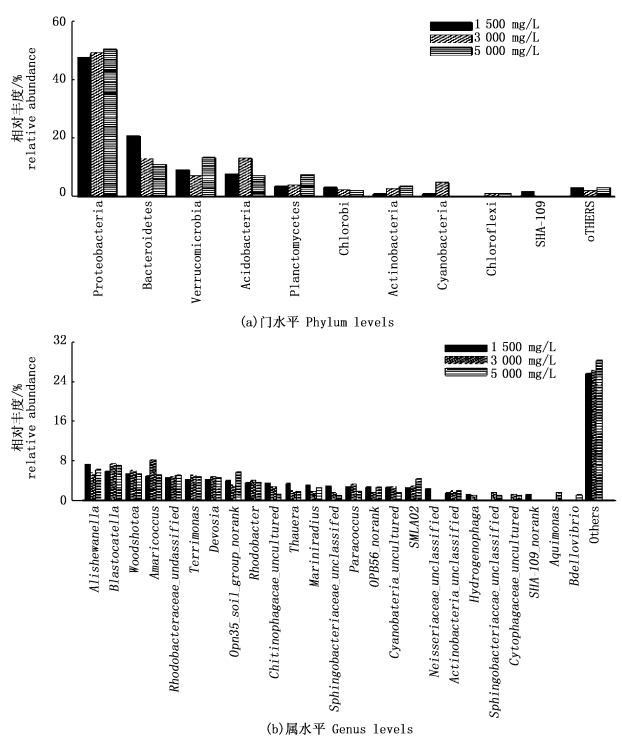
|
图 4 生物絮体门水平(a)和属水平(b)上的细菌群落结构及相对丰度
Fig. 4 The bacterial community and abundance of bioflocs (a: at the phyium levels, b: at the genus levels).
|
如图 4b所示,将相对丰度低于1%的菌属合并为“Others”,1 500 mg/L组相对丰度大于1%的菌属21个,优势菌属为Alishewanella(7.29%);3 000 mg/L组相对丰度大于1%的菌属21个,优势菌属为Amaricoccus (8.25%)、Blastocatella(7.41%);5 000 mg/L组相对丰度大于1%的菌属22个,优势菌属Blastocatella(7.12%)和Alishewanella(6.22%)。相对丰度较高的菌属还有Rhodobacteraceae_unclassified(4.58%、4.85%、5.08%)、Terrimonas(4.27%、5.13%、4.74%)、Devosia(4.23%、4.81%、4.53%)、Rhodobacter(3.61%、4.09%、3.61%)等。
3 讨论 3.1 反应器的水处理效果生物絮凝系统通过添加碳源,异养细菌迅速生长,不断利用水体中的TAN和有机碳,使TAN浓度迅速降低:NH4++1.18 C6H12O6+HCO3-+2.06 O2→C5H7O2N+6.06 H2O+3.07 CO2[10]。AVNIMELECH等的研究表明:加入蔗糖,TAN浓度在5 h之内由7 mg/L降至1 mg/L[11]。AVNIMWLWXH和KOCHBA还发现添加的TAN迅速同化为絮体的菌体蛋白[12]。本实验中,SBR生物絮凝反应器将RAS罗非鱼养殖水中TAN浓度(0.77~2.44) mg/L去除至0.2 mg/L左右,表明中试规模的SBR生物絮凝反应器对RAS罗非鱼养殖废水的TAN具有良好的去除效果。
YAO等的研究表明BFT不能有效去除NO2- -N[13]。SCHNEIDER等的研究结果表明:当进水碳源量增加时,系统中NO2--N的去除量增加[14]。HARGREAVES的研究表明生物絮凝系统中存在硝化现象,NO2--N可转化为NO3--N,随后被生物絮体利用[15]。本实验中NO2--N的平均RRNitrite高于98%,并且出水NO2--N浓度均低于0.02 mg/L,表明SBR生物絮凝反应器对NO2--N有较好的处理效果。
异养细菌不仅可以利用氨氮,也可以利用硝氮合成自身物质。研究表明,当有充足的碳源时(DOC>150 mg/L),生物絮凝反应器能够快速去除NO3--N[16]。实验后期,反应器进水DOC浓度基本稳定在30 mg/L,三组出水DOC浓度均小于10 mg/L;出水NO3--N浓度小于10 mg/L (图 2c),反应器表现出TAN、NO2--N和NO3--N的同步去除现象。研究发现,自养细菌只能将6%的DIN转化为有机氮,而异养细菌则能将近100%的DIN转化为有机氮[10]。而且,异养细菌的生长速率相当于自养细菌生长速率的10倍[15],能够将反应器中DIN充分转化。
3.2 反应器的氮去除率和体积去除负荷通过添加碳源,异养生物将无机氮转化为微生物蛋白。SCHNEIDER等的研究结果也表明不只是TAN,NO3--N同样能够为细菌的转化作用提供氮源[17]。实验组中没有额外添加氮源,反应器中氮主要来自罗非鱼循环水养殖废水。实验期间,反应器对NO2--N的去除率较高(大于98%),能够去除大部分的TAN (82%~86%)和部分的NO3--N (38%~40%)(表 1),而传统的硝化反应器只对TAN的去除有效,对NO3--N的去除较少,本实验能够同步去除TAN和NO3--N,可以节约大量固定投资及养殖成本,有利于水产养殖业的健康可持续发展。
ZHANG等的研究表明进水TAN浓度100 mg/L时TAN的体积去除负荷为75.8 g/(m3·d)[18]。张楠的研究表明:进水TAN浓度100 mg/L,PCL、PHB和Glu的TAN的体积去除负荷分别为(0.24±0.03) g/(m3·h)、(0.18±0.01) g/(m3·h)、(0.32±0.02) g/(m3·h)[19]。本实验中,进水TAN浓度为(0.77~2.44) mg/L,三组SBR反应器对TAN的体积去除负荷分别为(2.64±0.29) g/(m3·d)、(2.60±0.27) g/(m3·d)和(2.51±0.29) g/(m3·d),与张楠的研究结果相似。三组SBR反应器,每天可以平均去除NO3--N分别为(9.78±0.61) g/(m3·d)、(8.52±1.14) g/(m3·d)、(9.30±1.05) g/(m3·d),显示了BFT同样可以有效地去除NO3--N,该结果低于张楠等的研究NO3--N平均去除负荷(2.64±0.18) g/(m3·h)[19]。实验对NO3--N的体积去除负荷(8.52~9.78) g/(m3·d)低于唐成婷进水NO3--N浓度50 mg/L时的NO3--N的体积去除负荷1.48 g/(m3·h)[20]。LU的研究中反应器对DIN的平均去除负荷为(0.41±0.079) g/(m3·d)[21],比本实验结果偏高,可能与实验进水DIN浓度较低有关。
研究表明,高浓度的NO3--N对养殖对象产生较大的毒害作用,中等浓度的NO3--N (30~60 mg/L)也会影响其组织发育和激素分泌,对鱼体的生长发育、繁殖产生不利影响[22]。故RAS养殖特别是繁育系统会严格控制TAN、NO2--N、NO3--N浓度,所以实际运行过程中生物滤器的进水浓度较低。本实验SBR反应器进水浓度较低,可能是导致NO3--N和DIN的去除速率偏低的原因。本实验作为中试规模,在进水低浓度TAN、NO2--N、NO3--N、DIN时仍具有较低的出水浓度和较高的去除率,表现出SBR反应器具有极好的实际应用潜能。
3.3 生物絮体的营养CRAB的研究发现添加葡萄糖的絮体中蛋白质含量、粗脂肪含量分别为28%±3%、5.4%±0.6%[23]。LUO等的研究表明絮体粗蛋白含量为26.35%、粗脂肪含量为1.69%[24]。本研究中生物絮体蛋白质含量30.00%±1.32%、29.87%±0.67%、31.00%±0.75%与前人研究结果相似;粗脂肪含量9.51%±0.94%、4.37%±0.42%、3.65%±0.22%,反应器1 500 mg/L组显著高于其他两组(P<0.05),高于前人的研究结果。王道尊等指出:青鱼的当年鱼种、1冬龄鱼种以及成鱼阶段青鱼的脂肪需要量分别为6.5%、6.0%、4.5%[25]。与前人研究结果相比,本实验MLSS 1 500 mg/L时絮体粗脂肪含量相对较高,能满足大多数鱼类的需求,具有较高的实用价值。
有研究表明,絮体可以作为潜在的饲料替代蛋白或饲料蛋白的重要组成[26]。事实上,生物絮体不仅能为生命细胞营养和各种生物活性化合物提供丰富的营养物质,还执行消化酶活性、激活细胞免疫及应答功能。前人的研究发现生物絮体表现出相对较高的蛋白酶和淀粉酶的活性,提高对饲料的消化和利用率[26]。本实验中SBR生物絮凝反应器将养殖废水资源化处理成可被再次利用的生物絮体,对发展环境友好型的水产养殖业具有重要意义。
3.4 生物絮体的群落多样性分析ZHAO等利用原位式生物絮凝技术研究日本囊对虾(Marsupeneus japonicus)养殖过程中生物絮体的菌群构成,发现Proteobacteria是絮体中的优势菌,相对丰度43.89%±4.42%,能够较好地改善养殖水质[27]。此外,Proteobacteria还是城市污水处理系统中的优势菌门,相对丰度35%左右[28]。本研究中,Proteobacteria菌门相对丰度47.77%~50.50%,与前人的研究结果一致。相关研究表明Bacteroidetes是一类化能异养菌,能够降解复杂的有机物,并具有较好的生物除磷效果,在活性污泥和脱氮系统中较少[29]。Bacteroidetes是本实验的次优势菌,相对丰度为11.09%~20.86%,该研究结果表明Bacteroidetes中可能存在脱氮、除磷有关的菌种。
Blastocatella为Acidobacteria亚门,革兰氏阴性菌,好氧异养菌,以氧气为受体,将复杂有机烃类及含氮物质分解为小分子物质,减少污染[30],是3 000 mg/L组和5 000 mg/L中的优势菌。Amaricoccus是3 000 mg/L组的优势菌属,AULENTA的研究结果表明Amaricoccus属于α-Proteobacteria菌门,在厌氧条件下能够大量合成碳源贮存物质(PHB),降解污水中的有机物[31]。Rhodobacteraceae为α-Proteobacteria菌门异养细菌,在污水生物处理中对含氮污染物有较好的去除作用[32],Devosia为异养好氧型革兰氏阴性菌[33],通过同化作用控制水体中TAN浓度。该研究结果与生物絮凝技术通过添加碳源促进异养细菌生长、同化去除水体的无机氮、净化水质机理一致。
Alishewanell属于γ-Proteobacteria菌门,革兰氏阴性菌,是反硝化氨氧化反应器中的优势菌,能够利用多种电子受体去除污水中的NO3--N[34]。本实验中Alishewanella是1 500 mg/L组和5 000 mg/L组的优势菌属。另外,研究表明Terrimonas属于Bacteroidetes菌门,具好氧反硝化能力[35],而Rhodobacter为兼性厌氧细菌,与生物絮团形成有关,在厌氧条件下能进行反硝化作用[32],且两者均为中试生物絮凝反应器中的优势菌。表明中试生物絮凝反应器中可能同时存在好氧反硝化和厌氧反硝化过程,Rhodobacter促进了生物絮体的形成,良好生物絮体使得反应器具有较好的脱氮效果。
4 结论中试反应器能够有效地同步去除RAS罗非鱼养殖废水中的TAN、NO2--N和NO3--N,传统的硝化反应器大多只对TAN和NO2--N的去除有效,本实验可以节约一定的设备投入和养殖成本,有利于提高经济效益。反应器中的生物絮体主要由Proteobacteria菌门和Bacteroidetes菌门组成,优势菌属包括Alishewanella、Blastocatella、Amaricoccus、Rhodobacteraceae_unclassified、Terrimonas、Devosia等,各优势菌的相互作用使反应器具有较好的有机物质降解能力和脱氮效果。
三组反应器中絮体蛋白质含量差异不显著,均在30%左右。1 500 mg/L组絮体粗脂肪含量为9.51%±0.94%,显著高于其他两组,生物絮体营养价值较高,表明该中试生物絮凝反应器不仅可以较好地净化养殖水质,减少环境污染,还可促进水产养殖废水的资源化应用。
| [1] | 潘云峰, 罗国芝, 谭洪新, 等.不同碳源对水产养殖固体颗粒物生物絮凝效果的比较[J]. 水处理技术, 2011, 37(11): 20–25. PAN Y F, LUO G Z, TAN H X, et al.The comparison of different carbon sources impact on the bioflocs formation of solid waste of aquaculture[J]. Technology of Water Treatment, 2011, 37(11): 20–25. |
| [2] | WANG J K.Conceptual design of a microalgae-based recirculating oyster and shrimp system[J]. Aquacultural Engineering, 2003, 28(1/2): 37–46. |
| [3] | 王玮, 陈军, 刘晃, 等.中国水产养殖水体净化技术的发展概况[J]. 上海海洋大学学报, 2010, 19(1): 41–49. WANG W, CHEN J, LIU H, et al.The overview of aquaculture water purification technology in China[J]. Journal of Shanghai Ocean University, 2010, 19(1): 41–49. |
| [4] | TOVAR A, MORENO C, MÁNUEL-VEZ M P, et al.Environmental implications of intensive marine aquaculture in earthen ponds[J]. Marine Pollution Bulletin, 2000, 40(11): 981–988. DOI:10.1016/S0025-326X(00)00040-0 |
| [5] | DE SCHRYVER P, VERSTRAETE W.Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reactors[J]. Bioresource Technology, 2009, 100(3): 1162–1167. DOI:10.1016/j.biortech.2008.08.043 |
| [6] | 罗国芝, 姚妙兰, 鲁璐, 等.利用循环水养殖固体废弃物进行卤虫幼体营养强化的效果研究[J]. 上海海洋大学学报, 2015, 24(3): 350–356. LUO G Z, YAO M L, LU L, et al.The effect of Artemia nauplii nutrient enrichment by using circulating water aquaculture solid waste[J]. Journal of Shanghai Ocean University, 2015, 24(3): 350–356. |
| [7] | 国家环境保护总局. 水和废水监测分析方法[M]. (4版). 北京: 中国环境科学出版社, 2002. SEPA. Detection and Analasis Method of Water and Wastewater[M]. (4版). Beijing: China Environmental Science Press, 2002. |
| [8] | KNUCKEY R M, BROWN M R., ROBERT R, et al.Production of microalgal concentrates by flocculation and their assessment as aquaculture feeds[J]. Aquacultural Engineering, 2006, 35(3): 300–313. DOI:10.1016/j.aquaeng.2006.04.001 |
| [9] | FOLCH J, LEES M, STANLEY G H S.A simple method for the isolation and purification of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 266(1): 497–509. |
| [10] | EBELING J M, TIMMONS M B, BISOGNI J J.Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/2/3/4): 346–358. |
| [11] | AVNIMELECH Y.Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture, 1999, 176(3/4): 227–235. |
| [12] | AVNIMELECH Y, KOCHBA M.Evaluation of nitrogen uptake and excretion by tilapia in bio floc tanks, using 15N tracing[J]. Aquaculture, 2009, 287(1/2): 163–168. |
| [13] | YAO C, TAN H X, LUO G Z, et al.Effects of temperature on inorganic nitrogen dynamics in sequencing batch reactors using biofloc technology to treat aquaculture sludge[J]. North American Journal of Aquaculture, 2013, 75(4): 463–467. DOI:10.1080/15222055.2013.808297 |
| [14] | SCHNEIDER O, SERETI V, EDING E H, et al.Molasses as C source for heterotrophic bacteria production on solid fish waste[J]. Aquaculture, 2006, 261(4): 1239–1248. DOI:10.1016/j.aquaculture.2006.08.053 |
| [15] | HARGREAVES J A.Photosynthetic suspended-growth systems in aquaculture[J]. Aquacultural Engineering, 2006, 34(3): 344–363. DOI:10.1016/j.aquaeng.2005.08.009 |
| [16] | LUO G Z, AVNIMELECH Y, PAN Y F, et al.Inorganic nitrogen dynamics in sequencing batch reactors using biofloc technology to treat aquaculture sludge[J]. Aquacultural Engineering, 2013, 52: 73–79. DOI:10.1016/j.aquaeng.2012.09.003 |
| [17] | SCHNEIDER O, SERETI V, EDING E H, et al.Heterotrophic bacterial production on solid fish waste:TAN and nitrate as nitrogen source under practical RAS conditions[J]. Bioresource Technology, 2007, 98(10): 1924–1930. DOI:10.1016/j.biortech.2006.07.045 |
| [18] | ZHANG J X, ZHANG Y B, LI Y, et al.Enhancement of nitrogen removal in a novel anammox reactor packed with Fe electrode[J]. Bioresource Technology, 2012, 114: 102–108. DOI:10.1016/j.biortech.2012.03.018 |
| [19] | 张楠. PCL和PHB作为水产养殖-生物絮凝技术碳源的研究[D].上海:上海海洋大学, 2015. ZHANG N. PCL and PHB as carbon source for aquaculture-BFT producing bioflocs on aquaculture solid waste[D]. Shanghai:Shanghai Ocean University, 2015. |
| [20] | 唐成婷, 罗国芝, 谭洪新, 等.以PBS为载体和碳源的SND系统的脱氮效果研究[J]. 安全与环境学报, 2014, 14(5): 151–155. TANG C T, LUO G Z, TAN H X, et al.Effectiveness of nitrogen removal by simultaneous nitrification and denitrification reactor packed with poly (butylene suecinate) media[J]. Journal of Safety and Environment, 2014, 14(5): 151–155. |
| [21] | LU L, TAN H X, LUO G Z, et al.The effects of Bacillus subtilis on nitrogen recycling from aquaculture solid waste using heterotrophic nitrogen assimilation in sequencing batch reactors[J]. Bioresource Technology, 2012, 124: 180–185. DOI:10.1016/j.biortech.2012.07.084 |
| [22] | HAMLIN H J.Nitrate toxicity in Siberian sturgeon (Acipenser baeri)[J]. Aquaculture, 2006, 253(1/2/3/4): 688–693. |
| [23] | CRAB R, CHIELENS B, WILLE M, et al.The effect of different carbon sources on the nutritional value of bioflocs, a feed for Macrobrachium rosenbergii postlarvae[J]. Aquaculture Research, 2010, 41(4): 559–567. DOI:10.1111/are.2010.41.issue-4 |
| [24] | LUO G Z, LIANG W Y, TAN H X, et al.Effects of calcium and magnesium addition on the start-up of sequencing batch reactor using biofloc technology treating solid aquaculture waste[J]. Aquacultural Engineering, 2013, 57: 32–37. DOI:10.1016/j.aquaeng.2013.06.004 |
| [25] | 王道尊, 龚希章, 刘玉芳.饲料中脂肪的含量对青鱼鱼种生长的影响[J]. 水产学报, 1987, 11(1): 23–28. WANG D Z, GONG X Z, LIU Y F.The effects fat content in feeds on the growth of black carp fingerlings[J]. Journal of Fisheries China, 1987, 11(1): 23–28. |
| [26] | XU W J, PAN L Q.Effects of bioflocs on growth perfor-mance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J]. Aquaculture, 2012, 356-357: 147–152. DOI:10.1016/j.aquaculture.2012.05.022 |
| [27] | ZHAO P, HUANG J, WANG X H, et al.The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus[J]. Aquaculture, 2012, 354-355: 97–106. DOI:10.1016/j.aquaculture.2012.03.034 |
| [28] | WITZIG R, MANZ W, ROSENBERGER S, et al.Micro-biological aspects of a bioreactor with submerged membranes for aerobic treatment of municipal wastewater[J]. Water Research, 2002, 36(2): 394–402. DOI:10.1016/S0043-1354(01)00221-4 |
| [29] | 王海燕, 周岳溪, 戴欣, 等.16S rDNA克隆文库方法分析MDAT-IAT同步脱氮除磷系统细菌多样性研究[J]. 环境科学学报, 2006, 26(6): 903–911. WANG H Y, ZHOU Y X, DAI X, et al.Bacterial diversity study for the simultaneous nitrogen and phosphorus removal system (MDAT-IAT) by 16S rDNA cloning method[J]. Acta Scientiae Circumstantiae, 2006, 26(6): 903–911. |
| [30] | FOESEL B U, ROHDE M, OVERMANN J.Blastocatella fastidiosa gen. nov., sp. nov., isolated from semiarid savanna soil-The first described species of Acidobacteria subdivision 4[J]. Systematic and Applied Microbiology, 2013, 36(2): 82–89. DOI:10.1016/j.syapm.2012.11.002 |
| [31] | AULENTA F, DIONISI D, MAJONE M, et al.Effect of periodic feeding in sequencing batch reactor on substrate uptake and storage rates by a pure culture of Amaricoccus kaplicensis[J]. Water Research, 2003, 37(11): 2764–2772. DOI:10.1016/S0043-1354(03)00059-9 |
| [32] | FOESEL B U, DRAKE H L, SCHRAMM A.Defluviimonas denitrificans gen. nov., sp. nov., and Pararhodobacter aggregans gen. nov., sp. nov., non-phototrophic Rhodobacteraceae from the biofilter of a marine aquaculture[J]. Systematic and Applied Microbiology, 2011, 34(7): 498–502. DOI:10.1016/j.syapm.2011.08.006 |
| [33] | RIVAS R, WILLEMS A, SUBBA-RAO N S, et al.Description of Devosia neptuniae sp. nov. that Nodulates and Fixes Nitrogen in Symbiosis with Neptunia natans, an Aquatic Legume from India[J]. Systematic and Applied Microbiology, 2003, 26(1): 47–53. DOI:10.1078/072320203322337308 |
| [34] | LIU C S, ZHAO D F, YAN L H, et al.Elemental sulfur formation and nitrogen removal from wastewaters by autotrophic denitrifiers and anammox bacteria[J]. Bioresource Technology, 2015, 191: 332–336. DOI:10.1016/j.biortech.2015.05.027 |
| [35] | XIE C H, YOKOTA A.Reclassification of[Flavobacterium]ferrugineum as Terrimonas ferruginea gen. nov., comb. nov., and description of Terrimonas lutea sp. nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 1117–1121. DOI:10.1099/ijs.0.64115-0 |
2. Shanghai Aquacultural Engneering Research Center, Shanghai 201306, China;
3. Shanghai Collaborative Innovation Center for Aquatic Animal Genetics and Breeding, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


