2. 浙江省淡水水产研究所, 浙江 湖州 313001
翘嘴鲌 (Culter alburnus) 隶属于鲤科 (Cyprinidae)、鲌亚科 (Culterinae)、鲌属 (Erythroculter),是我国重要淡水经济鱼类之一[1]。自20世纪90年代人工繁殖获得突破以来,养殖用翘嘴鲌一直以野生种的直接利用和经济杂交利用[2]为主,其养殖性状潜力未被充分挖掘。作为一种有效辅助鱼类遗传与育种研究的手段[3],雌核发育不仅可以实现单性化养殖,而且通过2~3代的减数分裂型雌核发育诱导,能够实现选育优良个体的快速纯化和扩繁,显著地缩短选育种时间和节省大量人财物资源[4-5]。本实验室于2010年建立了翘嘴鲌的雌核发育诱导程序,之后连续数年通过挑选优良养殖个体进行了雌核发育诱导,至今已获得了多个具有生长优势的雌核发育系。翘嘴鲌新品种在选育过程中已从参数诱导、分子标记等方面对选育群体进行了分析[6-7]。前期研究发现,在相同诱导条件下,不同亲本甚至同一亲本的不同批次,其雌核发育诱导的成活率均有较大差异,为最大可能地满足良种繁育的需要,在已建立的雌核发育技术基础上,进一步了解冷休克处理对胚胎发育的影响,完善雌核发育胚胎孵化管理措施,对提高翘嘴鲌雌核发育诱导率具有一定指导意义。
1 材料与方法 1.1 胚胎发育试验材料试验于2015年6月在浙江省淡水水产研究所八里店综合试验基地进行。繁殖季节,选取性腺发育良好的亲鱼进行人工催产,催产所用药物为促黄体素释放激素类似物 (LRH-A2) 和绒促性素 (HCG),雌鱼注射量为 (LRH-A2 12.5 μg+HCG 125 IU)/kg,雄鱼减半。其中普通翘嘴鲌雌亲 (3尾) 和雄亲 (1尾) 为试验基地多年选育的个体,4龄,体质量为1 533~2 086 g。鲤雄性亲鱼 (7尾) 购买于市场,2~3龄,体质量为898~1 387 g。
1.2 雌核发育诱导方法精子灭活方法:获得鲤混合精液后,首先用1:3的Hanks溶液对其进行稀释,再将其均匀地涂在5个预冷的培养皿中,精液厚度大约为1 mm,盛有精液的培养皿放置于碎冰块之上。选择用2盏功率为15 W的紫外灯对精子进行照射灭活,照射时灯管与精液表面之间距离约15 cm,为使精子受到均匀的照射,用摇床不停地缓慢摇动培养皿。开始时每隔10 min观察一次精子的活力,30 min后,每隔5 min观察一次,直到鲤精子活力明显减弱,即80%仍具有良好运动力时停止。照射后的精子置于低温环境中进行避光保存直到授精。
染色体加倍方法为实验室早期建立的冷休克抑制第二极体外排法,具体参数为授精后4 min,(2±0.5)℃冰水冷休克处理15 min。
1.3 胚胎获得普通二倍体胚胎:普通翘嘴鲌精卵正常授精,作为试验对照组。
G1二倍体胚胎:遗传失活鲤精子与普通翘嘴鲌卵子授精后经冷休克处理。
G1单倍体胚胎:遗传失活鲤精子与普通翘嘴鲌卵子授精。未遗传失活鲤精子与普通翘嘴鲌卵子授精,其胚胎不能孵化出膜。
试验采用干法人工授精,建立3个雌核发育系,作为3个平行试验,人工授精每批次分组所用为同一亲鱼产的卵。所有卵子均在室温24~26 ℃下净水孵化,每隔两小时换一次水,直到仔鱼孵化出来。
1.4 胚胎发育观察按照其发育的各个时期定期取样,各时期测定样品数约30个,体视显微镜下观察胚胎发育各时期的形态特征,当其中半数发育至某时期的时间点作为该期的胚胎发育时间,记录、拍照。
1.5 形态特征分析随机采集2~4龄性成熟普通翘嘴鲌雌鱼 (31尾) 和雌核发育翘嘴鲌 (31尾),对其可数与可量性状进行测定, 普通翘嘴鲌平均体质量为898.9 g,平均体长41.7 cm。雌核发育翘嘴鲌平均体质量为2 172.9 g,平均体长56.4 cm。研究中所用的普通翘嘴鲌个体为2011—2013年每年6月份用经过选育的普通翘嘴鲌正常授精所获得的群体,养殖到2015年6月。雌核发育个体为同批次用鲤精子冷休克技术诱导减数分裂雌核发育获得的群体。
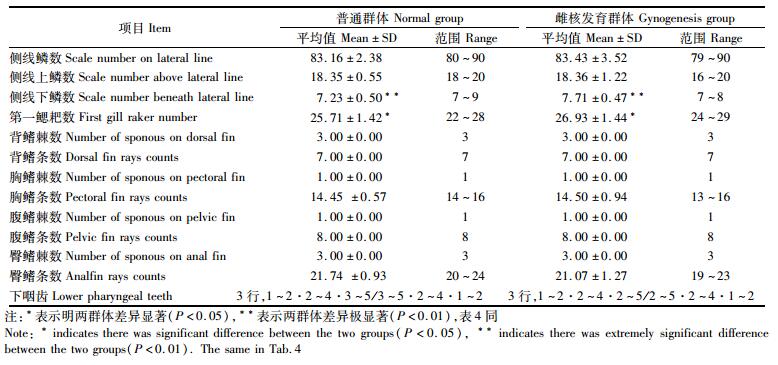
可数性状:侧线鳞数、侧线上鳞数、侧线下鳞数、第一鳃耙数、背鳍棘数、背鳍条数、胸鳍棘数、胸鳍条数、腹鳍棘数、腹鳍条数、臀鳍棘数、臀鳍条数、下咽齿。
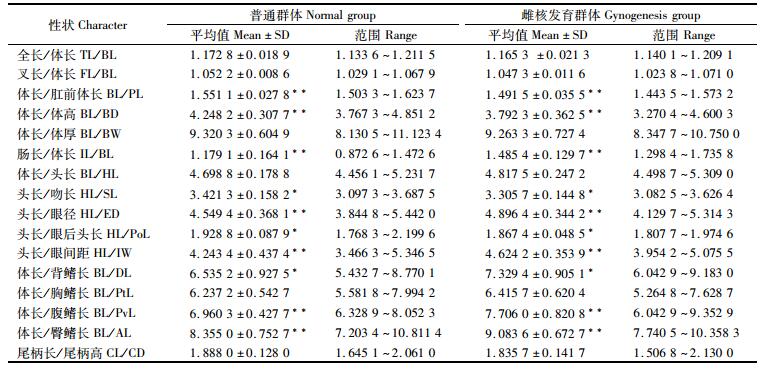
可量性状:体质量、全长、体长、叉长、肛前体长、体高、体厚、肠长、头长、吻长、眼径、眼后头长、眼间距、背鳍长、胸鳍长、腹鳍长、臀鳍长,尾柄长、尾柄高。将每尾鱼的可量性状参数转化为比例性状参数,以便消除鱼体大小不同对形态分析的影响。
1.6 统计分析统计各试验组的受精率、孵化率、畸形率和72 h成活率,以及不同时期各试验组的胚胎成活情况。受精率为原肠期正常胚胎数与总卵子数之比;孵化率为孵化个体数与原肠期正常胚胎数之比;畸形率为畸形个体数与孵化个体数之比;72 h成活率为72 h存活个体数占孵化个体数百分比;所得数据采用SPSS 13.0单因素方差分析,Duncan氏比较。形态学数据采用t检验检测2个组之间的差异显著性。
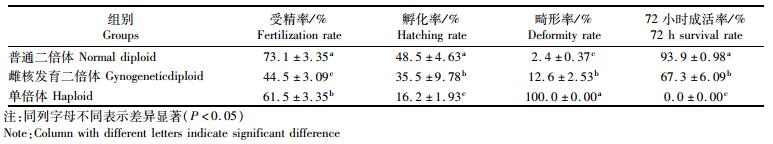
2 结果 2.1 不同倍体翘嘴鲌受精率、孵化率及成活率翘嘴鲌普通二倍体、雌核发育二倍体、单倍体的胚胎发育受精率、孵化率及成活率情况见表 1,翘嘴鲌普通二倍体组的受精率最高,为73.1%±3.35%;其次是单倍体组,为61.5%±3.35%,雌核发育二倍体组最低,仅为44.5%±3.09%。各试验组的孵化率从高到底依次为普通二倍体组、雌核发育组和单倍体组。雌核发育组畸形率高于普通二倍体组,二者72 h成活率差异显著 (P < 0.05)。
|
表 1 翘嘴鲌胚胎发育统计 Tab.1 The statistics of embryonic development of C.alburnus |
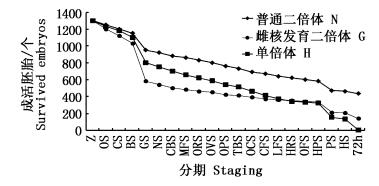
由图 1可知,各试验组的成活胚胎数变化趋势基本一致,死亡高峰期出现在原肠期和出膜前期。在原肠期阶段,雌核发育组的死亡胚胎数明显高于单倍体组和普通二倍体组,而单倍体组在出膜前期阶段的死亡胚胎数高于雌核发育组。
|
图 1 翘嘴鲌胚胎发育不同时期胚胎个体成活曲线
Fig. 1 The survival curves of embryo or individual of embryonic development of C.alburnus in different stages
1.受精卵 (zygote, Z); 2.胚盘期 (one cell stage, OS); 3.卵裂期 (cleavage stage, CS); 4.囊胚期 (blastula stage, BS); 5.原肠期 (gastrula stage, GS); 6.神经胚期 (neurula stage, NS); 7.胚孔封闭期 (closure of blastopore stage, CBS); 8.肌节出现期 (myotome formation stage, MFS); 9.眼基期 (optic rudiment stage, ORS); 10.眼囊期 (optic vesicle stage, OVS); 11.嗅板期 (olfactory placode stage, OPS); 12.尾芽期 (tail bud stage, TBS); 13.听囊期 (otic capsule stage, OCS); 14.尾鳍出现期 (caudal fin formation stage, CFS); 15.晶体出现期 (lens formation stage, LFS); 16.心脏出现期 (heart rudiment stage, HRS); 17.耳石期 (otolitkes formation stage, OFS); 18.心跳期 (heart pulsation stage, HPS); 19.出膜前期 (prehatching stage, PS); 20.出膜期 (hatching-out stage, HS); 21. 72小时 (72 hours, 72 h) |
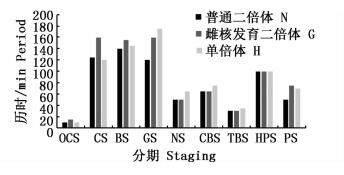
各组发育时序和形态均差异不大,发育时序为N=H>G。部分未受精卵吸水后形成假胚盘,不能继续卵裂。
2.2.2 卵裂期雌核发育二倍体与普通二倍体胚胎发育形态相似,部分胚胎出现卵膜破裂、卵黄囊凝集、卵裂球大小不一的现象,且有少量卵子出现非正常数目的卵裂球,如6细胞,这些卵子将无法发育至原肠胚。单倍体形态正常,死亡率较低。雌核发育胚胎卵裂期共历时2 h 40 min (图 2),发育较普通胚胎明显缓慢。单倍体该期发育速度与普通胚胎无明显差异。发育时序为H>N>G。
|
图 2 普通二倍体、雌核发育、单倍体翘嘴鲌胚胎发育速度比较
Fig. 2 The speed of normal diploid, gynogenetic diploid and haploid embryonic development of C.alburnus
|
雌核发育胚胎和普通胚胎形态相似。囊胚晚期时单倍体囊胚帽稍小,进入囊胚晚期后,单倍体胚胎死亡率增加。各组发育时序为H>N>G。
2.2.4 原肠期形态上雌核发育胚胎和普通二倍体外部特征相似,此期为死亡高峰期 (图 1),历时较长 (图 2)。单倍体胚环单薄,形状不规则,胚环上凹凸不平,也出现死亡高峰,此期滞留时间较长。各组发育时序为N>H>G。
2.2.5 神经胚期雌核发育组形态与普通二倍体差异不明显,但存在部分畸形胚胎。单倍体的轮廓比较模糊,出现大量畸形胚胎。各组发育时序为N>H>G。
2.2.6 胚孔封闭期除部分畸形胚胎外,雌核发育组与普通胚胎形态相似。单倍体该阶段持续的时间较长,胚体短小,看不清楚界限。各组发育时序为N>H>G。
2.2.7 尾牙期形态上,雌核发育二倍体组与普通胚胎无明显差异。单倍体胚胎“单倍体综合症”开始显现:胚体轮廓模糊,肌节数量少且分化不清晰,头大、尾小、躯干短粗。各组发育时序为N>H>G。
2.2.8 心跳期形态上,雌核发育组与普通胚胎无异。单倍体活动较弱,部分胚胎观察不到肌肉效应现象。发育时序为N>G>H。
2.2.9 出膜前期雌核发育组因部分个体肌肉无力,发育速度减慢,其外部特征与普通胚胎基本一致,此期出现大量胚胎死亡现象。单倍体胚胎畸形现象严重,也出现大量胚胎死亡 (图 1)。发育时序为N>G>H。
2.2.10 出膜期形态上,雌核发育组发育特征与普通胚胎相似,只是出膜时间跨度大,出现大量死亡胚胎,除少量畸形苗外,二者初孵仔鱼体色透明,无明显区别。单倍体组具有明显的单倍体综合症,孵化仔鱼活力很差,不能发育至平游。
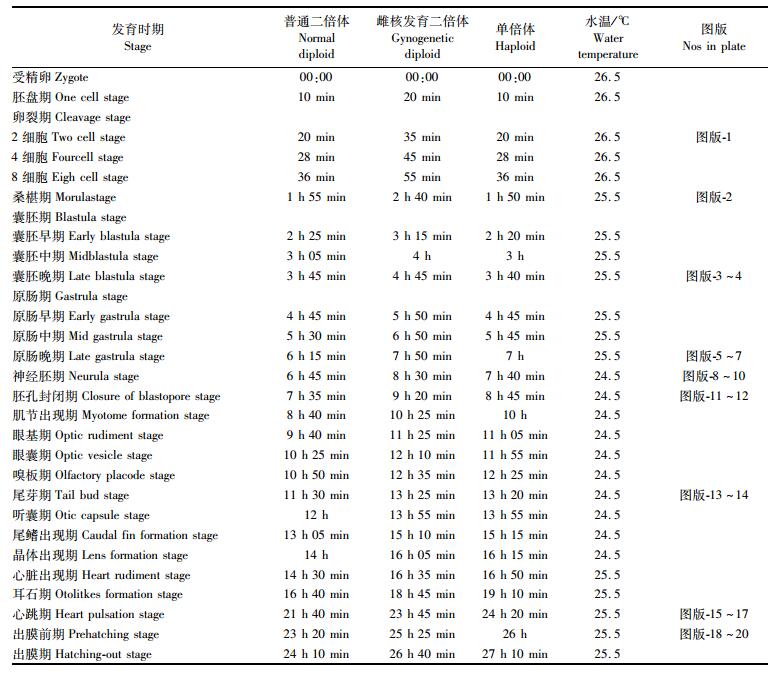
|
表 2 普通二倍体、雌核发育、单倍体翘嘴鲌胚胎发育时序 Tab.2 Time table of normal diploid, gynogenetic diploid and haploid embryonic development of C.alburnus |
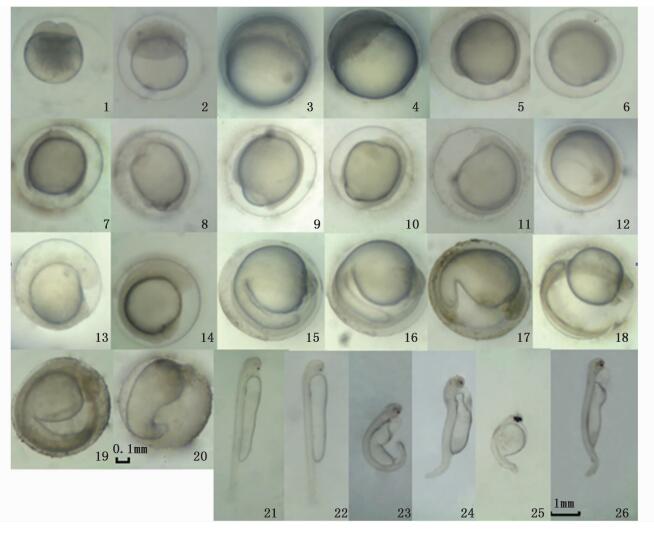
|
图版 翘嘴鲌普通二倍体、雌核发育二倍体和单倍体胚胎发育的比较
Plate1 Plate The embryonic development of normal diploid,gynogenetic diploid and haploid of C.alburnus
1~20标尺相同,21~26标尺相同 1. 雌核发育二倍体2细胞; 2. 雌核发育二倍体桑葚期; 3. 雌核发育二倍体囊胚晚期; 4. 单倍体囊胚晚期; 5. 普通二倍体原肠晚期; 6. 雌核发育二倍体原肠晚期; 7. 单倍体原肠晚期; 8. 普通二倍体神经胚期; 9. 雌核发育二倍体神经胚期; 10. 单倍体神经胚期; 11. 雌核发育二倍体胚孔封闭期; 12. 单倍体胚孔封闭期; 13. 雌核发育二倍体尾芽期; 14. 单倍体尾芽期; 15. 普通二倍体心跳期; 16. 雌核发育二倍体心跳期; 17. 单倍体心跳期; 18. 普通二倍体出膜前期; 19. 雌核发育二倍体出膜前期; 20. 单倍体出膜前期; 21. 普通二倍体初孵仔鱼; 22. 雌核发育二倍体初孵仔鱼; 23~26. 单倍体初孵仔鱼 1-20 had the same scale,21-26 had the same scale 1. Two cell stage in gynogenetic diploid; 2. Morula stage in gynogenetic diploid; 3. Late blastula stage in gynogenetic diploid; 4. Late blastula stage in haploid; 5. Late gastrula stage in normal diploid; 6. Late gastrula stage in gynogenetic diploid; 7. Late gastrula stage in haploid; 8. Neurula stage in normal diploid; 9. Neurula stage in gynogenetic diploid; 10. Neurula stage in haploid; 11. Closure of blastopore stage in gynogenetic diploid; 12. Closure of blastopore stage in haploid; 13. Tail bud stage in gynogenetic diploid; 14. Tail bud stage in haploid; 15. Heart pulsation stage in normal diploid; 16. Heart pulsation stage in gynogenetic diploid; 17. Heart pulsation stage in haploid; 18. Prehatching stage in normal diploid; 19. Prehatching stage in gynogenetic diploid; 20. Prehatching stage in haploid; 21. Newly hatched larvae of normal diploid; 22. Newly hatched larvae of gynogenetic diploid; 23-26. Newly hatched larvae of haploid |
普通翘嘴鲌与雌核发育群体可数与可量性状情况见表 3、表 4,对两个群体的可数与可量性状进行t检验,结果显示两群体侧线下鳞数、体长/肛前体长、体长/体高、肠长/体长、头长/眼径、头长/眼间距、体长/腹鳍长和体长/臀鳍长存在极显著性差异 (P < 0.01), 第一鳃耙数、头长/吻长、头长/眼后头长以及体长/背鳍长具有显著性差异 (P < 0.05)。
|
表 3 普通翘嘴鲌与雌核发育群体的可数性状 Tab.3 Meristic characters of normal and gynogenesis groups C.alburnus |
|
表 4 普通翘嘴鲌与雌核发育群体的可量性状 Tab.4 Metric characters of normal and gynogenesis groups C.alburnus |
近年来对鱼类雌核发育和单倍体鱼类胚胎发育特征已有报道[8-9]。与普通二倍体相比,翘嘴鲌雌核发育系,在发育时序及形态上无明显差异,胚胎发育也正常,但发育速度慢些,其发育缓慢主要表现在卵裂至原肠期阶段,此阶段历时较长 (图 2),出膜时间比普通二倍体长约10%。究其原因,可能是冷休克处理延缓了其胚胎发育进程的结果[10]。但也不排除与只具有母本遗传物质的雌核发育胚胎因基因高度纯合而引起的近交衰退有关。对此,仍需深入研究。翘嘴鲌雌核发育二倍体胚胎发育速度与经过冷休克诱导的兴国红鲤 (Cyprinuscarpiovar singuonensis) 不同,兴国红鲤受精卵经过冷休克处理后胚胎发育速度先慢后快,孵化出膜时间缩短[11]。但与条斑星鲽 (Verasper moseri)、大菱鲆 (Scophthalmus maximus)、黄姑鱼 (Nibea albiflora) 雌核发育二倍体胚胎发育相似[9-10, 12]。这种发育的差异可能因物种不同而不同。
3.2 雌核发育系在卵裂上出现异常且死亡率较高本研究观察到部分雌核发育胚胎与单倍体胚胎外观相似,但从卵裂开始出现卵裂球大小不一的现象,且约1/10胚胎在卵裂期出现非正常数目的卵裂球。朱作言[13]认为卵裂过程不涉及基因的转录,它是靠受精卵原有的物质来完成的。根据本试验现象推测,低温处理会使部分卵内某种调节途径中断,导致卵质的流动出现偏差,以至于卵裂球形状和数目出现异常现象。研究结果还发现,雌核发育胚胎在原肠期和出膜前期出现大量胚胎死亡现象,受精率和孵化率分别为44.5%±3.09%和35.5%±9.78%,与普通胚胎差异显著。洪一江等[11]指出,进入囊胚期后,某些卵质中的启动因子经低温处理而不能启动基因表达,细胞分化受阻,胚胎无法正常发育而死亡。因此,胚胎发育过程中的冷休克处理,可能是引起翘嘴鲌雌核发育二倍体受精率和孵化率低以及畸形率高的主要原因。
雌核发育二倍体成活率的高低与卵子质量、染色体加倍技术及胚胎孵化、仔鱼生态条件密切相关。本试验发现,冷休克处理后,雌核发育二倍体胚胎发育变的较为复杂,常表现出不规则细胞分裂、卵膜破裂、卵黄囊凝集及单倍体综合症等现象,且随着时间的推移,陆续出现死亡。死亡胚胎因卵膜的破裂,导致卵黄囊的溢出,极易败坏水质。因此,及时清理死亡胚胎并控制孵化水质条件尤为关键。特别是在胚胎死亡高峰期阶段,孵化管理的时候应予以密切关注,及时将死亡胚胎挑出和更换新水。
3.3 雌核发育系部分形态出现了变异特征本研究在两个翘嘴鲌群体的29个可量与可数性状中筛选到8个存在极显著性差异 (P < 0.01),4个具有显著性差异 (P < 0.05),表明雌核发育群体形态特征出现了一定的变化。试验结果与张新辉等[14]对10月龄团头鲂雌核发育群体和普通群体的22个性状进行测量后得出的两个群体没有明显区别的结论不一致,这可能是由于物种不同或者是鱼的年龄不同而引起的。为此有必要做进一步深化的研究。后续会对雌核发育翘嘴鲌群体和普通群体的形态差异做更加详细的分析。同一种类的肠体比随饵料质量和水域环境会产生较大的差异,在摄食低质难消化的食物时,河鲈 (Perca fluviatilis) 往往能发展出更长的肠道系统[15]。试验中两群体具有相同的生长条件,但雌核发育翘嘴鲌群体肠长/体长显著增大,延长的肠道增加了食物在鱼体内的消化时间,提高了食物的利用效率。同时,雌核发育群体体高与肛前体长均有所增大,反映了其可供食用部分增多,食用品质更高,更符合人类经济效益。雌核发育个体在形态上的变化,为今后优良翘嘴鲌的选育提供了一个新的遗传改良方法。
| [1] |
王琨. 兴凯湖翘嘴鲌肌肉品质及相关候选基因研究[D]. 哈尔滨: 东北农业大学, 2013.
WANG K. Studies on meat quality and related candidate genes of Culter alburnus in Xingkai Lake[D]. Harbin:Northeast Agricultural University, 2013. |
| [2] |
杨太有, 陈宏喜, 刘向奇, 等. 丹江口水库翘嘴红鲌 (Erythroculter ilishaeformis) 遗传多样性的RAPD和ISSR分析[J].
海洋与湖沼, 2008, 39(3): 240–244.
YANG T Y, CHEN H X, LIU X Q, et al. Genetic diversity of Erythroculter ilishaeformis from Danjiangkou reservoir revealed by RAPD and ISSR analysis[J]. Oceanologia et Limnologia Sinica, 2008, 39(3): 240–244. |
| [3] |
李卢. 人工雌核发育在鱼类遗传育种中的应用[J].
水产科技情报, 2006, 33(2): 56–59.
LI L. An application of artifical gynogensis to fish genetic breeding[J]. Fisheries Science & Technology Information, 2006, 33(2): 56–59. |
| [4] |
王桂兴, 刘海金, 张晓彦, 等. 牙鲆连续两代减数分裂雌核发育家系的遗传特征[J].
中国水产科学, 2012, 19(3): 381–389.
WANG G X, LIU H J, ZHANG X Y, et al. Analysis of homozygosity and genetic similarity between two successive generations in a meiogynogenetic Japanese flounder family[J]. Journal of Fishery Sciences of China, 2012, 19(3): 381–389. |
| [5] |
侯吉伦, 李超, 王桂兴, 等. 牙鲆连续三代减数分裂雌核发育家系的遗传特征分析[J].
中国工程科学, 2014, 16(9): 26–32.
HOU J L, LI C, WANG G X, et al. Analysis of genetic structure of three third-generation of successive meiogynogenetic families in Japanese flounder, Paralichthys olivaceus[J]. Engineering Sciences, 2014, 16(9): 26–32. |
| [6] |
李停, 贾永义, 刘士力, 等. 二次正交旋转组合设计优化人工诱导翘嘴鲌雌核发育[J].
中国水产科学, 2016, 23(1): 77–89.
LI T, JIA Y Y, LIU S L, et al. Optimizing conditions to induce artificial gynogenesis in Culter alburnus using a quadratic orthogonal rotation design[J]. Journal of Fishery Sciences of China, 2016, 23(1): 77–89. |
| [7] |
李倩, 顾志敏, 贾永义, 等. 翘嘴鲌连续两代减数分裂雌核发育群体的遗传特征分析[J].
上海海洋大学学报, 2015, 24(1): 1–11.
LI Q, GU Z M, JIA Y Y, et al. Analysis of genetic characteristics of two successive generation meiosis gynogenetic population in Erythroculter ilishaeformis Bleeker[J]. Journal of Shanghai Ocean University, 2015, 24(1): 1–11. |
| [8] |
王云, 刘少军, 易念, 等. 雌核发育鲫鲤早期胚胎发育观察[J].
湖南师范大学自然科学学报, 2005, 28(3): 58–61.
WANG Y, LIU S J, YI N, et al. Observation on early embryonic development of gynogenetic progeny from Allotetraploid hybrids[J]. Journal of Natural Science of Hunan Normal University, 2005, 28(3): 58–61. |
| [9] |
李忠红, 刘海金, 张世奎, 等. 雌核发育与正常二倍体条斑星鲽胚胎发育比较研究[J].
水产科学, 2009, 28(12): 752–756.
LI Z H, LIU H J, ZHANG S K, et al. Comparison of embryonic development in gynogenetic and diploid barfin flounder (Verasper moseri)[J]. Fisheries Science, 2009, 28(12): 752–756. |
| [10] |
孟振, 雷霁霖, 刘新富, 等. 不同倍性大菱鲆胚胎发育的比较研究[J].
中国海洋大学学报, 2010, 40(7): 36–42.
MENG Z, LEI J L, LIU X F, et al. Comparative study in embryonic development of different ploidy of turbot, Scophthalmus maximus[J]. Periodical of Ocean University of China, 2010, 40(7): 36–42. |
| [11] |
洪一江, 胡成钰, 张丰旺, 等. 冷休克对兴国红鲤胚胎发育的影响[J].
南昌大学学报 (理科版), 1993, 17(2): 99–104.
HONG Y J, HU C Y, ZHANG F W, et al. The effect of cold shock in the embryonic development of Singuo red carp (Cyprinus carpio var. singuonensis)[J]. Journal of Nanchang University (Natural Science), 1993, 17(2): 99–104. |
| [12] |
杨育凯, 简林江, 王志勇, 等. 黄姑鱼正常二倍体和雌核发育体胚胎发育及早期生长的比较研究[J].
上海海洋大学学报, 2013, 22(5): 690–697.
YANG Y K, JIAN L J, WANG Z Y, et al. Comparison of embryonic development and early growth in normal and gynogenetic diploid of Yellow drum Nibea albiflora[J]. Journal of Shanghai Ocean University, 2013, 22(5): 690–697. |
| [13] |
朱作言. 胡子鲶的胚胎发育[J].
水生生物学集刊, 1982, 7(4): 445–454.
ZHU Z Y. Embryonic development of Clarias fuscus (Teleostei, siluriformes)[J]. Acta Hydrobiologica Sinica, 1982, 7(4): 445–454. |
| [14] |
张新辉, 高泽霞, 罗伟, 等. 雌核发育团头鲂的形态和遗传特征分析[J].
水生生物学报, 2015, 39(1): 126–132.
ZHANG X H, GAO Z X, LUO W, et al. Studies on morphological characteristics and genetic analysis of the gynogenesis blunt snout bream (Megalobrama amblycephala)[J]. Acta Hydrobiologica Sinica, 2015, 39(1): 126–132. |
| [15] | OLSSON J, QUEVEDO M, COLSON C, et al. Gut length plasticity in perch:into the bowels of resource polymorphisms[J]. Biological Journal of the Linnean Society, 2007, 90(3): 517–523. DOI:10.1111/(ISSN)1095-8312 |
2. Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, Zhejiang, China
 2017,
Vol. 26
2017,
Vol. 26


