2. 中国水产科学研究院南海水产研究所 南海生物资源开发与利用协同创新中心, 广东 广州 510300;
3. 广州市农业环境与植物保护总站, 广东 广州 510450
合浦珠母贝 (Pinctada martensii) 是中国重要的海水养殖贝类和生产珍珠的主要母贝,也是海水养殖经济贝类育种工作中最早开展和研究时间最长的种类之一[1-2],前人已开展大量有关合浦珠母贝的同属不同种间的杂交育种、多倍体育种和选择育种等研究工作[2-5]。在选择育种方面,研究人员首先利用群体选择方法构建了合浦珠母贝育种材料,分析了F1、F2和F3的选育和对照组幼苗和养成期生长数据,估算了生长性状的现实遗传力和遗传获得[6-10]。此后,又开展了以家系遗传改良技术为核心的合浦珠母贝生长性状选择育种工作,筛选优良家系[11-12]、估计遗传参数[13-15]和评估选育效果[16]等工作,并开展了野生和选育群体遗传多样性[17-19]、遗传连锁图谱[20]和QTL定位[21-22]等分子标记辅助育种工作,这些研究成果为合浦珠母贝选择育种工作提供了理论依据和数据支持。
合浦珠母贝体质量性状遗传改良对珍珠贝生长速度和珍珠质量的提高具有重要作用[23],利用相关和回归分析计算各性状间相关系数,构建估算体质量的多元回归方程,有利于确定有效的选育性状,这种分析方法已广泛应用于华贵栉孔扇贝 (Chlamys nobilis)[24]、琴文蛤 (Meretrix lyrata)[25]、毛蚶 (Scapharca subcrenata Lischke)[26]、近江牡蛎 (Crassostrea rivularis Gould)[27]、厚壳贻贝 (Mytilus coruscus) 和紫贻贝 (M.edulis)[28]等贝类品种。何毛贤等[29]、刘志刚等[30]、DENG等[31]和陈飞飞等[32]先后利用不同来源合浦珠母贝不同养殖月龄壳长、壳高、壳宽和体质量等生长数据进行了相关和回归分析,但有关家系选择多个世代的选育组和对照组生长性状间相关和回归分析结果的比较研究尚未见报道。
该研究利用合浦珠母贝F4选育组和对照组苗种不同月龄生长数据,分析和比较了选育组和对照组壳长、壳高、壳宽和体质量间的相关性,分别构建两个组别估算体质量的多元回归方程,以期为合浦珠母贝选择育种工作中确定目标性状提供理论指导和数据支持。
1 材料与方法 1.1 实验材料实验材料为2014年2月于南海水产研究所热带水产研究开发中心三亚安游基地构建的F4选育组和对照组。利用海南三亚、广东徐闻和广西北海等地养殖合浦珠母贝个体构建选育基础群体,以壳高为选育目标,采用1雌对1雄的交配方案先后构建了F1、F2和F3选育家系,从F3选育家系中挑选优良个体构建F4选育组,对照组亲本来源于海南省黎安镇一珍珠养殖场随机挑选未经人工选育的合浦珠母贝个体。两组贝苗均采用人工解剖授精的方法获得,苗种培育主要依照黎火金等[14]。2014年5月,贝苗运至广东省雷州市覃斗镇珍珠贝养殖户进行海区养殖,在养殖过程中,定期清理笼具和换笼,养殖管理方式保持一致。
1.2 数据收集待海区养殖至6月龄、9月龄和12月龄时,收集养殖户选育组和对照组的生长数据,每次每个组别共计测量100个个体,测量性状包括壳长 (Shell length, SL)、壳高 (Shell height, SH) 和壳宽 (Shell width, SW) 和体质量 (Body weight, BW),具体测量参照陈飞飞等[32]。
1.3 统计分析利用Excel 2013整理选育组和对照组不同月龄生长数据,利用SAS 9.3软件对各组月龄生长数据相关分析和回归分析,利用R软件绘制散点图矩阵以显示各组性状间的相关关系,散点图矩阵中对角线图形显示各组生长性状的正态性情况,左下方散点图显示性状两两间的数据分布,右上方数值为性状间的相关系数[33]。
2 结果与分析 2.1 选育组和对照组生长性状描述性统计合浦珠母贝选育组和对照组不同月龄生长性状描述性统计量见表 1。选育组在各月龄壳长、壳高、壳宽和体质量平均值都大于对照组相应数据,标准差和变异系数也均小于对照组。壳长、壳高和壳宽在6月龄、9月龄和12月龄的变异系数范围分别为8.56%~10.96%、7.65%~12.11%和9.11%~15.06%。体质量变异系数较大,均超过20%,其中对照组6月龄体质量变异系数最大,其数值为39.78%。
|
表 1 选育组和对照组不同月龄生长性状描述性统计量 Tab.1 Descriptive statistics of growth traits among selective and control groups at different months |
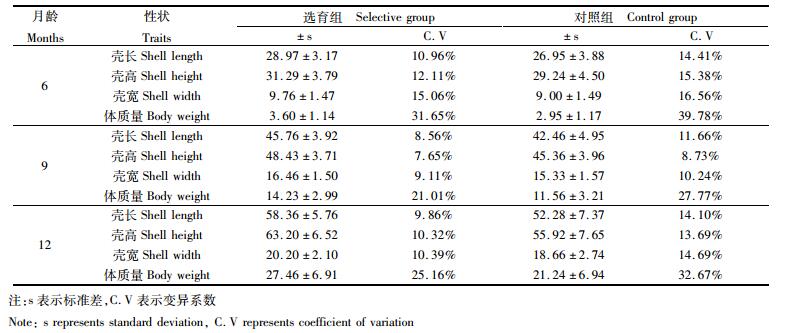
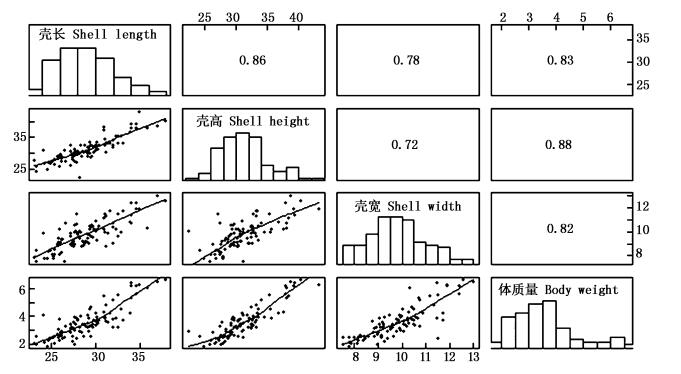
选育组和对照组6月龄生长性状间相关系数见图 1和图 2。选育组和对照组壳长、壳高、壳宽和体质量间相关系数均达到极显著水平 (P < 0.01)。选育组各性状均不呈正态分布 (P < 0.05),4个性状间相关系数范围是0.72~0.88。对照组除体质量外,其他3个性状均呈正态分布 (P>0.05),4个性状间相关系数范围是0.87~0.91。选育组各性状相关系数均小于对照组,选育组相关系数最大的为壳高和体质量,对照组相关系数最大的为壳宽和体质量,但壳高与体质量相关系数也较大,其数值为0.90。
|
图 1 选育组6月龄生长性状相关系数
Fig. 1 Correlation coefficients among growth traits of selective group at six months
|
|
图 2 对照组6月龄生长性状相关系数
Fig. 2 Correlation coefficients among growth traits of control group at six months
|
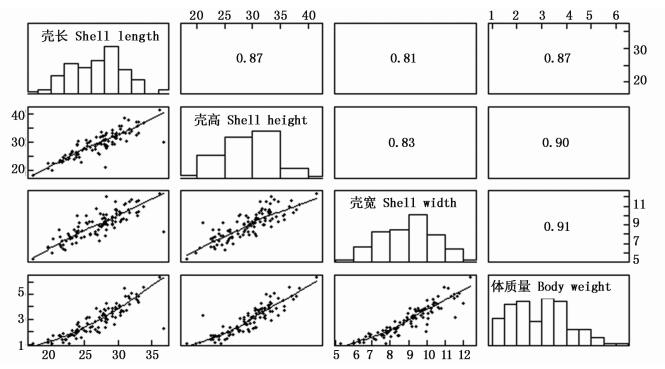
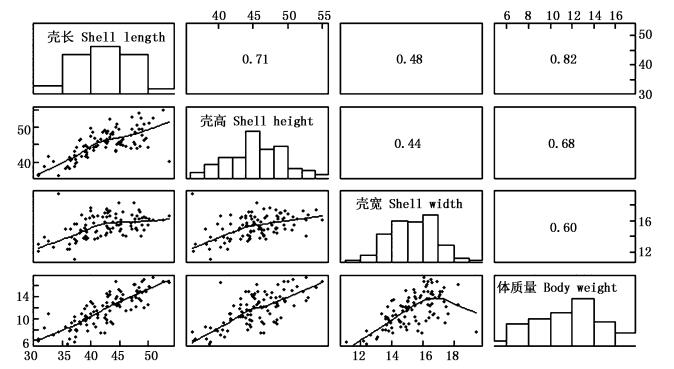
选育组和对照组9月龄生长性状间相关系数见图 3和图 4。选育组和对照组壳长、壳高、壳宽和体质量间相关系数均达到极显著水平 (P < 0.01)。选育组壳宽和体质量呈正态分布 (P>0.05),4个性状间相关系数范围是0.53~0.69。对照组各性状均呈正态分布 (P>0.05),4个性状间相关系数范围是0.44~0.82。选育组壳长、壳高和体质量间相关系数均小于对照组相应数值,但壳宽与其他性状间的相关系数均大于对照组相应数值。选育组和对照组相关系数最大的均为壳长和体质量,其数值分别0.69和0.82。
|
图 3 选育组9月龄生长性状相关系数
Fig. 3 Correlation coefficients among growth traits of selective group at nine months
|
|
图 4 对照组9月龄生长性状相关系数
Fig. 4 Correlation coefficients among growth traits of control group at nine months
|
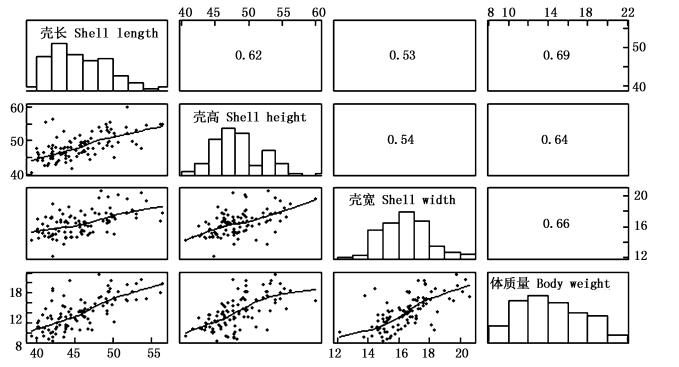
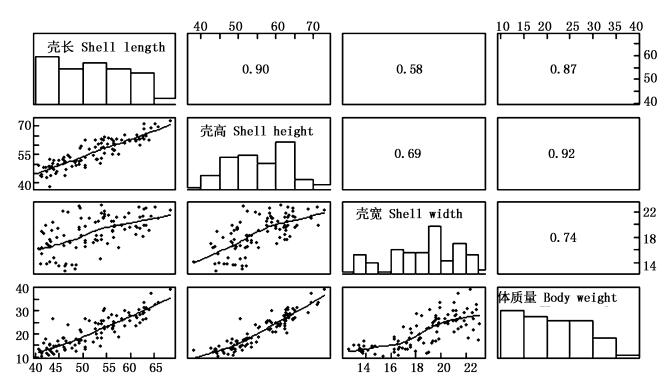
选育组和对照组12月龄生长性状间相关系数见图 5和图 6。选育组和对照组壳长、壳高、壳宽和体质量间相关系数均达到极显著水平 (P < 0.01)。选育组壳宽呈正态分布 (P>0.05),4个性状间相关系数范围是0.47~0.85。对照组各性状均不呈正态分布 (P < 0.05),4个性状间相关系数范围是0.58~0.92。选育组各性状相关系数均小于对照组相应数值,选育组相关系数最大的为壳长和壳高,对照组相关系数最大的为壳高和体质量,但壳长与壳高相关系数也较大,其数值为0.90。

|
图 5 选育组12月龄生长性状相关系数
Fig. 5 Correlation coefficients among growth traits of selective group at twelve months
|
|
图 6 对照组12月龄生长性状相关系数
Fig. 6 Correlation coefficients among growth traits of control group at twelve months
|
合浦珠母贝选育组和对照组不同月龄估算体质量的多元回归方程见表 2。方差分析F检验结果显示所有回归方程均达到显著水平 (P < 0.05)。各回归方程的判定系数 (R2) 范围为0.625~0.902,在相同月龄,选育组估算体质量的多元回归方程判定系数均小于对照组相应数值,两组间回归方程中常数项、壳长、壳高和壳宽的偏回归系数也有一定差异。在6月龄和12月龄时,选育组回归方程中壳长都未能达到显著水平 (P>0.05)。在所有月龄中,对照组回归方程中壳长、壳高和壳宽的偏回归系数均达到极显著水平 (P < 0.01)。

|
表 2 选育组和对照组不同月龄估算体质量的多元回归方程 Tab.2 Multiple regression equations for estimating body weight of selective and control groups at different months |
本研究中,选育组各月龄壳长、壳高、壳宽和体质量平均值均大于对照组相应数据,表明经过连续3代选育提高了合浦珠母贝生长性状的平均值,这与前3代选育的效果相一致[16]。所有月龄选育组和对照组生长性状间相关系数均达到极显著水平 (P < 0.01),6月龄、9月龄和12月龄选育组性状间相关系数范围分别是0.72~0.88、0.53~0.69和0.47~0.85,对照组性状间相关系数范围分别是0.87~0.91、0.44~0.82和0.58~0.92。除6月龄选育组壳宽与其他性状间相关系数均大于对照组外,选育组性状间相关系数均小于对照组。在有关合浦珠母贝生长性状间相关分析研究中,壳长、壳高、壳宽和体质量间相关系数范围分别为0.532~0.928[29]、0.436~0.831[30]、0.287 7~0.897 0[31]、0.814 6~0.922 8[32]和0.667~0.698[14],该研究与上述研究的性状间相关系数范围较为相近。
本研究建立以壳长、壳高和壳宽为自变量,体质量为依变量的各月龄选育组和对照组多元回归方程,所有回归方程均达到显著水平 (P < 0.05),选育组和对照组的方程判定系数范围分别为0.625~0.848和0.745~0.902,在相同月龄,选育组多元回归方程判定系数均小于对照组。在6月龄和12月龄时,选育组回归方程中壳长均未达到显著水平 (P>0.05)。何毛贤等[29]利用马氏珠母贝苗海区养殖的8次测量壳长、壳高、壳宽和体质量数据构建了不同生长时期的体质量对各形态性状的回归方程,方程判定系数范围是0.793~0.950,在第1、3、7和15个月对壳长的偏回归系数不显著 (P>0.05)。刘志刚等[30]进行不同养殖区合浦珠母贝各经济性状和体质量的回归分析,结果显示,剔除对体质量效应很小的性状外,建立了壳长、壳高和壳宽对体质量的线性回归模型,其复相关系数为0.939(P<0.01)。陈飞飞等[32]利用2龄合浦珠母贝三亚养殖群体的6个形态性状和体质量数据,通过多元分析剔除了偏回归系数不显著的顶点-腹缘长、韧带槽长和韧带槽宽等性状,多元回归方程为Y=0.6873X1+0.3182X2+0.9379X3-43.2267,方程中Y、X1、X2和X3分别为体质量、壳长、壳高和壳宽,判定系数为0.875 8。该研究与何毛贤等[29]研究结果相似,均在部分月龄的回归方程中,壳长的偏回归系数不显著 (P>0.05)。该研究中方程判定系数范围略小于何毛贤等[29]结果,陈飞飞等[32]得到的回归方程判定系数在该研究的判定系数范围内。综合上述研究结果可确定,壳长、壳高和壳宽是影响体质量的主要性状,并以此构建估算体质量的多元回归方程是合理有效的,可简便可靠地应用于实际生产中。
本研究利用合浦珠母贝F4选育组和对照组的3次生长数据进行相关和回归分析,结果显示,选育和对照组生长性状间相关系数范围分别为0.47~0.88和0.44~0.92,方程判定系数范围分别为0.625~0.848和0.745~0.902,选育组大部分相关系数和所有回归方程决定系数均小于对照组相应数值,该研究结果为合浦珠母贝生长性状选择育种工作的继续开展和确定重要选育目标性状提供了理论依据和数据支持。
| [1] |
谭才钢, 刘宝锁, 张东玲, 等. 合浦珠母贝主要形态性状与体质量的灰色关联分析[J].
南方水产科学, 2015, 11(2): 35–40.
TAN C G, LIU B S, ZHANG D L, et al. Analysis of grey relationship between morphological traits and body weight of pearl oyster (Pinctada fucata)[J]. South China Fisheries Science, 2015, 11(2): 35–40. |
| [2] |
王爱民, 石耀华. 中国马氏珠母贝遗传育种的现状与展望[J].
农业生物技术学报, 2003, 11(6): 547–553.
WANG A M, SHI Y H. Present status and future prospects for genetic breeding of pearl oyster (Pinctada martensii) in China[J]. Journal of Agricultural Biotechnology, 2003, 11(6): 547–553. |
| [3] |
何毛贤, 姜卫国. 合浦珠母贝遗传育种研究进展[J].
海洋湖沼通报, 2000: 75–82.
HE M X, JIANG W G. The advances of genetics and breeding in Pinctada martensii(D.)[J]. Transactions of Oceanology and Limnology, 2000: 75–82. |
| [4] |
邓陈茂, 童银洪, 符韶. 马氏珠母贝的研究进展[J].
现代农业科技, 2009: 204–205.
DENG C M, TONG Y H, FU S. Advances in Pinctada martensii[J]. Modern Agricultural Science and Technology, 2009: 204–205. |
| [5] |
曹占旺, 王大鹏, 甘西. 马氏珠母贝及海水珍珠的研究进展[J].
广西农业科学, 2009, 40(12): 1618–1622.
CAO Z W, WANG D P, GAN X. Advances in Pinctada martensii(Dunker) and its seawater pearl during recent years[J]. Guangxi Agricultural Sciences, 2009, 40(12): 1618–1622. |
| [6] |
何毛贤, 史兼华, 林岳光, 等. 马氏珠母贝选育子一代生长特性研究[J].
热带海洋学报, 2006, 25(1): 19–22.
HE M X, SHI J H, LIN Y G, et al. Studies on growth traits of first generation of selective line of Pinctada martensii Dunker[J]. Journal of Tropical Oceanography, 2006, 25(1): 19–22. |
| [7] | HE M X, GUAN Y Y, YUAN T, et al. Realized heritability and response to selectionfor shell height in the pearl oyster Pinctada fucata (Gould)[J]. Aquaculture Research, 2008, 39(8): 801–805. DOI:10.1111/j.1365-2109.2008.01889.x |
| [8] |
邓岳文, 符韶, 杜晓东, 等. 马氏珠母贝选系F2早期选择反应和现实遗传力估计[J].
广东海洋大学学报, 2008, 28(4): 26–29.
DENG Y W, FU S, DU X D, et al. Response to selection and realized heritability for early growth in the second-generation selected line of pearl oyster Pinctada martensii[J]. Journal of Guangdong Ocean University, 2008, 28(4): 26–29. |
| [9] | DENG Y W, FU S, DU X D, et al. Realized heritability and genetic gain estimates of larval shell length in the Chinese pearl oyster Pinctada martensii at three different salinities[J]. North American Journal of Aquaculture, 2009, 71(4): 302–306. DOI:10.1577/A08-024.1 |
| [10] | WANG Q H, DENG Y W, DU X D, et al. Realized heritability and genetic gains of three generation for superior growth in the pearl oyster Pinctada martensii[J]. Acta Ecologica Sinica, 2011, 31(2): 108–111. DOI:10.1016/j.chnaes.2010.12.001 |
| [11] |
何毛贤, 管云雁, 林岳光, 等. 马氏珠母贝家系的生长比较[J].
热带海洋学报, 2007, 26(1): 39–43.
HE M X, GUAN Y Y, LIN Y G, et al. Growth comparison between families of pearl oyster Pinctada martensii Dunker[J]. Journal of Tropical Oceanography, 2007, 26(1): 39–43. |
| [12] |
汤健, 刘文广, 林坚士, 等. 9个马氏珠母贝家系的中期生长性状评估[J].
南方水产科学, 2011, 7(5): 30–36.
TANG J, LIU W G, LIN J S, et al. Evaluation on mid-term growth of 9 families of pearl oyster Pinctada facata[J]. South China Fisheries Science, 2011, 7(5): 30–36. |
| [13] |
郭华阳, 张殿昌, 李恒德, 等. 合浦珠母贝幼体生长性状的遗传力及其相关性分析[J].
湖北农业科学, 2011, 50(21): 4441–4444.
GUO H Y, ZHANG D C, LI H D, et al. Estimates of heritability and genetic correlations for the growth of larvae of Pinctada fucata[J]. Hubei Agricultural Sciences, 2011, 50(21): 4441–4444. |
| [14] |
黎火金, 刘宝锁, 罗会, 等. 合浦珠母贝幼贝生长性状的遗传参数估计[J].
中国水产科学, 2013, 20(6): 1182–1187.
DOI:10.3724/SP.J.1118.2013.01182 LI H J, LIU B S, LUO H, et al. Estimates of genetic parameters for growth traits in juvenile pearl oyster Pinctada fucata[J]. Journal of Fishery Sciences of China, 2013, 20(6): 1182–1187. DOI:10.3724/SP.J.1118.2013.01182 |
| [15] |
陶后全, 吴灶和, 白成, 等. 马氏珠母贝早期生长性状的遗传参数估计[J].
广东海洋大学学报, 2014, 34(3): 10–16.
TAO H Q, WU Z H, BAI C, et al. Heritability estimates for growth straits in the earlier larva stage of Pinctada martensii[J]. Journal of Guangdong Ocean University, 2014, 34(3): 10–16. |
| [16] |
黎火金. 合浦珠母贝选育家系的生长性能与BLUP遗传评定[D]. 上海: 上海海洋大学, 2013.
LI H J. Growth performances and BLUP-based genetic evaluation of selected families in the pearl oyster Pinctada fucata[D]. Shanghai:Shanghai Ocean University, 2013. |
| [17] | YU D H, CHU K H. Genetic variation in wild and cultured populations of the pearl oyster Pinctada fucata from southern China[J]. Aquaculture, 2006, 258(1/4): 220–227. |
| [18] |
侯战辉, 王嫣, 石耀华, 等. 马氏珠母贝 (Pinctada martensii) 2个不同地理种群遗传变异的EST-SSR分析[J].
海洋与湖沼, 2008, 39(2): 178–183.
HOU Z H, WANG Y, SHI Y H, et al. EST-SSR analysis of genetic variation between two geographical populations of pearl oyster, Pinctada martensii (Dunker)[J]. Oceanologiaet Limnologia Sinica, 2008, 39(2): 178–183. |
| [19] |
管云雁, 刘文广, 何毛贤. 马氏珠母贝选育群体4个世代的遗传变异[J].
中国水产科学, 2013, 20(4): 764–770.
DOI:10.3724/SP.J.1118.2013.00764 GUAN Y Y, LIU W G, HE M X. Genetic variation during four generations of selective breeding in the pearl oyster Pinctada fucata[J]. Journal of Fishery Sciences of China, 2013, 20(4): 764–770. DOI:10.3724/SP.J.1118.2013.00764 |
| [20] |
喻达辉, 王小玉, 黄桂菊, 等. 合浦珠母贝遗传连锁图谱的构建[J].
中国水产科学, 2007, 14(3): 361–368.
YU D H, WANG X Y, HUANG G J, et al. Construction of genetic linkage maps in pearl oyster Pinctada fucata using AFLPmarkers[J]. Journal of Fishery Sciences of China, 2007, 14(3): 361–368. |
| [21] | LI Y G, HE M X. Genetic mapping and QTL analysis of growth-related traits in Pinctada fucata using restriction-site associated DNA sequencing[J]. PLoS One, 2014, 9(11): e111707. DOI:10.1371/journal.pone.0111707 |
| [22] | SHI Y H, WANG S, GU Z F, et al. High-density single nucleotide polymorphisms linkage and quantitative trait locus mapping of the pearl oyster, Pinctada martensii Dunker[J]. Aquaculture, 2014, 434: 376–384. DOI:10.1016/j.aquaculture.2014.08.044 |
| [23] |
王爱民, 石耀华, 周志刚. 马氏珠母贝不同地理种群内自繁和种群间杂交子一代形态性状参数及相关性分析[J].
海洋水产研究, 2004, 25(3): 39–45.
WANG A M, SHI Y H, ZHOU Z G. Morphological trait parameters and their correlations of the first generation from matings and crosses of geographical populations of Pinctada martensii (Dunker)[J]. Marine Fisheries Research, 2004, 25(3): 39–45. |
| [24] |
刘文广, 林坚士, 何毛贤. 不同贝龄华贵栉孔扇贝数量性状的通径分析[J].
南方水产科学, 2012, 8(1): 43–48.
LIU W G, LIN J S, HE M X. Path analysis of quantitative traits of scallop Chlamys nobilisat different ages[J]. South China Fisheries Science, 2012, 8(1): 43–48. |
| [25] |
刘博, 滕爽爽, 邵艳卿, 等. 琴文蛤形态性状对体量的影响效果分析[J].
海洋科学, 2011, 35(10): 91–95.
LIU B, TENG S S, SHAO Y Q, et al. Mathematical analysis of the correlations between the morphometric attributes and body weight Meretrix. lyrata[J]. Marine Sciences, 2011, 35(10): 91–95. |
| [26] |
李莉, 郑永允, 徐科凤, 等. 不同贝龄毛蚶壳形态性状对体质量的影响[J].
海洋科学, 2015, 39(6): 54–58.
LI L, ZHENG Y Y, XU K F, et al. The relationship between morphometric traits and body weight of Scapharca subcrenata at different ages[J]. Marine Sciences, 2015, 39(6): 54–58. |
| [27] |
肖述, 符政君, 喻子牛. 香港巨牡蛎雌雄群体的数量性状通径分析[J].
南方水产科学, 2012, 7(4): 1–9.
XIAO S, FU Z J, YU Z N. Path analysis of quantitative traits of male and female Hong Kong oyster Crassostrea hongkongensis[J]. South China Fisheries Science, 2012, 7(4): 1–9. |
| [28] |
郑晓静, 杨阳, 邹李昶, 等. 嵊泗列岛海域三种贻贝贝体框架性状对壳重的影响效应[J].
海洋与湖沼, 2015, 46(1): 165–172.
ZHENG X J, YANG Y, ZOU L C, et al. Effects of shell frame characteristics on shell weight of three species of Mytilus in Shengsi waters of the east China sea[J]. Oceanologiaet Limnologia Sinica, 2015, 46(1): 165–172. |
| [29] |
何毛贤, 史兼华, 林岳光, 等. 马氏珠母贝生长性状的相关分析[J].
海洋科学, 2006, 33(11): 1–4.
HE M X, SHI J H, LIN Y G, et al. The growth trait correlated responses in pearl oyster Pinctada martensi[J]. Marine Sciences, 2006, 33(11): 1–4. |
| [30] | 刘志刚, 王辉, 孙小真, 等. 马氏珠母贝经济性状对体重决定效应分析[J]. 广东海洋大学学报, 2007, 27(4): 15–20. |
| [31] | DENG Y W, DU X D, WANG Q H, et al. Correlation and path analysis for growth traits in F1 population of pearl oyster Pinctada martensii[J]. Marine Science Bulletin, 2008, 10(2): 68–73. |
| [32] |
陈飞飞, 黄桂菊, 陈明强, 等. 合浦珠母贝三亚养殖群体生长性状的相关与通径分析[J].
广东农业科学, 2012: 122–125.
CHEN F F, HUANG G J, CHEN M Q, et al. Correlation and path analysis of growth-related traits in Sanya cultured population of pearl oyster Pinctada fucata[J]. Guangdong Agricultural Sciences, 2012: 122–125. |
| [33] |
林元震, 陈晓阳. R与ASReml-R统计分析教程[M]. 北京: 中国林业出版社, 2012: 175-178.
LIN Y Z, CHEN X Y. R & ASReml-R statistical analysis tutorial[M]. Beijing: China Forestry Press, 2012: 175-178. |
2. South China Sea Resource Exploitation and Protection Collaborative Innovation Center (SCS-REPIC), South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, Guangdong, China;
3. Plant Protection and Agricultural Environment General Station of Guangzhou, Guangzhou 510450, Guangdong, China
 2017,
Vol. 26
2017,
Vol. 26


