2. Department of Molecular Membrane Biology, Max Planck Institute of Biophysics, 60438 Frankfurt am Main, Germany;
3. 中国科学院植物研究所, 北京 100093
白斑综合征病毒 (White spot syndrome virus,WSSV) 自1992年在中国台湾被发现以来,相继在中国大陆、泰国、印度、法国、美国、韩国、日本等地暴发[1-6],给世界各国对虾养殖业造成了严重的经济损失[7-8]。WSSV不仅可以感染对虾,还可以感染淡水螯虾、龙虾、螃蟹等海洋甲壳类动物[9],3~10 d内可造成对虾100%死亡[10]。WSSV的核酸为一大的双链环状DNA,分子长度为305 kbp,约有181个开放阅读框[11]。目前已得到中国大陆株、台湾株、韩国株和泰国株四株WSSV的全基因组序列[11-14]。虽然关于WSSV的研究仍在不断发展,但是WSSV的致病机理至今尚未清楚,因此仍没有针对病毒有效的阻断或防治手段,所以早期预防显得十分重要。
2000年,VENEGAS等[15]发现感染WSSV后存活下来的虾再次用WSSV攻毒,存活率会大大提高,与免疫反应具有相似性。2001年,HULTEN等[16]证明VP28蛋白在感染宿主的过程中起着关键性的作用。2004年,WITTEVELDT等[17]首次将大肠杆菌表达的VP28蛋白饲喂对虾,再攻毒,明显提高了成活率。此后VP28被多次证明可以保护对虾免受WSSV的感染,也先后在多种表达系统中表达。而蓝藻作为对虾的开口饵料具有重组表达VP28口服疫苗的优势。JIA等[18]将表达VP28的鱼腥藻7120(Anabaena sp. PCC 7120) 作为口服疫苗投喂仔虾后攻毒,成活率为68%。说明转VP28基因的蓝藻可以作为幼虾的口服疫苗,可以使对虾具有抵御WSSV的能力。
目前为止有关转基因蓝藻的高密度表达培养和外源基因表达规律方面的研究报道不多,所以针对外源基因表达量的定量研究显得尤为重要。由于大肠杆菌和蓝藻同为原核表达系统,所以我们构建大肠杆菌原核表达载体,重组表达VP28蛋白,纯化后作为定量Western的标准品,梯度稀释建立标准曲线,以此来测定转VP28基因蓝藻——鱼腥藻7120中VP28蛋白的绝对表达量。期望在蛋白水平上确定转VP28基因鱼腥藻7120的表达情况,为确定后续投喂口服疫苗的有效剂量和高效表达培养奠定基础。
1 材料与方法 1.1 材料转VP28基因鱼腥藻7120由中国科学院植物研究所提供。Bradford蛋白定量试剂盒、卡那霉素购自上海生工;克隆菌株DH5α、表达菌株BL21(DE3)、DNA纯化试剂盒、质粒提取试剂盒、2×PCR Master Mix、IPTG均购自天根生化科技 (北京) 有限公司;pET-28a (+) 表达载体购自上海中科新生命公司;T4 DNA连接酶、限制性内切酶购自TaKaRa公司;Goat Anti-Mouse IgG (H+L)-HRP二抗购自北京全式金生物有限公司。
1.2 方法 1.2.1 表达载体pET-28a-VP28的构建由于VP28的5′端是个疏水的跨膜区,并含有一个预测的信号肽,所以将VP28基因序列密码子优化后合成:ATGGATTTGTCCTTTACCCTGTCCGTAGTTAGCGCCATCCTGGCCATCACAGCGGTGATTGCGGTCTTTATTGTTATCTTTCGTTATCACAACACCGTGACTAAAACCATTGAAACCCATACTGATAACATTGAAACCAATATGGATGAAAACCTGCGTATTCCGGTTACGGCCGAAGTGGGGTCAGGCTATTTCAAAATGACGGATGTCTCATTCGATAGCGATACCTTAGGGAAAATTAAGATCCGTAACGGTAAAAGCGATGCGCAGATGAAAGAAGAAGACGCGGACTTAGTTATTACGCCCGTCGAAGGCCGTGCACTGGAAGTTACCGTAGGTCAGAATCTGACTTTTGAAGGCACGTTTAAAGTGTGGAATAATACGAGCCGTAAAATCAACATTACCGGTATGCAGATGGTACCGAAAATTAATCCAAGTAAAGCATTCGTCGGTTCGAGCAATACGAGTAGCTTTACGCCCGTTTCAATCGACGAGGATGAGGTGGGCACCTTCGTTTGTGGTACCACCTTCGGAGCGCCGATCGCCGCGACGGCGGGCGGTAATCTGTTCGATATGTACGTTCATGTCACATATTCGGGCACGGAGACAGAATAA。
根据VP28基因CDS序列和pET-28a (+) 表达载体的多克隆位点,设计特异性PCR引物:正向引物VP28-F1:5′ CATATCCATATGGATTTGTCCTTTACCCTGTC 3′;反向引物VP28-R1:5′ AATCACCTCGAGTTATTCTGTCTCCGTGCCCGAATA 3′;其中F1中含有NdeⅠ酶切位点;R1中含有XhoⅠ酶切位点。引物由上海生工生物工程有限公司合成。
根据说明书要求,采用2×PCR Master Mix (天根)50 μL反应体系扩增目的片段。反应条件:94 ℃ 5 min;94 ℃ 1 min,58 ℃ 30 s,72 ℃ 1 min,29个循环;72 ℃ 7 min;4 ℃保存。反应结束后,取10 μL进行1.0% Agarose电泳鉴定。
鉴定正确后,采用DNA纯化试剂盒纯化。按照常规分子克隆方法,将VP28 PCR产物、pET-28a (+) 载体进行NdeⅠ、XhoⅠ双酶切。DNA纯化试剂盒纯化回收酶切产物,T4 DNA连接酶22 ℃连接16 h。连接产物转化DH5α感受态细胞,涂布于含50 μg/mL Kana的LB平板,37 ℃倒置培养过夜。菌落PCR筛选阳性克隆,再提取重组质粒进行酶切鉴定并送至上海生工生物工程公司测序验证。
1.2.2 pET-28a-VP28在大肠杆菌中的表达将验证正确的重组质粒pET-28a-VP28转化至大肠杆菌BL21(DE3),挑取转化平板上的单克隆接种于含50 μg/mL卡那霉素的3 mL LB培养液的试管中,37 ℃ 220 r/min振摇过夜;次日按1:100接种于含50 μg/mL卡那霉素的30 mL LB培养液中,37 ℃ 220 r/min振摇至菌体OD600为0.4 (约2 h),加入IPTG至终浓度为0.5 mmol/L,37 ℃ 220 r/min振摇4 h,诱导表达;取出1 mL培养物,将表达菌体重悬于400 μL Ni-IDA Binding-Buffer (20 mmol/L Tris-HCl,5 mmol/L咪唑,0.5 mol/L NaCl,pH 8.0);重悬液进行超声波破碎 (冰浴中进行):功率100 W,工作4 s,间歇8 s,共10 min;超声破碎液4 ℃ 12 000 g离心20 min,取10 μL上清液加入等量的2×上样缓冲液,沉淀用400 μL 1×上样缓冲液重悬后取5 μL,恒压150 V进行12% SDS-PAGE。
1.2.3 VP28-His包涵体蛋白的纯化及SDS-PAGE检测将1 L诱导表达的培养菌体沉淀用20 mL Ni-IDA Binding-Buffer重悬后,超声破碎 (功率200 W,工作4 s,间歇8 s,共20 min),4 ℃ 12 000 g离心20 min,收集沉淀;沉淀连续用2、3、4和6 mol/L尿素重悬后充分溶解,4 ℃ 12 000 g离心15 min,收集沉淀;向沉淀中加入50 mmol/L Tris-HCl,重悬后充分溶解,4 ℃ 12 000 g离心15 min,收集沉淀;再向沉淀中加入8 mol/L尿素,重悬后充分溶解,4 ℃ 12 000 g离心15 min,取上清;利用Biologic LP层析系统,上清液以0.5 mL/min流速上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和层析柱;用Ni-IDA Binding-Buffer以0.5 mL/min流速冲洗,至流出液OD280到达基线;连续用含有10、20、50和250 mmol/L咪唑的Ni-IDA Washing-Buffer (20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH 8.0) 以1 mL/min流速冲洗,至流出液OD280到达基线;洗脱目的蛋白,收集流出液;进行12% SDS-PAGE分析。
1.2.4 转基因鱼腥藻7120中VP28表达量的定量检测将纯化和筛选后的转基因鱼腥藻7120以1:50的比例接种,设置3个平行。分别采集3个批次的转基因鱼腥藻7120接种后第1、3、5、7、9、11、13、15、17、19、21、23天的藻液,使用分光光度计测定其OD750值,绘制生长曲线。同时冻融法提取藻样的总蛋白,Bradford法测定总蛋白浓度后-80 ℃保存,用以测定不同时期藻体中VP28蛋白的表达量。
大肠杆菌中表达并纯化的重组VP28蛋白分别上样0.05、0.1、0.25、0.5、1和2 μg,作为定量Western的标准曲线。一抗为1:10 000的本实验室制备的抗VP28多肽单克隆抗体,二抗为1:5 000辣根过氧化物酶标记羊抗鼠抗体。使用ChemiDoc MP Imaging System (Bio-Rad) 检测条带发光信号强度,Image Lab软件计算蓝藻中重组表达的VP28的含量。转VP28鱼腥藻7120中表达的VP28蛋白与标准品pET-28a-VP28进行比较定量。
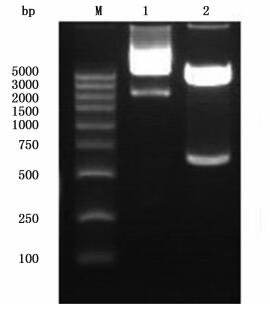
2 结果 2.1 重组质粒pET-28a-VP28的构建经琼脂糖凝胶电泳检测,重组质粒大小为5 910 bp,经NdeⅠ、XhoⅠ双酶切后,分子量大小为5 289 bp和621 bp,与预期大小一致,结果表明重组质粒构建成功 (图 1)。为确保序列的正确性,经双酶切验证的重组质粒送至上海生工生物工程有限公司测序,测序结果显示VP28序列正确。
|
图 1 琼脂糖凝胶电泳检测图
Fig. 1 Electropho-retogram of agarose gel detection
M.DNA分子量标准;1.重组质粒pET-28a-VP28(5 910 bp);2.pET-28a-VP28 Nde Ⅰ、XhoⅠ双酶切产物 M.DNA marker; 1.pET-28a-VP28 recombinant plasmid (5 910 bp); 2.pET-28a-VP28 NdeⅠ and XhoⅠ double digestion products |
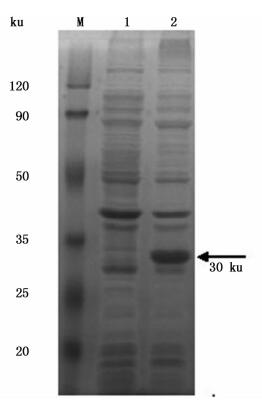
蛋白质分子量预测显示,VP28-His融合蛋白预期分子量约为30 ku左右。SDS-PAGE检测结果显示,分子量大小与预期一致 (图 2),并且VP28主要以包涵体的形式表达 (图 3)。
|
图 2 SDS-PAGE检测pET-28a-VP28的诱导表达
Fig. 2 pET-28a-VP28 induced expression detection
M.蛋白质分子量标准;1.未诱导全菌;2.诱导全菌;箭头指示VP28-His融合蛋白 M.Protein marker; 1.Total protein of non-induced pET-28a-VP28; 2.Total protein of induced pET-28a-VP28 vector; Arrows indicate VP28-His fusion protein |
|
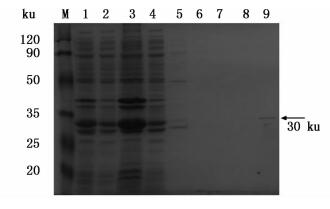
图 3 SDS-PAGE检测VP28-His包涵体纯化
Fig. 3 SDS-PAGE detection of VP28-His inclusion body purification
M.蛋白质分子量标准;1.全菌;2.破碎后上清;3.破碎后沉淀;4.流出液;5.结合缓冲液洗脱;6.10 mmol/L洗脱缓冲液洗脱;7.20 mmol/L洗脱缓冲液洗脱;8.50 mmol/L洗脱缓冲液洗脱;9.250 mmol/L洗脱缓冲液洗脱。箭头指示VP28-His融合蛋白 M.Protein marker; 1. Total protein of induced pET-28a-VP28; 2.Supernatant protein of induced pET-28a-VP28; 3. Pellet protein of induced pET-28a-VP28; 4.Effluent; 5.Elution with Binding Buffer; 6.Elution with Washing Buffer (10 mmol/L); 7.Elution with Washing Buffer (20 mmol/L); 8.Elution with Washing Buffer (50 mmol/L); 9.Elution with Washing Buffer (250 mmol/L). Arrows indicate VP28-His fusion protein |
融合蛋白包涵体经尿素洗涤、溶解后,利用Biologic LP层析系统,将上清液通过镍琼脂糖亲和层析柱 (Ni-IDA-Sepharose CL-6B) 纯化,经结合缓冲液和含有10、20、50和250 mmol/L咪唑的洗脱缓冲液洗脱,最终获得目的蛋白 (图 3),SDS-PAGE检测其纯度为95%。
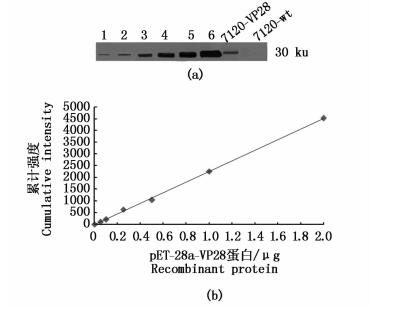
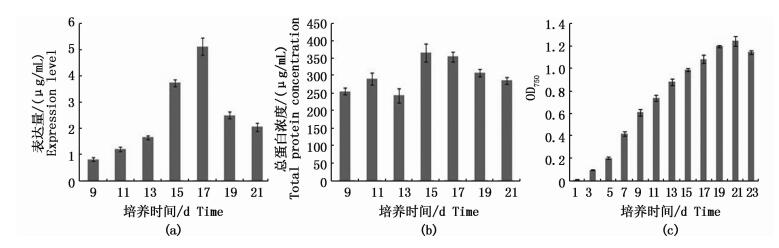
2.4 不同生长时期转基因鱼腥藻7120中VP28表达量、总蛋白变化和生长曲线转VP28鱼腥藻7120中的VP28表达量通过使用ChemiDoc MP Imaging System (Bio-Rad) 的Image Lab 5.2软件建立标准曲线 (图 4) 进行计算。结果显示转VP28鱼腥藻7120在培养第17天表达量最高,为5.14 μg/mL,占总蛋白浓度的1.45%(图 5a)。总蛋白浓度第15天最高,为365.9 μg/mL (图 5b),培养第21天生长量最大,OD750值为1.25(图 5c)。
|
图 4 定量Western Blotting标准曲线
Fig. 4 The standard curve of quantitative Western Blotting
1.已纯化重组蛋白0.05 μg;2.已纯化重组蛋白0.1 μg; 3.已纯化重组蛋白0.25 μg; 4.已纯化重组蛋白0.5 μg;5.已纯化重组蛋白1 μg;6.已纯化重组蛋白2 μg;7120-VP28.转VP28鱼腥藻7120;7120-wt.野生型鱼腥藻7120 1. purified pET-28a-VP28 protein 0.05 μg; 2.purified pET-28a-VP28 protein 0.1 μg; 3. purified pET-28a-VP28 protein 0.25μg; 4. purified pET-28a-VP28 protein 0.5 μg; 5. purified pET-28a-VP28 protein 1μg; 6.purified pET-28a-VP28 protein 2 μg; 7120-VP28. recombinant cyanobacteria with VP28 gene; 7120-wt.7120 wild type |
|
图 5 不同生长时期转基因鱼腥藻7120中VP28表达量、总蛋白浓度和生长曲线的变化
Fig. 5 The expression level of VP28, protein concentration and growth curve of transgenic strain in different periods
|
对虾已成为人类开发海洋生产食物的首选对象之一,虽然我国的对虾产量已居全球前列,但是由于病害造成的损失也是名列前茅,其中危害最严重的是白斑综合征病毒 (WSSV)。多年来只能改养抗病强的品种、筛选无病毒的虾苗、改善养殖措施和环境等,减少WSSV的感染。一旦感染,尚未见到在规模养殖中应用有效防治的药物,这已成为世界难题。将WSSV重组囊膜蛋白导入对虾体内防控WSSV的策略,成为近年研究的热点,其中尤以WSSV主要囊膜蛋白VP28研究居多。
蓝藻作为光合自养的原核生物,易于进行遗传操作,且多数不含内毒素,含蛋白酶较少,还可以作为对虾幼体时期的开口饵料,使蓝藻作为VP28蛋白的表达系统具有天然的优势。虽然已在丝状体蓝藻——鱼腥藻7120中成功表达了VP28基因,但是有关转VP28基因鱼腥藻7120的高密度表达培养和VP28表达规律方面的研究并不深入。而定量检测VP28的表达量是提高表达率、探索表达规律和最适诱导表达条件的基础,所以本文构建大肠杆菌重组质粒pET-28a-VP28原核表达VP28蛋白,经IPTG诱导,Ni-IDA-Sepharose CL-6B亲和层析柱纯化,获得了纯度为95%的目的蛋白。已纯化重组蛋白分别上样0.05、0.1、0.25、0.5、1和2 μg,作为横坐标,Chemi-Doc MP Imaging System成像仪检测的信号累计强度作为纵坐标,制作绝对定量Western的标准曲线,通过标准曲线来检测待测转基因鱼腥藻7120的VP28蛋白的绝对表达量。
实验结果表明,大肠杆菌表达的重组蛋白与鱼腥藻7120中表达的VP28分子量基本相同,纯化后的大肠杆菌重组蛋白梯度稀释作为绝对定量Western标准曲线,计算出转基因鱼腥藻7120随着时间的增长,VP28表达量逐渐增加,直至第17天达到最大表达量,为5.14 μg/mL,占总蛋白的1.45%。通过与总蛋白和生长曲线对比可以发现,此时既不是生长量最大 (第21天),也不是总蛋白浓度最大 (第15天),但却是VP28表达量最高的时期。由此可见,表达量和生长量以及总蛋白均不是协同关系,这有可能是因为此时的叶绿素含量增加,总蛋白加快合成从而影响了VP28蛋白的表达率。生长后期表达量下降可能是因为培养密度过高,培养液不足造成的。所以研究表达规律,确定其最大表达量的生长期,定期更换培养液,合理优化培养密度是十分必要的。绝对定量方法的建立不仅对转基因蓝藻的高效培养具有重要意义,也为日后确定投喂口服疫苗有效剂量防治白斑综合征奠定了基础。
| [1] | ZHAN W B, WANG Y H, FRYER J L, et al. White spot syndrome virus infection of cultured shrimp in China[J]. Journal of Aquatic Animal Health, 1998, 10(4): 405–410. DOI:10.1577/1548-8667(1998)010<0405:WSSVIO>2.0.CO;2 |
| [2] | LO C F, LEU J H, HO C H, et al. Detection of baculovirus associated with white spot syndrome (WSBV) in Penaeid shrimps using polymerase chain reaction[J]. Diseases of Aquatic Organisms, 1996, 25(1/2): 133–141. |
| [3] | KARUNASAGAR I, OTTAS K, KARUNASAGAR I. Histopathological and bacteriological study of white spot syndrome of Penaeus monodon along the west coast of India[J]. Aquaculture, 1997, 153(1/2): 9–13. |
| [4] | LIGHTNER D V. A handbook of shrimp pathology and diagnostic procedures for diseases of cultured Penaeid shrimp[M]. Baton Rouge, Louisiana, USA: World Aquaculture Society, 1996: 1-15. |
| [5] | PARK J H, LEE Y S, LEE S, et al. An infectious viral disease of penaeid shrimp newly found in Korea[J]. Diseases of Aquatic Organisms, 1998, 34(1): 71–75. |
| [6] | INOUYE K, MIWA S, OSEKO N, et al. Mass mortalities of cultured kuruma shrimp Penaeus japonicus in Japan in 1993:electron microscopic evidence of the causative virus[J]. Fish Pathology, 1994, 29(2): 149–158. DOI:10.3147/jsfp.29.149 |
| [7] | ESCOBEDO-BONILLA C M, ALDAY-SANZ V, WILLE M, et al. A review on the morphology, molecular characterization, morphogenesis and pathogenesis of white spot syndrome virus[J]. Journal of Fish Diseases, 2008, 31(1): 1–18. |
| [8] | LIGHTNER D V. Virus diseases of farmed shrimp in the Western Hemisphere (the Americas):a review[J]. Journal of Invertebrate Pathology, 2011, 106(1): 110–130. DOI:10.1016/j.jip.2010.09.012 |
| [9] | HAQ M B, VIGNESH R, SRINIVASAN M. Deep insight into white spot syndrome virus vaccines:a review[J]. Asian Pacific Journal of Tropical Disease, 2012, 2(1): 73–77. DOI:10.1016/S2222-1808(12)60018-8 |
| [10] | PRADEEP B, RAI P, MOHAN S A, et al. Biology, host range, pathogenesis and diagnosis of White spot syndrome virus[J]. Indian Journal of Virology, 2012, 23(2): 161–174. DOI:10.1007/s13337-012-0079-y |
| [11] | YANG F, HE J, LIN X H, et al. Complete genome sequence of the shrimp white spot bacilliform virus[J]. Journal of Virology, 2001, 75(23): 11811–11820. DOI:10.1128/JVI.75.23.11811-11820.2001 |
| [12] | TSAI M F, LO C F, VAN HULTEN M C W, et al. Transcriptional analysis of the ribonucleotide reductase genes of shrimp white spot syndrome virus[J]. Virology, 2000, 277(1): 92–99. DOI:10.1006/viro.2000.0596 |
| [13] | CHAI C Y, YOON J, LEE Y S, et al. Analysis of the complete nucleotide sequence of a white spot syndrome virus isolated from Pacific white shrimp[J]. Journal of Microbiology, 2013, 51(5): 695–699. DOI:10.1007/s12275-013-3171-0 |
| [14] | VAN HULTEN M C W, WITTEVELDT J, PETERS S, et al. The white spot syndrome virus DNA genome sequence[J]. Virology, 2001, 286(1): 7–22. DOI:10.1006/viro.2001.1002 |
| [15] | VENEGAS C A, NONAKA L, MUSHIAKE K, et al. Quasi-immune response of Penaeus japonicus to penaeid rod-shaped DNA virus (PRDV)[J]. Diseases of Aquatic Organisms, 2000, 42(2): 83–89. |
| [16] | VAN HULTEN M C W, WITTEVELDT J, SNIPPE M, et al. White spot syndrome virus envelope protein VP28 is involved in the systemic infection of shrimp[J]. Virology, 2001, 285(2): 228–233. DOI:10.1006/viro.2001.0928 |
| [17] | WITTEVELDT J, VLAK J M, VAN HULTEN M C W. Protection of Penaeus monodon against white spot syndrome virus using a WSSV subunit vaccine[J]. Fish & Shellfish Immunology, 2004, 16(5): 571–579. |
| [18] | JIA X H, ZHANG C L, SHI D J, et al. Oral administration of Anabaena--expressed VP28 for both drug and food against white spot syndrome virus in shrimp[J]. Journal of Applied Phycology, 2016, 28(2): 1001–1009. DOI:10.1007/s10811-015-0607-4 |
2. Department of Molecular Membrane Biology, Max Planck Institute of Biophysics, 60438 Frankfurt am Main, Germany;
3. Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China
 2017,
Vol. 26
2017,
Vol. 26


