2. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
3. 美国威斯康辛大学麦迪逊分校 食品科学学院, 麦迪逊 53706
目前的水产养殖业中,鱼体脂肪的过度沉积已成为影响其可持续发展的一个重要因素,而营养途径是调控养殖鱼类脂肪沉积的根本途径。鱼蛋白水解物在水产饲料中不但具有诱食、促生长及免疫调节等作用[1-3],近几年的研究还发现,水解鱼蛋白具有较好的降低脂肪沉积的作用[4-5],这为通过营养途径调控养殖鱼类脂肪沉积提供了新的思路。
牛磺酸是水解鱼蛋白富含的小分子物质之一,相关研究已表明牛磺酸在动物脂类代谢中起着重要作用,是水解鱼蛋白中起脂类代谢调节作用的主要功能物质之一[2, 6]。近年来,国内外学者对大西洋鲑(Salmo salar) [7] 、牙鲆(Paralichthys olivaceus)[8-9]、欧洲黑鲈(Dentex dentex)[10]等鱼类的研究表明,饲料中(尤其是在高植物蛋白饲料中)添加牛磺酸可以降低鱼体的脂肪含量,主要通过络合胆汁酸刺激胆汁酸的分泌来调节脂肪代谢。
本研究以大菱鲆为研究对象,通过摄食生长实验来研究在高植物蛋白饲料中添加牛磺酸或者同时使用牛磺酸和水解鱼蛋白对鱼体脂肪累积的影响。
1 材料与方法 1.1 水解鱼蛋白的制备本实验鱼水解蛋白的用鱼为太平洋狭鳕(Theragra chalcogramma,太平洋恩利食品有限公司),鱼水解蛋白的制备参考ZHENG等[11]的方法,选用两种蛋白酶即碱性蛋白酶和风味蛋白酶进行双酶水解,经离心得到粗滤酶解液。将所得酶解液用Pellicon 2超滤膜堆装置(1 000 u)超滤,超滤得到的低分子FPH,使用旋转蒸发仪(BUCHI)浓缩得到浓缩液,然后冷冻干燥后保存备用。
依据ZHENG等[11]的方法,利用高效液相色谱仪测定水解蛋白的分子量(色谱仪Agilent 1200,色谱柱TSK G2000,波长220 nm)。选用碳酸酐酶(MW 29000)、细胞色素C(MW12400)、抑肽酶(MW6511.44)、人血管紧张素Ⅱ(MW1046.18)、谷胱甘肽(MW 307.32)、乙氨酸-乙氨酸-乙氨酸(MW189)和甘氨酸(MW75.07)为标准品作标准曲线,测得低分子水解鱼蛋白的分子量分布为:5 000~10 000 u,0.2%;2 000~5 000 u,1.14%;1 000~2 000 u,5.21%;5 00~1 000 u,21.34%;200~500 u,56.64%;100~200 u,3.66%;<100 u,11.82%。
1.2 实验饲料本实验以鱼粉、植物蛋白(豆粕、玉米蛋白粉、谷朊粉)为蛋白源,以鱼油为脂肪源,制作成3种等氮、等能的饲料(表 1)。以含30%鱼粉的基础饲料为对照组,简称C。通过使用豆粕、玉米蛋白粉和谷朊粉来替代基础饲料中15%的鱼粉(约10%鱼粉蛋白),并添加0.8%的牛磺酸制成第一种实验饲料,即高植物蛋白饲料中添加牛磺酸,简称饲料HT(high plant protein diet with taurine)。以饲料HT为基础,继续添加低分子水解鱼蛋白来替代HT饲料7%鱼粉(约5%鱼粉蛋白),得到第二种实验饲料,简称HTPH(high plant protein diet with taurine and fish protein hydrolysate)。所有原料粉碎过80目筛,按照饲料配方(表 1)将原料混合,制成粒径3 mm的饲料,放于55 ℃烘箱中12 h烘干,然后保存于-20 ℃冰箱备用。

|
表 1 饲料配方与化学组成 Tab.1 Formulation and chemical composition of the experimental diets |
实验用鱼选用初始体质量为(4.16±0.01)g的大菱鲆幼鱼,由烟台开发区天源水产有限公司提供。实验开始前,先将鱼苗在实验系统内暂养两周使其适应养殖环境。养殖实验在室内流水(海水,流速为5 L/min)养殖系统内进行,养殖容器为水体体积为120 L的玻璃钢桶,养殖用水为深井海水,室内自然采光,连续充气,水温(14±0.5)℃,溶氧高于7 mg/L,盐度30±0.5,pH 7.5~8.0。生长实验开始时,停食24 h,选择大小均匀、体格健壮且体表无病的大菱鲆幼鱼,称重后随机分配在12个玻璃钢桶内(3个处理组,每组4个重复),每桶25尾鱼,每天用实验饲料饱食投喂两次(6:30和16:30),养殖周期为12周。
1.4 样品采集及检测分析实验结束时,停食24 h,每桶随机取3尾鱼,保存于-20 ℃用于鱼体脂肪及水分分析;每桶另外随机取3尾鱼,用27号针和1 mL注射器,从尾部尾静脉取血,血液放入消过毒的离心管后,盖上盖子,室温凝结2 h后4 ℃凝结4~6 h; 836 × g,4 ℃ 离心10 min,将血清吸出,-80 ℃保存备用。取完血后,取肌肉、肝脏及内脏用于脂肪及脂肪酸成分分析,样品保存于-80 ℃备用。
饲料和鱼体样品在105 ℃烘干至恒重,通过失重法测定水分含量。鱼体、肌肉及内脏脂肪含量使用索氏抽提法测定;肝脏脂肪含量采用氯仿甲醇法测定。中性脂和极性脂的测定亦采用氯仿甲醇法[用V(氯仿)∶V(甲醇)=2∶1 的混合液萃取,1.6%的CaCl2溶液分层,氮气吹干,每份样品2个平行]。使用南京建成生物工程研究所的试剂盒测定血清中甘油三酯、胆固醇、高密度脂蛋白胆固醇及低密度脂蛋白胆固醇的含量。鱼体组织的脂肪酸含量测定方法参考MOURENTE等[12]气相色谱法(GS,HP6890,USA)并稍作改进。
1.5 数据计算与统计肥满度、肝脏指数及内脏指数的计算公式如下:
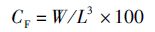 (1)
(1)
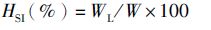 (2)
(2)
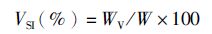 (3)
(3)
式中:CF为肥满度;HSI为肝体比;VSI为脏体比;W为鱼体湿质量(g);L为体长(cm);WL为肝脏湿质量(g);WV为内脏湿质量(g)。
用SPSS 16.0统计软件对实验各处理的数据进行单因素方差分析(ANOVA),当不同处理之间存在显著差异(P< 0.05)时,采用Tukey法进行均值间多重比较,所有数值用平均值±标准误表示。
2 结果 2.1 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆脂肪含量的影响 2.1.1 对大菱鲆鱼体脂肪含量及形体指标的影响由表 2可见,鱼体脂肪含量及鱼体极性脂含量在对照组(C)、HT组及HTPH组都没有显著性差异。但是,与对照组相比,HTPH组显著降低了鱼体中性脂含量(P<0.01)。与对照组相比,HT组及HTPH组都显著升高了鱼体水分含量,但是鱼体水分含量在HT组及HTPH组间没有显著性差异。HT组肝体比显著高于HTPH处理组(P< 0.05)。而肝体比在对照组与HT组之间以及对照组与HTPH组之间均没有显著性差异(P>0.05)。

|
表 2 高植物蛋白饲料中添加牛磺酸及水解鱼蛋白对大菱鲆鱼体脂肪含量及形体指标的影响(n=4) Tab.2 Effects of taurine and fish protein hydrolysate in high plant protein diets on the lipid content and physical indices of turbot(n=4) |
与对照组相比,HT组及HTPH处理组显著降低了肝脏脂肪含量及中性脂含量(P<0.01),见表 3。但是,极性脂在各处理组间没有显著性差异(P>0.05)。

|
表 3 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆肝脏脂肪含量的影响(n=4,%湿重) Tab.3 Effects of taurine and fish protein hydrolysate in high plant protein diets on the liver lipid compositions of turbot(n=4,%wet weight) |
HTPH处理组的肌肉脂肪含量显著低于对照组及HT组(P< 0.05),见表 4,但HT组及对照组之间没有显著性差异(P>0.05)。HTPH处理组的肌肉极性脂肪含量显著低于对照组(P< 0.05),但HT组及对照组之间以及HT组与HTPH组之间均没有显著性差异(P>0.05)。肌肉中性脂含量在各处理组间没有显著性差异(P>0.05)。

|
表 4 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆肌肉脂肪含量的影响(n=4,%干重) Tab.4 Effects of taurine and fish protein hydrolysate in high plant protein diets on the muscle lipid compositions of turbot(n=4,%dry weight) |
高植物蛋白饲料中牛磺酸及鱼蛋白水解物的添加对大菱鲆内脏脂肪含量、中性脂含量及极性脂含量均没有产生显著性影响(P>0.05),见表 5。

|
表 5 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆内脏脂肪含量的影响(n=4,%湿重) Tab.5 Effects of taurine and fish protein hydrolysate in high plant protein diets on the gut lipid compositions of turbot(n=4,%wet weight) |
HTPH组血清甘油三酯的含量显著低于对照组及HT组(P<0.01,表 6),但是血清甘油三酯在对照组及HT组间没有显著性差异(P>0.05)。血清胆固醇及血清低密度脂蛋白胆固醇受饲料处理影响的趋势与血清甘油三酯类似,但血清高密度脂蛋白胆固醇在各饲料处理间没有显著性差异(P>0.05)。

|
表 6 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆血清脂肪含量的影响(n=4) Tab.6 Effects of taurine and fish protein hydrolysate in high plant protein diets on the serum lipid compositions of turbot(n=4) |
对鱼体全鱼脂肪酸组成来说,HTPH组C18∶3n-6含量显著高于对照组及HT组(P<0.01),见表 7,而HT组的C20∶1n-9含量显著低于其他两组(P<0.01)。C20∶4n-6含量在对照组、HT组、HTPH组依次显著降低(P<0.01)。C22∶6n-3含量在HTPH组显著低于HT组及对照组(P<0.01)。对照组的n-3/n-6脂肪酸比例显著高于HT组及HTPH组。

|
表 7 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆全鱼脂肪酸组成的影响(n=4,%总脂肪酸) Tab.7 Effects of taurine and fish protein hydrolysate in high plant protein diets on the whole body fatty acid profiles of turbot(n=4,%total fatty acids) |
对肝脏脂肪酸来说,对照组C18∶1n-7、C20∶1n-9、C22∶5n-3含量及n-3/n-6值显著高于HT组及HTPH组(P<0.05),见表 8,而其C18∶2n-6、C18∶3n-3及n-6系列脂肪酸含量则显著低于HT组及HTPH组。HTPH组的C22∶6n-3及n-3系列长链多不饱和脂肪酸含量显著低于对照组(P<0.05),但HTPH与HT组之间及HT组与对照组之间没有显著性差异(P>0.05)。

|
表 8 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆肝脏脂肪酸组成的影响(n=4,%总脂肪酸) Tab.8 Effects of taurine and fish protein hydrolysate in high plant protein diets on the liver fatty acid profiles of turbot(n=4,%total fatty acids) |
对肌肉脂肪酸来说,HTPH组C14∶0、C16∶0、饱和脂肪酸含量及C18∶3n-6含量显著高于对照组及HT组,而其n-3脂肪酸含量及n-3长链多不饱和脂肪酸含量显著低于对照组及HT组(P<0.05),见表 9。肌肉C18∶2n-6及C20∶4n-6含量在对照组、HT组及HTPH组依次显著升高(P<0.01)。肌肉C20∶1n-9含量及n-3/n-6脂肪酸比例在HTPH组显著低于对照组,而n-6系列脂肪酸含量则显著高于对照组。对照组C20∶5n-3含量显著高于其他两个处理组。

|
表 9 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆肌肉脂肪酸组成的影响(n=4,%总脂肪酸) Tab.9 Effects of taurine and fish protein hydrolysate in high plant protein diets on the muscle fatty acid profiles of turbot(n=4,%total fatty acids) |
对肠道脂肪酸来说,C14∶0在HT组显著低于对照组(P<0.05),见表 10。HTPH组的肠道C18∶2n-6含量显著高于对照组及HT组(P<0.01),但其C18∶3n-6及C20∶1n-9含量仅显著高于HT组(P<0.05)。HT组的C18∶3n-3含量显著低于对照组及HTPH组(P<0.05)。C22∶5n-3在对照组、HT组及HTPH组依次显著降低(P<0.01),而C22∶6n-3、n-3系列脂肪酸及n-3长链多不饱和脂肪酸含量则在HT组显著高于对照组及HTPH组(P<0.01)。HTPH组的n-6系列脂肪酸含量显著高于对照组(P<0.05)。HT组的n-3/n-6脂肪酸比例显著高于HTPH组。

|
表 10 高植物蛋白饲料中牛磺酸及鱼蛋白水解物对大菱鲆肠道脂肪酸组成的影响(n=4,%总脂肪酸) Tab.10 Effects of taurine and fish protein hydrolysate in high plant protein diets on the intestine fatty acid profiles of turbot(n=4,%total fatty acids) |
目前关于水产饲料中降脂剂的研究还非常有限,仅在肉碱、谷氨酰胺及中草药等方面零星开展,仍缺乏系统而有序的研究。本实验研究结果表明,通过在高植物蛋白饲料中添加牛磺酸对大菱鲆肝脏脂肪产生了调节作用,有效降低了肝脏脂肪含量。这表明,在当前实验条件下,使用高植物蛋白饲料+牛磺酸的方式降低鱼体肝脏含量是可行的,这为通过饲料途径降低肝脏脂肪过度累积,维护肝脏健康提供了新的思路。牛磺酸调节鱼体脂肪代谢的作用在其他鱼上也得到过验证。ESPE等[5]对大西洋鲑的研究发现,在高植物蛋白含量的饲料中添加1 g/kg牛磺酸能够显著降低鱼体的脂肪蛋白比例,这主要跟机体脂肪的显著降低有关。KIM等[8-9]在牙鲆上的研究发现饲料中的牛磺酸能够络合胆汁酸,从而刺激胆汁酸的分泌,而胆汁酸的分泌增加会通过“G蛋白-胆汁酸受体TGR5-环腺苷酸cAMP-甲状腺激活酶D2”途径增加脂肪酸的氧化和能量消耗[13-17],从而调节脂肪代谢。CHATZIFOTIS等[10]在欧洲黑鲈上的研究也发现饲料中添加2 g/kg的牛磺酸能够显著提高胆汁酸盐激活的脂肪酶的活性。
另外,还有一些实验间接地证明了牛磺酸调节脂肪代谢的作用。ESPE等[18]在大西洋鲑上的另一项研究则表明,当给大西洋鲑投喂蛋氨酸缺乏的饲料时,因为蛋氨酸代谢的终产物是牛磺酸,因此导致了鱼体肝脏中牛磺酸含量锐减,而甘油三酯含量上升,这从侧面印证了牛磺酸同鱼体脂肪代谢间的关系。蛋氨酸降低脂肪生成酶及甘油三酯含量的作用在DIAS等[19]关于欧洲黑鲈上的实验中也得到了证明。然而,该领域也有一些研究得到了不同的结论,如GAYLORD等研究表明,调节虹鳟脂肪代谢及内脏脂肪含量的是蛋氨酸,但是跟牛磺酸没有关系[21]。在哺乳动物大鼠中,投喂低含量的牛磺酸和甘氨酸时,也观察到了增多的腹部脂肪[4]。虽然本实验的研究结果较为直接地证明了牛磺酸降低鱼体脂肪累积的效果,但是,该领域还需要更多的研究来继续阐明,尤其是对相关机理机制的研究。
本实验中,虽然高植物蛋白饲料中添加牛磺酸起到了一定的降低脂肪沉积的作用,但是,在高植物蛋白饲料中同时使用牛磺酸和水解鱼蛋白的脂肪调节作用更为明显,不但降低了肝脏脂肪,而且对全鱼中性脂肪、肌肉脂肪及血清脂肪都起到了有效的降低作用。因为牛磺酸是水解鱼蛋白中的有效成分之一,因此,该实验结果表明,水解鱼蛋白中起到降低脂肪沉积作用的不仅仅是牛磺酸,还有其他的有效物质。如前段所述,水解鱼蛋白中含量丰富的蛋氨酸可能就是其中一种[18-20]。另外,水解鱼蛋白中含有的其他一些小分子物质如甜菜碱、胆碱、肉毒碱和肌酸也可能对脂肪代谢产生调节,降低脂肪含量[21-23]。鱼蛋白水解物中的这些小分子物质对脂肪沉积的影响主要通过影响鱼体内脂肪的合成。鱼蛋白水解物中的小分子含氮化合物首先影响动物体内牛磺酸和S-腺苷蛋氨酸的合成,而这些小分子物质可能是通过补充动物体内用于甲基化同型半胱氨酸的S-腺苷蛋氨酸消耗,从而可以使更多的S-腺苷蛋氨酸用于其他的代谢途径,例如聚氨的合成[24-25]。聚氨的合成需要消耗乙酰辅酶A和丙二酰辅酶A,而乙酰辅酶A和丙二酰辅酶A作为脂肪的前体物质,导致脂肪合成减少。
本实验中在高植物蛋白饲料中同时使用牛磺酸和水解鱼蛋白还显著降低了血清总胆固醇含量及血清低密度脂蛋白胆固醇的含量。牛磺酸对胆固醇代谢的作用在大菱鲆上的另一项实验中已经得到验证。YUN等[26]发现与单纯添加1.0%胆固醇的饲料处理组相比,添加1.0%胆固醇+1.0%牛磺酸的处理组,其血浆总胆固醇、游离胆固醇及低密度脂蛋白胆固醇都显著降低,其胆固醇合成代谢关键酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMG-CoA)的mRNA表达量也显著降低。但是,本实验中,大菱鲆的内脏脂肪含量并未受到饲料处理的显著影响,这主要是因为在大菱鲆中内脏并不是脂肪蓄积的主要部位。
综合鱼体、肝脏、肌肉及肠道脂肪酸组成来看,高植物蛋白饲料中单独使用牛磺酸或者同时添加牛磺酸和水解鱼蛋白有降低长链多不饱和脂肪酸含量,升高饱和脂肪酸及亚麻酸亚油酸含量的趋势。这可能与高植物蛋白饲料的使用有关,也可能是因为牛磺酸及水解鱼蛋白中的其他小分子物质促进了鱼体对长链脂肪酸的利用。
综上,本实验结果表明,在高植物蛋白饲料中添加牛磺酸可以调节脂肪代谢,降低大菱鲆幼鱼肝脏脂肪累积,但是在添加牛磺酸的基础上继续使用水解鱼蛋白替代鱼粉后,其降低鱼体及组织脂肪累积的效果更佳,能够有效降低鱼体、肝脏、肌肉及血清中的脂肪含量,这也说明水解鱼蛋白中调节脂肪代谢的物质不止牛磺酸一种。
| [1] | CAHU C L, INFANTE J L Z, QUAZUGUEL P, et al.Protein hydrolysate vs. fish meal in compound diets for 10-day old sea bass Dicentrarchus labrax larvae[J]. Aquaculture, 1999, 171(1/2): 109–119. |
| [2] | AKSNES A, HOPE B, HØSTMARK Ø, et al.Inclusion of size fractionated fish hydrolysate in high plant protein diets for Atlantic cod, Gadus morhua[J]. Aquaculture, 2006, 261(3): 1102–1110. DOI:10.1016/j.aquaculture.2006.07.038 |
| [3] | KOTZAMANIS Y P, GISBERT E, GATESOUPE F J, et al.Effects of different dietary levels of fish protein hydrolysates on growth, digestive enzymes, gut microbiota, and resistance to GVibrio anguillarum Gin European sea bass (Dicentrarchus labrax) larvae[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2007, 147(1): 205–214. |
| [4] | LIASET B, MADSEN L, HAO Q, et al.Fish protein hydrolysate elevates plasma bile acids and reduces visceral adipose tissue mass in rats[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2009, 1791(4): 254–262. DOI:10.1016/j.bbalip.2009.01.016 |
| [5] | ESPE M, RUOHONEN K, EL-MOWAFI A.Hydrolysed fish protein concentrate (FPC) reduces viscera mass in Atlantic salmon (Salmo salar) fed plant-protein-based diets[J]. Aquaculture Nutrition, 2012, 18(6): 599–609. DOI:10.1111/anu.2012.18.issue-6 |
| [6] | HUXTABLE R J.Physiological actions of taurine[J]. Physiological Reviews, 1992, 72(1): 101–163. |
| [7] | ESPE M, RUOHONEN K, EL-MOWAFI A.Effect of taurine supplementation on the metabolism and body lipid-to-protein ratio in juvenile Atlantic salmon (Salmo salar)[J]. Aquaculture Research, 2012, 43(3): 349–360. DOI:10.1111/are.2012.43.issue-3 |
| [8] | KIM S K, MATSUNARI H, NOMURA K, et al.Effect of dietary taurine and lipid contents on conjugated bile acid composition and growth performance of juvenile Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2008, 74(4): 875–881. DOI:10.1111/fis.2008.74.issue-4 |
| [9] | KIM S K, MATSUNARI H, TAKEUCHI T, et al.Effect of different dietary taurine levels on the conjugated bile acid composition and growth performance of juvenile and fingerling Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2007, 273(4): 595–601. DOI:10.1016/j.aquaculture.2007.10.031 |
| [10] | CHATZIFOTIS S, POLEMITOU I, DIVANACH P, et al.Effect of dietary taurine supplementation on growth performance and bile salt activated lipase activity of common dentex, Dentex dentex, fed a fish meal/soy protein concentrate-based diet[J]. Aquaculture, 2008, 275(1/4): 201–208. |
| [11] | ZHENG K, LIANG M, YAO H, et al.Effect of dietary fish protein hydrolysate on growth, feed utilization and IGF-I levels of Japanese flounder (Paralichthys olivaceus)[J]. Aquaculture Nutrition, 2012, 18(3): 297–303. DOI:10.1111/anu.2012.18.issue-3 |
| [12] | MOURENTE G, TOCHER D R, DIAZ-SALVAGO E, et al.Study of the n-3 highly unsaturated fatty acids requirement and antioxidant status of Dentex dentex larvae at the Artemia feeding stage[J]. Aquaculture, 1999, 179(1/4): 291–307. |
| [13] | CARULLI N, DE LEON M P, PODDA M, et al.Chenodeoxycholic acid and ursodeoxycholic acid effects in endogenous hypertriglyceridemias[J]. The Journal of Clinical Pharmacology, 1981, 21(10): 436–442. DOI:10.1002/jcph.1981.21.issue-10 |
| [14] | IKEMOTO S, TAKAHASHI M, TSUNODA N, et al.Cholate inhibits high-fat diet-induced hyperglycemia and obesity with acyl-CoA synthetase mRNA decrease[J]. American Journal of Physiology-Endocrinology and Metabolism, 1997, 273(1): E37–E45. |
| [15] | KAST H R, NGUYEN C M, SINAL C J, et al.Farnesoid X-activated receptor induces apolipoprotein C-II transcription: a molecular mechanism linking plasma triglyceride levels to bile acids[J]. Molecular Endocrinology, 2001, 15(10): 1720–1728. DOI:10.1210/mend.15.10.0712 |
| [16] | WATANABE M, HOUTEN S M, WANG L, et al.Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-1c[J]. The Journal of Clinical Investigation, 2004, 113(10): 1408–1418. DOI:10.1172/JCI21025 |
| [17] | WATANABE M, HOUTEN S M, MATAKI C, et al.Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation[J]. Nature, 2006, 439(7075): 484–489. DOI:10.1038/nature04330 |
| [18] | ESPE M, RATHORE R M, DU Z Y, et al.Methionine limitation results in increased hepatic FAS activity, higher liver 18:1 to 18:0 fatty acid ratio and hepatic TAG accumulation in Atlantic salmon, Salmo salar[J]. Amino Acids, 2010, 39(2): 449–460. DOI:10.1007/s00726-009-0461-2 |
| [19] | DIAS J, ALVAREZ M J, ARZEL J, et al.Dietary protein source affects lipid metabolism in the European seabass (Dicentrarchus labrax)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2005, 142(1): 19–31. |
| [20] | GAYLORD T G, BARROWS F T, TEAGUE A M, et al.Supplementation of taurine and methionine to all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2007, 269(1/4): 514–524. |
| [21] | BROSNAN J T, JACOBS R L, STEAD L M, et al.Methylation demand: A key determinant of homocysteine metabolism[J]. Acta Biochimica Polonica, 2004, 51(2): 405–413. |
| [22] | ARSLAN C.L-carnitine and its use as a feed additive in poultry feeding a review[J]. Revue de Médecine Vétérinaire, 2006, 157(3): 134–142. |
| [23] | PEGG A E.Mammalian polyamine metabolism and function[J]. IUBMB Life, 2009, 61(9): 880–894. DOI:10.1002/iub.v61:9 |
| [24] | JAFARNEJAD A, BATHAIE S Z, NAKHJAVANI M, et al.Effect of spermine on lipid profile and HDL functionality in the streptozotocin-induced diabetic rat model[J]. Life Sciences, 2008, 82(5/6): 301–307. |
| [25] | JELL J, MERALI S, HENSEN, M L, et al.Genetically altered expression of spermidine/spermine N1-acetyltransferase affects fat metabolism in mice via acetyl-CoA[J]. Journal of Biological Chemistry, 2007, 282(11): 8404–8413. DOI:10.1074/jbc.M610265200 |
| [26] | YUN B, AI Q H, MAI K S, et al.Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot (Scophthalmus maximus L.) fed high plant protein diets[J]. Aquaculture, 2012, 324-325: 85–91. DOI:10.1016/j.aquaculture.2011.10.012 |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China;
3. Department of Food Science, University of Wisconsin-Madison, Madison 53706, USA
 2016,
Vol. 25
2016,
Vol. 25


