2. 中国水产科学研究院东海水产研究所, 上海 200090
刺参(Apostichopus japonicus)隶属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、楯手目(Aspidochirota)、刺参科(Stichopodidae),主要分布在我国的辽宁、山东、河北等地,朝鲜半岛、日本和俄罗斯远东沿海,被誉为我国的“海产八珍”之首,具有很高的经济和药用价值[1-5]。近年来,随着人们生活水平的提高,刺参的市场需求不断增加,这也带动刺参养殖业的迅速发展,形成了具有地方特色的养殖产业和新的海洋经济增长点。其中山东是我国北方刺参的重要产地之一,占全国刺参养殖总产量的七成以上,并迅速成为山东省重要海水养殖产业[6-7]。
然而,随着生产规模的扩大、捕捞力度的增加,我国野生刺参资源量大幅减少、苗种质量严重下降,主要表现为生长缓慢、个体差异大、病害频发、成活率低等[8],严重制约了刺参养殖业的健康发展。因此,改良刺参种质、培育优良新品种,对我国刺参增养殖业的持续健康发展愈显重要[9-10]。杂交育种是动植物改良遗传性状、培育优良品种的重要手段之一,利用杂种优势可获得产量高和抗逆性强的杂交后代[11]。杂交育种在水产动物育种中广泛应用,如在鱼类[12-14]、扇贝[15-19]、牡蛎[20-21]、海胆[22-23]和对虾[24-26]等均有报道。在刺参育种中杂交也得到应用,将中国刺参与日本红刺参杂交,杂交子一代的各生长性状在幼虫期和幼参期均表现出明显的杂种优势,有较高的杂种优势率[27-28]。
本研究选用不同地理群体的中国刺参,采用完全双列杂交建立选育杂交和自交群体,比较不同杂交组合与对照组在幼参期的生长状况,探究其一般配合力和特殊配合力,以及杂交组合的杂种优势,进而为刺参的杂交育种提供技术参数,为刺参杂交的生产实践提供基础资料。
1 材料与方法 1.1 材料4个不同地理群体刺参分别来自长岛、威海、大连及胶南,所选群体均为当地野生群体。每个群体采集1 000个野生雌雄个体作亲本,实验在中国水产科学研究院长岛增殖实验站内进行。
1.2 实验设计4个不同地理群体刺参构建4×4完全双列杂交家系共计16组(表 1),每组三个平行,每组选用雌雄亲本各200头进行群体繁殖。
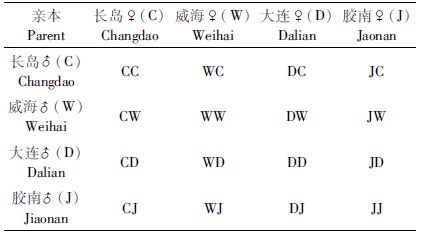
|
表 1 刺参4×4双列杂交试验设计 Tab.1 Design of diallel cross for Apostichopus japonicus |
选择自然海区重量为300 g以上体格健壮的刺参作为亲体促熟,室内自然水温(4.2 ℃)暂养。为保证各群体亲本性腺的同步发育,将各地理群体同时移入车间暂养10 d,培育池规格为10 m×3 m×1 m。暂养期间每天换水、投饵,投喂少量藻粉和过滤海泥,每5天倒池一次。待种参稳定后,每天升温0.5 ℃,换水2/3体积,根据种参摄食情况增减饵料,及时挑拣死亡种参,每5天倒池一次,定期解剖种参观察性腺发育情况。升至12 ℃和16 ℃时恒温培育3 d后继续升温,升至18 ℃时恒温培育,解剖观察性腺发育情况,等待产卵排精。性腺发育成熟后,升温刺激(20.5 ℃)种参排放。
种参排放时及时挑选出各群体的雌雄亲参,雌雄各200头,按表 1交配组合进行人工授精,水泥池内22 ℃孵化。幼参体长达4 mm 时开始大量附着,更换波纹板,调整密度。每天换水1/2、投喂藻粉和过滤海泥,根据幼参摄食情况增减饵料,及时挑拣死亡幼参。每5天倒池一次,定期更换波纹板调整培育密度。
1.4 取样及数据分析在幼参培育阶段,第30、60、80、105 天,每个平行随机取幼参30头,测量并记录刺参体长,测量方法参照魏杰等[29]测量方法,将刺参停食24~48 h,用浓度为0.5~0.6 mol / L 的硫酸镁海水溶液在常温下浸泡活体刺参1.5~2 h,解剖镜下测量活体刺参体长。将测量后的刺参样品放入自然海水中,在微流水5~8 h,即可正常运动、摄食。
参照孔令锋[20]的计算方法,计算杂交子代各性状的杂种优势率(H,Heterosis),公式为:
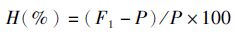 (1)
(1)
式中:H为杂种优势率;F1为杂交子代性状的平均值;P为两自交组性状的平均值。
参照黄远樟、刘来福[29-30]的计算方法,计算一般配合力及特殊配合力:
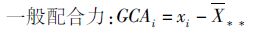 (2)
(2)
式中:GCAi 表示i亲本的一般配合力;xi表示i亲本所配组合的平均产量;X** 表示所有组合的总平均产量。
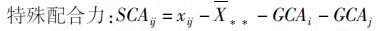 (3)
(3)
式中:SCAij表示i亲本和j亲本交配组合的特殊配合力;xi表示i亲本交配组合的平均产量;xij表示i亲本和j亲本所配组合的产量;X**为所有组合的总平均产量;GCAi 表示i亲本的一般配合力;GCAj 表示j亲本的一般配合力。
用EXCEL对各实验数据进行整理,采用SPSS 19.0 统计分析软件进行方差分析与比较。
2 结果 2.1 各组生长状况各实验幼参体长变化如表 2所示,不同阶段各组生长各不相同。30 d,JD>DJ >JC>WJ 组,幼参体长均在3.9 mm以上,大于总体平均值(3.82 mm),而WW<CW 组,幼参体长均小于3.7 mm,小于总体平均值(3.82 mm),JD 组显著高于WW 组和CW 组(P<0.05),DJ 组显著高于WW 组(P<0.05);60 d,CJ>WW>WJ>JD>JW>CD>JC 组,幼参体长均在5.30 mm以上,大于总体平均值(5.29 mm),而WD<DD<DW组,幼参体长均小于5.20 mm,小于总体平均值(5.29 mm),DW组显著低于CJ 组、WW 组、WJ 组和JD 组(P<0.05);80 d,CD>WC>WD>CW 组,幼参体长均在7.45 mm以上,大于总体平均值(7.40 mm),而DD<JJ 组,幼参体长均小于7.20 mm,小于总体平均值(7.40 mm),CD 组、WC 组、WD 组和 CW组显著高于DD 组和JJ 组(P<0.05);105 d,DJ>WD>JD>JC组,幼参体长均在10.60 mm以上,大于总体平均值(10.30 mm),而CC<WW<CJ组,幼参体长均小于10.00 mm,小于总体平均值(10.30 mm),CC组显著低于其他各组(P<0.05),DJ 组、WD 组JD 组和JC 组显著高于CC 组、WW 组、CJ 组和JJ 组(P<0.05)。可见,不同组合幼参生长速度各不相同,随着时间推移差异明显。
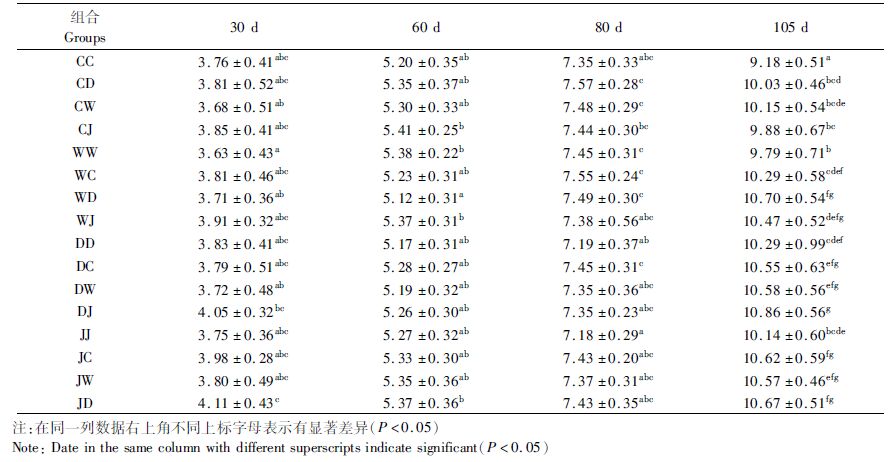
|
表 2 各实验组幼参的体长的变化 Tab.2 The body length of different groups |
各杂交组合幼参体长的杂种优势率变化如表 3所示,30 d时JD组杂种优势率最高(为9.83 %),60 d时DC 组和CJ 组杂种优势率较高(分别为3.15 %和3.13 %),80 d时CD组杂种优势率最高(4.12 %),105 d时JC组杂种优势率最高(9.69 %)。不同组合在同一生长阶段杂种优势率各不相同,同一组合在不同生长阶段杂种优势率也出现差别,有些生长阶段表现为正值,有些生长阶段则为负值。CD 组、JC 组和JD 组杂种优势率始终为正值,而CJ 组、WC 组,WJ 组、DC 组和DJ 组杂种优势率在某一生长阶段为负值,WD 组和DW 组杂种优势率只有一个正值出现,而CW 组杂种优势率则始终为负值。
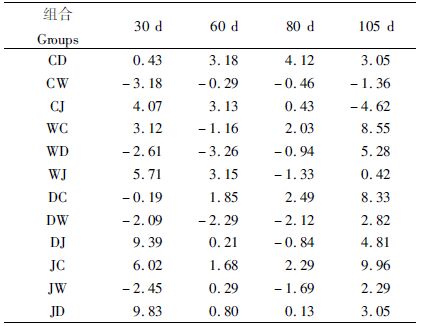
|
表 3 各杂交组合幼参体长的杂种优势率 Tab.3 Heterosis for body length of different groups |
本实验设计采用完全双列杂交,共有 (n2,n=4) 16个组合。因此,通过本实验可以同时估算父本和母本一般配合力(加性遗传)效应和子代特殊配合力(非加性遗传)效应。不同群体主要生长性状的父母本一般配合力如表 4所示,各群体不同阶段一般配合力效应表现不同,前期各群体一般配合力较低,后期一般配合力升高,但仍有些表现出负值。大连群体父母本一般配合力升高,且母本升高较父本快;长岛群体父母本一般配合力下降,父本下降较为明显;威海群体的一般配合力一直在较低水平;胶南群体母本一般配合力升高,而父本的一般配合力降低。105日龄时,母本一般配合力效应值较高的为大连群体(GCA D♀=0.28)和胶南群体(GCA J♀=0.21),这两个群体父本的一般配合力也较高。
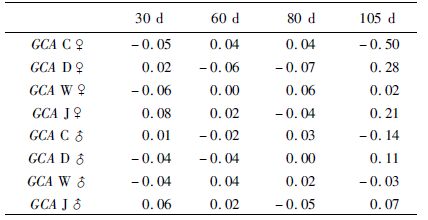
|
表 4 不同群体体长性状的父母本一般配合力效应值 Tab.4 General combining ability of body length in diallel cross groups |
不同交配组合在不同生长阶段的特殊配合力也不同 (表 5)。在30日龄时,体长平均值最高的杂交组合为JD ,母本的GCA是最高的(GCA J ♀ = 0.08),组合的特殊配合力也是最高的(SCA JD = 0.23)。在60日龄时,体长平均值最大的杂交组合为CD ,其母本GCA相对其他组较大(GCA C♀ = 0.04),但是其SCA不是最大的,SCA效应值最大的为JD 。在80日龄时,体长平均值最大的杂交组合为CD ,其父母本的GCA(GCA C♀ = 0.04,GCA D♂ =0.00)均不是最大值,但是其SCA(SCA CD = 0.12)为最大值,且与CJ 、DC 组合差别不大。在105日龄,体长平均值最高的杂交组合为DJ ,其母本GCA是最高的(GCA D♀=0.28),但其SCA不是最高的,WD组合的SCA效应值最高(SCA WD = 0.28),但与JC 、CW 、DJ 差别不大。可见,在不同生长阶段一般配合力(加性效应)和特殊配合力(非加性效应)发挥着不同的作用。
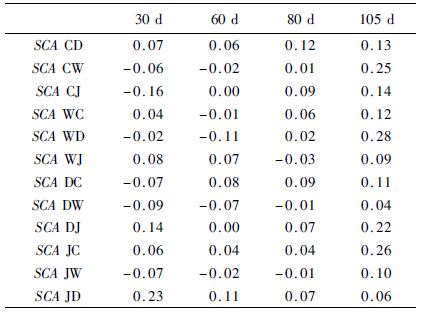
|
表 5 不同交配组合体长性状的特殊配合力效应值 Tab.5 Specific combining ability of body length indiallel cross groups |
杂交是动植物种质改良的重要手段之一,通过杂交使后代获得明显的杂种优势。而杂种优势是指杂种子一代在生长力、繁殖力、产量、品质等性状上优于双亲的一种复杂的生物学现象,且双亲的差异越大杂种优势越强,反之越弱[20]。种内杂交是杂交育种的一种,且其不易产生种质污染,有利于保护经济种类的种质资源。
本研究选用4个不同地理群体的中国刺参,采用完全双列杂交得到杂交和自交后代,比较交配组合幼参期的生长状况,结果表明,不同组合幼参生长速度各不相同,随着时间推移生长差异逐渐明显。杂种优势率方面,不同杂交组合在同一生长阶段各不相同,同一组合在不同生长阶段也有差别,CD 组、JC 组和JD 组始终为正值,说明其杂交后代有一定的杂种优势,且JC 组的杂种优势率始终较高;而CW 组的杂种优势率始终为负值,说明杂交后代没有表现出杂种优势;其他组既有正值也有负值,但是随着时间的推移不同杂交组合的杂种优势率为正值的组合增多,105日龄仅有CW 组表现为负值,表明后代杂种优势随着时间的推移越来越明显。相同的结果在中国刺参和日本红刺参杂交实验中也得到证实,胡美燕等研究中国刺参与日本红刺参杂交子一代的早期生长比较,结果发现,幼虫期8日龄时杂交组合和自交组合体长总体上差异不显著,幼参期160日龄时其中一个杂交组合体长显著高于其他组合,且体长的杂种优势率在160日龄均为正值[27];孙秀俊等研究了中国刺参(♂) × 日本红刺参(♀) 杂交子代的胚胎、幼体发育及幼参生长性状,结果发现随着时间增加自交苗和杂交苗的个体间体质量差异逐渐增大[28]。在其他水产动物育种过程中,不同地理群体间杂交也表现出一定的杂种优势,如不同地理群体的长牡蛎杂交,后代在生长性状上有一定的杂种优势[20-21];不同种群海胆杂交,杂交后代在12月龄时平均体质量表现出明显的杂种优势[22]。
配合力是衡量杂交组合中性状配合能力的重要指标,一般配合力主要是基因的加性效应,而加性效应更易稳定地遗传;而特殊配合力则是双亲杂交后通过互作表现出的基因的显性、超显性和上位效应,即非加性效应[31-32]。测定杂交后代的配合力效应值,在较高的一般配合力基础上,选择特殊配合力高的杂交组合,这对亲本选择和组合设计具有重要的指导意义,能够更好地促进杂交选育工作的开展[33]。本研究选用4个不同地理群体的中国刺参,大连和胶南群体作为母本一般配合力效应值较高,大连群体作为母本一般配合力效应值亦较高;而特殊配合力方面,前期J D组合的特殊配合力较高,后期WD、JC、CW、DJ组合特殊配合力较高,综合分析CD、DJ、JC、JD组合有较高特殊配合力。已有研究表明,某一性状亲本的一般配合力与杂交组合的特殊配合力间没有显著相关关系,这为选育一般配合力和特殊配合力高的强优势组合提供了可能[34]。
本研究选用4个不同地理群体的中国刺参,采用完全双列杂交得到杂交和自交后代,通过分析后代生长状况、杂种优势及配合力,确定了不同地理群体之间的优势杂交组合,为刺参的良种选育和养殖推广提供了重要参考资料。
| [1] | 廖玉麟. 中国动物志: 棘皮动物门, 海参纲[M]. 北京: 科学出版社, 1997. LIAO Y L. Fauna sinica: echinodermata, holothuroidea[M]. Beijing: Science Press, 1997. |
| [2] | 李丹彤, 常亚青, 陈炜, 等.獐子岛野生刺参体壁营养成分的分析[J]. 大连水产学院学报, 2016, 21(3): 278–282. LI D T, CHANG Y Q, CHEN W, et al.Analysis of nutritive composition of body wall in wild Apstichopus japonicus Selenka at Zhangzi Islan[J]. Journal of Dalian Fisheries University, 2016, 21(3): 278–282. |
| [3] | 苏秀榕, 娄永江, 常亚青, 等.海参的营养成分及海参多糖的抗肿瘤活性的研究[J]. 营养学报, 2003, 25(2): 181–182. SU X R, LOU Y J, CHANG Y Q, et al.Study on the nutritional components and the antineoplastic activity of polysaccharides of sea cucumber[J]. Acta Nutrimenta Sinica, 2003, 25(2): 181–182. |
| [4] | 樊绘曾.海参: 海中人参-关于海参及其成分保健医疗功能的研究与开发[J]. 中国海洋药物, 2001, 20(4): 37–44. FAN H Z.Sea Cucumber: ginseng of the seaThe Sea Cucumber and its composition of research and development of health care function[J]. Chinese Journal of Marine Drugs, 2001, 20(4): 37–44. |
| [5] | HATAKEYAMA T, SATO T, TAIRA E, et al.Characteri-zation of the interaction of hemolytic lectin CEL-Ⅲ from the marine invertebrate, Cucumaria echinata, with artificial lipid membranes: involvement of neutral sphingoglycolipids in the pore-forming process[J]. The Journal of Biochemistry, 1999, 125(2): 277–284. DOI:10.1093/oxfordjournals.jbchem.a022284 |
| [6] | 隋锡林.刺参人工育苗及养殖技术的进步与展望[J]. 水产科学, 2004, 23(9): 29–31. SUI X L.The advancement and outlook of cultural breeding and aquatics technique of Apostichopus japonicus[J]. Fisheries Science, 2004, 23(9): 29–31. |
| [7] | 李成林, 宋爱环, 胡炜, 等.山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010, 31(4): 126–133. LI C L, SONG A H, HU W, et al.Status analysis and sustainable development strategy of sea cucumber Apostichopus japonicus Selenka aquaculture industry in Shandong Province[J]. Progress in Fishery Sciences, 2010, 31(4): 126–133. |
| [8] | 孙慧玲. 刺参苗种繁育研究与产业现状以及存在问题[C]//中国海洋湖沼学会. "全球变化下的海洋与湖沼生态安全"学术交流会论文摘要集. 南京: 中国海洋湖沼学会, 2014: 1. SUN H L. The seedling breeding research and industry status quo and existing problems of Apostichopus japonicas[C]//Chinese Society of Oceanology and Limnology. "The Ocean and Lake Ecological Security of Global Change" Abstract Set of Academic Exchange. Nanjing: Chinese Society for Oceanology and Limnology, 2014: 1. |
| [9] | 常亚青, 隋锡林, 李俊.刺参增养殖业现状、存在问题与展望[J]. 水产科学, 2006, 25(4): 198–201. CHANG Y Q, SUI X L, LI J.The current situation, problem and prospect on the Apostichopus japonicus aquaculture[J]. Fisheries Science, 2006, 25(4): 198–201. |
| [10] | 邹积波, 高广斌, 姜洪亮, 等.分析刺参养殖发病原因、研讨对策, 走可持续发展之路[J]. 水产科学, 2006, 25(1): 53–54. ZOU J B, GAO G B, JIANG H L, et al.Causes and prevention of sea cucumber diseases: sustainable aquaculture[J]. Fisheries Science, 2006, 25(1): 53–54. |
| [11] | 范兆廷. 水产动物育种学[M]. 北京: 中国农业出版社, 2005: 87-88. FAN Z T. Breeding of aquatic animal[M]. Beijing: China Agriculture Press, 2005: 87-88. |
| [12] | 李炎璐, 陈超, 翟介明, 等.鱼类杂交育种技术及其在石斑鱼类中的应用[J]. 海洋渔业, 2012, 34(1): 102–109. LI Y L, CHEN C, ZHAI J M, et al.Fish hybridization and its application in grouper[J]. Marine Fisheries, 2012, 34(1): 102–109. |
| [13] | 李炎璐, 陈超, 王清印, 等.云纹石斑鱼(E. moara)(♀)×七带石斑鱼(E. septemfasciatus)(♂)杂交F1生长特征与其亲本子代的比较[J]. 渔业科学进展, 2015, 36(3): 42–49. LI Y L, CHEN C, WANG Q Y, et al.Comparative analysis of growth characteristics between hybrid F1 by Epinephelus moara (♀)×Epinephelus septemfasciatus (♂) and the offspring of their parents[J]. Progress in Fishery Sciences, 2015, 36(3): 42–49. |
| [14] | BRYDEN C A, HEATH J W, HEATH D D.Performance and heterosis in farmed and wild Chinook salmon (Oncorhynchus tshawytscha) hybrid and purebred crosses[J]. Aquaculture, 2004, 235(1/4): 249–261. |
| [15] | 于涛. 栉孔扇贝(♀)×虾夷扇贝(♂)杂种优势遗传机理的研究[D]. 上海: 上海海洋大学, 2011. YU T. Studies on the heterosis mechanism of scallop Chlamys farreri (♀)×Patinopecten yesoensis (♂)[D]. Shanghai: Shanghai Ocean University, 2011. |
| [16] | BEAUMONT A R, BUDD M D.Effects of self-fertilisation and other factors on the early development of the scallop Pecten maximus[J]. Marine Biology, 1983, 76(3): 285–289. DOI:10.1007/BF00393030 |
| [17] | 常亚青, 刘小林, 相建海, 等.栉孔扇贝不同种群杂交效果Ⅲ.中国种群与俄罗斯种群及其杂种1~2龄的生长发育[J]. 海洋学报, 2006, 28(2): 114–120. CHANG Y Q, LIU X L, XIANG J H, et al.Hybridization effects of the different geographic population of Chlamys farreri Ⅲ. The yearlong (1-2 years old) growth and development of Chinese population and Russian population and their reciprocal crosses[J]. Acta Oceanologica Sinica, 2006, 28(2): 114–120. |
| [18] | 刘小林, 常亚青, 相建海, 等.栉孔扇贝中国种群与日本种群杂交一代的中期生长发育[J]. 水产学报, 2003, 27(3): 193–199. LIU X L, CHANG Y Q, XIANG J H, et al.The medium-term growth and development of hybrid between Chinese and Japanese populations of Chlamys farreri[J]. Journal of Fisheries of China, 2003, 27(3): 193–199. |
| [19] | 郑怀平, 张国范, 刘晓, 等.海湾扇贝杂交家系与自交家系生长和存活的比较[J]. 水产学报, 2004, 28(3): 267–272. ZHENG H P, ZHANG G F, LIU X, et al.Comparison of growth and survival between the self-fertilized and hybridized families in Argopecten irradians irradians[J]. Journal of Fisheries of China, 2004, 28(3): 267–272. |
| [20] | 孔令锋, 滕爽爽, 李琪.长牡蛎中国群体与日本群体杂交子一代的生长和存活比较[J]. 海洋科学, 2013, 37(8): 78–84. KONG L F, TENG S S, LI Q.Growth and survival of the first generation of Hybrid between Chinese and Japanese populations of Pacific oyster Crassostrea gigas[J]. Marine Sciences, 2013, 37(8): 78–84. |
| [21] | 王卫军, 李琪, 杨建敏, 等.长牡蛎(Crassostrea gigas)三个选育群体完全双列杂交后代生长性状分析[J]. 海洋与湖沼, 2015, 46(3): 628–635. WANG W J, LI Q, YANG J M, et al.Analysis of growth trait of pacific oyster Crassostrea Gigas using complete diallel cross from three selective breeding strains[J]. Oceanologia et Limnologia Sinica, 2015, 46(3): 628–635. |
| [22] | RAHMAN M A, UEHARA T, LAWRENCE J M.Growth and heterosis of hybrids of two closely related species of Pacific sea urchins (Genus Echinometra) in Okinawa[J]. Aquaculture, 2005, 245(1/4): 121–133. |
| [23] | DING J, CHANG Y Q, WANG C H, et al.Evaluation of the growth and heterosis of hybrids among three commercially important sea unchins in China: Strongylocentrotus nudus, S. intermedius and Anthocidaris crassispina[J]. Aquaculture, 2007, 272(1/4): 273–280. |
| [24] | BENZIE J A H, KENWAY M, BALLMENT E, et al.Interspecific hybridization of the tiger prawns Penaeus monodon and Penaeus esculentus[J]. Aquaculture, 1995, 133(2): 103–111. DOI:10.1016/0044-8486(95)00013-R |
| [25] | TIAN Y, KONG J, YANG C H.Comparative growth and viability of hybrids between two populations of Chinese shrimp (Fennropenaeus chinensis)[J]. Chinese Science Bulletin, 2006, 51(19): 2369–2374. DOI:10.1007/s11434-006-2136-7 |
| [26] | 田燚, 孔杰, 杨翠华, 等.中国明对虾2个群体的杂交子一代早期分析[J]. 海洋学报, 2007, 29(3): 157–161. TIAN Y, KONG J, YANG C H, et al.Study on hybridization of two different populations of Fenneropenaeus chinensis[J]. Acta Oceanologica Sinica, 2007, 29(3): 157–161. |
| [27] | 胡美燕, 李琪, 孔令锋, 等.中国刺参与日本红刺参杂交子一代的早期生长比较[J]. 中国海洋大学学报, 2009, 39(s): 375–380. HU M Y, LI Q, KONG L F, et al.Comparative study on juvenile growth of hybrids between Chinese and Japanese stocks of sea cucumber(Stichopus japonicus)[J]. Periodical of Ocean University of China, 2009, 39(s): 375–380. |
| [28] | 孙秀俊, 李琪, 孔令锋, 等.中国刺参(♂)×日本红刺参(♀)杂交子代的胚胎、幼体发育及幼参生长性状的研究[J]. 中国海洋大学学报, 2012, 42(4): 26–32. SUN X J, LI Q, KONG L F, et al.Embryonic, larval development and juvenile growth in hybrid between green (♂) and red (♀) sea cucumber Apostichopus japonicus[J]. Periodical of Ocean University of China, 2012, 42(4): 26–32. |
| [29] | 魏杰, 常亚青, 聂竹兰, 等. 准确测量活体刺参体长的方法: 中国, CN100466970. C[P]. 2009-03-11. WEI J, CHANG Y Q, NIE Z L, et al. Method for accurately measuring body length of living stichopus japonicus: China, CN100466970C[P]. 2009-03-11. |
| [30] | 黄远樟, 刘来福.作物数量遗传学基础六、配合力: 不完全双列杂交[J]. 遗传, 1980, 2(2): 43–46. HUANG Y Z, LIU L F.The basis of quantitative genetics in crops VI. combining ability: incomplete diallel cross[J]. Hereditas (Beijing), 1980, 2(2): 43–46. |
| [31] | 刘来福, 毛盛贤, 黄远樟. 作物数量遗传[M]. 北京: 农业出版社, 1984: 206-284. LIU L F, MAO S X, HUANG Y Z. Crop quantity genetic[M]. Beijing: Agriculture Press, 1984: 206-284. |
| [32] | 王炳谦, 谷伟, 高会江, 等.利用配合力和微卫星标记预测虹鳟品系间的杂交优势[J]. 中国水产科学, 2009, 16(2): 206–213. WANG B Q, GU W, GAO H J, et al.Prediction of hybridization advantage among five strains of rainbow trout by combination ability and SSR markers[J]. Journal of Fishery Sciences of China, 2009, 16(2): 206–213. |
| [33] | 盛志廉, 陈瑶生. 数量遗传学[M]. 北京: 科学出版社, 1999: 110. SHENG Z L, CHEN Y S. Quantity genetics[M]. Beijing: Science Press, 1999: 110. |
| [34] | 胡志国, 刘建勇, 包秀凤, 等.九孔鲍双列杂交家系子代的杂种优势与配合力分析[J]. 南方水产科学, 2014, 10(1): 43–49. HU Z G, LIU J Y, BAO X F, et al.Combining ability and heterosis of hybridization between cultured and wild stocks of Haliotis diversicolor supertexta[J]. South China Fisheries Science, 2014, 10(1): 43–49. |
2. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China
 2017,
Vol. 26
2017,
Vol. 26


