公子小丑鱼(Amphiprion ocellaris),学名为眼斑双锯鱼,鲈形目(Perciformes)、雀鲷科(Pomacentridae)、海葵鱼属(Amphiprion)。主要分布在西太平洋低纬度的礁岩海域。公子小丑鱼因其鲜艳的外表和可爱的形象而为水族爱好者所喜爱。近年来随着海水观赏鱼贸易的发展,其经济价值逐渐被人们所重视。有关公子小丑鱼繁殖生物学和生态学方面的研究已有相关报道。王斌等[1]研究了公子小丑鱼的人工繁育技术,FRAKES和HOFF[2]研究了硝酸氮对公子小丑鱼幼鱼生长及成活的影响。董少杰等[3]研究了运输条件下温度、盐度及pH对公子小丑鱼亲鱼氨和有机物排泄的影响。本实验室鞠晨曦等[4]研究了盐度对公子小丑鱼幼鱼生长发育的影响。但如温度、光照等环境因子对其生长发育方面的影响尚未见相关研究报道。
温度作为海水鱼养殖中一个重要的环境因子和其成活率及生长发育都有着十分密切的联系,尤其是对于长期生活在温度较为稳定的珊瑚礁区域的小丑鱼更为重要。温度对热带海水鱼幼鱼的新陈代谢、生长发育、行为方式等方面有显著影响。温度不仅可以影响鱼类的摄食率、胚胎发育、标准代谢以及内源氮的代谢,还可以影响鱼类的免疫功能以及消化酶活性[5]。光照周期是另一个影响鱼类生长的重要环境因素。鱼类的生长率会随着光照周期的变化而呈现出一定的季节变动模式[6]。有研究表明,延长光照周期能够提高多种鱼类的生长速度,如塞内加尔鳎(Solea senegalensis)、拟庸鲽(Pleuronectes platessa)[7]、绿背菱鲆(Rhombosolea tapirina)[8]、大菱鲆(Scophthalmus maximus)[9]、大西洋庸鲽(Hippoglossus hipoglossus)[10]等。但也有研究发现,改变光照周期对某些鱼类生长没有明显影响[11],如黄国强对褐牙鲆(Paralichthys olivaceus)幼鱼的研究中发现幼鱼生长未受光照周期的影响[12]。因此研究光照周期对公子小丑鱼幼鱼生长方面的影响,对其进行科学的大规模养殖生产具有重要意义。
鱼类的生长主要是由下丘脑-垂体-肝脏生长轴(GH/IGF轴)调控的。温度、光照周期可以通过影响生长轴中相关激素水平来调控鱼类生长[13]。当外界环境变化时,下丘脑会分泌促生长激素释放(抑制)激素,促进(阻碍)垂体分泌生长激素(GH),GH通过与靶细胞膜表面的生长激素受体(GHR)结合,启动细胞内的信号传导机制,促进肝脏及其他组织中类胰岛素生长因子(IGF)的合成与分泌[14]。IGF的生物学效应又受到类胰岛素生长因子结合蛋白(IGFBP)的调节,通过血液循环到达机体各处组织,促进细胞的增殖分化,最终促进生物体生长。但具体调节机理还有待进一步探究。
本实验主要通过研究不同温度、光照周期对公子小丑鱼幼鱼成活率、生长率、饵料转化率及其生长相关基因 GHR1、GHR2、IGF、IGFBP基因在肝脏的相对表达量变化趋势,进一步探究GH/IGF生长轴在不同环境因子下对鱼类早期生长阶段的调节机理,并得到适合公子小丑鱼幼鱼生长的温度、光照周期条件,为其大规模的人工繁殖提供理论依据。
1 材料与方法 1.1 实验材料实验所用的公子小丑鱼为购于北京AMF海水农场的3月龄幼鱼,平均体质量为(0.76±0.20) g,平均体长为(2.0±0.4) cm。暂养于实验室流水养殖系统中,水交换量为1 L/min。养殖期间保持光照400 lx,水温(27±1) ℃,盐度30.0±0.5,pH 8.0±0.2,24 h人工通气和循环过滤海水。实验开始前驯养1周,使其适应实验环境。投喂海水鱼专用饲料(蛋白质:52%、脂肪:6.9%、纤维:2.5%、灰份:11%)。
1.2 方法 1.2.1 温度实验设计随机挑选200只健康、规格一致的公子小丑鱼幼鱼作为实验用鱼。温度实验共设17 ℃、22 ℃、27 ℃和32 ℃ 4个组。每组设两个平行组,每个平行组25尾鱼,实验在室内8个规格为60 cm×50 cm×40 cm的水族缸中进行。缸内水温通过电子恒温棒调控,采用自然光照射,保持24 h人工通气和循环过滤海水。实验为期50 d,实验期间投喂海水鱼专用饲料,每天投喂两次(8:30和16:30),每天投喂量为鱼体质量的5%(具体情况视天气和鱼类摄食情况而定)。投喂前称量其质量,记为投饵量。投喂1 h后用虹吸管吸出残饵,去除水分后称量,记为残饵量。最后一次投喂后次日早上8:00,从每个平行组中随机取6尾幼鱼测量体长并称体质量,取肝脏组织样品,于液氮中保存带回实验室,保存于-80 ℃低温冰箱以备之后分子生物学实验。
1.2.2 光照周期实验设计光照周期实验共设24L: 0D、16L: 8D、8L: 16D和0L: 24D四种光照周期组。每组设两个平行组,每个平行组25尾鱼,实验在室内8个规格为60 cm×50 cm×40 cm的水族缸中进行。除0L: 24D组外,其余各组光照强度一致,皆为400 lx,LED光源。光度计为上海嘉定学联仪表厂生产的JD-1A型。采用黑色塑料板进行遮光处理。后续实验步骤与温度实验一致。
1.2.3 生长相关基因相对表达量的测定将冻存的肝脏组织样品取出并匀浆后,按照TRIzol® reagent试剂盒操作说明提取并纯化总RNA。采用核酸蛋白测定仪测定所提RNA样品的OD260及OD280值,确定RNA样品的浓度及纯度。0.8%琼脂糖凝胶电泳检测RNA质量。
根据TaKaRa PrimeScriptTM 1st Strand cDNA Synthesis Kit试剂盒操作说明,将提取的总RNA进行反转录扩增获得cDNA。反转录产物于-20 ℃保存备用。根据本实验室已克隆出的公子小丑鱼GHR1基因、GHR2基因以及已报道的IGF基因(GenBank: JX494724.1),IGFBP基因(NCBI Reference Sequence: XM_008284070.1) 和β-actin基因(GenBank: AB921201.1) 的序列,设计特异性引物(表 1)。使用ABI PRISM® 7900 Sequence Detection System仪器, 参照SYBR®GreenRealtime PCR Master Mix试剂盒说明对实验各组样品的目的基因和β-actin基因cDNA进行定量测定。ABI PRISM® 7900 Sequence Detection System的具体反应程序设计为:95 ℃预变性30 s;95 ℃变性5 s、61 ℃退火30 s,共40个循环。每个样品设置3个重复,反应结束后进行溶解曲线分析,以验证产物特异性。

|
表 1 Real-time PCR检测所用引物序列 Tab.1 Nucleotide sequences of the primers used for real-time PCR |
平均体质量、体长增长率,成活率及饵料转化率的计算方法:
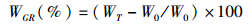 (1)
(1)
 (2)
(2)
 (3)
(3)
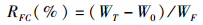 (4)
(4)
式中:WGR为平均体质量增长率;WT为平均每尾终末体质量(g);W0为平均每尾初始体质量(g); LGR为平均体长增长率;LT为平均每尾终末体长(mm);L0平均每尾初始体长(mm); S为成活率;NT为最终成活鱼尾数;N0为初始鱼尾数;RFC为饵料转化率;WF为消耗的饵料总重。
荧光定量PCR数据分析中,采用2-ΔΔt法计算各组样品中生长相关基因的相对表达量[15],并用SPSS 18.0统计软件进行One-Way ANOVE分析和Duncan氏多重比较来检验统计差异。所有数据以平均值±标准差(Means±SD)表示。当P < 0.05时认为差异显著。
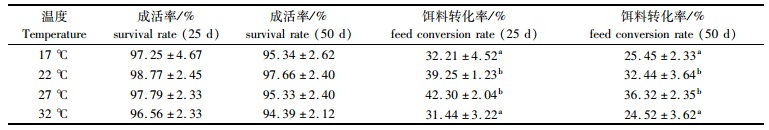
2 结果 2.1 温度对公子小丑鱼幼鱼成活率、饵料转化率及生长率的影响实验结果表明,在4种温度(17 ℃、22 ℃、27 ℃、32 ℃)条件下养殖25 d和50 d后的公子小丑鱼幼鱼的成活率都在95%以上,且各温度组间差异不显著(P >0.05)。饵料转化率在温度为27 ℃时最高,为42.30%±2.04%(25 d)和36.32%±2.35%(50 d),温度22 ℃组次之,17 ℃组和32 ℃组较低(表 2)。
|
表 2 不同温度条件下公子小丑鱼幼鱼的成活率及饵料转化率 Tab.2 The survival rates and feed conversion rates under different temperature conditions of young A ocellaris |
生长方面,公子小丑鱼幼鱼的平均体质量增长率在温度为27 ℃时最高,分别为37.62%±1.37%(25 d)和55.25%±6.35%(50 d)。温度22 ℃时次之,但与27 ℃组之间没有显著差异(P>0.05)。温度17 ℃组和32 ℃组较低,且与27 ℃和22 ℃组两组有显著性差异(P < 0.05)。体长增长率与体质量增长率结果相似,27 ℃时体长增长率最大,分别为17.30%±2.25%(25 d)和26.32%±4.55%(50 d),与其他各组差异显著(P < 0.05)。22 ℃次之,17 ℃和32 ℃较低,且二组间差异不显著(P>0.05, 表 3)。

|
表 3 不同温度对公子小丑鱼幼鱼生长的影响 Tab.3 Effects of different temperatures on growth of young A ocellaris |
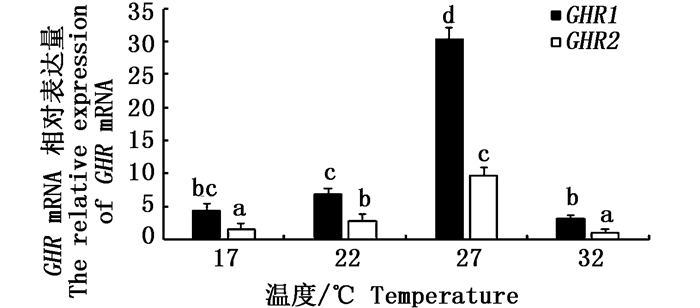
采用qRT-PCR技术检测不同温度条件下公子小丑鱼 GHR1、GHR2基因在肝脏中的相对表达量(图 1),结果显示,GHR1基因、GHR2基因在27 ℃组的表达量最高,22 ℃次之,在17 ℃和32 ℃组中表达量较低。
|
图 1 肝脏GHR mRNA在不同温度条件下的相对表达量
Fig. 1 The relative expression of liver GHR mRNA under different temperature conditions
不同字母表示两组间差异显著(P < 0.05) Different letters indicate there was a significant difference between the two groups(P < 0.05) |
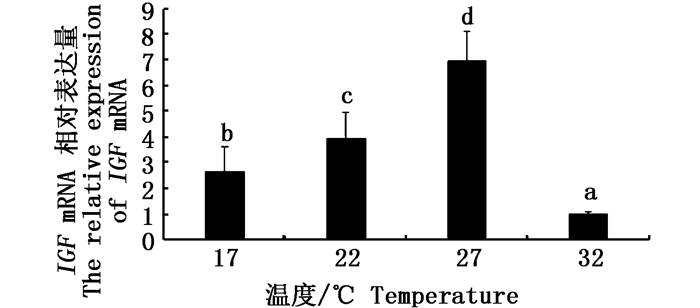
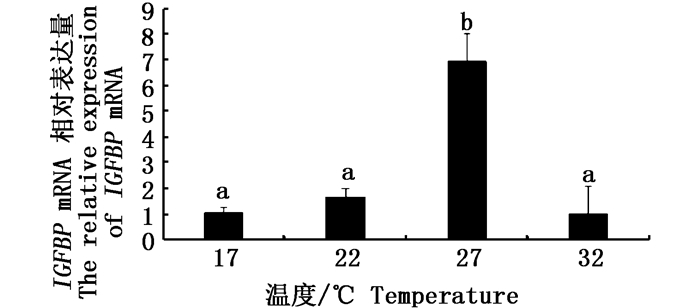
采用qRT-PCR技术检测公子小丑鱼肝脏IGF、IGFBP基因的相对表达量,结果显示,IGF基因的相对表达量在27 ℃组中最高,之后依次为22 ℃组、17 ℃组和32 ℃组,且各组间差异显著(P < 0.05, 图 2)。IGFBP基因的相对表达量在27℃组中最高,且显著高于其余3个温度组(P < 0.05)。17 ℃、22 ℃、32 ℃三组间没有显著性差异(P>0.05, 图 3)。
|
图 2 肝脏IGF mRNA在不同温度条件下的相对表达量
Fig. 2 The relative expression of liver IGF mRNA under different temperature conditions
不同字母表示两组间差异显著(P < 0.05) Different letters indicate there was a significant difference between the two groups(P < 0.05) |
|
图 3 肝脏IGFBP mRNA在不同温度条件下的相对表达量
Fig. 3 The relative expression of liver IGFBP mRNA under different temperature conditions
不同字母表示两组间差异显著(P < 0.05) Different letters indicate there was a significant difference between the two groups(P < 0.05) |
实验结果表明,在4种光照周期(24L: 0D、16L: 8D、8L: 16D、0L: 24D)条件下养殖25 d和50 d后的公子小丑鱼幼鱼的成活率都在93%以上,且各组间差异不显著(P>0.05)。饵料转化率在光照周期组24L: 0D中最高,为51.20%±4.87%(25 d)和41.24%±3.42%(50 d),16L: 8D组次之,8L: 16D组和0L: 24D组较低(表 4)。

|
表 4 不同光照周期条件下公子小丑鱼幼鱼的成活率及饵料转化率 Tab.4 The survival rates and feed conversion rates under different photoperiod conditions of young A.ocellaris |
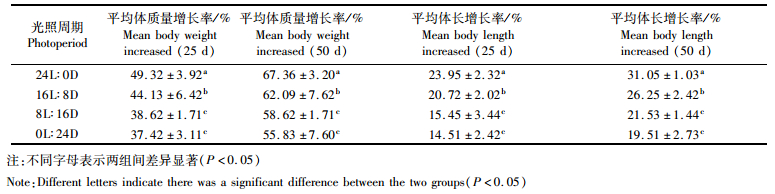
生长方面,公子小丑鱼幼鱼的平均体质量增长率在光照周期为24L: 0D时最高,分别为49.32%±3.92%(25 d)和67.36%±3.20%(50 d),与其他各组差异显著(P < 0.05)。16L: 8D组次之,8L: 16D组和0L: 24D组较低,后两组间没有显著差异(P>0.05)。平均体长增长率与平均体质量增长率的结果相似,光照周期为24L: 0D时增长率最高,分别为23.95%±2.32%(25 d)和31.05%±1.03% (50 d),与其他各组差异显著(P < 0.05),16L: 8D组次之,8L: 16D组和0L: 24D组较低,后两组间没有显著性差异(P>0.05,表 5)。
|
表 5 不同光照周期对公子小丑鱼幼鱼生长的影响 Tab.5 Effects of different photoperiods on growth rate of young A ocellaris |
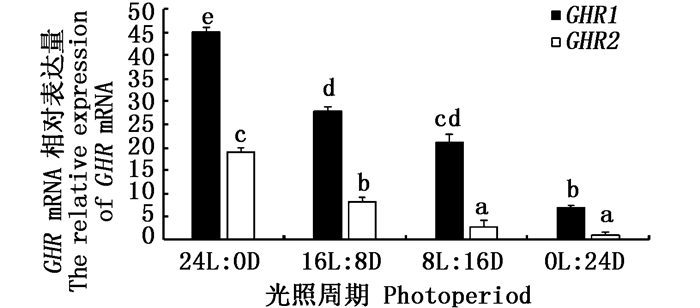
采用qRT-PCR技术检测公子小丑鱼肝脏GHR1基因、GHR2基因在不同光照周期下的相对表达量(图 4)。结果显示,GHR1基因、GHR2基因在光照周期24L: 0D组中相对表达量最高,而且显著高于其他光照周期组(P < 0.05)。16L: 8D组中次之,8L: 16D和0L: 24D组的相对表达量较低。其中,GHR1基因的相对表达量在16L: 8D、8L: 16D两组间没有显著性差异(P>0.05),GHR2基因的相对表达量在8L: 16D、0L: 24D两组间没有显著性差异(P>0.05)。
|
图 4 肝脏GHR mRNA在不同光照周期条件下的相对表达量
Fig. 4 The relative expression of liver GHR mRNA under different photoperiod conditions
不同字母表示两组间差异显著(P < 0.05) Different letters indicate there was a significant difference between the two groups(P < 0.05) |
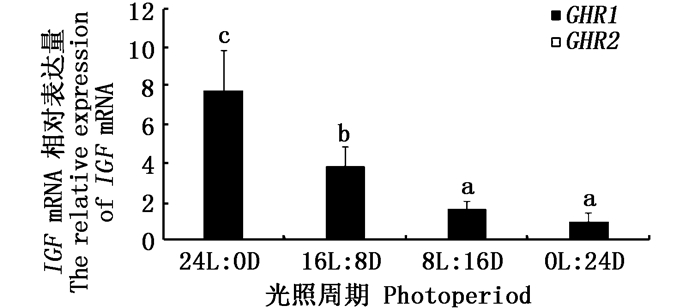
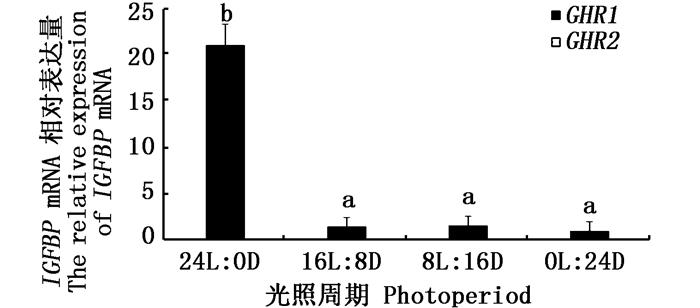
采用qRT-PCR技术检测公子小丑鱼肝脏IGF、IGFBP基因的相对表达量。结果显示,IGF基因在光照周期24L: 0D组中的相对表达量最高,与其他各组差异显著(P < 0.05),16L: 8D组次之,8L: 16D和0L: 24D组较低,两组间没有显著性差异(P>0.05,图 5)。IGFBP基因在光照周期24L: 0D组中的相对表达量最高,且显著高于其他三组(P < 0.05),但在16L: 8D、8L: 16D、0L: 24D三组间没有显著性差异(P>0.05,图 6)。
|
图 5 肝脏IGF mRNA在不同光照周期条件下的相对表达量
Fig. 5 The relative expression of liver IGF mRNA under different photoperiod conditions
不同字母表示两组间差异显著(P < 0.05) Different letters indicate there was a significant difference between the two groups(P < 0.05) |
|
图 6 肝脏IGFBP mRNA在不同光照周期条件下的相对表达量
Fig. 6 The relative expression of liver IGFBP mRNA under different photoperiod conditions
不同字母表示两组间差异显著(P < 0.05) Different letters indicate there was a significant difference between the two groups(P < 0.05) |
温度是影响海水鱼类生存、生长的重要环境因子之一。适宜的温度是鱼类正常生长的必要条件,是维持正常生理状态、促进生长、提高经济效益和保障鱼类品质的重要保障,温度过高或过低均会对鱼类的生理生态状况产生不利影响[16-17]。研究表明,鱼类的生长率在一定温度范围会随着温度的升高而增加,超过最适温度后则会下降[18-19]。本实验中,3月龄公子小丑鱼幼鱼在17 ℃、22 ℃、27 ℃、32 ℃ 4个温度组中的成活率没有显著性差异,都超过95%,随着温度的升高,幼鱼体长、体质量增长率均呈现先升高后降低的趋势,其中在27 ℃组中增长率最大。鱼类的生长取决于鱼类的采食量、对饲料的消化和吸收以及转变为机体组织的效率[20]。本实验对不同温度条件下公子小丑鱼幼鱼的饵料转化率比较后发现,饲养25 d和50 d后的饵料转化率随温度的升高而升高,并在温度27 ℃条件下达到了最大值。这说明饵料转化率也有其最适温度,且与生长率随温度的变化趋势相似。BUENTELLO等[21]研究发现,鲇鱼(Ictalurus punctatus)的采食量及饵料转化率均有其最适温度,低于或超过最适温度,采食量及饵料转化率都会不同程度地降低。有研究表明,细胞代谢与饵料转化率有高度的相关性,饵料转化率会随细胞代谢速率的增大而升高[22]。因而推测,当环境温度处于生长的最适温度时,幼鱼的代谢速率以及对营养物质的利用率都较高[23],使饵料转化率增大,从而促进了个体的生长。当温度低于或高于最适温度后,蛋白酶活性受到抑制,细胞代谢速率降低,并导致饵料转化率降低,继而影响生长速率。此外,温度对鱼类生长的影响也表现在对其生长相关激素的调控方面[24]。本实验中,公子小丑鱼幼鱼肝脏 GHR1、GHR2、IGF、IGFBP基因的相对表达量在温度27 ℃时均达到了最大值,当温度低于或高于27 ℃时都会不同程度的降低,与生长趋势相似。在对不同温度条件下金头鲷(Sparus aurata)肝脏GHR基因表达量的研究发现,升高温度可以增加肝脏GHR基因的表达量,提升血液中GH、IGF的浓度,从而促进个体生长[25]。GHR是下丘脑-垂体-GH/IGF生长轴上重要的调控因子之一,GH生理效应的正常发挥主要受到肝脏靶细胞膜上的GHR数量影响[26]。GHR与GH以二聚体的形式结合,启动细胞内JAK2/STAT信号机制,促进肝脏分泌IGF。IGF家族是多功能的细胞增殖因子,由配体IGF,结合蛋白IGFBP以及受体IGFR组成。IGFBP能够与高达95%的IGF结合,在血液中以复合物的形式存在。这些蛋白质复合物能够延长IGF的半衰期,并经由血液循环将IGF配体运载至机体各处,通过与靶细胞膜上的IGFR结合,加速细胞的增殖分化,促进生物体的生长[31]。研究表明,升高温度可以提高大菱鲆[27]、金头鲷[28]、大马哈鱼(Oncorhynchus keta)[29]银鲑鱼(Oncorhynchus kisutch)[30]等鱼类血液中IGF的浓度,其特定生长率也与IGF基因相对表达量呈正相关。这说明温度可以通过影响鱼类GH/IGF生长轴中生长相关基因的表达来调节其生长。本实验中,当水温在27 ℃时,幼鱼肝脏GHR基因大量表达,增加了与GH的结合几率,从而启动细胞内JAK2/STAT信号机制,刺激肝脏合成并分泌更多的IGF,经由IGFBP介导,通过血液循环与机体各处的靶细胞膜上的IGFR结合实现生物学效应[31],提高幼鱼的生长速率。
光照周期是另一个影响鱼类早期生长的环境因子。本实验对不同光照周期条件下3月龄公子小丑鱼幼鱼的生长状况进行比较研究, 结果显示,光照周期对幼鱼的成活率没有影响,但延长光照周期可以提高其生长速率,并在光照周期24L: 0D组中生长率最大。这与尖吻鲈(L.calcarifer)[32]及绿背菱鲽(Rhombosolea tapirina)[33]等鱼类的研究结果相似。与温度类似,光照周期对幼鱼生长的影响,也主要表现在对生长轴相关激素水平的调控方面。BJÖRNSSON[34]等对大西洋鲑(Salmon salar)1龄幼鲑的研究发现,延长光照周期可以显著提高血液GH的浓度,进而促进了肝脏GHR基因的表达。TAYLOR等[35]对虹鳟(Oncorhynchus mykiss)的研究表明,延长光照周期可以明显提高血液中IGF含量,从而刺激虹鳟生长。CRUZ和BROWN[36]对罗非鱼(Oreochromis niloticus)的研究发现,光照周期16L: 8D组中的IGF基因相对表达量要高于8L: 16D组。本实验中,不同光照周期条件下公子小丑鱼幼鱼肝脏 GHR1F、GHR2和IG基因的相对表达量与其平均体长、体质量增长率变化趋势相似,均随光照周期的增加而增大,并在24L: 0D组中达到最大值。这说明持续光照公子小丑鱼幼鱼对GH-IGF生长轴中各相关生长基因的表达有促进作用,继而提高了幼鱼的生长速率。此外,本实验对肝脏IGFBP基因的研究发现,其相对表达量虽然在光照周期24L: 0D时最高,但在16L: 8D、8L: 16D、0L: 24D各组间的相对表达量却无显著性差异,这与本实验中其他生长相关基因,尤其肝脏IGF基因的相对表达量变化趋势不完全一致。分析认为,IGFBP作为IGF的结合蛋白,可以介导IGF信号分子向特定靶细胞的传递[37]。除此之外,IGFBP也有独立于IGF之外的作用。魏平等研究发现,IGFBP可能在抑制代谢、细胞增殖、促进血糖升高等方面具有调控作用[38]。因此推测持续光照可能会提高肝脏IGFBP基因的表达,继而促进细胞增殖分化,使幼鱼生长速率加快,但具体调控机理还有待进一步探究。
综上所述,温度和光照周期是影响公子小丑鱼幼鱼生长的重要环境因子,二者主要通过对下丘脑-垂体-GH-IGF生长轴的调控来影响幼鱼的生长过程。本实验研究表明,随着温度的升高,公子小丑鱼幼鱼的饵料转化率、生长率及其相关生长基因的相对表达量均呈现先升高后降低的趋势,并在27 ℃达到最高值。光照周期方面,幼鱼生长率及其相关生长基因的相对表达量在24D: 0L组最高,由此推测3月龄公子小丑鱼幼鱼生长的最适温度为27 ℃,最适光照周期为24D: 0L。
| [1] |
王斌, 王士莉, 杨爱国, 等. 眼斑双锯鱼的人工繁育技术研究[J].
渔业科学进展, 2010, 31(5): 41–46.
WANG B, WANG S L, YANG A G, et al. Study on artificial breeding of Amphiprion ocellaris[J]. Progress in Fishery Sciences, 2010, 31(5): 41–46. |
| [2] | FRAKES T, HOFF F H. Effect of high nitrate-N on the growth and survival of juvenile and larval anemonefish, Amphiprion ocellaris[J]. Aquaculture, 1982, 29(1/2): 155–158. |
| [3] |
董少杰, 梁拥军, 孙向军, 等. 运输条件下温度、盐度和pH值对眼斑双锯鱼亲鱼氨和有机物排泄的影响[J].
天津农业科学, 2013, 19(3): 32–37.
DONG S J, LIANG Y J, SUN X J, et al. Effects of salinity, temperature and pH on ammonia and organic matter excretion of the false clownfish (Amphiprion ocellaris) brood stocks in transport experiment[J]. Tianjin Agricultural Sciences, 2013, 19(3): 32–37. |
| [4] |
鞠晨曦. 公子小丑鱼(Amphiprion ocellaris)胚胎发育的形态学观察及盐度对幼鱼生长的影响[D]. 上海: 上海海洋大学, 2013.
JU C X. Morphological observation of embryonic development and effects of salinity on growth of false clownfish (Amphiprion ocellaris)[D]. Shanghai:Shanghai Ocean University, 2013. |
| [5] | PECK M A, BUCKLEY L J. Measurements of larval Atlantic cod (Gadus morhua) routine metabolism:temperature effects, diel differences and individual-based modeling[J]. Journal of Applied Ichthyology, 2008, 24(2): 144–149. DOI:10.1111/j.1439-0426.2007.01004.x |
| [6] | BOEUF G, FALCON J. Photoperiod and growth in fish[J]. Vie et Milieu, 2001, 51(4): 247–266. |
| [7] | FONDS M. A Seasonal Fluctuation in Growth Rate of Young Plaice (Pleuronectes platessa) and Sole (Solea solea) in the Laboratory at Constant Temperatures and A Natural Daylight Cycle[M]//NAYLOR E, HARTNOLL R G. Cyclic Phenomena in Marine Plants and Animals. Amsterdam:Elsevier, 1979:151-156. |
| [8] | IMSLANDA K, FOLKVORD A, STEFANSSON S O. Growth, oxygen consumption and activity of juvenile turbot (Scophthalmus maximus L.) reared under different temperatures and photoperiods[J]. Netherlands Journal of Sea Research, 1995, 34(1/3): 149–159. |
| [9] | IMSLAND A K, FOLKVORD A, JÓNSDÓTTIR D B, et al. Effects of exposure to extended photoperiods during the first winter on long-term growth and age at first maturity in turbot (Scophthalmus maximus)[J]. Aquaculture, 1997, 159(1/2): 125–141. |
| [10] | JONASSEN T M, IMSLAND A K, KADOWAKI S, et al. Interaction of temperature and photoperiod on growth of Atlantic halibut Hippoglossus hippoglossus L.[J]. Aquaculture Research, 2000, 31(2): 219–227. DOI:10.1046/j.1365-2109.2000.00447.x |
| [11] | FUCHS J. Effect of photoperiod on growth and survival during rearing of larvae and juveniles of sole (Solea solea)[J]. Aquaculture, 1978, 15(1): 63–74. DOI:10.1016/0044-8486(78)90072-8 |
| [12] |
黄国强, 李洁, 唐夏, 等. 光照周期对褐牙鲆幼鱼生长、能量分配及生化指标的影响[J].
水产学报, 2014, 38(1): 109–118.
HUANG G Q, LI J, TANG X, et al. Effects of photoperiod on the growth, energy allocation, and biochemical parameters in juvenile brown flounder (Paralichthys olivaceus)[J]. Journal of Fisheries of China, 2014, 38(1): 109–118. |
| [13] | BJÖRNSSON B T. The biology of salmon growth hormone:from daylight to dominance[J]. Fish Physiology and Biochemistry, 1997, 17(1/6): 9–24. DOI:10.1023/A:1007712413908 |
| [14] | ARGETSINGER L S, CARTER-SU C. Mechanism of signaling by growth hormone receptor[J]. Physiological Reviews, 1996, 76(4): 1089–1107. |
| [15] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Cr method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [16] | SUN L H, CHEN H R, HUANG L M. Effect of temperature on growth and energy budget of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2006, 261(3): 872–878. DOI:10.1016/j.aquaculture.2006.07.028 |
| [17] | BAUM D, LAUGHTON R, ARMSTRONG J D, et al. The effect of temperature on growth and early maturation in a wild population of Atlantic salmon parr[J]. Journal of Fish Biology, 2005, 67(5): 1370–1380. DOI:10.1111/jfb.2005.67.issue-5 |
| [18] | XIE X J, SUN R Y. The bioenergetics of the southern catfish (Silurus meridionalis Chen):growth rate as a function of ration level, body weight, and temperature[J]. Journal of Fish Biology, 1992, 40(5): 719–730. DOI:10.1111/jfb.1992.40.issue-5 |
| [19] |
张晓华, 苏锦祥, 殷名称. 不同温度条件对鳜仔鱼摄食和生长发育的影响[J].
水产学报, 1999, 23(1): 91–94.
ZHANG X H, SU J X, YIN M C. The influences of temperature on the feeding, growth and development of larval Siniperca chuatsi[J]. Journal of Fisheries of China, 1999, 23(1): 91–94. |
| [20] | BUREL C, RUYET P L, GAUMET F, et al. Effects of temperature on growth and metabolism in juvenile turbot[J]. Journal of Fish Biology, 1996, 49(4): 678–692. DOI:10.1111/jfb.1996.49.issue-4 |
| [21] | BUENTELLO J A, GATLIN D M, NEILL W H. Effects of water temperature and dissolved oxygen on daily feed consumption, feed utilization and growth of channel catfish (Ictalurus punctatus)[J]. Aquaculture, 2000, 182(3/4): 339–352. |
| [22] |
袁章琴, 谭支良, 曾军英, 等. 饲料转换效率与细胞能量代谢[J].
华北农学学报, 2009, 24(S1): 184–190.
YUAN Z Q, TAN Z L, ZENG J Y, et al. Feed efficiency and cellular energy metabolism[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(S1): 184–190. |
| [23] | KEEMBIYEHETTY C N, WILSON R P. Effect of water temperature on growth and nutrient utilization of sunshine bass (Morone chrysops ♀×Morone saxatilis ♂)fed diets containing different energy/protein ratios[J]. Aquaculture, 1998, 166(1/2): 151–162. |
| [24] | FIESS J C, KUNKEL-PATTERSON A, MATHIAS L, et al. Effects of environmental salinity and temperature on osmoregulatory ability, organic osmolytes, and plasma hormone profiles in the Mozambique tilapia (Oreochromis mossambicus)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2007, 146(2): 252–264. |
| [25] | CALDUCH-GINER J A, MINGARRO M, DE CELIS S V R, et al. Molecular cloning and characterization of gilthead sea bream (Sparus aurata) growth hormone receptor (GHR). Assessment of alternative splicing[J]. Comparative Biochemistry and physiology part B:Biochemistry and Molecular Biology, 2003, 136(1): 1–13. DOI:10.1016/S1096-4959(03)00150-7 |
| [26] | FUKADA H, OZAKI Y, PIERCE A L, et al. Salmon growth hormone receptor:molecular cloning, ligand specificity, and response to fasting[J]. General and Comparative Endocrinology, 2004, 139(1): 61–71. DOI:10.1016/j.ygcen.2004.07.001 |
| [27] | IMSLAND A K, BIÖRNSSON B T, GUNNARSSON S, et al. Temperature and salinity effects on plasma insulin-like growth factor-Ⅰ concentrations and growth in juvenile turbot (Scophthalmus maximus)[J]. Aquaculture, 2007, 271(1/4): 546–552. |
| [28] | MINGARRO M, DE CELIS S V R, ASTOLA A, et al. Endocrine mediators of seasonal growth in gilthead sea bream (Sparus aurata):the growth hormone and somatolactin paradigm[J]. General and Comparative Endocrinology, 2002, 128(2): 102–111. DOI:10.1016/S0016-6480(02)00042-4 |
| [29] | BECKMAN B R, SHIMIZU M, GADBERRY B A, et al. The effect of temperature change on the relations among plasma IGF-Ⅰ, 41-kDa IGFBP, and growth rate in postsmolt coho salmon[J]. Aquaculture, 2004, 241(1/4): 601–619. |
| [30] | PIERCE A L, BECKMAN B R, SCHEARER K D, et al. Effects of ration on somatotropic hormones and growth in coho salmon[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2001, 128(2): 255–264. DOI:10.1016/S1096-4959(00)00324-9 |
| [31] | JIANG J, WANG X D, HE K, et al. A conformationally sensitive GHR[growth hormone (GH) receptor] antibody:impact on GH signaling and GHR proteolysis[J]. Molecular Endocrinology, 2004, 18(12): 2981–2996. DOI:10.1210/me.2004-0102 |
| [32] | BARLOW C G, PEARCE M G, RODGERS L J, et al. Effects of photoperiod on growth, survival and feeding periodicity of larval and juvenile barramundi Lates calcarifer (Bloch)[J]. Aquaculture, 1995, 138(1/4): 159–168. |
| [33] | HART P R, HUTCHINSON W G, PURSER G J. Effects of photoperiod, temperature and salinity on hatchery-reared larvae of the greenback flounder (Rhombosolea tapirina Günther, 1862)[J]. Aquaculture, 1996, 144(4): 303–311. DOI:10.1016/0044-8486(96)01305-1 |
| [34] | BJÖRNSSON B T, HEMRE G I, BJØRNEVIK M, et al. Photoperiod regulation of plasma growth hormone levels during induced smoltification of underyearling Atlantic salmon[J]. General and Comparative Endocrinology, 2000, 119(1): 17–25. DOI:10.1006/gcen.2000.7439 |
| [35] | TAYLOR J F, MIGAUD H, PORTER M J R, et al. Photoperiod influences growth rate and plasma insulin-like growth factor-Ⅰ levels in juvenile rainbow trout, Oncorhynchus mykiss[J]. General and Comparative Endocrinology, 2005, 142(1/2): 169–185. |
| [36] | CRUZ E M V, BROWN C L. Influence of the photoperiod on growth rate and insulin-like growth factor-Ⅰ gene expression in Nile tilapia Oreochromis niloticus[J]. Journal of Fish Biology, 2009, 75(1): 130–141. DOI:10.1111/jfb.2009.75.issue-1 |
| [37] |
赵艳, 卢玲, 刘云章, 等. IGFBP-1的生理功能及其表达调控的研究进展[J].
山东农业科学, 2015, 47(1): 139–143.
ZHAO Y, LU L, LIU Y Z, et al. Research progress on physiological function and expression regulation of insulin-like growth factor-binding protein-1[J]. Shandong Agricultural Sciences, 2015, 47(1): 139–143. |
| [38] |
魏平. 胰岛素样生长因子结合蛋白-1(IGFBP-1) 研究进展[J].
国外医学分子生物学分册, 2002, 24(5): 269–272.
WEI P. Research progress of insulin-like growth factor binding protein-1(IGFBP-1)[J]. Foreign Medical Molecular Biology Volume, 2002, 24(5): 269–272. |
 2017,
Vol. 26
2017,
Vol. 26


