2. 远洋渔业协同创新中心, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306
大青鲨 (Prionace glauca) 隶属于真鲨目 (Carcharhiniformes),真鲨科 (Carcharhinoidei),大青鲨属 (Prionace),是一种大型远洋性中上层软骨鱼类,广泛分布于世界三大洋的热带、亚热带或温带海域,种群资源量较丰富[1]。
作为海洋生态系统食物链中顶级物种,鲨鱼类对海洋生态系统的稳定性和多样性起着十分重要的作用[2]。大青鲨作为鲨鱼类中的一种,在三大洋的延绳钓渔业中为主要兼捕鲨鱼种[3]。从印度洋的金枪鱼延绳钓兼捕量来看,印度洋金枪鱼委员会 (Indian Ocean Tuna Commission,IOTC)2000—2014年报告[4]数据显示2000—2006年印度洋的大青鲨兼捕量保持在500 t左右,2007年达到1 000 t以上,2012年达到最高的5 439 t,当前兼捕量在4 500 t左右,这不仅反映了大青鲨资源量丰富,同时也从侧面反映出了高强度的延绳钓捕捞作业。国际自然保护联盟 (International Union for Conservation of Nature,IUCN) 于2009年确定其为近危物种[5],2013年3月于泰国曼谷召开的《濒危野生动植物种国际贸易公约》(Convention on International Trade in Endangered Species of Wild Fauna and Flora, CITES) 第16届缔约方大会[6]通过了将路氏双髻鲨、无沟双髻鲨、锤头双髻鲨、长鳍真鲨和鼠鲨列入CITES附录Ⅱ的决议,这项决议引起了各区域渔业管理组织 (Regional Fisheries Management Organizations,RFMOs) 对鲨鱼类资源的关注;各国也积极制订鲨鱼国家行动计划对濒危的鲨鱼种群资源进行保护。大青鲨作为延绳钓渔业最主要的兼捕种,更是受到了国家和区域渔业管理组织的极大关注,对相关海域大青鲨资源量进行评估也列入了各区域渔业管理组织的工作范畴中。
鱼类生物学特性是种群资源评估的重要基础。大洋性鱼类的生物学数据收集较为困难,目前国内外主要对太平洋和大西洋的大青鲨年龄、生长、洄游和繁殖特性进行了研究[7-12],而有关印度洋海域的研究较少,并且缺乏该水域大青鲨基础生物学方面的信息。因此,本研究通过国家科学观察员在印度洋金枪鱼延绳钓船上收集到的数据,对该水域的大青鲨渔业生物学特征进行较为全面的研究,为我国参与国际鲨鱼养护和管理及区域渔业管理组织进行大青鲨资源评估提供了基础生物学数据。
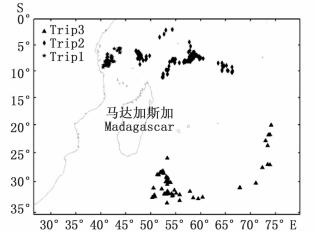
1 材料与方法 1.1 调查时间和区域印度洋延绳钓3个航次调查时间分别为2012年10月—2013年1月,2013年10月—2014年2月和2014年8月—2014年9月,航次1的作业区域为5°~10S°/40°~44°E,航次2的作业区域为1°~12°S/47°~67°E,航次3作业区域为19°~33°S/50°~75°E,调查区域为印度洋西南部海域,以马达加斯加岛为分界线,调查海域分别集中在马达加斯加北部海域和东南部附近海域。大青鲨为兼捕鱼种,由随船的科学观察员记录和整理数据,体重用磅秤称量,精确度为1 kg;体长用卷尺测量,精确度为1 cm。
|
图 1 调查区域
Fig. 1 Sampling areas for the blue shark in the Indian Ocean
|
观察员随船观察大青鲨的性别、性成熟度和胃含物等,并测量其叉长 (Fork length, LF):自吻端到尾鳍中央分叉处的长度 (cm)、加工重量 (Round weight, WR) 等数据。主要分析方法如下:
(1) 叉长分布以20 cm为组距,绘制雌雄样本频率分布图,确定优势叉长组;采用Kolmogorov-Smirnov检验方法检验雌雄样本长度分布有无显著性差异,通过t-test检验雌雄样本的叉长均值有无显著性差异。
(2) 通过鳍脚钙化程度来判断雄性大青鲨是否达到性成熟,当鳍脚呈完全钙化状态,则雄性达到成熟,反之为未成熟;通过观察生殖系统 (卵巢发育情况) 来判别雌性大青鲨的性成熟程度,雌性性成熟的特征为卵壳腺出现膨大或卵巢内可见黄色卵粒或子宫膨大 (子宫内有胎儿),子宫内壁有大量血丝 (内壁非发白) 等[13-14]。对各叉长组成熟个体的比率和叉长组组中值数据采用非线性Logistic模型[15]拟合, 建立成熟比例-叉长关系模型:
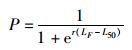 (1)
(1)
式中:LF为各叉长组组中值;P为各叉长组的成熟个体比率;r为曲线斜率;L50为50%成熟个体的叉长。
(3) 性比为雌性个体尾数除以雄性个体尾数乘100%,并采用χ2检验判断性比是否符合1:1。
(4) 摄食等级采用5级标准[16],分别为0级 (空胃)、1级 (胃内有少量食物, 体积不超过胃腔的1/2)、2级 (胃内食物较多, 体积超过胃腔的1/2)、3级 (胃内食物充满, 但胃壁不膨胀)、4级 (胃内食物饱满, 胃壁膨胀凸出)。
数据分析工具为Microsoft Excel 2010和SPSS17.0。
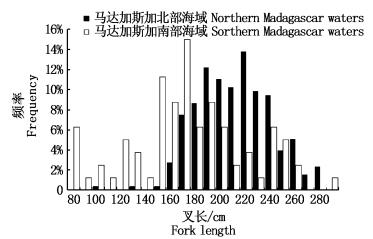
2 结果 2.1 群体组成的空间变化印度洋3个航次的调查范围按纬度差异可分为马达加斯加岛北部海域和东南部海域,马达加斯加岛北部海域的采样纬度范围为1°~12°S,东南部附近海域的采样纬度范围为19°~30°S。分析大青鲨叉长与纬度的关系 (图 2),马达加斯加岛北部区域捕获的大青鲨样本共253尾, 叉长范围为100~280 cm,平均值为 (207.6±30.6) cm,群体组成主要以大个体为主,优势叉长组为160~240 cm,占总数的83.0%,而马达加斯加岛南部海域捕获的大青鲨样本共80尾,叉长范围为74~285 cm,平均值为 (170.9±47.1) cm,群体组成主要以中小型个体为主,优势叉长组为140~200 cm,占总数的56.3%。经t检验, 马达加斯加岛东南部、北部海域捕获的大青鲨叉长均值呈极显著性差异 (P < 0.01)。
|
图 2 叉长与纬度关系
Fig. 2 Relationship of the fork length and latitude
|
航次1区域共收集大青鲨样品87尾,其中雌性57尾 (100~280 cm FL),雄性30尾 (150~280 cm FL),航次2区域共收集大青鲨样品173尾,其中雌性76尾 (172~282 cm FL),雄性97尾 (141~282 cm FL),航次3区域共收集大青鲨样品73尾,其中雌性24尾 (74~285 cm FL),雄性49尾 (77~254 cm FL),雌雄性比分别为2.00、0.78和0.49。经χ2检验,航次2区域采集的大青鲨雌雄样本符合1:1比例 (P=0.11 > 0.05),航次1和航次3区域采集的大青鲨雌雄样本不符合1:1比例 (P < 0.05)。
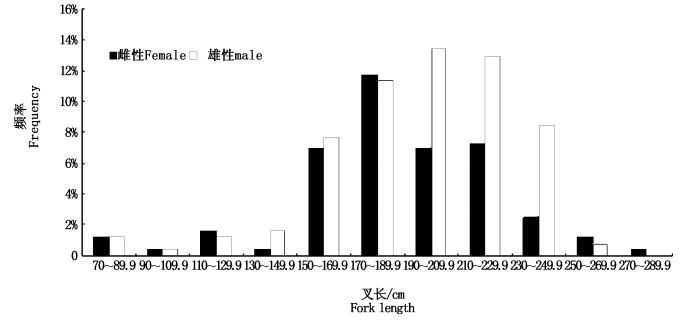
3个航次位于印度洋西南部海域,将3个航次数据合并分析,其中雌性157尾,雄性176尾,雌性叉长范围为74~285 cm,平均值 (208.5±40.72) cm,优势叉长组为150~229.9 cm,占总样本的32.84%;雄性叉长范围为77~282 cm,平均值为 (210.4±39.9) cm,优势叉长组为150~250 cm,占总样本的54.06%。雌、雄性比为0.91,符合1:1比例 (P=0.494>0.05);雌、雄的叉长分布无显著性差异 (P=0.592 > 0.05);经t检验,雌、雄的叉长均值无显著性差异 (P=0.672 > 0.05)。
|
图 3 印度洋大青鲨叉长分布
Fig. 3 Fork length frequency distribution for the blue shark in the Indian Ocean
|
通过观察雄性大青鲨的鳍脚钙化程度,11尾个体未达到性成熟,叉长范围为77~196 cm (x=150 cm),对应的鳍脚长度范围为5~14 cm (x=6.9 cm); 性成熟个体有115尾,叉长范围为120~282 cm (x=225.0 cm),对应的鳍脚长度范围为8~27 cm (x=19.2 cm)。根据记录的全部雄性大青鲨繁殖生物学数据,计算雄性大青鲨性成熟率的Logistic曲线方程为P=1/{1+e[-0.10×(LF-182.3)]},对应的50%雄性大青鲨性成熟叉长为182.3 cm (图 4)。
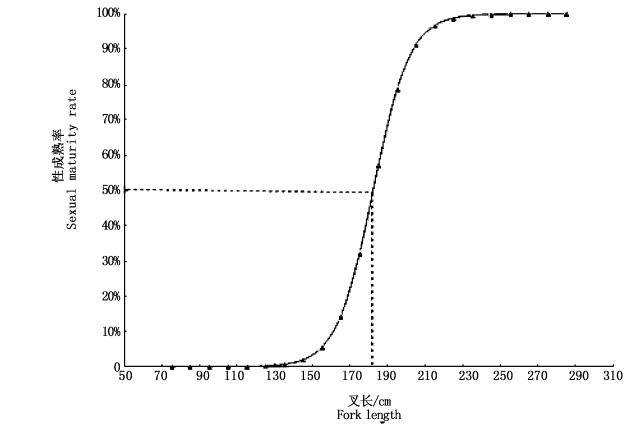
|
图 4 不同叉长组雄性大青鲨性成熟率和L50值
Fig. 4 Percentages of mature male of the blue shark with different fork length intervals and L50
|
通过观察雌性大青鲨的性腺发育状况,共记录115尾雌性大青鲨性成熟期情况,其中达到性成熟 (Ⅲ期以上) 的个体有90尾,对应叉长范围为172~285 cm,其中处于怀仔状态的雌性大青鲨15尾。根据记录的全部雌性大青鲨繁殖生物学数据,雌性大青鲨性成熟率的Logistic曲线方程为P=1/{1+e[-0.15×(LF-183.6)]},对应的50%雌性大青鲨性成熟叉长为183.6 cm (图 5)。
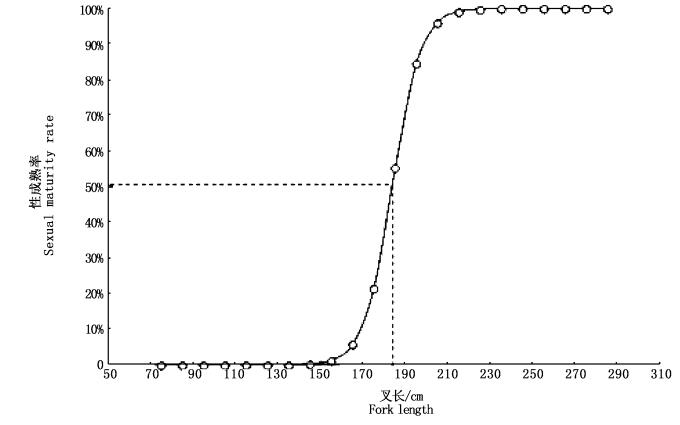
|
图 5 不同叉长组雌性大青鲨性成熟率和L50值
Fig. 5 Percentages of mature female of the blue shark with different fork length intervals and L50
|
观察样本的胃饱满度,主要以0级为主,其次为1级,共占总数的77.21%;2~4级所占比例较小 (表 1)。经Pearson相关分析显示,大青鲨的叉长分布与摄食等级相关性不显著 (P > 0.05),性腺成熟度与摄食等级也不存在显著相关性 (P > 0.05)。通过对样本的胃含物观察,发现大青鲨的胃含物中主要以帆蜥鱼和鱿鱼为主,另有一些其他食物如少量金枪鱼类、鲭和蟹。
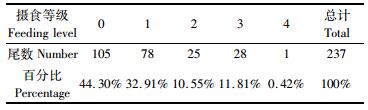
|
表 1 大青鲨摄食等级组成比例 Tab.1 Proportion of feeding levels for the blue shark |
本研究中,大青鲨兼捕数据来源于金枪鱼延绳钓渔业的商业捕捞数据,基于此,大青鲨的调查纬度跨度较大,但主要作业区域分布在印度洋南部的热带和温带海域。调查数据显示大青鲨的叉长分布范围较广,这与太平洋和大西洋兼捕大青鲨的叉长分布范围基本符合[8, 13]。通过对3个航次雌、雄样本的长度分布研究,发现雌、雄样本的叉长分布无显著性差异,且雄性大青鲨的叉长均值也与雌性样本无显著差异,这与吴峰等[13]和ZHU等[17]对大西洋和东太平洋的雌雄大青鲨叉长分布特征的研究不同。
从调查站点来看,3个航次在印度洋南部海域的作业区域主要集中在低纬度的马达加斯加岛北部区域 (即热带海域) 和纬度较高的马达加斯加岛东南部区域 (即温带海域)。本研究通过长度分布特征和繁殖生物学分析发现在热带海域兼捕的大青鲨以大型个体为主,而在温带海域捕获的大青鲨以中小型个体为主,高春霞等[18]在研究北大西洋大青鲨叉长与纬度关系分析时也发现北大西洋热带海域的大青鲨个体大于冰岛海域附近的大青鲨,究其原因,可能与大青鲨的高度洄游特征有关。由于本调查受商业性捕捞限制,因此有关印度洋大青鲨的洄游模式尚需进一步研究查明。
本研究对印度洋南部海域333尾大青鲨样本的性比进行了分析,经检验性比符合1:1,与PRATT[19]、STEVENS[20]对北大西洋海域大青鲨雌雄性比的研究一致,和HENDERSON等[21]的研究结果也相同。然而,分航次对印度洋南部海域大青鲨样本性比的分析情况看,航次1的大青鲨雌雄性比符合1:1比例,航次2和航次3均不符合1:1比例,究其原因,可能是航次2和航次3调查样本容量较小,由偶然性造成的偏差;但也有可能是栖息环境不同导致大青鲨繁殖习性出现差异,根据国外学者研究,某些海域大青鲨确实存在雌雄性比不符合1:1的情况,如在地中海兼捕的大青鲨主要以雄性为主[11],而爱尔兰沿岸海域捕获的大青鲨以雌性为主[22]。本次调查观测126尾雄性大青鲨样本中,约8.7%的样本未达到性成熟,而未性成熟样本中约90.9%来自温带海域;观测的热带海域的雄性大青鲨样本达到性成熟的比例为90.7%。通过分析115尾雌性大青鲨样本性成熟情况,同样发现热带海域雌性大青鲨性成熟比例显著高于温带海域,且观测中发现正怀仔的雌性大青鲨中有89.3%来自热带海域。可见,印度洋南部海域成体大青鲨的主要活动区域为热带海域。
印度洋金枪鱼委员会 (IOTC) 在2015年印度洋大青鲨现状的报告[23]中指出,印度洋雌性大青鲨达到50%性成熟对应的全长为194 cm,雄性达到50%性成熟时对应的全长为201 cm,转换成叉长后与本文结果相一致。
本研究观测的89尾大青鲨的胃含物样本显示,大青鲨的食物包括鱿鱼、帆蜥、鲭、甲壳类、沙丁和金枪鱼类等,其中以鱿鱼和帆蜥为主,分别占总样本的42%和38%,这与西南大西洋热带水域大青鲨对头足类和小型硬骨鱼类的摄食率基本吻合[24]。日本研究者在白令海发现的大青鲨胃含物中,头足类出现频率高达74.5%[25]。另有研究表明,由于口裂大小的不同,鲨鱼摄食的种类与其个体大小有重要的关系[26]。本研究中,胃含物中仅含鱿鱼和沙丁鱼的大青鲨占总样本的27.0%,平均叉长为224 cm;胃含物中含有帆蜥、金枪鱼等大型硬骨鱼类的大青鲨占总样本的71.2%,平均叉长为225 cm。结果显示鲨鱼摄食种类与个体大小无显著关系,可能是因为调查海域内金枪鱼类等硬骨鱼类资源比较丰富,可以满足不同大小大青鲨的捕食需求,因此对鱿鱼、甲壳类等食物的需求减少。
本研究的采样区域属于印度洋西南部海域,鉴于渔业生产的局限性及海上安全性调查考虑,取样范围未能全部覆盖整个印度洋海域,且观察员在海上收集数据依赖于商业性渔船,而渔船总是倾向于目标鱼种集中的地方,因此调查数据可能存在一定的误差;另外,由于前人对该区域大青鲨种群分子研究的缺乏,本研究未考虑该区域大青鲨是否存在不同群体,这需在今后的研究中进一步深入了解。由于在大洋里实施专项的科研调查花费较高,导致大洋鱼类样本收集较为困难, 本文的研究有助于人们更好地理解印度洋大青鲨的生物学信息,为我国科研工作者从事印度洋大青鲨资源评估提供基础数据,以更好地履行国际渔业可持续发展的义务。
| [1] | MEJUTO J, GARCIÍA-CORTEÉS B. Reproductive and distribution parameters of the blue shark Prionace glauca, on the basis of on-board observations at sea in the Atlantic, Indian and Pacific Oceans[J]. Collective Volume of Scientific Papers, ICCAT, 2005, 58(3): 951–973. |
| [2] | CAMHI M D, PIKITCH E K, BABCOCK E A. Sharks of the open ocean:biology, fisheries and conservation[M]. America: Wiley-Blackwell, 2008: 1-5. |
| [3] | HAZIN F H V, HAZIN H G, TRAVASSOS P. CPUE and catch trends of shark species caught by Brazilian longliners in the southwestern Atlantic Ocean[J]. Collective Volume of Scientific Papers, ICCAT, 2007, 60(2): 636–647. |
| [4] | Indian Ocean Tuna Commission[EB/OL]. 2016.http://iotc.org/oqs#fieldset-generate-report.2016 |
| [5] | The IUCN red list of threatened species:Prionace glauca[EB/OL]. (2005-10-01).http://www.iucnredlist.org/details/39381/0 |
| [6] |
《濒危野生动植物种国际贸易公约》(CITES) 规定和我国履约政策介绍[EB/OL]. 上海: 上海水产行业协会, (2014-10-24). http://www.fishery.org.cn/fishery/article.jsp?id=1414133415594.
Regulations of CITES and introductions of china's policy for execution of treaty[EB/OL]. Shanghai:Shanghai Fisheries Trade Association, (2014-10-24).http://www.fishery.org.cn/fishery/article.jsp?id=1414133415594. |
| [7] |
刘一淳, 朱国平, 戴小杰. 东太平洋大青鲨年龄与生长的研究[J].
海洋渔业, 2006, 28(2): 124–128.
LIU Y C, ZHU G P, DAI X J. Age and growth of Prionaceglanca in the East Pacific Ocean[J]. Marine Fisheries, 2006, 28(2): 124–128. |
| [8] |
戴小杰, 许柳雄. 东太平洋热带海域大青鲨繁殖生物学特征[J].
水产学报, 2005, 29(4): 565–569.
DAI X J, XU L X. Reproductive biology characteristics of Prionace glauca in the tropical Eastern Pacific Ocean[J]. Journal of Fisheries of China, 2005, 29(4): 565–569. |
| [9] |
高春霞, 戴小杰, 吴峰, 等. 北大西洋大青鲨年龄和生长初步研究[J].
上海海洋大学学报, 2013, 22(1): 120–127.
GAO C X, DAI X J, WU F, et al. A preliminary study on age and growth of the blue shark (Prionace glauca) in the North Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2013, 22(1): 120–127. |
| [10] | SKOMAL G B, NATANSON L J. Age and growth of the blue shark (Prionace glauca) in the North Atlantic Ocean[J]. Fishery Bulletin, 2003, 101(3): 627–639. |
| [11] | MEGALOFONOU P, DAMALAS D, DE METRIO G. Biological characteristics of blue shark, Prionace glauca, in the Mediterranean Sea[J]. Journal of the Marine Biological Association of the United Kingdom, 2009, 89(6): 1233–1242. DOI:10.1017/S0025315409000216 |
| [12] | HAZIN F H V. Fisheriesoceano graphical study on tuna, billfishes and sharks in the southwestern equatorial Atlantic ocean[D]. Tokyo:Tokyo University of Fisheries, 1993:286. |
| [13] |
吴峰, 戴小杰, 姜润林. 热带中东大西洋海域大青鲨繁殖生物学研究[J].
海洋湖沼通报, 2012: 29–36.
WU F, DAI X J, JIANG R L. Reproductive biology of blue shark in the tropical Eastern Central Atlantic Ocean[J]. Transactions of Oceanology and Limnology, 2012: 29–36. |
| [14] |
高春霞, 田思泉, 戴小杰, 等. 热带中东大西洋拟锥齿鲨生物学的初步研究[J].
上海海洋大学学报, 2013, 22(2): 289–294.
GAO C X, TIAN S Q, DAI X J, et al. Preliminary analysis of the biology of the crocodile shark, Pseudocarcharias kamoharai in the tropical Eastern-central Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2013, 22(2): 289–294. |
| [15] | OLIVEIRA P, HAZIN F H V, CARVALHO F, et al. Reproductive biology of the crocodile shark Pseudocarcharias kamoharai[J]. Journal of Fish Biology, 2010, 76(7): 1655–1670. DOI:10.1111/jfb.2010.76.issue-7 |
| [16] | MEJUTO J, DE LA SERNA J M, GARCIA B, et al. An overview of the sex-ratio at size of the swordfish (Xiphias gladius L.) around the world:similarity between different strata[J]. ICCAT Collective Volume of Scientific Papers, 1995, 44(3): 197–205. |
| [17] | ZHU J F, DAI X J, XU L X, et al. Reproductive biology of female blue shark Prionace glauca in the southeastern Pacific Ocean[J]. Environmental Biology of Fishes, 2011, 91(1): 95–102. DOI:10.1007/s10641-010-9763-1 |
| [18] |
高春霞. 北大西洋大青鲨生物学研究及种群统计分析[D]. 上海: 上海海洋大学, 2013.
GAO C X. Observations on the biology and demographic analysis for the blueshark in the North Atlantic Ocean[D]. Shanghai:Shanghai Ocean University, 2013. |
| [19] | PRATT H L J R. Reproduction in the blue shark, Prionace glauca[J]. Fishery Bulletin, 1979, 77(2): 445–470. |
| [20] | STEVENS J D. Vertebral rings as a means of age determination in the blue shark (Prionace glauca L.)[J]. Journal of the Marine Biological Association of the United Kingdom, 1975, 55(3): 657–665. DOI:10.1017/S0025315400017318 |
| [21] | HENDERSON A C, FLANNERY K, DUNNE J. Observations on the biology and ecology of the blue shark in the North-east Atlantic[J]. Journal of Fish Biology, 2001, 58(5): 1347–1358. DOI:10.1111/jfb.2001.58.issue-5 |
| [22] | WHELAN K. The sea angler in Ireland[M]. Dublin: Town House, 1991. |
| [23] | IOTCSecretariat.Status of the Indian Ocean blue shark (BSH:Prionace glauca)[R]. IOTC-2014-SC17-ES17, Indian Ocean Tuna Commission, 2015. |
| [24] | HAZIN F H V, LESSA R P, CHAMMAS M. First observations on stomachs contents of the blue shark, Prionace glauca, from southwestern equatorial Atlantic[J]. RevistaBrasileirade Biologia, 1994, 54(2): 195–198. |
| [25] | KUBODERAT, WATANABE H, ICHII T. Feeding habits of the blue shark, Prionace glauca, and salmon shark, Lamnaditropis, in the transition region of the Western North Pacific[J]. Reviews in Fish Biology and Fisheries, 2007, 17(2): 111–124. |
| [26] | LUCIFORAL O, GARCÍAV B, MENNIR C. Effects of body size, age and maturity stage on diet in a large shark:ecological and applied implications[J]. Ecological Research, 2009, 24(1): 109–118. DOI:10.1007/s11284-008-0487-z |
2. Collaborative Innovation Center for Distant-water Fisheries, Shanghai 201306, China;
3. National Distant-water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China;
4. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


