2. 上海海洋大学 水产与生命学院, 上海 201306
我国是盐碱水资源较多的国家,约有0.46亿公顷,主要分布在东北、华北、西北内陆地区的19个省、市和自治区[1]。其中东北地区多为碳酸盐类型水体,这种水体虽然盐度不高(1~5) ,但具有高碳酸盐碱度、高pH和高离子系数特点[2]。研究发现高碳酸盐碱度先于盐度限制鱼类的生存、生长和繁殖,因此极大地限制了内陆东北地区盐碱水的开发利用进程[2]。
瓦氏雅罗鱼(Leuciscus waleckii,以下简称雅罗鱼)隶属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、雅罗鱼亚科(Leuciscinae),俗称东北雅罗鱼、华子鱼、白鱼,是我国北方知名的土著鱼类[3]。雅罗鱼主要分布在黑龙江流域、辽河及内蒙古一些内陆盐碱湖泊中,具有极强的耐受碳酸盐碱度(Carbonate alkalinity,CA)特性,能够在内陆高盐碱湖泊达里湖(CA53.57,pH 9.6) 中生存[4];这些天然优势使其成为开展鱼类耐盐碱分子生理机制研究及内陆三北地区盐碱水域增养殖的理想材料。
呼吸和排泄是鱼类新陈代谢活动的重要生理指标,耗氧率和排氨率的高低反映了生物体内糖、脂肪和蛋白质的代谢情况。鱼类除受自身因素(种类、个体大小和生理状态等)和摄食情况的影响外,其耗氧率和排氨率还受水环境因素的影响。其中水温、pH和盐度对鱼类耗氧率和排氨率的影响已有诸多文献报道,如盐度对鲢(Hypophthalmichthys molitrix)[5]、鲤(Cyprinus carpio)[6]和大菱鲆幼鱼(Scophamus maximus)[7],盐度和pH对日本黄姑鱼(Nibea japonica)幼鱼[8],温度、盐度和pH对鲻(Mugil cephalus)幼鱼耗氧率和排氨率的影响[9];而碱度对鱼类基础生理代谢方面的研究则主要集中在几种适应高盐碱湖泊的土著鱼类,如马加迪湖罗非鱼(Oreochromis alcalicus grahmi)[10]、尖喉鳟(Oncorhynchus clarki henshawi)[11]、青海湖裸鲤(Gymnocypris przewalskii)[12]以及达里湖雅罗鱼[13]等。
基于雅罗鱼转录组数据[14],本研究通过设定不同浓度的碳酸盐碱度,将雅罗鱼在不同碱度胁迫下的生理变化过程(如耗氧率、排氨率、血氨浓度等)及可能参与这些生理过程的基因表达情况首次进行关联分析,系统地阐述雅罗鱼在高碱胁迫下的生理代谢策略及可能的分子机制,同时为雅罗鱼在内陆三北地区碳酸盐类型盐碱水域的增养殖提供科学依据。
1 材料与方法 1.1 实验材料雅罗鱼为课题组2009年从内蒙古达里湖引进,本实验于2015年4月在黑龙江水产研究所进行,实验鱼为人工繁育获得的F3。选取大小一致,体质量为(84.62±6.70) g,全长为(18.19±0.55) cm,健康活泼的F3个体50尾放在室内循环水族箱中(96.5 cm×52.5 cm×45.5 cm)暂养一周。实验水为过滤、曝气24 h的自来水,水温(20±2) ℃,pH 7.25,溶解氧6.38 mg/L,氨氮0.32 mg/L,盐度为0.10 g/L,总碱度为0.44 mmol/L,总硬度为80.08 mg/L。实验前48 h停止投食。
1.2 碳酸盐碱度梯度的设置根据池炳杰等[15]的报道,雅罗鱼96 h 100%的存活率为CA115。因此,本研究共设定了6个碳酸盐碱度梯度(分别为10、30、50、70、90、110 mmol/L)和1个淡水对照组(CA0.44 mmol/L),每个处理组分别设置2个平行组。采用NaHCO3 (分析纯)配置相应的碱度,然后用0.02 mol/L的盐酸标定,以酚酞、甲基橙-苯胺蓝(混合)作指示剂[16]。实测碱度分别为9.4、29.6、48.0、69.6、88.0和109.2 mmol/L。
1.3 不同碱度雅罗鱼耗氧率和排氨率的测定采用封闭流水式呼吸法[17]测定雅罗鱼耗氧率和排氨率。首先在配好相应碱度的水槽(64 cm×33 cm×19 cm)内分别放入5尾实验鱼,使其适应4 h,保持水温在18~19 ℃,白天室内自然光照。然后将有机玻璃封闭式流水式呼吸室(图 1,容积大小20 L)逐一放入对应碱度的水槽中,将5尾实验鱼全部装入呼吸室,排净呼吸室内的空气,为消除试验鱼在转移过程中应激作用对耗氧率和排氨率的影响,实验鱼转移到呼吸室中稳定1 h后再开始测定。待实验鱼处于自然状态时,通过调节出水阀门测定流速,保持各实验组流速在6~7 mL/s之间,然后开始计时。每隔1小时测定1次单位时间的水流量、呼吸室进出水的溶解氧和氨氮含量,连续测3次单位时间作为重复。采用碘量法[18]测定水样中的溶解氧和纳氏试剂分光光度法[19]测定水样中的氨氮含量。

|
图 1 封闭流水式呼吸室
Fig. 1 Closed water breathing chamber
|
耗氧率的计算公式:
 (1)
(1)
式中:OCR为耗氧率(mg/g·h);DO0为进水口溶氧(mg/L);DO1为出水口溶氧(mg/L);V为单位时间水流量(L/h);W为实验鱼体质量(g)。
排氨率的计算公式:
 (2)
(2)
式中:AER为排氨率(μg/g·h);N0为进水口氨氮含量(μg/g);N1为出水口氨氮含量(μg/g);V为单位时间水流量(L/h);W为实验鱼体质量(g)。
1.5 样品采集实验结束后,将实验鱼从呼吸室倒入到相应碱度的水槽中,样品采集前进行麻醉(丁香油,20 mg/L)。用纱布吸干鱼体表水分,称重并测量体长。用浸润肝素钠(50 μL)的2 mL注射器从鱼体尾静脉抽血,将采集的血液置于1.5 mL离心管中,于4 000 r/min,常温离心8 min (Sigma 1-14) ,取上层血浆于-40 ℃冰箱保存用于血氨含量的测定,同时采集对应鱼体的鳃组织置于液氮中用于后续Rh排氨基因家族的定量表达分析。
1.6 血氨含量的测定采用血氨试剂盒(南京建成生物科技有限公司)测定血液氨氮总含量,具体操作步骤根据试剂盒说明书进行。采用酶标仪(BioTek Synergy 2) 在630 nm 处测定各样品吸光度值,根据试剂盒说明书所附公式计算血氨总含量。
1.7 鳃组织排氨基因(Rh)定量PCR检测4种Rh基因及18 S引物采用CHANG等发表的引物[20]。采用SV Total RNA Isolation System试剂盒(Promega)提取总RNA,PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)试剂盒反转录成cDNA。采用ABI 7500定量PCR 仪(Applied Biosystem 7500) 检测基因的表达量。SYBR定量PCR反应体系为20 μL:SYBR premix Ex Taq (TaKaRa)10 μL,Rox Reference Dye 0.4 μL,引物1.6 μL,cDNA 模板2 μL,RNase-free water 6 μL。PCR 反应程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
1.8 数据分析耗氧率和氨氮排泄率参考吕富等[21]报道的方法;基因表达量采用2-ΔΔCt法[22]。实验数据采用平均值±标准差表示,利用Excel 2010和SPASS 19.0软件进行数据统计分析。组间差异采用Duncan氏多重比较,显著水平为P< 0.05,极显著水平为P<0.01。
2 结果与分析 2.1 不同碱度对雅罗鱼耗氧率的影响随着碱度的上升,雅罗鱼的耗氧率呈先下降后上升的趋势,但碱度处理组的耗氧率显著低于对照组(P<0.01) 。在CA30~70时,耗氧率虽有一定的下降,但各组间无明显差异(P>0.05) ;在CA 90时达到最低值,耗氧率为(0.186±0.018) mg/(g·h),但与CA70处理组差异不显著(P>0.05) ;随后在CA110时则有所上升,二者差异显著(P< 0.05) ,见图 2。
2.2 不同碱度对雅罗鱼排氨率的影响随着碱度的上升,雅罗鱼的排氨率均明显低于对照组,差异极显著(P<0.01) ;与耗氧率的研究结果相似,在CA30~70时,排氨率虽有一定的下降,但各组间无明显差异(P>0.05) ;在CA90时排氨率达到最低值,为(3.37±1.24) μg/(g·h),随后在CA110有所上升,但差异不显著(P>0.05) ,见图 3。

|
图 2 不同碱度对雅罗鱼耗氧率的影响
Fig. 2 The influence of different alkalinity conditons on oxygen consumption rate in L. waleckii
不同字母表示不同组间差异显著(P< 0.05) ,图 3-6同。 Different letters indicate significant difference between different groups(P< 0.05) ,the same in fig. 3-6. |

|
图 3 不同碱度对雅罗鱼排氨率的影响
Fig. 3 The influence of different alkalinity conditions on ammonia excretion rate in L. waleckii
|
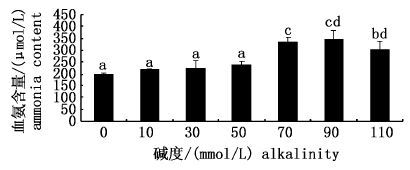
随着碱度的上升,雅罗鱼血氨含量呈先上升后下降的趋势,在CA90时达到最高值,血氨含量为(346.51±36.48) μmol/L,随后在CA110时有所下降。单因素方差分析显示,碱度低于50时,各低碱度组与对照组血氨含量差异不明显(P>0.05) ;当碱度高于50时,各高碱度组与低碱度组及对照组差异极显著(P<0.01) ,见图 4。
|
图 4 不同碱度对雅罗鱼血氨含量的影响
Fig. 4 The influence of different alkalinity conditions on plasma ammonia content in L. waleckii
|
与对照组相比,Rhcg1在所有碱度处理组表达量明显增加(P< 0.05) ,增幅为对照组的1.38~3.51倍,其中CA110增幅最大;Rhag在CA10、CA30 、CA90和CA110 4个碱度组表达量有所增加,增幅分别为1.46倍、1.95倍、2.66倍和1.66倍;Rhbg在不同碱度处理组表达量增加不明显,仅在CA30 和CA90表达量有所增加,增幅为1.33倍和1.25倍;Rhcg2只在两个高碱度组(CA90 和CA110) 表达量增加明显,其增幅为对照组的1.71倍和4.00倍。各碱度组相比,Rhcg1和Rhcg2在CA110的表达量显著高于其他碱度组(P< 0.05) ;Rhag在CA90的表达量显著高于其他碱度组(P< 0.05) ,而Rhbg在各碱度组的表达差异不明显,CA10的表达量显著低于CA30、CA70、CA90和CA110,见图 5。

|
图 5 4 种Rh基因在不同碱度雅罗鱼鳃组织中的表达量
Fig. 5 Expression levels of Rhag,Rhbg,Rhcg1 and Rhcg2 in gill in L. waleckii under different alkalinity conditions
|
由图 6可知,雅罗鱼在碱度为CA≤70时,氧氮比(O∶N)为31.150~35.446,各组间无显著性差异(P>0.05) ;而在碱度为90~110时,O∶N为55.349和57.372,明显高于其他碱度组及对照组(P< 0.05) 。

|
图 6 不同碱度条件下雅罗鱼氧氮比
Fig. 6 Oxygen-nitrogen ratio of L. waleckii under different alkalinity conditions
|
为了适应各种盐度、各种离子组成和变化的pH,鱼类必须拥有高效的离子和渗透压调节机制[23]。RAO等[24]认为,鱼类处于等渗点的盐度时,耗氧率最低,偏离等渗点,耗氧率上升。此观点在一些海水鱼类的相关研究中得以证实。如对1.0~2.5 g的平鲷(Rhabdosargus sarba)[25]、日本鳗鲡(Anguilla japonica)仔鱼[26]和云斑(Ictalurus nebulosus)[27]在不同盐度条件下的耗氧率检测发现,鱼类的耗氧率随着盐度的增加而逐渐下降,即在低盐度条件下的耗氧率高于高盐度条件。同样地,水体碳酸盐碱度的改变,也会对鱼体的渗透压平衡造成冲击。然而郑伟刚等[28]研究发现,随着碱度的升高,彭泽鲫(Carassius auratus var pengzenensis)幼鱼耗氧率随之升高。究其原因可能是彭泽鲫长期生活在淡水中,对碱度的耐受力差,只能通过提高新陈代谢速率以满足体内的能量需求。达里湖雅罗鱼长期生活在高盐碱湖泊中,对高碱度具有极强的耐受力。从本文的研究结果也可以看出,当碱度为30~70 mmol/L时,达里湖雅罗鱼的耗氧率基本维持不变,这与青海湖裸鲤的研究结果相似[29],表明耐盐碱鱼类在其适宜碱度范围内能够通过维持其生理稳态达到对高盐碱环境的适应。近期,王楠等[30]研究发现,在相同碱度胁迫下(CA60) 达里湖雅罗鱼和松花江雅罗鱼的耐低氧诱导因子HIF-3α基因呈现截然不同的表达方式,松花江雅罗鱼诱导其高表达,而达里湖雅罗鱼抑制其表达,进一步表明达里湖雅罗鱼在其适宜碱度范围内无需提高新陈代谢水平抵御高碱度胁迫。总体来看,达里湖雅罗鱼其耗氧率随着碱度的增加而下降,该结果与海水鱼类的研究结果类似,并在CA90达到最低,该结果是否说明达里湖雅罗鱼在CA90时达到了等渗点还有待进一步的深入研究,但后续相应条件下的排氨率和血氨含量进一步证实CA90可能是达里湖雅罗鱼所能承受的最大碱度胁迫压力。该结果对今后开展达里湖雅罗鱼在不同类型盐碱水域的增殖放流具有重要的指导意义。
3.2 达里湖雅罗鱼的排氨策略及分子机制氨是体内蛋白质代谢的最终产物。正常条件下鱼类排氨是没有问题的,但在高盐碱条件下,氨中毒被证明是一些鱼类无法适应高盐碱环境的主要原因[11]。尽管如此,世界各国的一些高盐碱湖泊仍有鱼类存活并形成旺族。研究发现,进化出特殊的排氨机制是这些耐盐碱鱼类存活的制胜法宝。如马加迪湖(pH 10.0,CA400 mmol/L)的罗非鱼可以将氮废物完全以尿素的方式排出[31],而其他耐盐碱鱼类仍以排氨的方式解决其氨氮排泄问题,如土耳其凡湖(pH 9.8,CA153 mmol/L)的卡拉白鱼(Chalcalburnus tarichi)[32]、我国青海湖(pH 9.4,CA30 mmol/L)的裸鲤[33]及达里湖的雅罗鱼[10]。那么,这些排氨的耐盐碱鱼类是如何实现逆境排氨的呢?WANG等[33]认为不同的水体缓冲力(碱度)是造成马加迪湖罗非鱼和其他耐盐碱鱼类排氨策略差异的主要原因,但尚无相关证据。本研究通过设定不同碱度(水体缓冲力)测定达里湖雅罗鱼的排氨速率发现,随着碱度的上升,达里湖雅罗鱼的排氨速率被明显抑制,这与安晓萍等[13]测定的研究结果一致,说明达里湖雅罗鱼通过降低排氨速率适应高盐碱环境。但是从我们的研究结果也可以看出,随着碱度的上升,尽管排氨速率下降了,但并未完全抑制(图 3)。近年来研究发现,氨转运蛋白Rh 家族在鱼类逆境排氨过程中发挥着重要作用[34]。本课题组前期通过转录组差异表达研究发现,达里湖雅罗鱼至少存在4种Rh基因,且在碱度胁迫下显著高表达[20]。本研究检测结果显示,随着碱度的上升,调控氨氮排泄的Rh 基因家族均有不同程度的上调表达,其中Rhcg1全部上调表达,而且与Rhcg2在高碱度组(CA110) 上调表达最明显,这与CA110 排氨速率有所上升的结果不谋而合(图 3,5)。根据Rh基因的表达可以看出,达里湖雅罗鱼通过启动排氨基因的高表达以此解决其在高盐碱环境下的排氨难题。该结果与赵兰等[35]在鲤、MARVIN等[36]在斑马鱼(Danio rerio)幼鱼和成鱼的研究结果类似。
另外,从不同碱度测得的血氨含量可以看出,随着碱度的上升,雅罗鱼血氨含量随之升高,并在CA90时达到最高值,与氨氮排泄率的最低点相呼应。同时发现,碱度在0~50之间,雅罗鱼血氨含量无显著差异(P>0.05,图 4),该结果与安晓萍等[10]的结论是一致的。说明达里湖雅罗鱼通过保持体内正常浓度的氨氮含量适应高盐碱环境。但是从排氨率来看,所有碱度组的排氨率明显低于对照组(P< 0.05,图 3),包括与达里湖雅罗鱼自然生存环境碱度相近的CA50,说明达里湖雅罗鱼在高碱适应过程中,可以将体内积累的多余氨消耗掉以此避免氨中毒。已有研究表明,耐盐碱鱼类可能通过降低体内的氨氮排泄率或将积累的氨转化成无毒的氨基酸或尿素达到对高盐碱高pH环境的适应[37]。常玉梅等研究发现,随着碱度的上升,达里湖雅罗鱼血浆游离氨基酸和尿素含量均有明显增加。这些研究结果进一步从侧面证实了达里湖雅罗鱼可以将体内多余的氨通过转化成无毒的氨基酸和尿素,从而保持体内正常的氨氮含量,实现在高碱环境下的长期存活。
3.3 达里湖雅罗鱼高碱胁迫下的能量代谢氧氮比作为估计生物体代谢中能源物质消耗的一个重要指标,可以反映机体内蛋白质、脂肪和碳水化合物三者提供能量的比例。MAYZAUD等[38]指出如果完全以蛋白质提供能量,O∶N为7~10;IKEDA指出如果以蛋白质和脂肪供能,O∶N为24[39];CONOVER等[40]提出如果完全以脂肪或碳水化合物提供能量,O∶N将无穷大。已有研究发现,盐度对尼罗罗非鱼(Oreochromis niloticus)[41]和缢蛏(Sinonovacula constricta)[42]O∶N的影响基本符合上述变化规律。因此,O∶N的变化可能与自身所处环境压力密切相关,可以作为生物反映其适应环境压力的一项指标[43]。本研究中,达里湖雅罗鱼在其适宜碱度范围内(CA ≤70) 时,O∶N无显著变化(P>0.05) ,表明达里湖雅罗鱼不需要消耗过多的能源物质即可实现生理稳态,这与耗氧率的结果是相符的。但当碱度达到CA90时,达里湖雅罗鱼则开始启动耗能程序,其中脂肪和碳水化合物的代谢水平远高于蛋白质,通过减少蛋白质耗能,以此降低毒氨的产生(图 6)。该结果为以后的实际生产养殖(如饲料配方的选择)等方面提供了重要借鉴。
| [1] | 王慧, 来琦芳, 房文红.沧州运东地区盐碱水资源对开展渔业的影响[J]. 河北渔业, 2003: 16–18. WANG H, LAI Q F, FANG W H.Infection of saline-alkali water resource to fishery development in area east of canal of Cangzhou city[J]. Hebei Fisheries, 2003: 16–18. |
| [2] | 杨富亿, 李秀军, 杨欣乔, 等.凡纳滨对虾对东北碳酸盐型盐碱水域的适应能力[J]. 海洋科学, 2008, 32(1): 41–44. YANG F Y, LI X J, YANG X Q, et al.Adaptability of Litopenaeus vannamei to carbonate saline-alkaline waters in northeast China[J]. Marine Sciences, 2008, 32(1): 41–44. |
| [3] | 李延松, 董崇智, 赵春刚.黑龙江上游黑河江段瓦氏雅罗鱼渔业生物学研究[J]. 黑龙江水产, 2004: 36–38. LI Y S, DONG C Z, ZHAO C G.Study on the fishery biology of Leuciscus waleckii (Dybowski) in Heilongjiang section of the upstream of Heilongjiang River[J]. Heilongjiang Fisheries, 2004: 36–38. |
| [4] | 池炳杰, 常玉梅, 闫学春, 等.瓦氏雅罗鱼达里湖群体和乌苏里江群体的遗传多样性和遗传结构分析[J]. 中国水产科学, 2010, 17(2): 228–235. CHI B J, CHANG Y M, YAN X C, et al.Genetic variability and genetic structure of Leuciscus waleckii Dybowski in Wusuli River and Dali Lake[J]. Journal of Fishery Sciences of China, 2010, 17(2): 228–235. |
| [5] | VON OERTZEN J A.Resistance and capacity adaptation of juvenile silver carp, Hypophthalmichthys molitrix (Val.), to temperature and salinity[J]. Aquaculture, 1985, 44(4): 321–332. |
| [6] | WANG J Q, LIU H L, PO H Y, et al.Influence of salinity on food consumption, growth and energy conversion efficiency of common carp (Cyprinus carpio) fingerlings[J]. Aquaculture, 1997, 148(2/3): 115–124. |
| [7] | 唐贤明, 隋曌, 田景波, 等.盐度对大菱鲆幼鱼耗氧率和排氨率的影响[J]. 南方水产, 2006, 2(4): 54–58. TANG M X, SUI Z, TIAN J B, et al.Effects of salinity on metabolic rate of juvenile turbot (Scophamus maximus)[J]. South China Sea Fisheries Science, 2006, 2(4): 54–58. |
| [8] | 柴学军, 胡则辉, 徐君卓, 等.盐度和pH对日本黄姑鱼幼鱼耗氧率和排氨率的影响[J]. 浙江海洋学院学报(自然科学版), 2009, 28(2): 146–150. CHAI X J, HU Z F, XU J Z, et al.Effect of salinity and pH on oxygen consumption rate and ammonia excretion rate in Juvenile Nibea japonica[J]. Journal of Zhejiang Ocean University (Natural Science), 2009, 28(2): 146–150. |
| [9] | 李加儿, 曹守花, 区又君, 等.温度、盐度和pH对鲻幼鱼耗氧率、排氨率以及窒息点的影响[J]. 中国水产科学, 2014, 21(5): 954–962. LI J E, CAO S H, QU Y J, et al.Influence of temperature, salinity, and pH on oxygen consumption rate, ammonia excretion rate, and suffocation point in juvenile Mugil cephalus[J]. Journal of Fishery Sciences of China, 2014, 21(5): 954–962. |
| [10] | BERGMAN A N, LAURENT P, OTIANG'A-OWITI G, et al.Physiological adaptations of the gut in the Lake Magadi tilapia, Alcolapia grahami, an alkaline- and saline-adapted teleost fish[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2003, 136(3): 701–715. |
| [11] | ROBINSON M L. Physiological and genetic factors influencing thermal tolerance in the Lahontan Cutthroat Trout (Oncorhynchus clarkii henshawi)[D]. Reno: University of Nevada, 2010. |
| [12] | WANG Y S, GONZALEZ R J, PATRICK M L, et al.Unusual physiology of scale-less carp, Gymnocypris przewalskii, in Lake Qinghai: A high altitude alkaline saline lake[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2003, 134(2): 409–421. |
| [13] | 安晓萍, 齐景伟, 罗旭光, 等.不同水体中瓦氏雅罗鱼的氨氮排泄率以及血液和组织中氨氮含量研究[J]. 现代农业科技, 2014: 244–245. AN X P, QI J W, LUO X G, et al.Ammonia excretion rates and contents in blood and other tissues in Leuciscus waleckii from different water systems[J]. Modern Agricultural Science and Technology, 2014: 244–245. |
| [14] | CHANG Y M, TANG R, SUN X W, et al.Genetic analysis of population differentiation and adaptation in Leuciscus waleckii[J]. Genetica, 2013, 141(10/12): 417–429. |
| [15] | 池炳杰, 梁利群, 刘春雷, 等.滩头雅罗鱼幼鱼对NaCl浓度和碱度的适应性分析[J]. 中国水产科学, 2011, 18(3): 689–694. CHI B J, LIANG L Q, LIU C L, et al.Adaptability of Tribolodon brandti (Dybowski) to NaCl concentration and alkalinity[J]. Journal of Fishery Sciences of China, 2011, 18(3): 689–694. |
| [16] | 雷衍之.淡水养殖水化学[M].南宁: 广西科学技术出版社, 1993: 65-77. LEI Y Z.Water chemistry of fresh water farming[M].Nanning: Guangxi Science & Technology Press, 1993: 65-77. |
| [17] | 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 18654.8-2008养殖鱼类种质检验第8部分: 耗氧率与临界窒息点的测定[S]. 北京: 中国标准出版社, 2008: 1-5. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 18654.8-2008 Inspection of germplasm for cultured fishes-Part 8: Determination oxygen consuming rate and critical stifling point[S]. Beijing: China Standards Press, 2008: 1-5. |
| [18] | 梁秀丽, 潘忠泉, 王爱萍, 等.碘量法测定水中溶解氧[J]. 化学分析计量, 2008, 17(2): 54–56. LIANG X L, PAN Z Q, WANG A P, et al.Determination of dissolved oxygen in water by iodometric method[J]. Chemical Analysis and Meterage, 2008, 17(2): 54–56. |
| [19] | 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 276-281. State Environmental Protection Administration of China. Monitoring and analytical methods of water and wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 276-281. |
| [20] | CHANG Y M, TANG R, DOU X J, et al.Transcriptome and expression profiling analysis of Leuciscus waleckii: An exploration of the alkali-adapted mechanisms of a freshwater teleost[J]. Molecular Biosystems, 2014, 10(3): 491–504. |
| [21] | 吕富, 潘鲁青, 王爱民, 等.盐度对异育银鲫呼吸和氨氮排泄生理的影响[J]. 水生生物学报, 2010, 34(1): 184–189. LV F, PAN L Q, WANG A M, et al.Effects of salinity on oxygen consumption rate and ammonia excretion rate of allogynogemetic crucian carp[J]. Acta Hydrobiologica Sinica, 2010, 34(1): 184–189. |
| [22] | LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402–408. |
| [23] | HWANG P P, LEE T H.New insights into fish ion regulation and mitochondrion-rich cells[J]. Comparative biochemistry and physiology Part A: Molecular & Integrative Physiology, 2007, 148(3): 479–497. |
| [24] | RAO G M M.Oxygen consumption of rainbow trout (Salmo gairdneri) in relation to activity and salinity[J]. Canadian Journal of Zoology, 1968, 46(4): 781–786. |
| [25] | 丁彦文, 李加儿.平鲷Rhabdosargus sarba (Forskäl)幼鱼耗氧率的初步研究[J]. 湛江海洋大学学报, 2000, 20(3): 8–12. DING Y W, LI J E.A preliminary study on the oxygen consumption of fry of flat bream Rhabdosargus sarba (Forskäl)[J]. Journal of Zhanjiang Ocean University, 2000, 20(3): 8–12. |
| [26] | 王广军, 谢俊, 潘德博.日本鳗鲡初孵仔鱼耗氧率的初步研究[J]. 海洋水产研究, 2001, 22(1): 52–55. WANG G J, XIE J, PAN D B.A preliminary study on the oxygen consumption rate of Japanese eel (Anguilla japonica) larva[J]. Marine Fisheries Research, 2001, 22(1): 52–55. |
| [27] | FURSPN P, PRANGE H D, GREENWALD L.Energetics and osmoregulation in the catfish, Ictalurus nebulosus and I. Punctatus[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1984, 77(4): 773–778. |
| [28] | 郑伟刚, 张兆琪.盐度和碱度对澎泽鲫幼鱼耗氧率和排氨率的影响[J]. 水产养殖, 2003, 24(6): 38–41. ZHENG W G, ZHANG Z Q.Effects of salinity and alkalinity on oxygen consumption rates and ammonia excretion rates of Carassius auratus Pengze Fingerlings[J]. Journal of Aquaculture, 2003, 24(6): 38–41. |
| [29] | 刘济源, 么宗利, 来琦芳, 等.盐碱胁迫对青海湖裸鲤耗氧率、血浆渗透浓度和离子浓度的影响[J]. 生态学杂志, 2012, 31(3): 664–669. LIU J Y, YAO Z L, LAI Q F, et al.Effects of saline-alkali stress on the oxygen consumption and plasma osmolality and ion concentrations of Gymnocypris przewalskii[J]. Chinese Journal of Ecology, 2012, 31(3): 664–669. |
| [30] | 王楠, 常玉梅, 唐然, 等.瓦氏雅罗鱼耐碱性状相关分子标记的筛选[J]. 中国水产科学, 2015, 22(6): 1105–1114. WANG N, CHANG Y M, TANG R, et al.Screening microsatellite markers associated with alkaline tolerance in Leuciscus waleckii[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1105–1114. |
| [31] | WOOD C M, NAWATA C M, WILSON J M, et al.Rh proteins and NH4+-activated NH4+-ATPase in the Magadi tilapia (Alcolapia grahami), a 100% ureotelic teleost fish[J]. The Journal of Experimental Biology, 2013, 216(16): 2998–3007. |
| [32] | WILKIE M P, WOOD C M.The adaptations of fish to extremely alkaline environments[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1996, 113(4): 665–673. |
| [33] | WANG Y S, GONZALEZ R J, PATRICK M L, et al.Unusual physiology of scale-less carp, Gymnocypris przewalskii, in Lake Qinghai: A high altitude alkaline saline lake[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2003, 134(2): 409–421. |
| [34] | WRIGHT P A, WOOD C M.A new paradigm for ammonia excretion in aquatic animals: Role of Rhesus (Rh) glycoproteins[J]. The Journal of Experimental Biology, 2009, 212(15): 2303–2312. |
| [35] | 赵兰, 徐鹏, 孙效文.碳酸盐碱度胁迫下鲤鱼氨排泄相关基因的差异表达[J]. 生物技术通报, 2013: 185–193. ZHAO L, XU P, SUN X W.Ammonia eexcretion related genes expression of Common carp under the stress of carbonate alkalinity[J]. Biotechnology Bulletin, 2013: 185–193. |
| [36] | BRAUN M H, STEELE S L, PERRY S F.The responses of zebrafish (Danio rerio) to high external ammonia and urea transporter inhibition: Nitrogen excretion and expression of rhesus glycoproteins and urea transporter proteins[J]. The Journal of Experimental Biology, 2009, 212(23): 3846–3856. |
| [37] | BARIMO J F, SERAFY J E, FREZZA P E, et al.Habitat use, urea production and spawning in the gulf toadfish Opsanus beta[J]. Marine Biology, 2007, 150(3): 497–508. |
| [38] | MAYZAUD P.Respiration and nitrogen excretion of zooplankton. IV. The influence of starvation on the metabolism and the biochemical composition of some species[J]. Marine Biology, 1976, 37(1): 47–58. |
| [39] | IKEDA T.Nutritional ecology of marine zooplankton[J]. Memoirs of the Faculty of Fisheries Hokkaido University, 1974, 22(1): 1–97. |
| [40] | CONOVER R J, CORNER E D S.Respiration and nitrogen excretion by some marine zooplankton in relation to their life cycles[J]. Journal of the Marine Biological Association of the United Kingdom, 1968, 48(1): 49–75. |
| [41] | 范德朋, 潘鲁青, 马甡, 等.温度对缢蛏(Sinonovacula constricta)耗氧率和排氨率的影响[J]. 青岛海洋大学学报, 2002, 32(1): 56–62. FAN D P, PAN L Q, MA S, et al.Effects of temperature on oxygen consumption rate and ammonia excretion rate of Sinonovacula constricta[J]. Journal of Ocean University of Qingdao, 2002, 32(1): 56–62. |
| [42] | KATSANEVAKIS S, STEPHANOPOULOU S, MILIOU H, et al.Oxygen consumption and ammonia excretion of Octopus vulgaris (Cephalopoda) in relation to body mass and temperature[J]. Marine Biology, 2005, 146(4): 725–732. |
| [43] | DE ALMEIDA-VAL V M, GOMES A R C, LOPES N P.Metabolic and physiological adjustments to low oxygen and high temperature in fishes of the amazon[J]. Fish Physiology, 2005, 21: 443–500. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


