2. 上海海洋大学 水产与生命学院, 上海 201306
养殖池塘作为一个人为控制的封闭生态系统,随着养殖生产的进行,进入池塘的残饵、排泄物、生物残体等有机物越来越多[1],导致养殖污染严重,蓝藻暴发频繁,严重制约了养殖业的健康发展[2]。首先,池塘暴发蓝藻后,蓝藻大量死亡和分解使水体溶氧迅速下降甚至耗尽,造成养殖动物缺氧死亡[3];其次,蓝藻池塘中的养殖动物有“腥臭味”,降低了养殖动物的品质和养殖效益[4-5];此外,蓝藻能产生藻毒素对养殖动物直接产生毒害,已间接威胁人类的健康[6]。为此,控制蓝藻暴发成为池塘养殖水体调控的关键技术之一,而对蓝藻暴发的机理及诱发蓝藻暴发主导因子的深入研究是解决这一问题的关键。
已有许多学者从营养盐、温度、光照、pH和蓝藻自身的生理特点探索了蓝藻的暴发机制,但至今蓝藻的确切暴发机制仍未阐明[5-7]。有研究发现,蓝藻暴发与细菌种群之间存在密切的联系:太湖水体细菌群落结构在蓝藻暴发前期和蓝藻暴发末期存在差异,Flavobacteriaceae在蓝藻暴发前期大量出现,而在蓝藻暴发时消失[8];玄武湖蓝藻暴发期到衰退期,其水体中优势菌种数由16种减少至6种[9];在洋河水库中也发现,蓝藻暴发末期α-proteobacteria的存量高于其他阶段[10]。目前,国内大量研究工作都是针对蓝藻湖泊[11-13]、水库[10]中的细菌群落组成,而对蓝藻池塘的细菌群落结构的研究却很少。开展对后者的研究,对了解蓝藻暴发机制和养殖水体中蓝藻控制与治理,都有着非常重要的理论意义与应用价值。
本研究以3个地区4个养殖场的淡水草鱼养殖池塘为研究对象,通过比较蓝藻暴发池塘和对照池塘细菌群落和水环境因子的差异,分析蓝藻暴发池塘细菌群落特征,为水产养殖中蓝藻暴发的控制与治理提供理论依据。
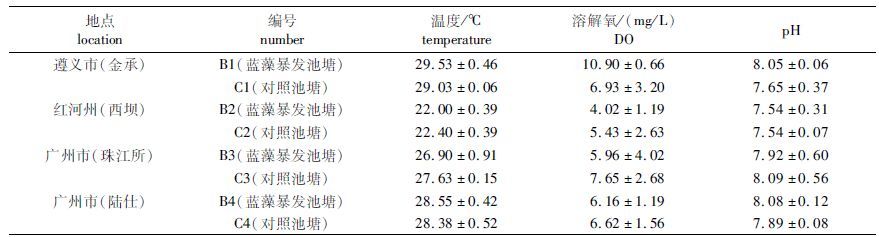
1 材料与方法 1.1 样品采集 1.1.1 采样地点分别选择贵州遵义市绥阳县金承养殖场(27.97°N,107.12°E)、云南红河州开远市羊街乡三角海水库西坝养殖场(23.57°N,103.28°E)、广东广州市珠江水产研究所试验基地(23.06°N,113.22°E)、广东广州市陆仕水产公司(23.31°N,113.14°E)3个地区4个养殖场的草鱼淡水养殖池塘,于蓝藻高发期的9-10月份,在蓝藻暴发时采集的蓝藻暴发池塘的水样,并选择同一养殖场内的非蓝藻暴发池塘作为对照池塘。经过后期的筛选,在每个养殖场挑选出3口蓝藻暴发池塘及3口对照池塘。
蓝藻暴发池塘的判别,首先通过观察池塘水面上浮的颗粒状聚集的藻席加以选择,然后根据后期的镜检确定水体中含有大量成团的微囊藻并结合叶绿素a(Chl.a)含量[14]加以确定。
对照池塘的选择,首先选择水面无藻席的池塘,然后结合后期镜检确认水体无成团的微囊藻及Chl.a含量[14]加以确定。
1.1.2 样品采集方法采样时使用有机玻璃采水器,水样取自水面下 0.5 m处。水样用5点采样法采集混合后装入500 mL灭菌广口瓶中,在溢流状态下旋紧瓶盖使取样瓶内尽量不含空气。水样采集后冰袋保存,运送回实验室,24 h内测定理化及生物指标,并提取水样总DNA。取1.5 mL水样装入2 mL离心管用鲁哥试剂固定,用于后期镜检。
1.2 理化指标测定测定水温、溶解氧(DO)、pH、Chl.a、微囊藻毒素a(MC-LR)、氨态氮(NH4-N)、硝酸态氮(NO3-N)、亚硝酸态氮(NO2-N)、可溶性磷酸盐(PO4-P)、总氮(TN)和总磷(TP)等指标。其中水温(T)、溶解氧(DO)和pH使用便携式多参数水质分析仪(YSI Professional Plus,美国)现场测定;Chl.a的测定采用反复冻融丙酮萃取法[15];MC-LR使用微囊藻毒素ELISA试剂盒(Beacon,美国)测定[16];NH4-N、NO3-N、NO2-N、PO4-P采用merckPharo100多参数水质分析仪(德国)测定;TN、TP送广州省生态环境与土壤研究所分析测试中心测定,其中TN的测定采用碱性过硫酸钾消解紫外分光光度法(HJ636—2012) 、TP的测定采用钼酸铵分光光度法(GB11893—1989) 。
1.3 水体总DNA的提取真空抽滤100 mL水样于0.2 μm的滤膜上,剪成4瓣后置于50 mL灭菌离心管中,用OMEGA水样提取试剂盒按照说明书提取水体总DNA,并使用1%琼脂糖凝胶120 V、20 min电泳检测产物质量。水样总DNA于-40 ℃冰箱保存。
1.4 16S rDNA 的V3可变区PCR扩增将同一养殖场的蓝藻暴发池塘与对照池塘的平行样品细菌总DNA分别混合,采用通用引物GC-338F(5′-CGCCC GCCGC GCGCG GCGGG CGGGG CGGGG GCACG GGGGG ACTCC TACGG GAGGC AGCAG-3′)和534R(5′-ATTAC CGCGG CTGCT GG-3′)[17-18]对总细菌的16S rDNA的V3可变区进行扩增。采用touchdown-PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,之后每个循环退火温度降低0.5 ℃;20个循环后,在55 ℃的退火温度下再进行15个循环,最终72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检验扩增产物,其余用于DGGE电泳分析。通用引物由Invitrogen(上海)公司合成。
1.5 PCR扩增产物变性梯度凝胶电泳(DGGE)及序列分析用DGGE将PCR扩增产物进行分离,采用的变性胶梯度为42%~48%,聚丙烯酰胺凝胶的浓度为8%。电泳温度控制在60 ℃,用200 V电压预电泳10 min,接着在110 V条件下电泳12 h。电泳结束后,在室温条件下用稀释10 000倍的Genefinder(至善生物,厦门)核酸染料摇床上染色30 min。用凝胶成像系统 (Carestream,USA)观察记录DGGE图谱。
1.6 目的条带割胶回收与克隆测序将目的条带割胶回收,使用不带GC夹子的引物388F/534R对目的片段进行扩增,然后将PCR产物进行割胶纯化与克隆。纯化后的PCR产物与载体pMD19-T(TaKaRa,大连) 16 ℃水浴3 h进行连接,后加入E.coli DH5α感受态细胞热激转化,利用氨苄青霉素(100 mg/mL)抗性选取阳性转化子并确认阳性克隆体后,送Invitrogen(上海)公司测序。
1.7 数据分析利用Excel进行数据处理;使用SPSS 16.0 for windows软件分析显著性差异及回归分析,理化数据用平均值±标准差(X±SD)表示,P<0.05为差异显著。用Quantity One 4.5软件分析样品电泳条带的数目和亮度,获取DGGE图谱的数字化信息,用PRIMER 5.0的SIMPER (Similarity Percentage Analysis)功能,通过条带的peak值来分析蓝藻暴发池塘与对照组之间的差异,细菌群落结构的相似性通过Dice相似系数来比较,完成非加权配对算术平均法聚类(UPGMA)。生物多样性指数采用条带数(S)、Margalef丰富度指数(D)、Pielou均匀度指数(J′)、Shannon多样性指数(H′)和Simpson优势度指数(1-λ)表示。各指数的计算公式分别为:
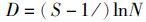 (1)
(1)
 (2)
(2)
 (3)
(3)
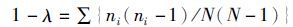 (4)
(4)
式中:S为条带数;ni第i个条带的光密度值;N为某一泳道所有条带的光密度值之和。冗余分析(redundancy analysis,RDA)判断环境因子与细菌群落的显著相关性关系,所用数据均经过lg(x+1) 转换,RDA分析所使用软件为CANOCO for windows 4.5。
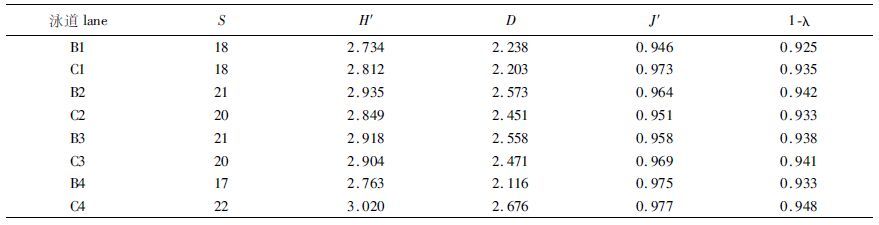
2 结果与分析 2.1 基于DGGE图谱的细菌群落多样性分析对不同地区的蓝藻暴发池塘与对照池塘的DNA样品进行细菌16S rDNA V3区片段的PCR扩增,继而构建细菌群落DGGE图谱,见图 1a。将DGGE 图谱条带信息数字化并进行多样性指数计算,结果见表 2。条带数(S)为17~22,多样性指数(H′)为2.76~3.02,丰富度指数(D)为2.11~2.67,均匀度(J′)为0.945~0.977,优势度指数(1-λ)为0.924~0.948。用方差分析(one way ANOVA)检验,这些指数在蓝藻暴发池塘与对照组池塘间的差异均不显著(P>0.05) 。说明蓝藻暴发池塘与对照池塘的细菌群落多样性差异不大。

|
图 1 养殖池塘水体细菌群落结构DGGE指纹图谱及聚类分析(UPGMA)
Fig. 1 DGGE profiles and UPGMA clustering of 16S rDNA genes from the pond water
中文注解 英文注解 |
|
表 1 采样养殖池塘基本参数 Tab.1 The basic parameters of sampled ponds |
|
表 2 不同样品的细菌多样性指数 Tab.2 Shannon-wiener index,Margalef index,Pielou index and Simpson index of different bacterial community |
依据DGGE指纹谱带的丰度对养殖水体细菌群落结构进行基于Dice系数的UPGMA聚类分析(图 1b)。在相似性0.39处分化为两条主枝干,蓝藻暴发池塘(B1、B2、B3、B4) 聚为一支,对照池塘(C1、C2、C3、C4) 聚为另一支,表明两种池塘样品细菌群落结构间存在明显差异,而且每组内相似性都在50%以上。
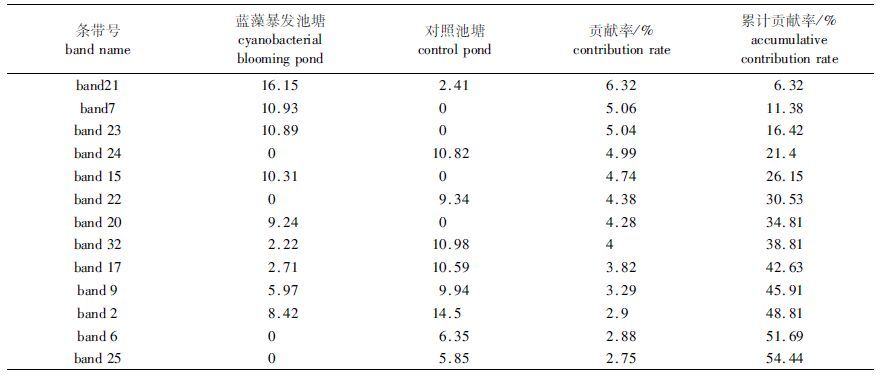
2.3 DGGE 图谱特异条带分析对DGGE 图谱条带的数字化结果,用SIMPER分析蓝藻暴发池塘与对照池塘之间的差异,条带累积贡献率超过50%的条带见表 3。由图 1a和表 3可知,蓝藻暴发池塘(B组)的特异条带有两条,条带15、20;对照池塘(C组)的特异条带为条带24、25;蓝藻暴发池塘的条带21明显亮于对照池塘;而对照池塘的条带17、32则比蓝藻暴发池塘亮。
|
表 3 蓝藻池塘与对照池塘主要差异性条带及其贡献率 Tab.3 The main difference banding and its contribution between cyanobacterial blooming pond and control pond |
将养殖水体细菌DGGE图谱可分辨的22条特征条带通过切胶、克隆、测序后,得到31条大小在169~197 bp之间的序列,将所得序列提交到GenBank数据库,采用BLAST 程序进行序列比对,结果见表 4。所获得的序列与数据库中序列的最大相似性在96%~100% 之间,其中有14条序列与数据库中的序列相似性为100%,有10条序列为未培养细菌。养殖池塘水体菌群主要归属为蓝细菌门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和芽单胞菌门(Gemmatimonadetes)5个门。

|
表 4 养殖池塘水体细菌DGGE条带测序结果 Tab.4 Blast results of bacterial 16S rDNA partial sequences of pond water with the database from GenBank |
蓝藻暴发池塘样品的优势菌为蓝细菌门的微囊藻属(Microcystis sp.),特有细菌为拟杆菌门的屈挠杆菌属(Uncultured Flexibacter sp.);对照池塘的优势菌为蓝细菌门的聚球藻属(Synechococcus sp.)、α-变形菌纲的甲基杆菌属(Methylobacterium sp.)和红环菌科的Dechloromonas sp. ;而蓝藻门的鱼腥藻属(Anabaena sp.)、α-变形菌纲的鞘氨醇单胞菌属(Sphingomonas sp.)、β-变形菌纲伯克氏菌科的甲基杆菌属(Methylobacterium sp.)、Uncultured Polynucleobacter sp.、红杆菌属(Uncultured Rhodobacter sp.)和生丝微菌属(Hyphomicrobium sp.)是各个池塘所共有的菌群。
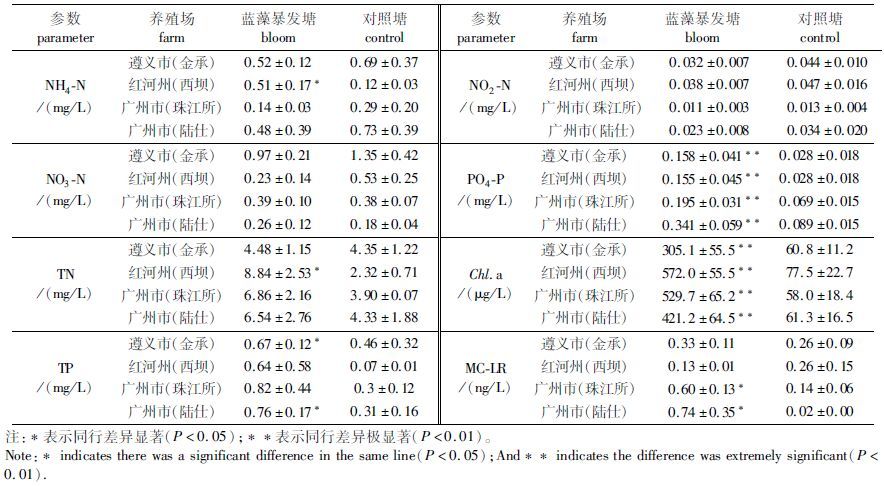
2.5 水体样品理化指标结果分析由表 5可知,蓝藻暴发池塘水体的可溶性磷酸盐(PO4-P)、叶绿素a(Chl.a)均极显著高于对照池塘(P<0.01) ;硝酸态氮(NO3-N)、亚硝酸态氮(NO2-N)在蓝藻暴发池塘与对照池塘的水体间差异均不显著。一般来说,Chl.a可以作为衡量蓝藻暴发程度的指标[14],由线性回归分析可以得出,Chl.a与PO4-P存在正相关关系(R2=0.869,P<0.01) 。
|
表 5 养殖水质参数 Tab.5 Water quality parameters of the aquaculture water |
将DGGE 指纹图谱中37条(图 1a,特异条带的测序结果见表 4) 可识别的条带的位置和亮度分别类比于物种的种类和数量,对DGGE 图谱条带数字化结果进行去趋势对应分析(detrended correspondence analysis ,DCA)。结果显示最大梯度长度为2.264,小于3,即选用线性模型要好于单峰模型。因此,本文选择线性模型冗余分析(redundancy analysis,RDA)进行养殖池塘水体细菌群落与水环境因子的排序。通过对水环境因子的蒙特卡罗检验(monte carlo permutation test)表明,PO4-P和NO3-N与养殖池塘水体细菌群落具有显著的相关性(P<0.05) ,因此选择PO4-P和NO3-N两个环境因子研究其与细菌群落的关系。结果显示:第一排序轴和第二排序轴的特征值分别为34.2和15.8,前两轴共解释了50.1%的养殖水体细菌群落的变化特征,而物种和环境因子相关系数分别为0.982和0.969,表明排序能够很好地反映养殖池塘水体细菌群落与水环境因子间的关系。
在只包含PO4-P和NO3-N两个环境因子的二维空间内,不同养殖池塘及水体细菌群落的RDA排序图(图 3) 。第一排序轴的主要影响因子是PO4-P,为负相关,相关系数为-0.876;第二排序轴的主要影响因子是NO3-N,为正相关,相关系数为0.967。蓝藻暴发池塘的特异及优势条带15(Prochlorothrix sp.)、20(Uncultured Flexibacter sp.)、21(Microcystis sp.)与PO4-P呈正相关;而对照池塘的特异及优势条带17(Synechococcus sp.)、24(Uncultured Polynucleobacter sp.)、25(Uncultured Polynucleobacter sp.)、32(Methylobacterium sp.)与PO4-P呈负相关。

|
图 2 养殖池塘水体细菌群落与水环境因子的RDA排序图
Fig. 2 Redundancy analysis for bacteria and environmental factors in aquaculture pond water
图中箭头1-37代表类比于物种的DGGE指纹图谱中的条带,见图 1a;PO4-P.可溶性磷酸盐;NO3-N.硝态氮。 1 to 37 represent the DGGE fingerprint as shown in figure 1 which analogy in species; PO4-P. soluble phosphate; NO3-N. nitrate nitrogen. |
有研究发现,PO4-P是影响蓝藻丰度的主要因子[19],高PO4-P浓度有利于使能够形成蓝藻水华的种类成为优势种[7]。在本次研究中,蓝藻暴发池塘的PO4-P含量显著高于对照池塘,且PO4-P与代表蓝藻暴发程度的Chl.a存在正相关关系。此结果与XU的研究结果相同,其在对玄武湖蓝藻暴发的研究中发现微囊藻(Microcystis)丰度与PO4-P浓度呈正相关[20]。此外,本研究发现PO4-P与蓝藻暴发池塘优势及特异细菌存在正相关关系。刘庆等在研究中曾发现,PO4-P与附着细菌样品蓝藻种群结构动态变化具有显著的相关性[21]。因此,较高的PO4-P含量有利于Microcystis成为优势藻类,且与蓝藻暴发相关的细菌关系密切,有利于蓝藻的暴发。
一般来说,蓝藻的暴发总是和细菌的变化相关联。蓝藻的生物量会对水体的细菌群落结构产生很大的影响[8],有许多细菌是蓝藻的附生菌[22],蓝藻产生的藻毒素也会对某些细菌存在抑制作用[11]。本研究发现蓝藻暴发池塘的特定的菌群为屈挠杆菌(Flexibacter)。已报道的Flexibacter均属于异养菌,不但分布广泛[23],而且具有溶解藻类细胞特别是蓝藻细胞的能力:前苏联科学家曾经报道过屈挠杆菌亚种(Flexibacter sp.)具有溶解藻类营养细胞的能力[24],我国学者李勤生从藻池中分离出来的一株屈挠杆菌(Flexibacter sp.)也可以溶解蓝藻营养细胞[23]。Flexibacter属于噬纤维菌科(Cytophagaceae),RASHIDAN等发现噬纤维菌科(Cytophagaceae)的噬细胞菌属(Cytophaga)也具有裂解蓝藻细胞的能力,而且Cytophaga的丰度与蓝藻暴发及其发展紧密关联[25]。Cytophagaceae属于拟杆菌门(Bacteroidetes),我国学者在对湖泊与水库蓝藻暴发的研究中均发现,Bacteroidetes是蓝藻暴发期的主要细菌菌群,且在蓝藻暴发的过程中有显著的变化:太湖梅梁湾水域在蓝藻暴发前期以Bacteroidetes为优势菌,而在蓝藻暴发末期其在水样中的比例很小[12];太湖贡湖湾Bacteroidetes的黄杆菌科(Flavobacteriaceae)在蓝藻暴发前期大量出现,而在暴发时消失[8];玄武湖蓝藻暴发期间Proteobacteria、Firmicutes和Bacteroidetes为主要优势菌群,而衰退期主要优势菌群仅为Proteobacteria和Firmicutes[9];洋河水库蓝藻暴发时,Bacteroidetes在总细菌中的含量由蓝藻暴发前期(6月)的6.6%下降至暴发中期(8月)的1.2%,又在暴发末期(10月)上升至24%,Bacteroidetes的OUT数也由蓝藻暴发前中期的1个增加到了暴发末期的8个[10]。因此,Bacteroidetes与蓝藻暴发的关系密切,而蓝藻的暴发可能会引起可以裂解蓝藻的Flexibacter含量的增高。
本次研究的蓝藻暴发池塘中的优势藻类为Microcystis,而蓝藻暴发池塘的聚球藻(Synechococcus)的含量明显低于对照池塘。Synechococcus属于蓝细菌门(Cyanobacteria),是浮游生物群落的优势组分,是全球碳循环的主要参与者和初级生产力的贡献者[26]。一般来说Synechococcus比Microcystis具有生长优势。因为Synechococcus(直径为0.2~2 μm[27])个体略小于Microcystis(直径为2~7 μm[28]),较小的细胞个体能更有效地获取和使用营养物质[27];另外Synechococcus可以进行生物固氮[27],而Microcystis属于非固氮蓝藻[22],这些特性让Synechococcus营养获取上比Microcystis更具有优势。但本次采集的养殖池塘富营养化严重,含氮的营养盐已不是影响其生长的限制因子。有学者研究发现Microcystis产生的微囊藻毒素(Microcystin,MC) 可以通过降低Synechococcus的光合活性来抑制Synechococcus的生长[29]。叶文瑾在对太湖水体蓝藻暴发的研究中发现Microcystis和Synechococcus存在此消彼长的动态关系[11]。因此,在蓝藻暴发池塘中可能是因为Microcystis的大量生长抑制了Synechococcus的生长。
蓝藻暴发池塘和对照池塘中共有的优势菌群为α,β-变形菌纲(α,β-Proteobacteria)。α-proteobacteria包括大部分贫养型杆菌,多数类群是好氧菌;多数β-Proteobacteria也是好氧菌,但其也可以在厌氧生境中利用有机物的降解产物[30]。多数β-Proteobacteria具有降解污染物的能力,因此随营养浓度的升高β-Proteobacteria的种群数量也会升高[31]。有文献表明,蓝藻暴发时,α,β-Proteobacteria是蓝藻的主要附生菌[22]。而且α-Proteobacteria中的鞘氨醇单胞菌(Sphingomonas)对于微囊藻毒素具有很强的降解能力[22, 32]。
许多学者在对湖泊水库的研究中表明,蓝藻暴发会导致水体细菌多样性的降低[9, 13, 33]。但本研究发现,蓝藻暴发池塘与对照池塘的细菌多样性差别不大。可能是因为本次研究的养殖池塘水体富营养化比较严重,水体营养过剩会抑制某些对环境敏感的细菌的生长,降低水体细菌的多样性[15, 34]。此外,水体的细菌多样性还与水面面积有很大的关系,RECHE在研究位于西班牙内华达山脉上的11个高原湖泊中的细菌群落结构和多样性时发现,细菌多样性和湖泊的面积呈显著的正相关关系[35]。而养殖池塘相对于湖泊水库的面积要小得多,因此也有可能是养殖池塘的面积较小从而导致了细菌多样性本身较低,进而导致蓝藻暴发对养殖池塘细菌多样性的影响作用不明显。
| [1] | 温志良, 张爱军, 温琰茂.集约化淡水养殖对水环境的影响[J]. 水利渔业, 2000, 20(4): 19–20. WEN Z L, ZHANG A J, WEN Y M.The influence of intensive freshwater aquaculture on water environment[J]. Reservoir Fisheries, 2000, 20(4): 19–20. |
| [2] | ZHONG F, GAO Y N, YU T, et al.The management of undesirable cyanobacteria blooms in channel catfish ponds using a constructed wetland: contribution to the control of off-flavor occurrences[J]. Water Research, 2011, 45(19): 6479–6488. |
| [3] | SEVRIN-REYSSAC J, PLETIKOSIC M.Cyanobacteria in fish ponds[J]. Aquaculture, 1990, 88(1): 1–20. |
| [4] | SCHRADER K K, DENNIS M E.Cyanobacteria and earthy/musty compounds found in commercial catfish (Ictalurus punctatus) ponds in the Mississippi Delta and Mississippi-Alabama Blackland Prairie[J]. Water Research, 2005, 39(13): 2807–2814. |
| [5] | 张永生, 孔繁翔, 于洋, 等.蓝藻伪空胞的特性及浮力调节机制[J]. 生态学报, 2010, 30(18): 5077–5090. ZHANG Y S, KONG F X, YU Y, et al.The characteristics and buoyancy regulations of cyanobacterial gas vesicles[J]. Acta Ecologica Sinica, 2010, 30(18): 5077–5090. |
| [6] | 秦伯强, 杨柳燕, 陈非洲, 等.湖泊富营养化发生机制与控制技术及其应用[J]. 科学通报, 2006, 51(19): 2401–2412. QIN B Q, YANG L Y, CHEN F Z, et al.Mechanism and control of lake eutrophication[J]. Chinese Science Bulletin, 2006, 51(19): 2401–2412. |
| [7] | 赵孟绪, 韩博平.汤溪水库蓝藻水华发生的影响因子分析[J]. 生态学报, 2005, 25(7): 1554–1561. ZHAO M X, HAN B P.Analysis of factors affecting cyanobacteria bloom in a tropical reservoir (Tangxi Reservoir, China)[J]. Acta Ecologica Sinica, 2005, 25(7): 1554–1561. |
| [8] | NIU Y, SHEN H, CHEN J, et al.Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China[J]. Water Research, 2011, 45(14): 4169–4182. |
| [9] | 郑小红, 肖琳, 任晶, 等.玄武湖微囊藻水华暴发及衰退期细菌群落变化分析[J]. 环境科学, 2008, 29(10): 2956–2962. ZHENG X H, XIAO L, REN J, et al.Variation of bacterial community composition in the outbreak and decline of Microcystis spp. Bloom in Lake Xuanwu[J]. Environmental Science, 2008, 29(10): 2956–2962. |
| [10] | 陈威. 富营养化水体不同水华阶段细菌群落结构的变化[D]. 新乡: 河南师范大学, 2010. CHEN W. Variation of bacteria community stuctures in eutrophic water body during water bloom[D]. Xinxiang: He'nan Normal University, 2010. |
| [11] | 叶文瑾. 太湖富营养化水体和底泥中微生物群落的分子生态学研究[D]. 上海: 上海交通大学, 2009. YE W J. Molecular ecology research on microbial community in the water and sediment of eutrophic Lake Taihu[D]. Shanghai: Shanghai Jiao Tong University, 2009. |
| [12] | 奚万艳, 吴鑫, 叶文瑾, 等.太湖梅梁湾水域蓝藻水华前与水华末期细菌群落结构的变化[J]. 应用与环境生物学报, 2007, 13(1): 97–103. XI W Y, WU X, YE W J, et al.Changes in bacterial community structure during preceding and degraded period of cyanobacterial bloom in a bay of the Taihu Lake[J]. Chinese Journal of Applied and Environmental Biology, 2007, 13(1): 97–103. |
| [13] | 田川. 太湖浮游细菌分子生态学及溶藻细菌的研究[D]. 上海: 上海交通大学, 2012. TIAN C. Research on bacterioplankton diversity and the Algicidal bacteria in Lake Taihu[D]. Shanghai: Shanghai Jiao Tong University, 2012. |
| [14] | CHEN M J, CHEN F Z, XING P, et al.Microbial eukaryotic community in response to Microcystis spp. bloom, as assessed by an enclosure experiment in Lake Taihu, China[J]. FEMS Microbiology Ecology, 2010, 74(1): 19–31. |
| [15] | 翁笑艳, 林美爱, 严颖.地表水浮游植物叶绿素a测定方法比较研究[J]. 中国环境监测, 2009, 25(3): 36–38. WENG X Y, LIN M A, YAN Y.Comparison of determination of phytoplankton chlorophyll a by spectroscopic methods in freshwater[J]. Environmental Monitoring in China, 2009, 25(3): 36–38. |
| [16] | 桂佳, 辛艳萍, 韩博平, 等.Beacon公司微囊藻毒素检测试剂盒的性能评价[J]. 生态科学, 2009, 28(5): 428–432. GUI J, XIN Y P, HAN B P, et al.Performance evaluation of Beacon Microcystin Plate Kit[J]. Ecological Science, 2009, 28(5): 428–432. |
| [17] | TORSBIK V, DAAE F L, SANDAA R A, et al.Review article: novel techniques for analysing microbial diversity in natural and perturbed environments[J]. Journal of Biotechnology, 1998, 64(1): 53–62. |
| [18] | KENNEDY A C.Bacterial diversity in agroecosystems[J]. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 65–76. |
| [19] | 胡韧, 顾继光, 聂祥, 等.3座南亚热带串联调水水库浮游植物群落的CCA分析[J]. 生态科学, 2008, 27(5): 315–319. HU R, GU J G, NIE X, et al.A comparison of phytoplankton assemblages in three subtropical pumped storage reservoirs based on CCA analysis[J]. Ecological Science, 2008, 27(5): 315–319. |
| [20] | XU Y, WANG G X, YANG W B, et al.Dynamics of the water bloom-forming Microcystis and its relationship with physicochemical factors in Lake Xuanwu (China)[J]. Environmental Science and Pollution Research, 2010, 17(9): 1581–1590. |
| [21] | 刘庆, 郭亮, 邢鹏, 等.富营养化浅水湖泊蓝藻的种群结构和多样性研究[J]. 农业环境科学学报, 2012, 31(3): 570–579. LIU Q, GUO L, XING P, et al.Cyanobacterial community composition and diversity in shallow lakes of different trophic status[J]. Journal of Agro-Environment Science, 2012, 31(3): 570–579. |
| [22] | LI N, ZHANG L, LI F C, et al.Metagenome of microorganisms associated with the toxic Cyanobacteria Microcystis aeruginosa analyzed using the 454 sequencing platform[J]. Chinese Journal of Oceanology and Limnology, 2011, 29(3): 505–513. |
| [23] | 李勤生, 黎尚豪, 王大耜.中华屈挠杆菌的分离和鉴定[J]. 微生物学报, 1984, 24(1): 7–13. Q S, LI S H, WANG D S.Isolation and characterization of Flexibacter chinenses sp. nov[J]. Acta Microbiology Sinica, 1984, 24(1): 7–13. |
| [24] | 李勤生, 利群, 蔡庆华.东湖屈挠杆菌的分离及其生物学特性研究[J]. 水生生物学报, 1990, 14(3): 216–223. LI Q S, LI Q, CAI Q H.Study on isolation and biological characters of flexibacter strains from Donghu lake[J]. Acta Hydrobiologica Sinica, 1990, 14(3): 216–223. |
| [25] | RASHIDAN K K, BIRD D F.Role of predatory bacteria in the termination of a cyanobacterial bloom[J]. Microbial Ecology, 2001, 41(2): 97–105. |
| [26] | 胡智泉, 刘永定.微囊藻毒素在细长聚球藻中的积累及其毒性效应[J]. 中国环境科学, 2005, 25(1): 23–27. HU Z Q, LIU Y D.Accumulation of microcystin-RR in Synechococcus elongatus and its toxic effects[J]. China Environmental Science, 2005, 25(1): 23–27. |
| [27] | RAVEN J A.The twelfth tansley lecture[J]. The twelfth tansley lecture. Small is beautiful: the picophytoplankton, 1998, 12(4): 503–513. |
| [28] | KONDO R, YOSHIDA T, YUKI Y, et al.DNA-DNA reassociation among a bloom-forming cyanobacterial genus, Microcystis[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(2): 767–770. |
| [29] | 胡智泉, 刘永定, 肖波.微囊藻毒素对几种淡水微藻的生长和光合活性的影响[J]. 生态环境, 2008, 17(3): 885–890. HU Z Q, LIU Y D, XIAO B.Effects of microcystin on the growth and photosynthetic activity of algae in freshwater[J]. Ecology and Environment, 2008, 17(3): 885–890. |
| [30] | ZENG J, YANG L Y, DU H W, et al.Bacterioplankton community structure in a eutrophic lake in relation to water chemistry[J]. World Journal of Microbiology and Biotechnology, 2009, 25(5): 763–772. |
| [31] | 孙鑫鑫, 刘惠荣, 冯福应, 等.乌梁素海富营养化湖区浮游细菌多样性及系统发育分析[J]. 生物多样性, 2009, 17(5): 490–498. SUN X X, LIU H R, FENG F Y, et al.Diversity and phylogenetic analysis of planktonic bacteria in eutrophic zone of Lake Wuliangsuhai[J]. Biodiversity Science, 2009, 17(5): 490–498. |
| [32] | PARK H D, SASAKI Y, MARUYAMA T, et al.Degradation of the cyanobacterial hepatotoxin microcystin by a new bacterium isolated from a hypertrophic lake[J]. Environmental Toxicology, 2001, 16(4): 337–343. |
| [33] | 刘娅琴, 邹国燕, 宋祥甫, 等.框式复合型生态浮床对富营养水体浮游植物群落结构的影响[J]. 水生生物学报, 2010, 34(1): 196–203. LIU Y Q, ZOU G Y, SONG X P, et al.Effect of a new ecological floating bed system (EFBS) on phytoplankton community in Eutrophicated water[J]. Acta Hydrobiologica Sinica, 2010, 34(1): 196–203. |
| [34] | 冯胜, 秦伯强, 高光.细菌群落结构对水体富营养化的响应[J]. 环境科学学报, 2007, 27(11): 1823–1829. FENG S, QIN B Q, GAO G.Response of bacterial communities to eutrophic water in Lake Taihu[J]. Acta Scientiae Circumstantiae, 2007, 27(11): 1823–1829. |
| [35] | RECHE I, PULIDO-VILLENA E, MORALES-BAQUERO R, et al.Does ecosystem size determine aquatic bacterial richness[J]. Ecology, 2005, 86(7): 1715–1722. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


