植物凋落物,在全球范围内尤其是在高生产力生态系统中扮演着重要的非生物能流载体角色,如红树林生态系统中红树植物凋落物[1]、河口生态系统中沼生植物凋落物[2-3],由于生态系统中有限的植食性消费者存在,这些植物凋落物主要以碎屑形式进入食物网。岛礁海域岩相海藻场生态系统中,大型海藻周年生活变动产生的凋落物经微生物分解后的有机质(DOM)和海藻颗粒有机物(POM)一同组成海藻碎屑,为海藻场食物网中碎屑食物链及微生物提供大量碳源,而凋落物的分解直接依赖于微生物[4]。同时海藻碎屑同底栖微藻随海流扩散至周围不同生境如浅海沙滩[5-6]、岩礁潮间带[7]甚至深海热液口[8],使岛礁海域有数倍高于开阔海域的次级生产力,形成独特、高效的能量循环机制。
大多数海藻场食物网研究中,碎屑作为初级生产者通常被整体带入碎屑食物链营养级的计算[9-10],然而在实际海域中,饵料碎屑往往由多种藻类凋落物在不同分解时期的碎屑组成,这些碎屑理化特征(粒径、碳氮比等)不同,生态功能也不尽相同。有研究表明凋落物δ15N值随分解时间逐渐富集,最高可达到15‰的增量[11];陈卉等[12]在对秋茄和互花米草凋落物研究中发现自然分解过程中C、N稳定同位素均有不同程度变化。因此,查明大型海藻凋落物在不同分解阶段的理化特征,对探明海藻碎屑生态功能意义重大。
由于海洋环境相对复杂,碎屑收集难度较大,目前针对海洋大型海藻凋落物的C、N稳定同位素变化研究比较少见,研究方法主要以室内模拟实验为主[13],有一定局限性。本实验以枸杞岛海藻场夏季常见底栖大型藻类凋落物为研究对象,引入森林植物掉落物研究的经典方法原位埋袋法[14]模拟海藻叶片自然分解过程,获取不同分解阶段凋落物C、N稳定同位素、有机C/N等凋落物分解指标,探索在海藻凋落物碎屑化过程中δ15N变化对大型底栖动物营养级计算的影响,进而明确海藻凋落叶片碎屑化过程机制及影响范围,以期为海藻场内部食物网结构、岛礁海域生物养护机制等研究提供相关数据及理论基础。
1 材料与方法 1.1 样品采集与处理实验地点枸杞岛北部后头湾海藻场,地理位置处于内湾,海藻场外部有密集贻贝养殖区,海流强度较弱。借鉴陆地森林生态系统凋落物研究中的“原位埋袋法”,埋袋时间为2015年7月25日,采集枸杞岛海藻场夏季大型海藻优势种孔石莼(U.pertusa)、细枝软骨藻(C.tenuissima)、舌状蜈蚣藻(G.livida)、瓦氏马尾藻(S.vachellianum)、羊栖菜(H.fusifarme),藻类植株现场采集并将藻类叶片放入筛绢缝制网袋(120目,20 cm×20 cm)。筛绢袋用水下钢架(100 cm×50 cm×10 cm)固定,不同钢架内放入不同藻种网袋,钢架表面用渔网盖住以方便取袋(图 1),分别于新鲜藻叶埋袋后5、11、18、21、28、36、42 d潜水取袋,筛绢袋中凋落物分解完全视为分解结束。
|
图 1 埋袋实验示意图
Fig. 1 Diagram of litter bag experiment
|
定期潜水取袋。样品采集后,立即冷冻保存。
1.2 化学分析测试带回实验室的样品,经去离子水清洗后,用1mol/L HCl酸化处理去除有机杂质,置于-55 ℃真空条件下冷冻干燥24 h,使用混合型球磨仪(Retsch MM440)粉碎样品。
样品同位素分析及有机C、N含量采用元素分析仪-稳定同位素质谱仪联机(Flash EA 1112 HT-Delta V Advantages,Thermo 公司)测定。样品在元素分析仪中高温燃烧后生成CO2和N2,质谱仪通过检测CO2的13C/ 12C以及 14N的15N/14N,并与国际标准物(PDB)对比后计算出样品的δ13C值(δ13C的分析误差 < ±0.2‰),与国际标准物(纯净空气中的N2)比对后计算出样品的δ15N值(δ15N的分析误差 < ±0.3‰)。δ13C和δ15N值用下面的公式进行计算:

式中:X指13C或15N,R表示13C/12C或15N/14N的值。
1.3 数据处理利用SPSS 19.0软件进行统计分析和作图。
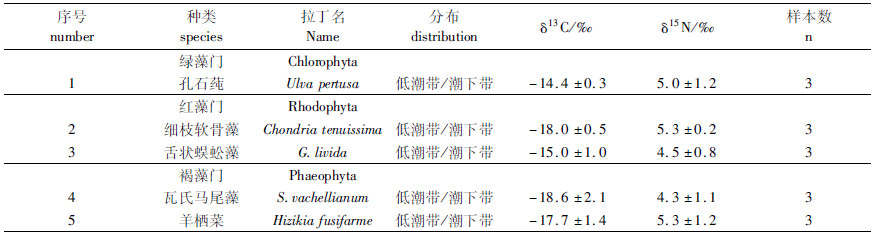
2 结果 2.1 大型海藻新鲜凋落叶δ13C、δ15N值原位埋袋法采集枸杞岛海藻场5种夏季大型底栖海藻优势种:瓦氏马尾藻、细枝软骨藻、孔石莼、羊栖菜和舌状蜈蚣藻凋落物。其中细枝软骨藻、孔石莼、羊栖菜主要分布在中低潮带及潮下带1 m以内;舌状蜈蚣藻主要分布于水下1~3 m以内;瓦氏马尾藻则主要分布于水下1~6 m(表 1)。同一时间采集5种大型海藻新鲜藻叶测得δ13C值平均值最低为孔石莼,与δ13C值平均值最高的瓦氏马尾藻相差4.2‰,但δ15N平均值最高的羊栖菜与最低瓦氏马尾藻相差仅有1‰。
|
表 1 枸杞岛海藻场夏季主要大型海藻新鲜藻叶δ13C、δ15N值 Tab.1 Stable carbon and nitrogen isotopic ratios of macro algae collected from seaweed bed in the summer |
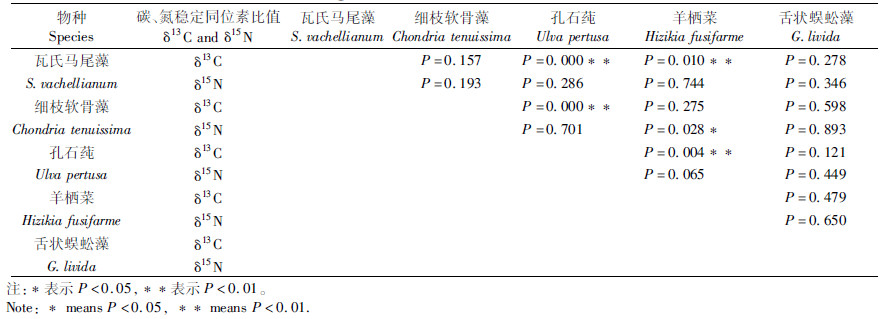
对比枸杞岛海藻场5种夏季大型海藻凋落物间δ13C、δ15N值差异性发现,孔石莼δ13C值与瓦氏马尾藻、细枝软骨藻和羊栖菜间有显著差异(P < 0.01),而δ15N值差异明显的只有羊栖菜和细枝软骨藻(P < 0.05,表 2),其余藻种间δ13C、δ15N值并没有明显差异(P>0.01)。
|
表 2 海藻场夏季大型海藻凋落物种间δ13C、δ15N差异 Tab.2 Interspecific carbon and nitrogen isotopic ratios between macro algae collected from seaweed bed in the summer |
5种大型海藻碎屑化过程中有机C含量总体呈现下降趋势(图 2),瓦氏马尾藻、细枝软骨藻、羊栖菜、舌状蜈蚣藻在分解5 d左右达到最高值后平缓下降至较低值,孔石莼有机C含量在分解30 d后才有明显下降。 海藻凋落物有机N含量分解前后变化相对较小,舌状蜈蚣藻在分解初期N含量上升了5.36‰,变化幅度最大。

|
图 2 海藻场夏季大型海藻凋落物分解过程中C含量、N含量、C/N值变化
Fig. 2 C content, N content, C/N ratios of macro algae during degradation
|
分解过程中5种海藻的δ13C值均呈现先下降后趋于稳定的趋势(图 3),其中瓦氏马尾藻、孔石莼、羊栖菜和舌状蜈蚣藻分解完全δ13C值较新鲜藻叶值变得更负;只有细枝软骨藻分解完全后较未分解新鲜藻叶上升约1.9‰。5种海藻的δ15N值变化较δ13C值变化更为复杂。瓦氏马尾藻、细枝软骨藻、孔石莼三种海藻δ15N值在经历分解初期(0~11 d)的富集后在分解后期贫化至和初始值无异,羊栖菜δ15N值在分解完全(42 d)时较新鲜藻叶贫化了约1.5‰,舌状蜈蚣藻δ15N值则一直处于富集趋势(图 3)。

|
图 3 海藻场夏季大型海藻分解过程中δ13C、δ15N值变化
Fig. 3 Stable carbon and nitrogen isotopic ratios of macro algae during degradation
|
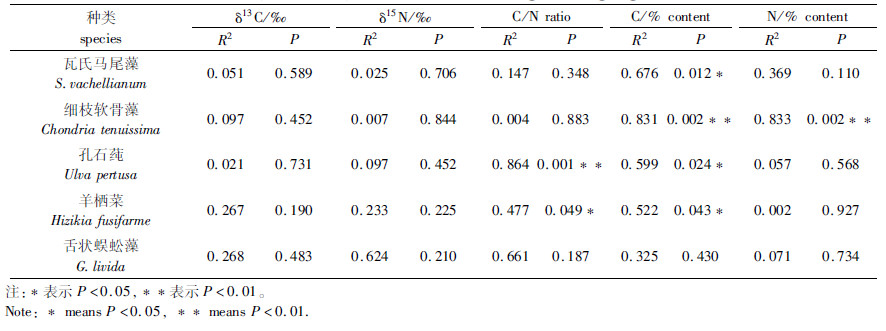
通过线性回归分析发现(表 3),在分解过程中,5种大型海藻δ13C值、δ15N值与分解时间均没有显著线性关系;羊栖菜C/N与分解时间呈显著负相关关系(P<0.05),孔石莼凋落物C/N与分解时间负相关关系极其显著(P<0.01);瓦氏马尾藻、孔石莼和羊栖菜C含量与分解时间呈显著负相关关系(P<0.05),细枝软骨藻C、N含量均与分解时间负相关关系极其显著(P<0.01)。
|
表 3 海藻凋落物分解过程中δ13C、δ15N 、C/N、C、N含量值随时间变化线性回归分析 Tab.3 Linear regression analysis of stable carbon and nitrogen isotopic ratios, C content, N content, C/N ratios of macro algae during degradation |
不同海藻凋落分解的不同时期,其δ15N值较新鲜藻叶变化程度也不尽相同,变化主要集中在分解前半段(0~21 d),分解结束后δ15N值和新鲜藻类差别不大(<2‰,图 4)配对样本t检验5种大型海藻间Δδ15N值差异不显著(P>0.05)。
3 讨论 3.1 大型海藻凋落物的分解过程综合大型海藻凋落物C、N、C/N和C、N稳定同位素值随分解时间变化结果,海藻凋落物分解可大致分为分解初期(分解0~11 d)和分解后期(分解11~42 d)两阶段,这两阶段主导分解的理化因素不同。在分解初期(分解0~11 d),海藻凋落物δ13C值平均下降2.7‰(图 3),N含量和C/N值一直维持在较高水平(图 2),凋落物中易溶有机成分蛋白质、酚类等快速分解,凋落物主要处于化学淋溶阶段。但大部分陆地森林凋落物如针叶树种马尾松(Pinus massoniana)、阔叶树种木荷(Schiima wallichii)等[15-16]淋溶阶段发生在分解最初的2~6个月,淋溶时间远远长于海藻凋落物。造成这一现象的原因分外界环境和内部因素两部分,首先,大型海藻凋落物掉落在海底硬底质或砂质底,受海流影响剧烈,有研究表明陆地森林生态系统中凋落物分解速度与降水量和土壤含水量正相关[17],而红树植物凋落物掉落在泥质底潮间带也表现出较短的淋溶时间(15 d)[18],证明海水浸泡有加速淋溶的作用。研究区域海藻场海水盐度较高(31),海水溶解氧饱和(7.5 mg/L)[19],夏季海水温度27 ℃左右,海藻场靠近密集贻贝养殖区,人类活动密集,工业生活废水等向海洋直接排放,海水富营养化现象严重,海水环境有利于凋落物淋溶分解。其次,海藻凋落物性质决定其分解速度相对迅速,以本实验中分解速度最快的舌状蜈蚣藻为例,藻体中可溶性有机物多糖占海藻干物质50%以上[20],微生物滋生迅速,另外海藻叶片厚度小、强度低,极易受物理、生物破碎,相比其他植物凋落物更容易碎屑化,导致海藻凋落物淋溶阶段可以在一周甚至几天之内完成。
海藻凋落物分解后期(分解11~42 d),5种凋落物N含量分别达到峰值(图 2),微生物大量滋生,凋落物δ13C值在分解后期除细枝软骨藻外变化均不超过2‰(图 3),海藻凋落物进入微生物主导分解阶段,较轻的12C以CO2形式排出,较重的13C逐渐富集,这一阶段主要分解化学淋溶剩余难分解物质如脂质、木质素等。羊栖菜和孔石莼凋落物C/N与分解时间呈显著负相关关系(P<0.5,表 3),说明海藻凋落物在经过初期的破碎、淋溶后分解速度逐渐变快。植物C/N是凋落物分解过程中表征氮固持或氮矿化的最好指标[21],新鲜藻叶C/N比较高,微生物、细菌等缺乏氮供给,会固持大部分氮,导致氮含量增加,所以植物凋落物C/N越高,而N含量越低,凋落物分解速度越慢。但植物C、N、C/N含量并不直接影响凋落物分解,而凋落物低N含量会在一定程度上限制微生物的生长发育[22-23],不利于凋落物分解。凋落物经生物破碎、分解后形成粒径小于200 μm颗粒,增加了凋落物碎屑的比表面积,促进微生物繁殖[24],加快凋落物分解速度。海藻的δ15N值在分解过程中变化情况相比δ13C值变化更复杂,可能是由于复杂的微生物群落变化所致。LEHMANN等[25]提出δ15N值的变化可能与分解过程中细菌同化的已分解无机氮含量有关,并提出凋落物分解过程中δ15N值变化的量级和方向包含细菌群落和无机氮含量两种影响因素。自然环境中,藻类物种和底质环境是影响细菌群落主要因素[26-27],不同植物凋落物滋生微生物速度、种群不同,造成不同种植物在分解时呈现不同的 δ15N值变化。
3.2 大型海藻凋落物分解对食物网能流影响海藻凋落物分解形成的碎屑对食物网有重要非生物能流载体的生态功能,直接影响海域初级生产力结构,从而影响上层食物网营养结构。由于凋落物分解过程中δ15N值变化比较复杂,我们采用不同分解阶段碎屑的δ15N值较新鲜藻叶变化值均值代表藻类凋落物碎屑化过程的变化(图 4),结合实验区域摄食藻类凋落物碎屑和藻叶的底栖动物代表种黄口荔枝螺(Thais luteostoma)、疣荔枝螺(Thais clavigera)、短毛海鳞虫(Halosydna brevisetosa)、角蝾螺(Turbo cornutus)δ15N值数据[28]计算,结果显示由于凋落物分解过程δ15N值变化引起的营养级变动幅度约为0.4±0.1。已有研究表明角蝾螺对实验藻类有一定摄食偏好[29],而且在实际野外调查时发现很多底栖动物如螺类、倍足类、多毛类、桡足类、节肢动物等在摄食新鲜藻类的同时,也会对刚刚凋落的藻类和藻类碎屑进行摄食。另外藻类凋落物δ15N值变化幅度在凋落物分解前期(0~11 d)平均日变化量为2.6‰,明显高于分解后期(11~42 d)平均日变化量的0.5‰(图 4)。所以,忽略海藻凋落物在向海藻碎屑转变这一过程中δ15N值的变化势必引起上层消费者营养级计算的误差,而且碎屑化过程前期的影响更为剧烈。
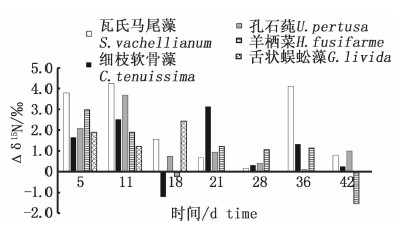
|
图 4 凋落物分解过程中δ15N值变化量(δ15N碎屑-δ15N新鲜藻叶)
Fig. 4 Variation of δ15N value during degradation of litter
|
大型海藻凋落物经微生物分解能够增加海藻床底质的有机质、N、P含量,作为海藻幼苗的多功能有机肥料再次参加到生态系统的能量循环中,多种植物混合凋落物分解能够持续提供更多的养分,同时会影响分解者的多样性、丰富度和生理活性[30]。分解时产生的CO2会释放至水体中或被海藻植物吸收,另外海藻分解速度较陆地植物更快,养分循环效率更高。海藻场水动力及营养循环过程复杂[31],海藻碎屑随海流垂直、水平扩散也是海藻场生态系统对外关键的能量输送环节。
4 结论本研究采用海藻场大型海藻原位埋袋法,研究了有机C含量、有机N含量、C/N、δ13C、δ15N值在大型海藻凋落过程中的变化,其中有机C含量、有机N含量、C/N总体随藻体分解而越来越低,但描述大型海藻δ13C、δ15N值随时间变化的一般规律是比较困难的,不同藻种分解过程中的理化变化也不尽相同。但在变化过程中δ13C、δ15N值较新鲜藻叶有一定波动,δ15N值的变动会对同时摄食海藻碎屑和海藻植株的杂食性底栖动物营养级计算造成0.4左右的偏差,对整体食物网结构有一定影响。所以在研究海藻场食物网结构以及计算利用大型海藻的初级消费者营养级时,应综合摄食生态进行讨论分析。海洋中海藻凋落物所处环境相对复杂,了解海藻碎屑过程中的变化有助于海藻场初级生产力来源、组成的分析研究,从微观角度研究凋落物在碎屑化过程中对整个海域食物网能量流动的影响将是日后研究重点。
| [1] | FOURQUREAN J W, SCHRLAU J E.Changes in nutrient content and stable isotope ratios of C and N during decomposition of seagrasses and mangrove leaves along a nutrient availability gradient in Florida Bay, USA[J]. Chemistry and Ecology, 2003, 19(5): 373–390. |
| [2] | HAINES E B.The Origins of Detritus in Georgia Salt Marsh Estuaries[J]. Oikos, 1977, 29(2): 254–260. |
| [3] | HUGHES E H, SHERR E B.Subtidal food webs in a georgia estuary:δ13C analysis[J]. Journal of Experimental Marine Biology and Ecology, 1983, 67(3): 227–242. |
| [4] | SMITH B D, FOREMAN R E.An assessment of seaweed decomposition within a southern Strait of Georgia seaweed community[J]. Marine Biology, 1984, 84(2): 197–205. |
| [5] | DUGAN J E, HUBBARD D M, MCCRARY M D, et al.The response of macrofauna communities and shorebirds to macrophyte wrack subsidies on exposed sandy beaches of southern California[J]. Estuarine, Coastal and Shelf Science, 2003, 58: 25–40. |
| [6] | LASTRA M, PAGE H M, DUGAN J E, et al.Processing of allochthonous macrophyte subsidies by sandy beach consumers:estimates of feeding rates and impacts on food resources[J]. Marine Biology, 2008, 154(1): 163–174. |
| [7] | BUSTAMANTE R H, BRANCH G M, EEKHOUT S.Maintenance of an exceptional intertidal grazer biomass in South Africa:subsidy by subtidal kelps[J]. Ecology, 1995, 76(7): 2314–2329. |
| [8] | VETTER E W, DAYTON P K.Organic enrichment by macrophyte detritus, and abundance patterns of megafaunal populations in submarine canyons[J]. Marine Ecology Progress Series, 1999, 186: 137–148. |
| [9] | POST D M, PACE M L, HAIRSTON JR, N G.Ecosystem size determines food-chain length in lakes[J]. Nature, 2000, 405(6790): 1047–1049. |
| [10] | MILLER R J, PAGE H M.Kelp as a trophic resource for marine suspension feeders:a review of isotope-based evidence[J]. Marine Biology, 2012, 159(7): 1391–1402. |
| [11] | CARACO N F, LAMPMAN G, COLE J J, et al.Microbial assimilation of DIN in a nitrogen rich estuary:implications for food quality and isotope studies[J]. Marine Ecology Progress Series, 1998, 167: 59–71. |
| [12] | 陈卉. 中国两种亚热带红树林生态系统的碳固定、掉落物分解及其同化过程[D]:厦门:厦门大学, 2013. CHEN H. Carbon sequestration, litter decomposition and consumption in two subtropical mangrove ecosystems of China[D]. Xiamen:Xiamen University, 2013. |
| [13] | HILL J M, MCQUAID C D.Variability in the fractionation of stable isotopes during degradation of two intertidal red algae[J]. Estuarine, Coastal and Shelf Science, 2009, 82(3): 397–405. |
| [14] | SILVER W L, MIYA R K.Global patterns in root decomposition:comparisons of climate and litter quality effects[J]. Oecologia, 2001, 129(3): 407–419. |
| [15] | BERG B, MCCLAUGHERTY C.Plant litter:Decomposition, humus formation, carbon sequestration[J]. New York:Springer-Verlag, 2003. |
| [16] | MORO M J, DOMINGO F.Litter decomposition in four woody species in a Mediterranean climate:weight loss, N and P dynamics[J]. Annals of Botany, 2000, 86(6): 1065–1071. |
| [17] | CHEN H. Root decomposition in three coniferous forests:effects of substrate quality, temperature, and moisture[D]. Corvallis, Oregon:Oregon State University, 1999:214. |
| [18] | CUNDELL A M, BROWN M S, STANFORD R, et al.Microbial degradation of Rhizophora mangle leaves immersed in the sea[J]. Estuarine and Coastal Marine Science, 1979, 9(3). |
| [19] | 陈清满, 章守宇, 林军, 等.枸杞岛紫贻贝生长状况及其与环境因子关系[J]. 上海海洋大学学报, 2012, 21(5): 809–815. CHEN Q M, ZHANG S Y, LIN J, et al.Growth conditions of Mytilus edulis Linnaeus and its relationship with environmental factors in Gouqi Island[J]. Journal of Shanghai Ocean University, 2012, 21(5): 809–815. |
| [20] | 牛建峰, 王广策, 曾呈奎, 等.带形蜈蚣藻多糖和可溶性蛋白含量测定及藻红蛋白分析鉴定[J]. 海洋科学, 2006, 30(8): 50–53. NIU J F, WANG G C, TSENG C K, et al.Determination of amylose and dissolvable protein in Grateloupia turuturu Yamada by spectrophotometry identifying of its phycoerythrin[J]. Marine Sciences, 2006, 30(8): 50–53. |
| [21] | TAYLOR B R, PARSONS W F J, PARKINSON D.Decomposition of Populustremuloides leaf litter accelerated by addition of Alnuscrispa litter[J]. Canadian Journal of Forest Research, 1989, 19(5): 674–679. |
| [22] | BOHLEN P J, PARMELEE R W, ALLEN M F, et al.Differential effects of earthworms on nitrogen cycling from various nitrogen-15-labeled substrates[J]. Soil Science Society of America Journal, 1999, 63(4): 882–890. |
| [23] | MOORE T R, TROFYMOW J A, TAYLOR B, et al.Litter decomposition rates in Canadian forests[J]. Global Change Biology, 1999, 5(1): 75–82. |
| [24] | WERRY J, LEE S Y.Grapsid crabs mediate link between mangrove litter production and estuarine planktonic food chains[J]. Marine Ecology Progress Series, 2005, 293: 165–176. |
| [25] | LEHMANN M F, BERNASCONI S M, BARBIERI A, et al.Preservation of organic matter and alteration of its carbon and nitrogen isotope composition during simulated and in situ early sedimentary diagenesis[J]. Geochimica et Cosmochimica Acta, 2002, 66(20): 3573–3584. |
| [26] | ESTEP M L F, MACKO S A.Nitrogen isotope biogeochemistry of thermal springs[J]. Organic Geochemistry, 1984, 6: 779–785. |
| [27] | FELLERHOFF C, VOSS M, WANTZEN K M.Stable carbon and nitrogen isotope signatures of decomposing tropical macrophytes[J]. Aquatic Ecology, 2003, 37(4): 361–375. |
| [28] | 蒋日进, 章守宇, 王凯, 等.枸杞岛近岸海域食物网的稳定同位素分析[J]. 生态学杂志, 2014, 33(4): 930–938. JIANG R J, ZHANG S Y, WANG K, et al.Stable isotope analysis of the offshore food web of Gouqi Island[J]. Chinese Journal of Ecology, 2014, 33(4): 930–938. |
| [29] | 周曦杰, 章守宇, 王旭, 等.枸杞岛海藻场角蝾螺夏季摄食选择性及其生态学意义[J]. 水产学报, 2015, 39(4): 511–519. ZHOU X J, ZHANG S Y, WANG X, et al.The feeding behaviour and ecological function during summer of one herbivore on seaweed bed in Gouqi Island:the gastropod, Turbo cornutus Solander[J]. Journal of Fisheries of China, 2015, 39(4): 511–519. |
| [30] | HANSEN R A, COLEMAN D C.Litter complexity and composition are determinants of the diversity and species composition of oribatid mites (Acari:Oribatida) in litterbags[J]. Applied Soil Ecology, 1998, 9(1/3): 17–23. |
| [31] | LAPOINTE B E, BEDFORD B J.Stormwater nutrient inputs favor growth of non-native macroalgae (Rhodophyta) on O'ahu, Hawaiian Islands[J]. Harmful Algae, 2011, 10(3): 310–318. |
 2016,
Vol. 25
2016,
Vol. 25


