2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
3. 远洋渔业协同创新中心, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306
脊椎动物心脏发育受到许多基因的调控。目前研究较多的与心脏发育相关的基因包括bmp/smad、Wnt、FGF、Notch和视黄酸等通路[1-4]。多个bmps家族成员被报道参与了初级阶段的心肌细胞发育与分化。Bmp2可促进心脏祖系细胞的特异性分化[5-9];而bmp4在小鼠心脏的房室分隔形成过程中起着很重要的作用[10]。另外,心脏的发育还涉及到多个锌指蛋白GATA家族成员的参与。Gata6虽不能诱导bmp4的表达,但能够维持bmp4的表达水平,并且参与心肌组织内胚层和中胚层的形成 [11]。
microRNA (miRNA)是一类长约18~25 nt 的单链非编码小RNA,主要通过结合于靶基因的 3′非翻译区(3′Untranslated Regions,3′UTR),抑制靶基因的翻译或导致 mRNA 降解,从而抑制靶基因的表达[12]。近年来,小分子RNA参与心脏发育相关基因的转录后调控时有报道。如:研究发现miR-1通过钙调蛋白/NFAT信号通路下调钙调蛋白信号负调控mef2a和gata4,进而抑制心肌细胞的增殖 [13]。
独角雪冰鱼(Chionodraco hamatus,CH,简称冰鱼)是生活在南极深海零度以下无污染水域的底栖性鱼类。作为已知脊椎动物中唯一不含血红蛋白的类群,冰鱼的血液循环系统发生了巨大的补偿性生理变化。与同等体重的常见含血红蛋白的南极鱼类相比,冰鱼心脏约为其他南极鱼心脏的三倍以上,血管明显变粗[14]。南极冰鱼心脏是研究心脏增生发育的重要模型,冰鱼心脏的发育与调控机制研究也是备受关注的科学问题。
前期研究中,本实验室发现一些microRNA在冰鱼心脏与相同生境下其他南极鱼心脏中的表达差异显著,其中的miR-210-5p表达量变化显著。我们推测miR-210-5p很可能参与冰鱼心脏增生的调控。本研究针对独角雪冰鱼心脏中异常高表达的miR-210-5p,利用体内显微注射斑马鱼胚胎实验和转细胞实验,首次研究得到了该microRNA在心脏发育中的功能及作用机制。本研究为揭示miR-210-5p在南极冰鱼体内心脏发育的影响机制提供了理论依据,并为进一步探讨极端低温环境条件下microRNA对心脏发育的作用机制与进化研究奠定了基础。
1 材料与方法 1.1 实验动物和样本采集斑马鱼(AB品系)饲养于上海海洋大学海洋科学学院28 ℃恒温斑马鱼饲养房培养室。循环水系统购买于上海海圣公司。独角雪冰鱼采集于南极埃默里冰架和南极熊猫码头,解剖后,取其心脏等组织保存于-80 ℃冰箱。
1.2 试剂Trizol试剂、RealBand 3-color Regular Range Protein Marker、5× protein loading buffer和β-ACTIN一抗抗体均购于上海生工生物科技有限公司;PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBRPremix Ex TaqTM Ⅱ (Tli RNaseH Plus)和pMD18-T vector购于TaKaRa公司;Axygen DNA Gel Extraction Kit购于Axygen公司;EcoR Ⅰ限制性内切酶和Bam H I限制性内切酶购于NEB公司;胎牛血清购于Gibico公司;Attractene transfection reagent来自凯捷生物公司;0.45 μm PVDF膜由Milipore生物公司提供;2× Easy Taq PCR SuperMix购于北京全式金生物公司;Top10感受态细胞购于天根生物公司;DMEM-高糖培养基和Super Signal West Pico Chemiluminescent Substrate蛋白显影液购于Thermo公司;BMP4抗体和GFP抗体来自GeneTex公司;BMP2抗体来自杭州华安生物公司;SMAD1来自于abcam公司;GATA6抗体购于LSBio公司;TBX2B由OriGene technologies提供;miR-210-5p 模拟体和NC(Negative Control,阴性对照)由上海吉玛基因生物公司合成;Eppendorf显微注射仪和ZEISS高端立体显微镜均购自德国。
1.3 方法 1.3.1 斑马鱼显微注射取健康、性成熟的斑马鱼,于前一晚喂食前将雌雄放入产卵缸内。暗处理10~12 h后拿掉挡板,使其完成交配和产卵。收集、挑选正常发育的胚胎(分两组)用于显微注射,实验组miR-210-5p注射浓度为50 μm(1 nL/卵),对照组的处理同实验组(NC序列:UUGUACUACACAAAAGUACUG)。之后,将注射好的斑马鱼胚胎饲养于斑马鱼饲养房,饲养温度28 ℃,光周期为明14 h,暗10 h。每天记录并统计死亡率。
1.3.2 观察斑马鱼心脏发育状况取72 hpf (hours postfertilization,受精后小时)斑马鱼胚胎,用立体显微镜(ZEISS)观察并拍照,记录心脏畸形状况。
1.3.3 总RNA的提取将72 hpf的斑马鱼收集到1.5 mL离心管中,用1×PBS洗2遍,利用trizol试剂提取总RNA,具体步骤按照说明书进行。用 1%琼脂糖凝胶电泳鉴定所提取 RNA 的完整性。用NanoDrop2000进行浓度测定,-80 ℃保存。
1.3.4 cDNA的合成利用PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒进行RNA的反转录得到cDNA,具体如下:两步法获得第一条链cDNA,反转体系(第一步)为10 μL:gDNA Eraser,1 μL;5×gDNA Eraser Buffer,2 μL;Total RNA,1 μg;超纯水加至10 μL,上述混合物42 ℃,2 min,然后4 ℃保存。反转录第二步反应体系为20 μL:混合液(第一步)10 μL;5×PrimeScript Buffer 2,4 μL;PrimeScript RT Enzyme Mix1,1 μL;RT Primer Mix 1 μL,超纯水加至20 μL,上述混合液37 ℃、15 min,85 ℃、5 s,4 ℃保存,获得的cDNA保存于-20 ℃。
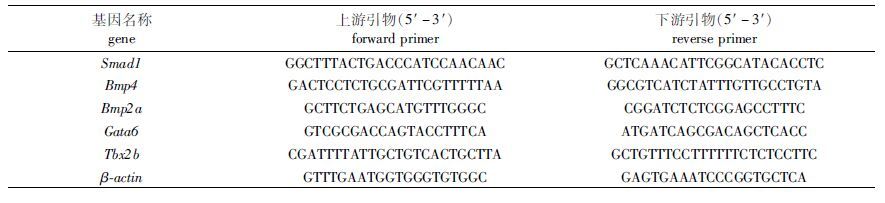
1.3.5 Real time qRT-PCR使用SYBRⅡ ExScript RT-PCR Kit定量PCR(bio-rad CFX96),体系:SYBR 10 μL,上游引物1 μL,下游引物1 μL,模板1 μL,灭菌水7 μL。反应条件:95 ℃ 5 min,95 ℃ 3 min,60 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃ 10 min。qRT-PCR所用引物如表 1所示。
|
表 1 qRT-PCR所用引物 Tab.1 Primer list of qRT-PCR |
在实验组和对照组中分别取40枚发育72 h的斑马鱼卵收集到1.5 mL离心管中,用1×PBS洗2遍,加入生工蛋白提取试剂溶液A 400 μL,溶液B 4 μL(转染24 h的H9C2细胞六孔板,每孔加入200 μL溶液A,2 μL溶液B),混匀后冰上震荡或捣碎10 min,静置20 min,4 ℃ 12 000 r/min离心10 min。取上清,使用NanoDrop 2000进行浓度测定,保存于-40 ℃备用。
1.3.7 Western blot蛋白样品加入5×loading buffer (5%巯基乙醇)混匀,100 ℃水浴锅煮沸10 min,72 hpf斑马鱼胚胎的上样量为1.5 mg/泳道。80 V,30 min,100 V,1 h,SDS-PAGE凝胶电泳样品。电转转膜转移凝胶至PVDF膜,250 mA,1 h。5%脱脂奶粉慢摇封闭1 h。兔BMP2抗体(1∶1000),兔BMP4抗体(1∶500),兔GFP抗体(1∶5000),兔GATA6抗体(1∶1000),兔SMAD1抗体(1∶1000),兔TBX2B抗体(1∶1000)慢摇2 h,PBST洗涤3次,孵育二抗1 h,PBST洗涤2次,PBS洗涤一次后显色处理,显影。
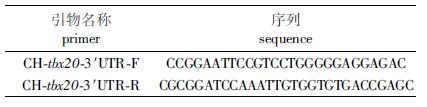
1.3.8 CH-EGFP-C2-tbx20-3′UTR的表达载体构建根据本实验室对独角雪冰鱼转录组测序所得的tbx20的3′UTR区域,设计含有酶切位点的引物(表 2)扩增tbx20-3′UTR片段。从独角雪冰鱼的肌肉组织中提取基因组DNA,PCR扩增目的片段,胶回收获取扩增片段,将tbx20-3′UTR连接到PMD18-T载体,并进行菌液测序。选取含有正确片段的菌液扩大培养并提取质粒,将p-EGFP-C2质粒和含有目的片段的TA克隆载体双酶切(Eco r1,Bam h1)获得目的片段。将tbx20-3′UTR和含有酶切位点的p-EGFP-C2置于22 ℃连接4 h。转化挑菌,PCR鉴定是否为含有目的片段的菌液。选取正确的菌液扩大培养,提取质粒并去内毒素。南极冰鱼tbx20-3′UTR片段的扩增引物如表 2所示。
|
表 2 引物序列 Tab.2 Primer list |
倒置显微镜下,观察细胞的状态,以及是否已经长满培养皿。弃去培养基,贴壁加入2 mL PBS液清洗2遍。将0.25%胰酶1 mL加入培养皿内,上下左右铺匀,室温消化1 min左右。加入4 mL的含10%血清的新鲜培养基,反复吹打消化好的细胞使其脱壁并分散,制成细胞悬液。六孔板中每个孔加入150~200 μL的细胞悬液和2 mL含10%血清的DAEM培养基,吹打均匀,于37 ℃培养12~18 h。细胞生长至铺满50%转染,转染步骤按照凯捷试剂说明书,转染后6 h换液,再过24 h观察细胞瞬时荧光,拍照并提取蛋白。
2 结果 2.1 miR-210-5p生物信息学分析独角雪冰鱼、青鳉、斑马鱼以及大鼠中的miR-210-5p序列表现出很大的保守性,独角雪冰鱼与青鳉,斑马鱼的miR-210-5p序列基本一致,与大鼠的序列相比第2~7个种子序列具有保守性(图 1)。

|
图 1 miR-210-5p序列保守性分析
Fig. 1 miR-210-5p sequence conservative analysis
|
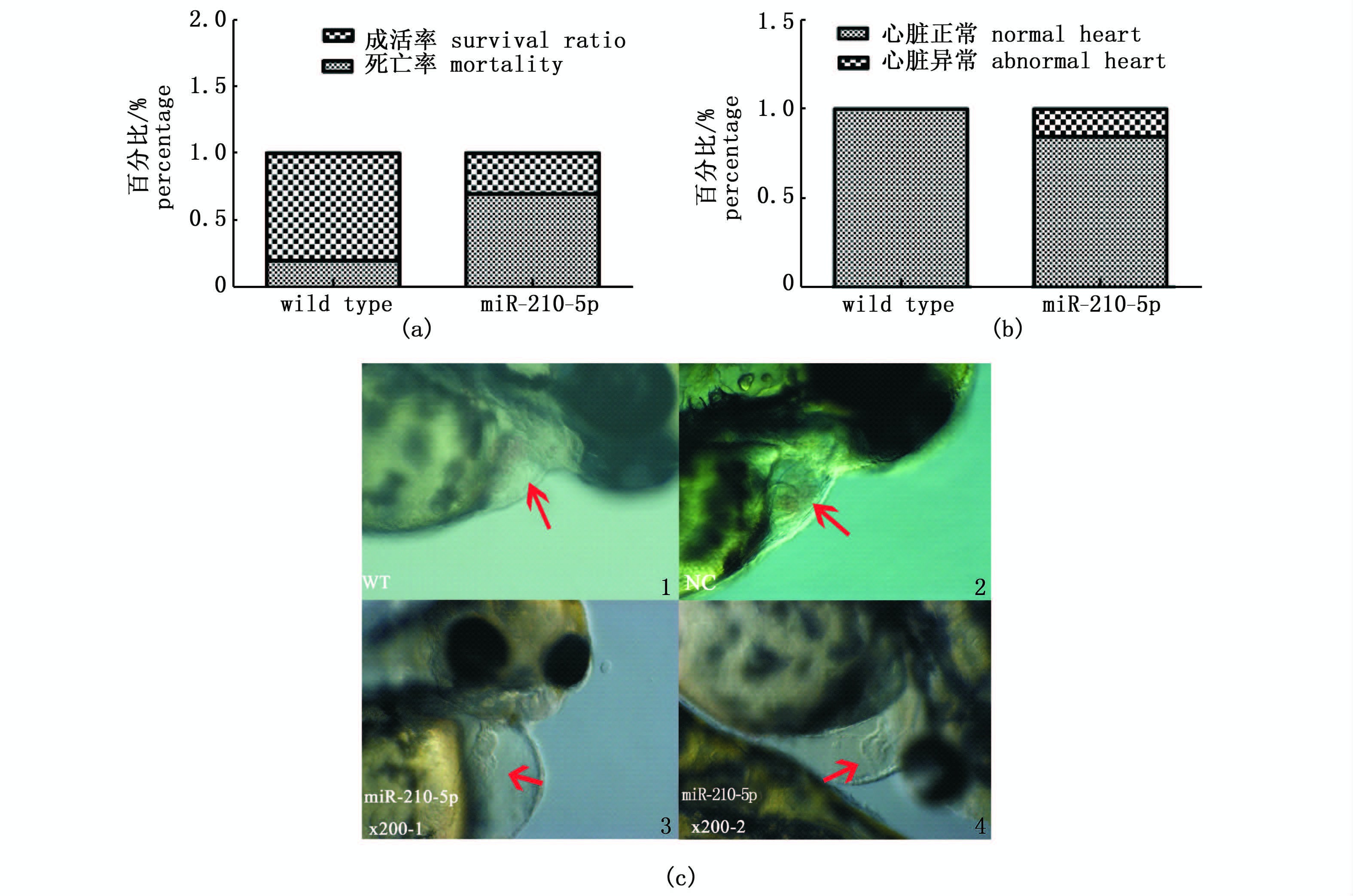
与野生型(Wild Type,WT)相比,注射miR-210-5p 72 h后,斑马鱼胚胎的死亡率升高(图 2a),心脏畸形的胚胎数目增加(图 2b),心包膜出现水肿现象(图 2c)。
|
图 2 注射miR-210-5p (50 μm)72 hpf斑马鱼的死亡率及心脏发育状况
Fig. 2 The mortality of 72 hpf zebrafish embryos and cardiac development after the microinjection of miR-210-5p (50 μm)
(a) 注射miR-210-5p (50 μm,1 nL)受精后72 h内统计胚胎死亡率结果; (b) 注射miR-210-5p后72 hpf的斑马鱼胚胎心脏发育状况; (c) 注射miR-210-5p (50 μm,1nL)后72 h,高端立体显微镜下观察斑马鱼胚胎心脏的发育状况。 (a) The statistical results of the 72 hpf zebrafish embryos mortality after miR-210-5p (50 μm,1nL) microinjection; (b) The statistical results of the cardiac development of 72 hpf zebrafish embryos after microinjection; (c) The zebrafish heart in 200-time microscope. |
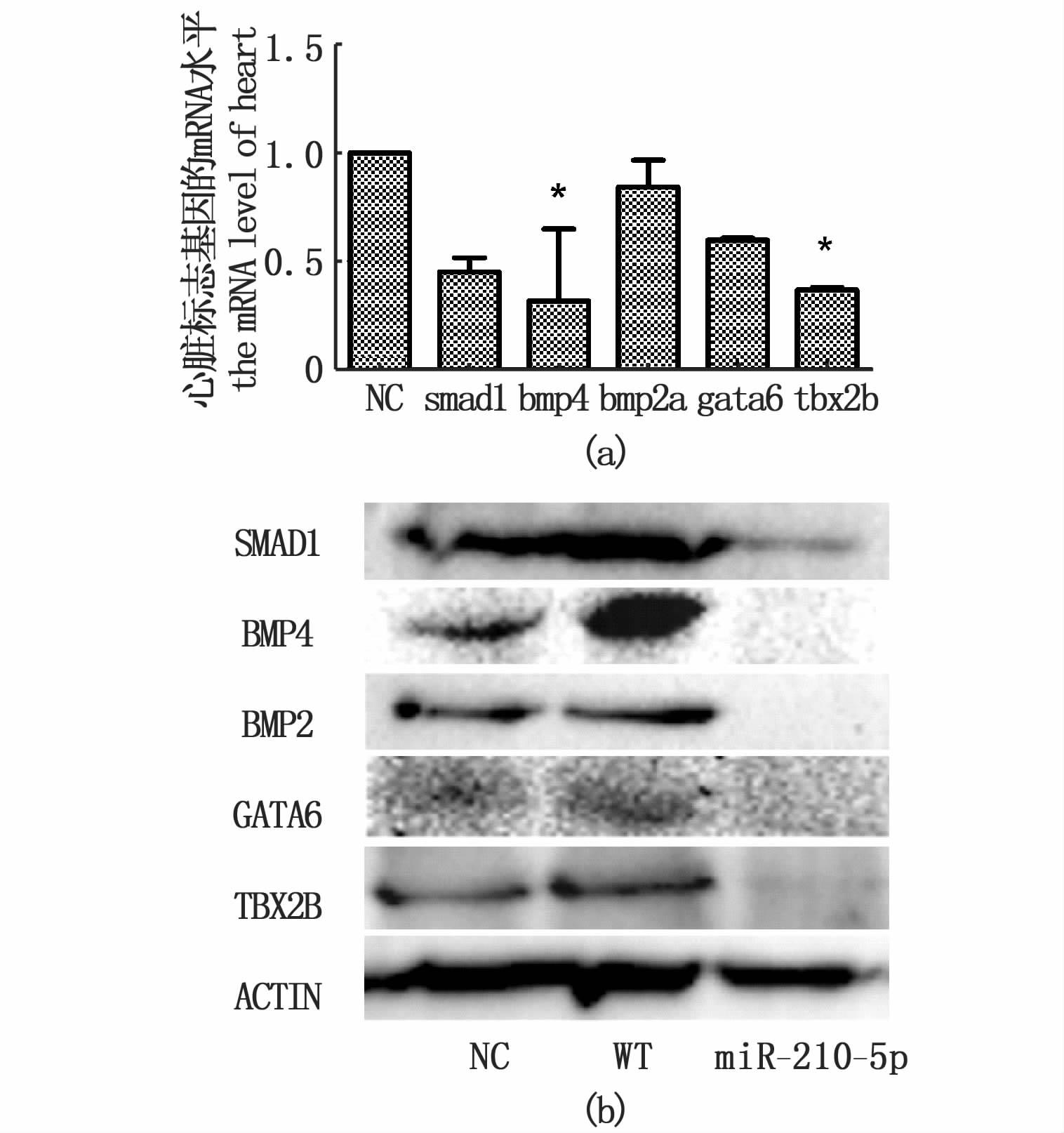
注射miR-210-5p之后,提取72 hpf的斑马鱼胚胎总RNA,qRT-PCR 和Western blot 检测心脏发育相关基因的mRNA和蛋白表达。结果显示:过表达miR-210-5p斑马鱼胚胎能够下调心脏发育基因bmp4、smad1和tbx2b的表达(图 3a)。与对照组相比,BMP4、BMP2、SMAD1、GATA6和TBX2B的蛋白表达下降(图 3b)。
|
图 3 量PCR和Western blot检测斑马鱼心脏发育相关基因变化
Fig. 3 Expression analysis of heart development related genes in zebrafish by qRT-PCR and Western blot
(a) 斑马鱼心脏发育相关基因mRNA水平(P< 0.05);(b) western blotting检测斑马鱼心脏发育相关基因变化。 (a) The mRNA level of heart development related genes in zebrafish (P< 0.05); (b) Expression analysis of heart development related genes in zebrafish by western blotting. |
将构建好的真核表达载体p-EGFP-CH-tbx20-3′UTR和miR-210-5p共同转染至HEK293T细胞中,观察荧光强度。p-EGFP-CH-tbx20-3′UTR空质粒转染作为空白对照,p-EGFP-CH-tbx20-3′UTR和NC共转作为阴性对照。结果发现,与空质粒相比,阴性对照(NC)的荧光没有显著变化,但miR-210-5p与质粒载体共转之后绿色荧光蛋白相对较弱(图 4a)。另外,我们还检测了绿色荧光蛋白的水平,发现miR-210-5p与质粒共转之后,绿色荧光蛋白的表达水平下降(图 4b)。因此,我们推测,miR-210-5p很可能通过与CH-tbx20-3′UTR结合,抑制tbx20的转录后翻译。
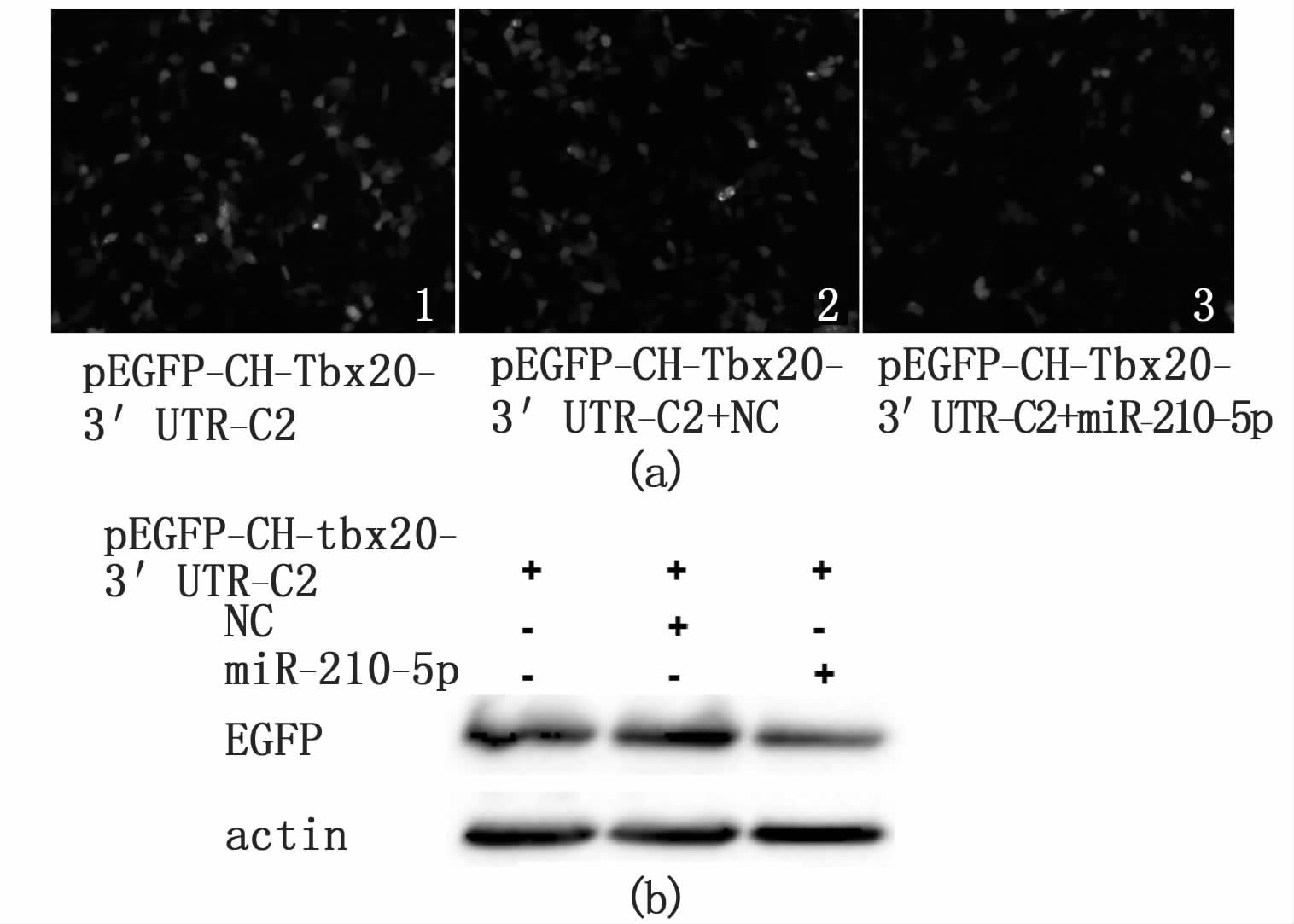
|
图 4 转染24 h后检测GFP荧光蛋白的表达情况
Fig. 4 The expression of fusion GFP protein after transfecting miR-210-5p into HEK293T cells
(a) 转染24h后观察细胞GFP的瞬时荧光表达 ;(b)转染24 h后western blot检测GFP荧光蛋白的表达。 (a) Transient expression of GFP after transfection of 24 h; (b) The protein level of fusion GFP in HEK293T cells after transfection of 24 h. |
南极气候恶劣,水域低温高氧,许多生物包括南极鱼类在进化过程中逐渐适应了环境。南极冰鱼和其他生物一样,只有获得足够的氧气才能生存,可是其体内不含血红蛋白或者具有功能的红血球,因此冰鱼的心脏产生了很大的补偿性变化,其心脏比其他南极鱼类增大了3倍,血管明显变粗[14]。前期研究发现,与同等环境下的南极鱼相比,南极冰鱼心脏中的某些microRNA的表达发生了很明显的变化,冰鱼心脏中miR-210-5p的表达显著升高。我们推测,miR-210-5p与冰鱼心脏补偿性增生相关。目前也有一些与miR-210相关的研究,如在卵巢异位细胞系中,低氧刺激下HIF-1α和miR-210的表达量显著升高,而miR-210的过表达对保持细胞的活力也有一定的作用[15]。另外,阻滞miR-210的表达能够提高心肌梗死模型小鼠的成活率并改善其心脏功能[16]。研究显示miR-210能促进肾癌细胞的增殖和转移,抑制肾癌细胞的凋亡[17]。已有文献中涉及miR-210与心脏发育的并不多,因此本研究试图探索miR-210-5p对冰鱼心脏发育的调控机制,并进一步认识miR-210的生物学功能。
本研究将miR-210-5p显微注射进入斑马鱼胚胎,斑马鱼的心脏发育出现异常,表现为心包膜水肿,心脏发育畸形(图 2)。过表达miR-210-5p的斑马鱼胚胎,几个心脏发育相关基因mRNA水平的表达下调,其中bmp4和tbx2b被显著下调(图 3a)。有研究证实,bmp4可通过增加心肌细胞nox4表达及其ros依赖性通路,诱导心肌细胞肥大、凋亡和心脏纤维化[18]。Tbx2a和tbx2b在斑马鱼初级心管中表达,在受精后两天转录水平限制在房室管,在tbx2a和tbx2b突变体斑马鱼中,心室形成受阻[19]。Bmp/smad通路在心脏发育过程中起着很重要的调控作用[4]。GATA结合蛋白是锌指转录因子,家族中GATA4和GATA6参与内胚层的发育以及心血管系统的形成[20-23]。本文检测了bmp/smad通路中的几种蛋白表达,它们的蛋白表达水平均显著下调(图 3b)。因此,我们推测miR-210-5p极有可能是通过bmp/smad通路发挥作用的。
Tbx20基因是心脏发育相关的重要因子,它是早期房室管形成和内皮细胞迁移所需的转录因子[24]。在房室管心肌层中,Tbx20维持bmp2、tbx3和hand1的表达[24]。已有研究表明,在非洲爪蟾中,smad1的抑制会特异地阻滞tbx20的表达,而tbx5、MHC等其他许多心肌发育因子的表达不会受到影响。Tbx20是bmp/smad信号通路下游的一个转录靶点。Bmp家族以及下游调控基因smad家族在早期心脏发育中参与很多生物学过程,包括心肌细胞的特化、增殖和分化[25]。我们推测,tbx20很可能是miR-210-5p的一个靶基因。因此,我们将独角雪冰鱼tbx20基因的3′UTR区域重组到pEGFP-C2质粒载体上,并和miR-210-5p共转染到HEK293T细胞中,检测GFP的荧光变化。与阴性对照相比,miR-210-5p和pEGFP-CH-tbx20-3′UTR共转染后的荧光量下降,同时荧光蛋白的表达量也下降(图 4)。我们认为,miR-210-5p可能是与tbx20的3′UTR区域结合,抑制融合荧光蛋白的表达。在独角雪冰鱼中miR-210-5p很可能是通过靶向抑制tbx20的表达来抑制其心脏发育的。尽管本项目所揭示的miR-210-5p对心脏发育的调控作用还远远不足,但需要指出的是,这些结果为今后揭示南极冰鱼心脏补偿性增生的机制奠定了一定的基础。
| [1] | KEEGAN B R, FELDMAN J L, BEGEMANN G, et al.Retinoic acid signaling restricts the cardiac progenitor pool[J]. Science, 2005, 307(5707): 247–249. |
| [2] | MARQUES S R, LEE Y, POSS K D, et al.Reiterative roles for FGF signaling in the establishment of size and proportion of the zebrafish heart[J]. Developmental Biology, 2008, 321(2): 397–406. |
| [3] | REITER J F, VERKADE H, STAINIER D Y R.Bmp2b and Oep promote early myocardial differentiation through their regulation of gata5[J]. Developmental Biology, 2001, 234(2): 330–338. |
| [4] | RONES M S, MCLAUGHLIN K A, RAFFIN M, et al.Serrate and notch specify cell fates in the heart field by suppressing cardiomyogenesis[J]. Development, 2000, 127(17): 3865–3876. |
| [5] | ANDRÉE B, DUPREZ D, VORBUSCH B, et al.BMP-2 induces ectopic expression of cardiac lineage markers and interferes with somite formation in chicken embryos[J]. Mechanisms of Development, 1998, 70(1/2): 119–131. |
| [6] | KLAUS A, SAGA Y, TAKETO M M, et al.Distinct roles of Wnt/β-catenin and Bmp signaling during early cardiogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(47): 18531–18536. |
| [7] | LEE K H, EVANS S, RUAN T Y, et al.SMAD-mediated modulation of YY1 activity regulates the BMP response and cardiac-specific expression of a GATA4/5/6-dependent chick Nkx2.5 enhancer[J]. Development, 2004, 131(19): 4709–4723. |
| [8] | SCHLANGE T, ANDRE E B, ARNOLD H H, et al.BMP2 is required for early heart development during a distinct time period[J]. Mechanisms of Development, 2000, 91(1/2): 259–270. |
| [9] | SCHULTHEISS T M, BURCH J B, LASSAR A B.A role for bone morphogenetic proteins in the induction of cardiac myogenesis[J]. Genes & Development, 1997, 11(4): 451–462. |
| [10] | JIAO K, KULESSA H, TOMPKINS K, et al.An essential role of Bmp4 in the atrioventricular septation of the mouse heart[J]. Genes & Development, 2003, 17(19): 2362–2367. |
| [11] | PETERKIN T, GIBSON A, PATIENT R.GATA-6 maintains BMP-4 and Nkx2 expression during cardiomyocyte precursor maturation[J]. The EMBO Journal, 2003, 22(16): 4260–4273. |
| [12] | LEE Y S, DUTTA A.MicroRNAs in cancer[J]. Annual Review of Pathology: Mechanisms of Disease, 2009, 4: 199–227. |
| [13] | IKEDA S, HE A, KONG S W, et al.MicroRNA-1 negatively regulates expression of the hypertrophy-associated calmodulin and mef2a genes[J]. Molecular and Cellular Biology, 2009, 29(8): 2193–2204. |
| [14] | ACIERNO R, MACDONALD J A, AGNISOLA C, et al.Blood volume in the hemoglobinless Antarctic teleost Chionodraco hamatus (L nnberg)[J]. Journal of Experimental Zoology, 1995, 272(5): 407–409. |
| [15] | XU T X, ZhAO S Z, DONG M, et al.Hypoxia responsive miR-210 promotes cell survival and autophagy of endometriotic cells in hypoxia[J]. European Review for Medical and Pharmacological Sciences, 2016, 20(3): 399–406. |
| [16] | WANG Y P, PAN X H, FAN Y Q, et al.Dysregulated expression of microRNAs and mRNAs in myocardial infarction[J]. American Journal of Translational Research, 2015, 7(11): 2291–2304. |
| [17] | LIU T Y, ZHANG H, DU S M, et al.Expression of microRNA-210 in tissue and serum of renal carcinoma patients and its effect on renal carcinoma cell proliferation, apoptosis, and invasion[J]. Genetics and Molecular Research, 2016, 15(1): gmr.15017746. |
| [18] | SUN B, HUO R, SHENG Y, et al.Bone morphogenetic protein-4 mediates cardiac hypertrophy, apoptosis, and fibrosis in experimentally pathological cardiac hypertrophy[J]. Hypertension, 2013, 61(2): 352–360. |
| [19] | SEDLETCAIA A, EVANS T.Heart chamber size in zebrafish is regulated redundantly by duplicated tbx2 genes[J]. Developmental Dynamics, 2011, 240(6): 1548–1557. |
| [20] | KUO C T, MORRISEY E E, ANANDAPPA R, et al.GATA4 transcription factor is required for ventral morphogenesis and heart tube formation[J]. Genes & Development, 1997, 11(8): 1048–1060. |
| [21] | LAFOREST B, ANDELFINGER G, NEMER M.Loss of gata5 in mice leads to bicuspid aortic valve[J]. Journal of Clinical Investigation, 2011, 121(7): 2876–2887. |
| [22] | MOLKENTIN J D, LIN Q, DUNCAN S A, et al.Requirement of the transcription factor GATA4 for heart tube formation and ventral morphogenesis[J]. Genes & Development, 1997, 11(8): 1061–1072. |
| [23] | MORRISEY E E, TANG Z H, SIGRIST K, et al.GATA6 regulates HNF4 and is required for differentiation of visceral endoderm in the mouse embryo[J]. Genes & Development, 1998, 12(22): 3579–3590. |
| [24] | CAI X Q, NOMURA-KITABAYASHI A, CAI W B, et al.Myocardial Tbx20 regulates early atrioventricular canal formation and endocardial epithelial-mesenchymal transition via Bmp2[J]. Developmental Biology, 2011, 360(2): 381–390. |
| [25] | MANDEL E M, KALTENBRUN E, CALLIS T E, et al.The BMP pathway acts to directly regulate Tbx20 in the developing heart[J]. Development, 2010, 137(11): 1919–1929. |
2. Key Laboratory of Sustainable Exploitation of Ocean Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. Collaborative Innovation Center for Distant-water Fisheries, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


