南极磷虾(Euphausia superba)是全球现存的单种生物资源量最为丰富的生物之一[1],具有巨大的开发和利用潜力。南极磷虾具有食物和饵料用途,还含有比较高的活性成份。如富含以EPA和DHA为代表的Omega-3s[2]成分。南极磷虾的蛋白质含量比较高,肌肉鲜样粗蛋白含量为16.31%[3]。南极磷虾肌肉水解产物中氨基酸种类丰富,含有18种,其中包含人体所需的8种必需氨基酸(EAA)和10种非必需氨基酸(NEAR)。研究表明:必需氨基酸含量为25.88 %,占南极磷虾肌肉中氨基酸总量的45. 28%[3]。CHEN等[4]在对磷虾蛋白水解产物进行分析后,得出南极磷虾蛋白所含的必需氨基酸含量满足FAO/WHO/UNU1985推荐的人体对蛋白质的摄取要求。天然的生物活性肽,如肽类抗生素、生物毒素和激素等,在生物体内含量极低,提取难度非常大,所以难以大规模地生产,形成产业化,而通过添加外源酶对组织蛋白进行酶解,然后从中筛选出具有特定功能的多肽更加经济、简便,因而目前常采用酶解制肽的方法进行多肽的制备[5]。本文还进行了南极磷虾多肽的体外抗氧化活性研究。
1 材料与方法 1.1 材料与试剂材料:南极磷虾捕于南极海域48.2区,-20 ℃冷冻保存运到实验室。
主要试剂:茚三酮、果糖、磷酸二氢钠、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶等试剂均购于上海国药集团试剂有限公司,SDS-PAGE蛋白标准品购于中科瑞泰(北京)生物科技有限公司。
1.2 仪器与设备主要仪器:高速冷冻离心机H2050(湘仪离心机仪器有限公司);FJ-200高速分散均质机;紫外可见分光光度计(上海美谱达仪器有限公司);超滤系统(Sartorius stedim,Vivafiow200);真空冷冻干燥器CHRIST ALPHAI-2(北京博劢行仪器有限公司)。
1.3 方法 1.3.1 制备多肽的工艺流程南极磷虾→解冻→加水匀浆→加酶保温水解→灭酶→冷却→离心→超滤→真空冷冻干燥→南极磷虾多肽粉。
1.3.2 蛋白酶的选定选取3种不同的蛋白酶(木瓜蛋白酶、碱性蛋白酶、胰蛋白酶)分别在其最适温度、pH下添加酶量为1%,按料液质量体积比1∶2(g/mL)水解南极磷虾3 h得到3种多肽,对上述3种多肽分别进行体外抗氧化活性,以超氧阴离子清除率、羟自由基清除率、DPPH清除率为指标。选取综合抗氧化效果最好的多肽,从而确定使用的蛋白酶。
1.3.3 响应面优化南极磷虾多肽的制备工艺单因素设计:单因素试验选择液料比、pH、酶量、酶解温度、酶解时间为南极磷虾蛋白水解主要影响因素,以南极磷虾蛋白水解度为考察指标[6]。
响应面设计:在单因素试验基础上,综合考虑酶量、酶解温度、酶解时间3个因素对南极磷虾蛋白水解度的影响(表 1),采用Box-Behnken的设计方案来进行响应面分析试验,用响应面分析软件Design-Expert对响应面结果进行绘制。

|
表 1 南极磷虾多肽制备工艺的响应面法试验因素和水平 Tab.1 The test factors and levels of the response surface method test for Euphausia superba peptide production technology |
本实验采用茚三酮比色法[7]测定蛋白质水解度(SDH)。
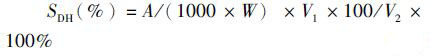 (1)
(1)
式中:SDH为蛋白质水解度;A为蛋白质毫克数(mg);W为所称样品的蛋白质含量(g); V1为水解液总体积(mL);V2为稀释液体积(mL)。
1.3.5 凝胶电泳参考HERMANN和GEBHARD[8]的方法,将南极磷虾蛋白酶解液进行电泳测定其分子量的分布范围。
1.3.6 抗氧化试验设计多肽对超氧阴离子清除率和羟自由基清除率的测定参照YANG等[9]的方法。多肽对DPPH清除率的测定参照CHEN等[10]的方法。
2 结果与分析 2.1 蛋白酶的确定将南极磷虾肌肉组织进行水解,分别添加1% 3种不同的蛋白酶(木瓜蛋白酶、碱性蛋白酶、胰蛋白酶),在其酶的最适温度(55 ℃、45 ℃、50 ℃),pH(6.0、10.0、8.0)下水解3 h得到多肽,并分别进行体外抗氧化活性,以超氧阴离子清除率、羟自由基清除率、DPPH清除率为指标。
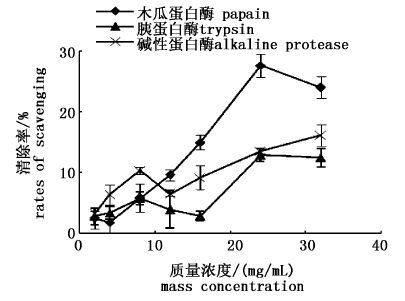
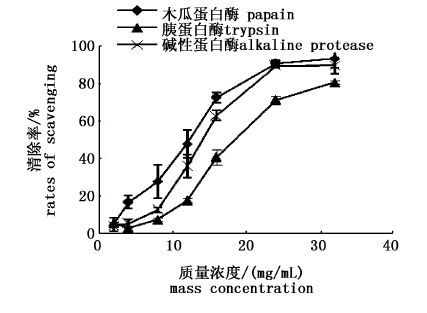
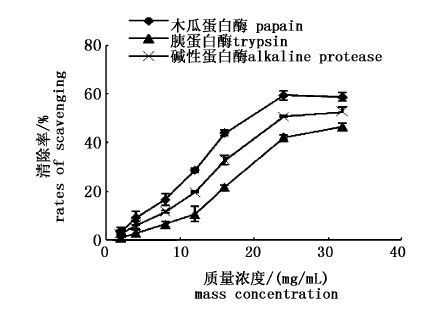
3种不同蛋白酶水解产物的抗氧化性见图 1~3,在本实验体系浓度范围内,木瓜蛋白酶制备的多肽对超氧阴离子、羟自由基和DPPH自由基的清除能力最大,且随着多肽浓度的增大而增加;在浓度为24 mg/mL时,对超氧阴离子、羟自由基和DPPH自由基的清除率最大,分别达到27.71%、93.17%、58.61%。因此选取木瓜蛋白酶作为制备南极磷虾多肽的酶制剂。
|
图 1 酶解物对超氧阴离子的清除率
Fig. 1 The rates of scavenging effects on superoxide anion of substratum
|
|
图 2 酶解物对羟自由基的清除率
Fig. 2 The rates of scavenging effects on hydroxyl free radical of substratum
|
|
图 3 酶解物对DPPH的清除率
Fig. 3 The rates of scavenging effects on DPPH of substratum
|
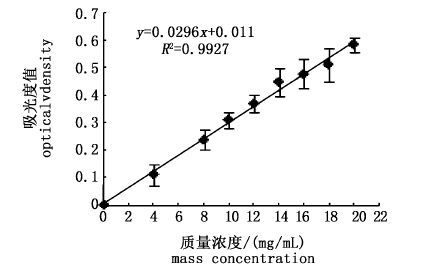
由图 4可以看出,蛋白质浓度与吸光度值呈线性关系,线性方程为y=0.0296x+0.011,相关性R2=0.9927。其横坐标为反应体系中的甘氨酸质量浓度,纵坐标为相应吸光度。
|
图 4 标准曲线
Fig. 4 The standard curve
|
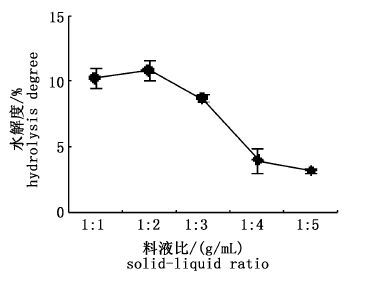
实验单因素实验结果见图 5~8。由图 5可知,在本次实验范围内,随着料液比的增加,蛋白水解度曲线先上升后下降,料液比为11∶2 (g/mL)时水解度最大,随后逐渐下降。可能是料液比为11∶1 (g/mL)时,水解体系过于粘稠,不利于酶和底物的作用导致酶解不充分。料液比为11∶2 (g/mL)时反应处于最佳状态水解度上升,之后随着液料比的增加,反应体系的酶及底物浓度降低,水解度下降。
|
图 5 料液比对水解度的影响
Fig. 5 The effect of solid-liquid ratio on the hydrolysis degree
|
|
图 6 pH对水解度的影响
Fig. 6 The effect of pH on the hydrolysis degree
|
|
图 7 酶量对水解度的影响
Fig. 7 The effect of enzyme amount on the hydrolysis degree
|
|
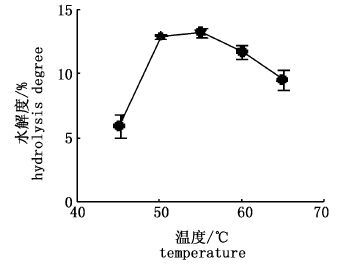
图 8 酶解温度对水解度的影响
Fig. 8 The effect of temperature on the hydrolysis degree
|
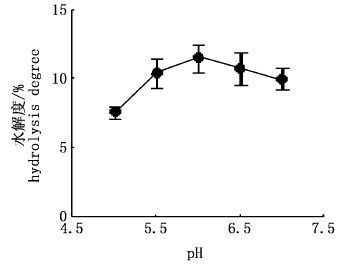
由图 6可知,水解度随pH增加而加大,蛋白水解度曲线先上升后下降,pH为6.0时,水解度最大随后逐渐下降。表明木瓜蛋白酶水解南极磷虾蛋白的最适pH范围为5.5~6.5。
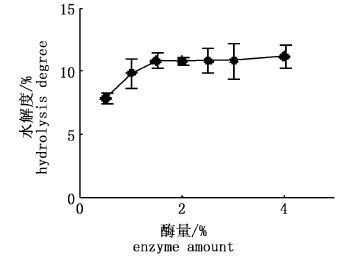
由图 7可知,随着酶量的增加,蛋白水解度曲线先上升后趋于平缓,酶量为1.5%时,水解度曲线上升到第一个最大值,之后曲线上升水平趋于平缓。表明继续加大蛋白酶的用量对于提高水解度影响不大。
由图 8可知,随着温度的上升,蛋白水解度先上升后下降,酶解温度在50~55 ℃之间水解度曲线达到最高峰。可能是随着酶解温度的升高,木瓜蛋白酶活性增大,催化效率增强,从而使反应速度提升,水解度增加;但是温度持续上升超过其最适温度范围之后,木瓜蛋白酶酶活性下降,水解度减小。
由图 9可知,随着酶解时间的增加,蛋白水解度先上升后趋于平缓,酶解时间超过2 h后,水解度上升趋势趋于平缓。结果显示,酶解时间达到一定时,再延长酶解时间对于提高水解度结果影响不大。

|
图 9 酶解时间对水解度的影响
Fig. 9 The effect of time on the hydrolysis degree
|
在单因素试验基础上,选择酶量、酶解温度、酶解时间3个因素进行3因素3水平响应面优化试验。利用Design Expert V8.0.6对试验结果进行分析,通过回归拟合得到酶量、酶解温度、酶解时间3个自变量(表 1)的二次多项回归方程:

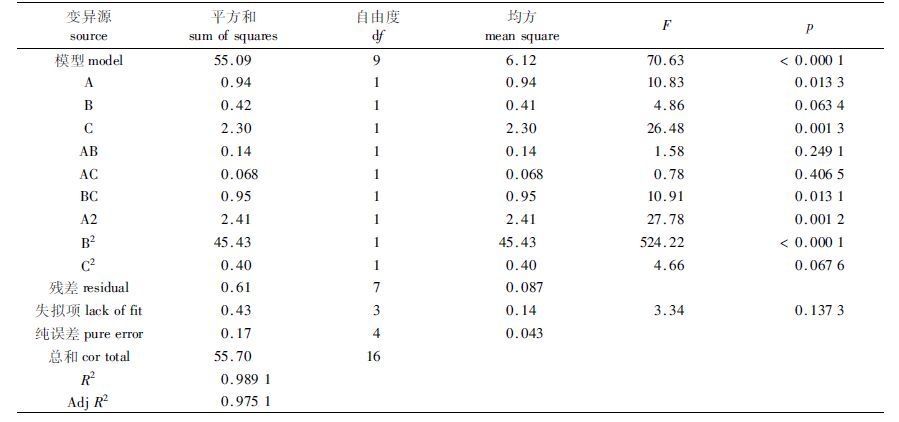
对回归模型进行方差分析见表 2,由表 2可知,模型的值小于0.000 1,即模型为极显著水平,表明不同处理间的差异极显著。该模型的失拟项P>0.05为不显著水平,失拟项是反映实验数据与模型不相符情况的数据,说明该模型选择正确。模型的决定系数R2=0.9891,矫正决定系数Adj R2=0.9791,表明该模型可以解释响应值变化的97.91%,所以模型拟合程度好,实验误差小,可有效分析和预测南极磷虾蛋白水解度的效果。从方差分析表中还可看出,南极磷虾蛋白水解度的各工艺参数对蛋白水解度效果影响的大小排序:时间>酶量>温度。其中,时间为极显著水平,酶量为显著水平。
|
表 2 回归模型系数方差分析 Tab.2 The variance analysis of regression model coefficient |
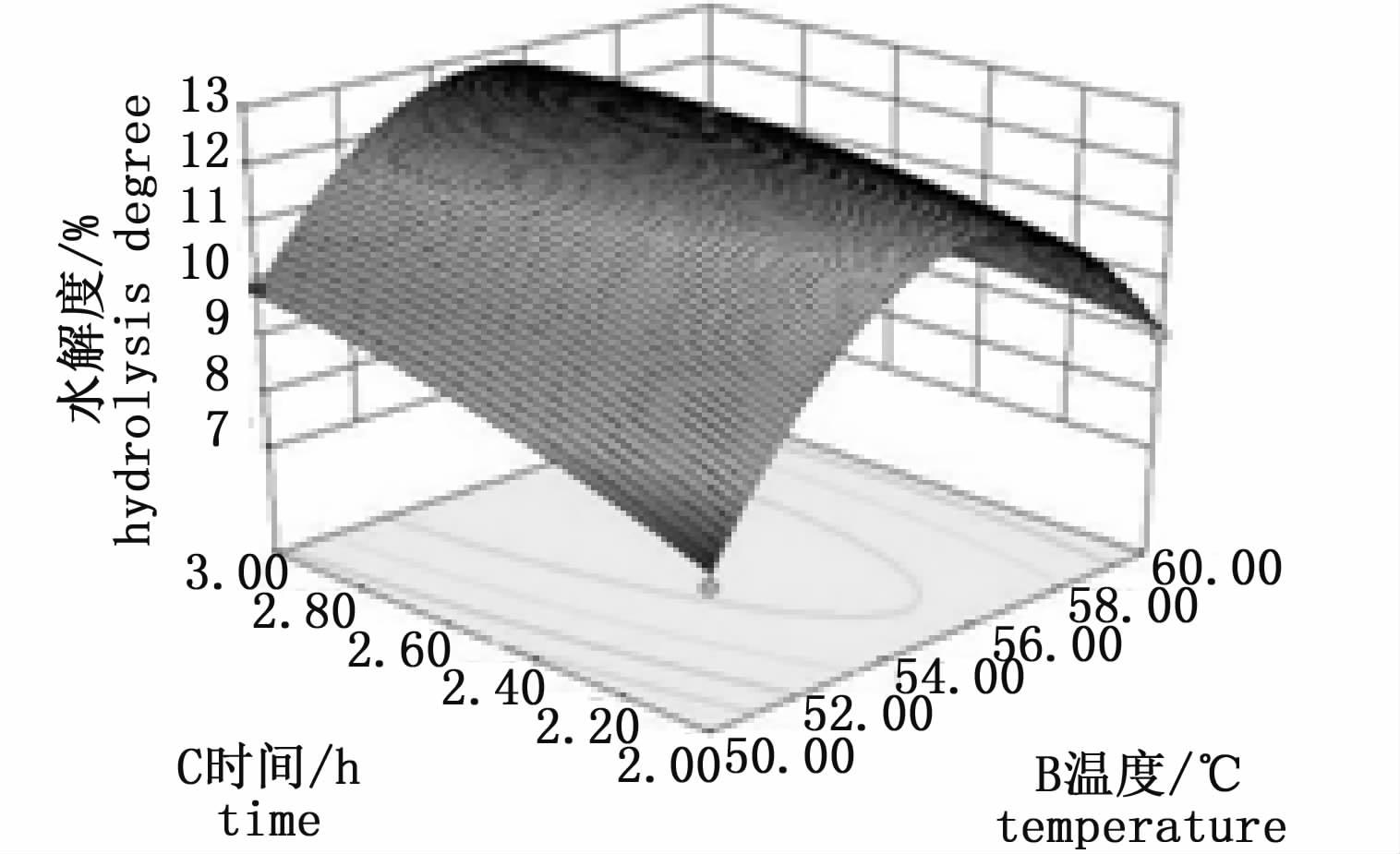
响应面图形可以反映最佳参数和各参数间的相互作用及其强弱趋势[11],见图 10~12。由图 10可知,酶量与温度的交互影响不显著,水解度主要由酶量决定,温度不变时,酶量增加到适当的程度可以得到较高的水解度。由图 11可知,水解度主要由时间决定,随着酶量和时间的增加,水解度曲面向高水平方向移动,然后曲面趋于平缓。由图 12可知,温度与时间的交互影响显著,随着温度的增加,时间响应抛物曲线的最高点先向高水平方向移动然后降低。

|
图 10 酶量与温度对水解度的交互影响
Fig. 10 The interaction of enzyme amount and temperature on the hydrolysis degree
|

|
图 11 酶量与时间对水解度的交互影响
Fig. 11 The interaction of enzyme amount and time on the hydrolysis degree
|
|
图 12 温度与时间对水解度的交互影响
Fig. 12 The interaction of temperature and time on the hydrolysis degree
|
采用Design Expert V 8.0.6 软件的Optimization选项对上述的二次多项回归方程进行分析,南极磷虾蛋白水解度最高时的条件:酶量为1.08%,温度为54.88 ℃,时间为2.93 h,水解度为12.827%。
为验证响应面优化条件及结果的可靠性,为了实际操作简便,采用适宜的优化条件:酶量为1.0%,温度为55 ℃,时间为2.9 h进行试验,其他条件为液料比11∶2、pH 6.0,得到实际水解度为12.88%,与预测值偏差不大,证明该结果合理。
2.4 多肽分子量的测定将木瓜蛋白酶水解南极磷虾制备的多肽进行SDS-PAGE试验,结果如图 13所示,1号是marker,2~5号为不同浓度的未添加木瓜蛋白酶的南极磷虾水解液,6号是木瓜蛋白酶水解南极磷虾制备的多肽,该样品有3个明显条带,其分子量大多位于3~7 ku。将酶解液分别通过分子截留量为10 000,5 000的超滤系统,多肽提取物按分子量大小分为MW≥10 ku,5~10 ku,MW≤5 ku。

|
图 13 木瓜蛋白酶水解南极磷虾制备的多肽凝胶电泳图
Fig. 13 Gel electrophoresis of protein peptide prepared by papain hydrolysis of Euphausia superba
|
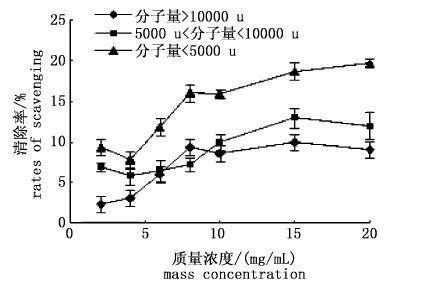
超氧阴离子为生物体内第一个氧自由基,是其他活性氧的前体,能导致细胞死亡、酶失去活性、DNA和膜的降解,并能引起不饱和脂肪酸和其他易受影响物质的过氧化[12]。所以,研究南极磷虾多肽抗氧化活性的重要指标为多肽对超氧阴离子的清除能力。图 14所示为不同分子量的南极磷虾多肽对超氧阴离子的清除能力,清除率与多肽浓度为正相关关系,MW≤5k的多肽在质量浓度为20 mg/mL时清除率达到19.62%,清除能力与其他2种多肽相比更高。
|
图 14 多肽对超氧阴离子的清除率
Fig. 14 The effects of polypeptide scavenging on superoxide anion
|
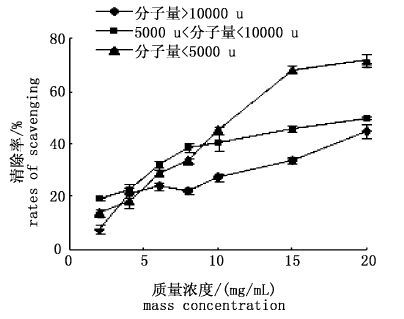
从图 15可以看出,3种不同分子量的南极磷虾多肽对羟自由基的清除能力有明显差异,并且随着浓度的增加而提高。在多肽浓度为20 mg/mL时,分子量<5 000的多肽对羟自由基的清除能力最大,清除率达到71.71%;浓度为15 mg/mL时,3种多肽对对羟自由基的清除能力明显增强,MW≤5 ku、5~10 ku、MW≥10 ku的多肽对羟自由基的清除率分别为68.23%、45.81%、33.74%。可能是相对分子量较小的多肽对羟自由基的清除作用比较明显。
|
图 15 多肽对羟自由基的清除率
Fig. 15 The effects of polypeptide scavenging on hydroxyl free radical
|
图 16所示为不同分子量的多肽对DPPH自由基的清除能力,由图可以看出,在本实验体系浓度范围内,3种不同分子量的多肽对DPPH自由基均有不同的清除能力,随着多肽浓度的增加,其清除能力也增大,呈明显的剂量依赖关系。随着浓度的增大,多肽对羟自由基的清除能力大小为:(MW≤5 ku)>(5~10 ku)>(MW≥10 ku),其最大清除率分别为74.33%、67.24%、55.13%。

|
图 16 中多肽对DPPH自由基的清除率标题
Fig. 16 The effects of polypeptide scavenging on DPPH
|
本研究首先通过单因素实验选定了参与响应面试验的料液比、温度、时间3个主要因素并设立不同水平,运用响应面分析方法建立二次多项回归数学模型。较优条件为:pH 6.0,料液比11∶2,酶量为1.0%,温度55 ℃,时间2.9 h,该条件下南极磷虾蛋白水解度为12.88%。实验结果表明该模型具有明显的统计学意义,可用于实践生产中,为南极磷虾多肽制备的工业化生产提供理论参考依据。
本研究采用超滤膜法分离南极磷虾多肽,分离效果良好,可作为分离纯化多肽的一种方法。体外抗氧化试验表明,不同分子量的多肽都有不同程度的抗氧化能力,对超氧阴离子、羟自由基和DPPH自由基的清除能力都比较良好,且随多肽质量浓度的增大而增加。结果显示,MW≤5 ku的多肽的抗氧化能力最佳,对超氧阴离子、羟自由基和DPPH自由基的清除能力均高于其他分子量段的多肽。这可能是由于多肽抗氧化的活性与氨基酸种类或极性相关[13]。本实验为南极磷虾多肽的制备寻找新方法,也为南极磷虾的综合开发利用以及今后的科学研究提供理论基础。
| [1] | 吴伟平, 谢营樑.南极磷虾及磷虾渔业[J]. 现代渔业信息, 2010, 25(1): 10–13. WU W P, XIE Y L.Antarctic krill and krill fishery[J]. Modern Fisheries Information, 2010, 25(1): 10–13. |
| [2] | SUZUKI T.Dordrecht, Netherlands: Allied Science Publishers Ltd[M]., 1981: 193-251. |
| [3] | 孙雷, 周德庆, 盛晓风.南极磷虾营养评价与安全性研究[J]. 海洋水产研究, 2008, 29(2): 57–64. SUN L, ZHOU D Q, SHENG X F.Nutrition and safety evaluation of Antarctic krill[J]. Marine Fisheries Research, 2008, 29(2): 57–64. |
| [4] | CHEN Y C, TOU J C, JACZYNSKI J.Amino acid and mineral composition of protein and other components and their recovery yields from whole Antarctic krill (Euphausia superba) using isoelectric solubilization/precipitation[J]. Journal of Food Science, 2009, 74(2): H31–H39. DOI:10.1111/jfds.2009.74.issue-2 |
| [5] | 刘艳秋. 大豆多肽生产工艺的优化及其生物活性的研究[D]. 长春: 吉林农业大学, 2004. LIU Y Q. Research on the optimization of production techniques of soybean polypeptides and its bio-activity[D]. Changchun: Jilin Agricultural University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10193-2004105236.htm |
| [6] | 李明杰, 姜国良, 赫佳明.南极磷虾肽制备工艺优化及抗氧化测定[J]. 食品工业科技, 2012, 33(3): 279–282. LI M J, JIANG G L, HE J M.Optimization of preparation and assay antioxidation of polypeptide from Antarctic krill[J]. Science and Technology of Food Industry, 2012, 33(3): 279–282. |
| [7] | QIN Y C. Effect of Amide contents in wheat gluten hydrolysates on the thermal flavor generation[D]. Rutgers, USA: Rutgers University, 1995: 54-56. |
| [8] | 崔敏, 傅婕, 迟原龙, 等.茚三酮比色法和甲醛滴定法测定水解胶原的比较[J]. 中国皮革, 2011, 40(7): 1–4. CUI M, FU J, CHI Y L, et al.Comparison of ninhydrin colorimetry and formaldehyde titration in determination of collagen hydrolysate[J]. China Leather, 2011, 40(7): 1–4. |
| [9] | SCHÄGGER H, Von JAGOW G.Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J]. Analytical Biochemistry, 1987, 166(2): 368–379. DOI:10.1016/0003-2697(87)90587-2 |
| [10] | YANG W F, WANG Y, LI X P, et al.Purification and structural characterization of Chinese yam polysaccharide and its activities[J]. Carbohydrate Polymers, 2015, 117: 1021–1027. DOI:10.1016/j.carbpol.2014.09.082 |
| [11] | CHEN Y, WANG M F, ROSEN R T, et al.2, 2-Diphenyl-1-picrylhydrazyl radical-scavenging active components from Polygonum multiflorum thunb[J]. Journal of Agricultural and Food Chemistry, 1999, 47(6): 2226–2228. DOI:10.1021/jf990092f |
| [12] | 张春华, 包斌, 陈山乔, 等.响应面优化超临界CO2萃取罗非鱼头油的研究[J]. 上海海洋大学学报, 2015, 24(2): 293–302. ZHANG C H, BAO B, CHEN S Q, et al.Optimization for supercritical CO2 extraction of tilapia fish head oil by response surface method[J]. Journal of Shanghai Ocean University, 2015, 24(2): 293–302. |
| [13] | 何芳, 汪之和, 马婉婉, 等.不同分子量条斑紫菜多糖体外抗氧化活性研究[J]. 上海海洋大学学报, 2015, 24(5): 783–788. HE F, WANG Z H, MA W W, et al.Study on antioxidant activity of polysaccharides with different molecular weights from Pyropia yezoensis in vitro[J]. Journal of Shanghai Ocean University, 2015, 24(5): 783–788. |
| [14] | 翟学超, 钟立成.鹿血抗氧化肽不同分子量肽段抗氧化活性的研究[J]. 经济动物学报, 2015, 19(4): 144–146. ZHAI X C, ZHONG L C.Antioxidant activity different molecular weight peptides in antioxidant peptide of deer blood[J]. Journal of Economic Animal, 2015, 19(4): 144–146. |
 2016,
Vol. 25
2016,
Vol. 25


