2. 中国水产科学研究院淡水渔业研究中心 农业部淡水渔业和种质资源利用重点实验室, 江苏 无锡 214081
操作胁迫是鱼类养殖及实验中不可避免的物理应激因子,包括对鱼类的操作、低氧、拥挤、运输、空气暴露和机械损伤等[1]。这些刺激往往引发鱼体代谢、内分泌及免疫系统等一系列的变化[2]。皮质醇水平的升高是鱼类应激反应的主要特征,它能进一步影响鱼体血糖、乳酸、转氨酶等代谢中间产物的水平[3]。急性空气暴露胁迫可引起大西洋鲑[4]、花狼鱼[5]、欧亚鲈鱼[6]、长江刀鲚[7]血浆皮质醇的变化,重组乌颊鱼[8]血糖、乳酸的变化,圆口铜鱼[9]谷丙转氨酶、谷草转氨酶等酶类的变化,南方鲶鱼[10]血清总蛋白、血糖、甘油三酯等血液生化指标的变化。应激状态下机体细胞能够迅速合成热应激蛋白70,作为一种细胞保护蛋白,它能够帮助蛋白质正确折叠、组装、运输,同时调节、修复损伤蛋白并降解变性蛋白[11-12];保护细胞线粒体免受细胞因子的损伤,在抗细胞凋亡、抗氧化中起重要作用[13];还能参与免疫应答协助抗原的处理和提呈,发挥协同免疫作用[14]。研究发现急性操作胁迫可以提高圆口铜鱼肾组织HSP70的表达量,而肝和鳃组织变化并不明显[9]。
美洲鲥(Alosa sapidissima)隶属于鲱形总目(Clupeomorpha)、鲱形目(Clupeiformes)、鲱科(Clupeidae)、西鲱属(Alosa)。它在整个生长发育过程中对外界环境变化异常敏感,表现出对闪光、噪声、人工操作、运输等明显的应激反应;尤其在人工繁殖过程中常常涉及到如拉网、捕捉、离水和注射等手工操作,极易导致鱼体受伤死亡。目前尚未有人工离水操作对美洲鲥亲鱼血清生化指标以及鳃、肝等组织HSP70 mRNA水平影响的研究。为了探讨美洲鲥亲鱼的急性操作应激规律,本文从生理学和分子生物学方面研究了急性操作胁迫对于美洲鲥亲鱼生理机能的影响,以期为进一步研究美洲鲥亲鱼人工操作胁迫机理提供基础数据。
1 材料与方法 1.1 实验鱼及养殖管理实验鱼:美洲鲥亲鱼饲养于中国水产科学研究院淡水渔业研究中心宜兴屺亭基地。体质量为(690.22±19.00) g,体长为(34.34±0.33) cm。
养殖管理:采用自然光照,养殖用水为曝气的地下水,24 h微孔增氧,每天吸污并换水10~15 cm,每日上午、下午投喂1次宁波天邦海水鱼膨化饲料。实验期间水温为(21±0.5) ℃,溶氧>8 mg/L,pH为7.8,氨氮为0.001 6 mg/L,亚硝氮为0.037 mg/L。
1.2 实验设计对照组设置:在实验开始前,拉网选取规格基本一致的健康美洲鲥鱼亲鱼12尾,放入另一相同条件的水泥池中暂养两周。采样前24 h停止喂食,用100 mg/L丁香油进行全池麻醉,迅速取材,作为急性操作胁迫应激零点。
急性操作胁迫实验:从暂养池拉网后随机选取18尾美洲鲥亲鱼分为3组,分别置于3个网箱(1 m×1 m×1.5 m,6尾/箱)。急性操作胁迫采用手工捕捉的方式进行,3个网箱分别施以15 s、30 s以及60 s的空气暴露(网箱上提,使鱼保持在空气中),再放入水中5 min,重复操作3次。
1.3 样品采集与处理对照组和3个实验处理组分别取6尾亲鱼,所有实验鱼用100 mg/L丁香油麻醉10 min后,测量体质量和体长,并以含适量ACD抗凝剂的注射器尾静脉采血,静置于4 ℃冰箱2 h后,在5 000 r/min、4 ℃条件下离心10 min得到血浆,最后转移至-20 ℃冰箱中保存。采完血迅速解剖美洲鲥,采集鳃、肝编号后迅速置于液氮中冻存,放入-70 ℃冰箱中保存备用。
1.4 血清的分析血清皮质醇、T3、T4含量测定采用放射免疫分析法,在西安核仪厂xh6080放免仪中检测,试剂盒购自北京北方生物技术研究所。溶菌酶、CAT、MDA、SOD、GST、Na+、K+、Ca2+以及Cl-测定试剂盒均购自南京建成生物工程研究所。GLU、TG、TC、TP、ALT、AST等指标测定在迈瑞BS400全自动生化分析仪上完成。血液生化指标测定参照周玉等[15]进行测定。
1.5 鳃、肝组织HSP70 mRNA水平的测定从-70 ℃冰箱取出样品,每条美洲鲥亲鱼取50~100 mg组织,之后按RNAiso Reagent (TaKaRa,大连)说明书进行总RNA提取。按Prime ScriptTMRT reagent Kit with gDNA Eraser (TaKaRa,大连) 试剂盒说明操作反转录获取cDNA。根据美洲鲥HSP70基因cDNA序列设计引物F1:5′-AGAACAAGAGGGCTGTGAGGAGA-3′;R1:5′- TCAATGCCATCAAAGAGCGAGT-3′。内参基因为β-actin,设计引物F2:5′-AACGGATCCGGTATGTGCAAAGC-3′;R2:5′-AACGGATCCGGTATGTGCAAAGC-3′。所有引物均由上海生工生物技术有限公司合成。
采用嵌合荧光法进行Real Time PCR扩增反应。用SYBR Premix Ex TaqTMⅡ试剂盒说明配置反应体系,具体操作在ABI 7500 PCR仪 (Applied Biosystem,美国) 上进行。样品进行3次重复点样以减小操作误差。PCR反应条件:50 ℃ 2 min,95 ℃ 2 min; 95 ℃ 15 s,60 ℃ 30 s,40个循环;溶解的反应条件为:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。
1.6 数据处理实验数据应用 Excel 2010 和 SPSS 20 进行统计学计算和分析。荧光定量实验运用公式2-ΔΔ CT计算基因表达量,采用单因素方差分析(One-way ANOVA)和 Duncan 氏多重比较分析实验各组间的差异性。计算结果用平均值±标准误( Mean±SE ) 来表示。
2 结果与分析 2.1 急性操作胁迫对血清生化指标的影响将美洲鲥亲鱼从养殖池转入实验网箱后,鱼体显得烦躁不安、剧烈游动、不断冲撞网箱壁、鳃盖开合频率加快。离水空气暴露操作后,鱼体挣扎剧烈、呼吸频率加快。空气暴露实验期间,部分鱼体背鳍基部发红、出现渗血现象,随后其吻部、眼眶也均出现一定程度的出血状况。
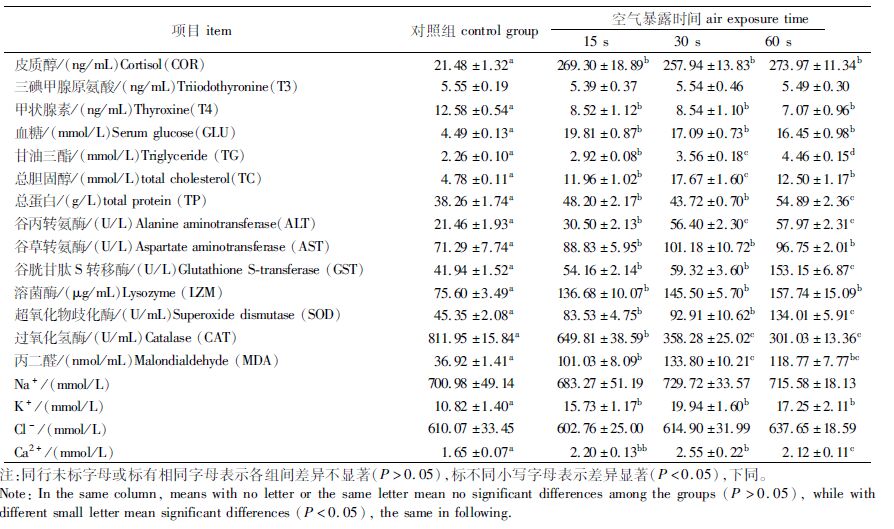
由表 1可知,空气暴露刺激后,鱼血清皮质醇含量明显高于对照组的水平(P<0.05),而不同强度空气暴露实验组之间皮质醇含量无显著差异(P>0.05)。实验组T4水平在空气暴露后出现显著下降(P< 0.05),而实验组T3水平与对照组无显著差异(P>0.05)。酶活性测定结果表明,与对照组相比,施加不同强度操作胁迫后CAT出现显著下降(P< 0.05),而ALT、AST、GST、LZM、SOD、MDA等有显著升高(P< 0.05)。不同强度操作胁迫后GLU、TG、TC、TP、K+和Ca2+均显著高于对照组(P< 0.05)。Na+和Cl-含量与对照组没有明显的差异(P>0.05)。
|
表 1 不同强度操作胁迫后美洲鲥亲鱼血清生化指标的变化 Tab.1 Changes in serum biochemical parameters in Alosa sapidissima broodstocks after different intensity stress |
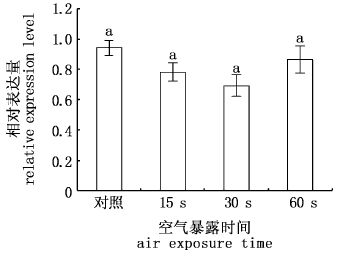
在鳃组织中,与对照组相比,15 s、30 s和60 s空气暴露组均未出现显著差异 (P>0.05)。急性操作胁迫实验后鳃HSP70 mRNA水平稍有波动,但没有显著变化(图 1)。
|
图 1 不同强度操作胁迫对鳃HSP70 mRNA表达水平的影响
Fig. 1 Effect of different intensity handling stress on the expression of HSP70 in gill
|
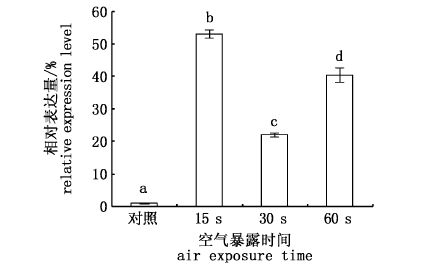
在肝组织中,与对照组相比,15 s、30 s和60 s空气暴露组HSP70 mRNA水平均有显著升高 (P< 0.05),且不同强度空气暴露组之间也存在显著差异 (P< 0.05) ,见图 2。
|
图 2 不同强度操作胁迫对肝HSP70 mRNA表达水平的影响
Fig. 2 Effect of different intensity handling stress on the expression of HSP70 in liver
|
操作胁迫在鱼类养殖中常常出现,它能够影响鱼体的正常代谢。血液是由血浆和血细胞组成,而血浆中又包含了无机盐、细胞代谢产物、酶、激素等众多的营养成分,血液中的各项生化指标都记录着机体重要的健康信息,机体的生理活动及病理改变往往会造成自身血液成分发生改变,因此我们可以通过测定血液中的相关指标来监测机体的代谢水平及组织器官功能状态[16]。通过生理学指标的变动来分析鱼类的应激反应成为一种检测养殖鱼类健康状况的有效方法。同时对于建立某些应激性操作,如鱼类离水操作等方面适宜的操作规范,同样具有至关重要的参考价值。
鱼类在急性操作胁迫下,迅速启动神经-体液调节,作为神经内分泌系统重要组成部分的下丘脑-垂体-肾间组织轴 (HPI),它使鱼体促肾上腺皮质激素(ACTH) 分泌量增加,最终导致其头肾合成并且释放出大量的皮质醇到血液中[17],而释放到血液中的皮质醇又成为了衡量鱼类应激反应强度的有效指标[18]。大量研究结果表明,鱼类在多种应激源作用下皮质醇水平均会出现不同程度的升高,在受到养殖过程中的一些躯体性应激源如拥挤、捕捉、运输、惊吓、空气暴露等影响后,结果表现也相当一致[9, 19-21]。实验中手动提拉网箱使鱼体暴露在空气中,根据空气暴露时间不同对美洲鲥亲鱼进行了3组急性操作胁迫处理,结果显示美洲鲥对外界环境改变具有明显的应激反应。通过测定血清皮质醇浓度变化,本实验结果与对照组相比,不同强度急性操作胁迫后显著提高了血清皮质醇浓度,确定急性操作胁迫能够引起美洲鲥亲鱼机体显著的应激反应。甲状腺激素是甲状腺所分泌的具有一定生物活性的激素,它在血液中主要有T3、T4两种形式,且T3、T4间可以相互转化,在血液中保持动态平衡,T3生物活性大,在机体内的作用不容忽视[22]。本实验表明,急性操作胁迫后显著降低了美洲鲥亲鱼血清T4含量,而T3含量未见明显变化。
应激条件下,机体能量需求增大,机体在一系列神经内分泌系统调节下,皮质醇等激素分泌增多,进而加速体内代谢速率,自身血糖水平出现波动,故而通过检测血糖水平可衡量机体的生理应激状态。部分研究结果显示,急性操作胁迫能够导致鱼体血糖水平急剧升高[6, 8-10],而本实验中美洲鲥亲鱼GLU水平在15 s、30 s、60 s空气暴露组中均明显升高,可能一方面由于应激导致血液肾上腺素、去甲肾上腺素以及皮质醇激素的含量增加,机体代谢加快,极大促进了肝脏糖元向葡萄糖的转化,以此满足机体对能量的需求;另一方面皮质醇激素作用下对机体组织细胞葡萄糖利用产生了明显抑制[23]。此外血清中TG、TC和TP水平也在实验后表现出一定程度的增长,这或许是因为急性操作胁迫后机体皮质醇分泌增加,促进了相关组织中的脂肪酸、氨基酸释放进入血液,加速代谢过程,为机体提供足够能量[24]。
作为鱼类应激生物学研究领域的一个重要分支,氧化应激是机体细胞水平上最常见的应激。过氧化脂质及其产物MDA和酶抗氧化系统SOD、CAT常作为氧化应激水平的量化指标。本实验中MDA和SOD均比对照组有显著增加,而CAT则比对照组显著降低。以上结果说明该应激实验中,机体氧化反应中产生的具有强氧化性的自由基含量剧增,虽然机体的自由基清除速度也加快,但随着实验操作应激强度加大和时间延长,不足以及时清理掉大量多余的自由基,导致机体氧化及抗氧化系统失衡[25],细胞遭到破坏。实验组ALT、AST和GST均出现显著升高,表明急性操作胁迫可能对肝脏造成了一定的损伤。另外AST含量在心肌细胞中最多,本实验操作后其含量显著增加,预示着心肌细胞可能受到一定程度的损伤,影响机体供氧,但这部分结果需要后续进一步的研究。
鱼类特异性免疫系统很不发达,所以非特异性免疫在鱼类自身保护、维持机体健康方面就显得举足轻重。LZM作为鱼类体内重要的非特异性免疫因子之一,是一种能够水解致病菌中黏多糖的碱性酶,通过破坏病原体细胞壁的粘多糖而使细菌溶解,因此溶菌酶活性对鱼体免疫功能及健康至关重要[26]。一般情况下,越高的血液溶菌酶活力也表明其具有的免疫能力越强。不同强度操作胁迫刺激后显著提高了血清LZM水平。这与赵建华[9]报道的圆口铜鱼在经历不同强度急性操作胁迫后LZM升高结果一致,也与李茜[27]的研究中指出操作胁迫导致圆口铜鱼肾间组织增生、肾间细胞数目和细胞核增加相符。
一般情况下,机体细胞内液钠浓度低,钾浓度高;而细胞外液刚好相反。本实验急性操作胁迫后,血清中K+和Ca2+浓度显著增高,而Na+和Cl-实验前后浓度仅稍有波动,这与杜浩等[28]研究美洲鲥在环境改变和运输后血清K+、Ca2+和Na+的情况类似。血清离子的波动推测可能与美洲鲥应激后发生的自身溶血现象有关,红细胞及相关组织细胞膜遭到破坏进而导致了细胞内K+大量进入血清[29],同时细胞内低浓度的Na+也进入血清,但由于其自身细胞内外浓度的极大差异并未引起Na+明显波动;此外应激后机体产生的大量自由基可造成钠钾ATP酶功能抑制及损伤,影响正常细胞膜的阳离子运输效率[30]。血清Ca2+的增加很可能是因为急性胁迫下肌糖元无氧分解成乳酸降低了血清的pH,导致部分结合态的钙游离出来,增加了血清中钙离子的浓度。血清离子的这些波动可能会对机体正常电解质平衡系统的功能造成一定影响,鱼体应激后出现的水肿现象往往也与此相关。
3.2 急性操作胁迫对组织HSP70基因表达的影响本实验中不同强度操作胁迫后并未引起HSP70在鳃中的明显变化,这与研究发现操作胁迫未引起大西洋鲑[28]、圆口铜鱼[9]鳃组织HSP70 mRNA水平明显变化的结果一致。观察不同强度操作胁迫后肝脏的HSP70 mRNA表达水平发现,与对照组相比,15 s、30 s和60 s空气暴露实验后HSP70 mRNA水平显著升高。这与操作胁迫并未引起虹鳟[29]、圆口铜鱼[9]肝组织HSP70 mRNA水平显著变化的结果有所差异。由于不同鱼体对同一应激源的反应灵敏度有很大差别,本研究中的美洲鲥对应激反应极其敏感,一离开水体很快就会死亡;美洲鲥亲鱼HSP70在15 s、30 s、60 s等3组不同强度操作后其表达水平也出现显著差异,而其升高幅度并不与急性操作胁迫的强度呈正相关;研究显示HSP70在受到急性操作胁迫后在不同组织会出现不同程度的升高或降低或波动不明显等现象,这不仅与应激源的种类、强度、持续时间等有关,也与其在不同物种、不同组织中的特异性表达相关。结合肝脏相关酶ALT、AST和GST的活力在实验处理后均显著升高的结果,推测应激实验处理后对机体肝脏产生了一定损伤,但机体肝脏HSP70含量迅速增加,发挥细胞保护功能,进而增强自身抗应激能力;表明鱼体可能通过HSP70基因的表达,降低外界不良刺激所造成的影响。
综上所述,美洲鲥亲鱼在不同强度急性操作胁迫下,其内分泌系统、免疫系统及抗氧化系统均发生了一定的变化。激素、酶等血清活性物质的改变说明机体在该应激下新陈代谢水平受到了影响。通过分析血清相关指标的测定结果,认为急性操作胁迫可能对美洲鲥亲鱼的肝脏、心脏等组织均造成一定的损伤,使其发生一系列生理变化,并最终造成器官功能失调或丧失。因此,在鱼类应激反应研究中,能否继皮质醇、血糖等生化指标后探究出更多灵敏且有效的衡量机体应激状态的指标,应激蛋白HSP70作为操作胁迫过程中的生物学指标的可能性探究仍需更加系统的研究。
| [1] | FRICK L H, WALKER T I, REINA R D.Trawl capture of Port Jackson sharks, Heterodontus portusjacksoni, and gummy sharks, Mustelus antarcticus, in a controlled setting: effects of tow duration, air exposure and crowding[J]. Fisheries Research, 2010, 106(3): 344–350. DOI:10.1016/j.fishres.2010.08.016 |
| [2] | 赵建华, 杨德国, 陈建武, 等.鱼类应激生物学研究与应用[J]. 生命科学, 2011, 23(4): 394–401. ZHAO J H, YANG D G, CHEN J W, et al.Research and application on the biology of fish stress[J]. Chinese Bulletin of Life Sciences, 2011, 23(4): 394–401. |
| [3] | DEANE E E, WOO N Y S.Advances and perspectives on the regulation and expression of piscine heat shock proteins[J]. Reviews in Fish Biology and Fisheries, 2011, 21(2): 153–185. DOI:10.1007/s11160-010-9164-8 |
| [4] | FAST M D, HOSOYA S, JOHNSON S C, et al.Cortisol response and immune-related effects of Atlantic salmon (Salmo salar Linnaeus) subjected to short- and long-term stress[J]. Fish & Shellfish Immunology, 2008, 24(2): 194–204. |
| [5] | LAYS N, IVERSEN M M T, FRANTZEN M, et al.Physiological stress responses in spotted wolffish (Anarhichas minor) subjected to acute disturbance and progressive hypoxia[J]. Aquaculture, 2009, 295(1/2): 126–133. |
| [6] | ACERETE L, BALASCH J C, ESPINOSA E, et al.Physiological responses in Eurasian perch (Perca fluviatilis L.) subjected to stress by transport and handling[J]. Aquaculture, 2004, 237(1/4): 167–178. |
| [7] | 王宇, 卢丹琪, 李伟萍, 等.急性操作胁迫对刀鲚应激反应相关神经内分泌因子的影响[J]. 水产学报, 2014, 38(6): 803–812. WANG Y, LU D Q, LI W P, et al.The effect of acutehandling stress on the stress-related neuroendocrine factor in Coilia nasus[J]. Journal of Fisheries of China, 2014, 38(6): 803–812. |
| [8] | ARENDS R J, MANCERA J M, MUNOZ J L, et al.The stress response of the gilthead sea bream (Sparus aurata L.) to air exposure and confinement[J]. Journal of Endocrinology, 1999, 163(1): 149–157. DOI:10.1677/joe.0.1630149 |
| [9] | 赵建华. 圆口铜鱼应激生理机制及缓解策略研究[D]. 武汉: 华中农业大学, 2014: 39-82. ZHAO J H. Studies on the physiological mechanism and coping strategies of stress of Coreius guichenoti[D]. Wuhan: Huazhong Agricultural University, 2014: 39-82. |
| [10] | 林艳华, 罗毅平.空气暴露对南方鲇血液学指标的影响[J]. 西南大学学报(自然科学版), 2011, 33(6): 69–73. LIN Y H, LUO Y P.Influence of aerial exposure on hematological parameters of the Southern Catfish (Silurus meridionalis)[J]. Journal of Southwest University (Natural Science), 2011, 33(6): 69–73. |
| [11] | WAMA G K, VIJAYAN M M, FORSYTH R B, et al.Heat shock proteins and physiological stress in fish[J]. American Zoologist, 1999, 39(6): 901–909. DOI:10.1093/icb/39.6.901 |
| [12] | FEDER M E, HOFMANN G E.Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999, 61: 243–282. DOI:10.1146/annurev.physiol.61.1.243 |
| [13] | MORIMOTO R I, TISSIERES A, GEORGOPOULOUS C.The stress response, function of the proteins and perspective[M].New York: Cold Spring Harbor Laboratory Press, 1990: 1-36. |
| [14] | 张旭辉.热休克蛋白70与热耐受的机制[J]. 解放军预防医学杂志, 2001, 19(1): 73–75. ZHANG X H.Heat shock protein 70 and the mechanism of heat tolerance[J]. Journal of Preventive Medicine of Chinese People's Liberation Army, 2001, 19(1): 73–75. |
| [15] | 周玉, 郭文场, 杨振国, 等.欧洲鳗鲡血液某些生物化学指标的测定[J]. 动物学杂志, 2002, 37(1): 50–52. ZHOU Y, GUO W C, YANG Z G, et al.Determination of some hematological and biochemical values of European Eel, Anguilla anguilla[J]. Chinese Journal of Zoology, 2002, 37(1): 50–52. |
| [16] | 周玉, 郭文场, 杨振国, 等.鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163–165. ZHOU Y, GUO W C, YANG Z G, et al.Advances in the study of haemotological indices of fish[J]. Journal of Shanghai Fisheries University, 2001, 10(2): 163–165. |
| [17] | WENDELAAR BONGA S E.The stress response in fish[J]. Physiological Reviews, 1997, 77(3): 591–625. |
| [18] | STRANGE R J, SCHRECK C B, EWING R D.Cortisol concentrations in confined juvenile chinook salmon (Oncorhynchus tshawytscha)[J]. Transactions of the American Fisheries Society, 1978, 107(6): 812–819. DOI:10.1577/1548-8659(1978)107<812:CCICJC>2.0.CO;2 |
| [19] | 刘波, 王美垚, 谢骏, 等.低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J]. 生态学报, 2011, 31(17): 4866–4873. LIU B, WANG M Y, XIE J, et al.Effects of acute cold stress onserum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia (Oreochromis niloticus)[J]. Acta Ecologica Sinica, 2011, 31(17): 4866–4873. |
| [20] | FEVOLDEN S E, RØED K H, FJALESTAD K.A combined salt and confinement stress enhances mortality in rainbow trout (Oncorhynchus mykiss) selected for high stress responsiveness[J]. Aquaculture, 2003, 216(1/4): 67–76. |
| [21] | GOMES L C, ROUBACH R, ARAUJO-LIMA C A R M, et al.Effect of fish density during transportation on stress and mortality of juvenile tambaqui Colossoma macropomum[J]. Journal of the World Aquaculture Society, 2003, 34(1): 76–84. DOI:10.1111/jwas.2003.34.issue-1 |
| [22] | WANG Y Y.Review of finfish and shellfish nutrition[M].Beijing: Academic Press, 1993: 153-156. |
| [23] | VIJAYAN M M, PEREIRA C, GRAU E G, et al.Metabolic responses associated with confinement stress in tilapia: the role of cortisol[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1997, 116(1): 89–95. DOI:10.1016/S0742-8413(96)00124-7 |
| [24] | MOMMSEN T P, VIJAYAN M M, MOON T W.Cortisol in teleosts: dynamics, mechanisms of action, and metabolic regulation[J]. Reviews in Fish Biology and Fisheries, 1999, 9(3): 211–268. DOI:10.1023/A:1008924418720 |
| [25] | 刘淑兰, 翟少伟.氧化应激对鱼类的影响及其模型的研究进展[J]. 饲料博览, 2012: 48–51. LIU S L, ZHAI S W.Research progress of effects of oxidative stress on fish and oxidative stress model[J]. Feed Review, 2012: 48–51. |
| [26] | 唐玫, 马广智, 徐军.鱼类免疫学研究进展[J]. 免疫学杂志, 2002, 18(3): 112–116. TANG M, MA G Z, XU J.Advances in research of fish immunology[J]. Immunological Journal, 2002, 18(3): 112–116. |
| [27] | 李茜. 急性操作胁迫对养殖圆口铜鱼头肾免疫功能的影响[D]. 武汉: 华中农业大学, 2013: 14-28. LI Q. Effects of acute handing stress on head kidney immune function in farmed largemouth bronze gudgeon (Coreius guichenoti)[D]. Wuhan: Huazhong Agricultural University, 2013: 14-28. |
| [28] | 杜浩, 危起伟, 甘芳, 等.美洲鲥应激后皮质醇激素和血液生化指标的变化[J]. 动物学杂志, 2006, 41(3): 80–84. DU H, WEI Q W, GAN F, et al.Changes in serum cortisol and blood biochemical parameters after stress in American Shad[J]. Chinese Journal of Zoology, 2006, 41(3): 80–84. |
| [29] | MCENROE M, CECH JR J J.Osmoregulation in juvenile and adult white sturgeon, Acipenser transmontanus[J]. Environmental Biology of Fishes, 1985, 14(1): 23–30. DOI:10.1007/BF00001573 |
| [30] | 吴小春.自由基与钠钾ATP酶的损伤[J]. 国外医学临床生物化学与检验学分册, 1991, 12(2): 54–58. WU X C.Free radicals and potassium sodium atpase damage[J]. Foreign Medical Sciences (Section of Clinical Biochemistry and Laboratory Medicine), 1991, 12(2): 54–58. |
| [31] | ZARATE J, BRADLEY T M.Heat shock proteins are not sensitive indicators of hatchery stress in salmon[J]. Aquaculture, 2003, 223(1/4): 175–187. |
| [32] | VIJAYAN M M, PEREIRA C, FORSYTH R B, et al.Handling stress does not affect the expression of hepatic heat shock protein 70 and conjugation enzymes in rainbow trout treated with β-naphthoflavone[J]. Life Sciences, 1997, 61(2): 117–127. DOI:10.1016/S0024-3205(97)00366-4 |
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, Jiangsu, China
 2016,
Vol. 25
2016,
Vol. 25


