2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
4. 远洋渔业协同创新中心, 上海 201306
稳定同位素分析方法作为摄食生态学研究的重要分析手段之一,已广泛用于研究动物摄食习性和重建其洄游路径[1-2],在实验室控制条件下探索稳定同位素的周转速率和分馏规律是其重要研究内容之一[3]。GANNES等呼吁稳定同位素生态学家更多地进行实验室控制实验[4],至今已有许多研究者通过实验室条件控制实验,探索各物种及不同组织稳定同位素周转和分馏规律,CAUT等对已有的稳定同位素周转和分馏的研究进行统计,各类物种的研究情况如下:哺乳类13C:95种,15N:89种;鸟类13C:61种,15N:52种;鱼类13C:41种,15N:47种;两栖类13C:3种,15N:2种;无脊椎动物13C:90种,15N:77种等[5]。目前对于鱼类稳定同位素周转和分馏的研究较少,对于黄颡鱼(Pelteobagrus fulvidraco)的此类研究仍为空白。黄颡鱼是广泛分布于我国各大水系的经济鱼类,国内已有对其生物学特征及营养生态位的报道[6-8],近年来黄颡鱼的人工养殖日益发展,其食性日益受到重视。黄颡鱼属杂食性鱼类,在水生生态系统底层食物网中具有重要地位,其生活史过程中,随个体生长,口径增大,其摄食的食物也发生转变[9-10]。目前国内利用稳定同位素对黄颡鱼等小型底层鱼类的研究较少,WANG等对鄱阳湖瓦氏黄颡鱼营养级与体长关系研究,并利用POST总结出的水生生物分馏系数估算出瓦氏黄颡鱼的食物主要来源为底层食物网(68%±27%)[11-12]。不同物种的分馏系数存在差异,若采用综述中总结的分馏系数进行营养级评估,可能会给研究物种带来误差[4]。近年来研究者发现其他组织与肌肉具有不同的周转速率[13-14],有研究发现肝脏的周转周期较短(几周或者几个月),可以反映鱼类摄食习性的季节性变化[15],可利用此特征分析同一个体的不同组织的稳定同位素比值,从而研究其不同时间尺度的食性变化,判断单一个体在生活史不同生长阶段的营养生态位宽度[16]。本文于实验室可控条件下,采用初始规格一致的人工养殖黄颡鱼,通过改变其饵料来模拟其食性转换过程,探讨黄颡鱼不同组织碳、氮稳定同位素周转速率的差异,分析组织生长作用及新陈代谢作用对稳定同位素比值变化的贡献比,探究黄颡鱼各组织碳、氮稳定同位素分馏规律,为野生环境下进一步探究黄颡鱼摄食特征和生态位奠定基础,为应用稳定同位素技术准确解释淡水生态系统结构和功能提供理论数据。
1 材料与方法 1.1 实验设计本实验的黄颡鱼选自上海松江养殖场,体表无伤痕,体质良好。在实验室循环水系统水族箱中暂养2 d以适应环境,筛选规格大小一致的个体200尾(体长:7.3±0.7cm,体质量:6.8±1.7cm),分为对照组(组A)和实验组(组B),即2个水族箱,各100尾。黄颡鱼于实验室驯养90 d后开始食性转换实验,驯养期间对两组黄颡鱼均投喂同一种饵料(饵料A,δ15N:6.0‰±0.1‰;δ13C:-23.7‰±0.1‰),食性转换实验开始后,组A继续投喂饵料A,组B投喂δ13C、δ15N比值较高的饵料B (δ15N=13.5‰±1.0‰;δ13C=-17.5‰±0.6‰)。投喂时间为每日8:30和20:30,每尾黄颡鱼每天投喂饵料量占体重的2%~3%,光照时间为每日12 h,水温为(24±1)℃。
第90天作为食性转换实验的第0天,为监测养殖期间黄颡鱼组织稳定同位素的周转,分别在第0、4、11、25、32、46、74和116天进行取样[17-18],每组随机取3尾黄颡鱼进行体长、体质量等生物学测定,随后解剖采集黄颡鱼组织样品。将鱼体表擦干,刮取体表粘液,解剖取得鱼体背鳍下方肌肉、胸鳍和背鳍鱼鳍、肝脏和鳃共5种组织,立即用超纯水冲洗,并将所有组织样品置于-55 ℃下冷冻干燥24 h以上,用球磨仪(MM400)将样品研磨成粉末,冷冻保存以备测定分析。本研究未对黄颡鱼组织样品进行脱脂,以避免脱脂导致的δ13C和δ15N数据离散化[19]。
1.2 碳、氮稳定同位素测定将所有样品送入vario ISOTOPE cube元素分析仪和IsoPrime100稳定同位素比例分析质谱仪测定得出碳、氮稳定同位素比值。碳、氮稳定同位素组成以国际通用的δ值表示,其公式为:
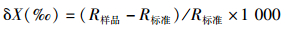 (1)
(1)
式中:X表示所测定的同位素种类,R代表所测得的重轻同位素比值,即碳为13C/12C, 氮为15N/14N。碳稳定同位素标准物为USGS24(-16.0‰ vPDB),氮稳定同位素标准物为USGS26(53.7‰ vN2),以此量化稳定同位素比值。每测定10个样品加入3个标准样品[蛋白质(-26.98‰ vPDB与5.96‰ vN2)]。稳定同位素测定在上海海洋大学稳定同位素分析实验室进行,仪器分析误差为0.05‰(δ13C)和0.06‰(δ15N)。
1.3 数据处理黄颡鱼组织氮稳定同位素周转遵循时间模型[8, 14, 20-21],该模型是以时间为自变量的负指数模型,表述如下:
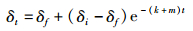 (2)
(2)
式中:δt表示t时黄颡鱼组织的稳定同位素比值,δf为组织与饵料B完全平衡时的稳定同位素比值,δi为食性转换前稳定同位素比值,t表示时间,以食性转换实验开始之日计为起始时间,周转常数为生长系数(k)和新陈代谢周转常数(m)之和。δf和v通过非线性回归方法估计得到,而生长常数则可通过指数生长模型求得[22]:
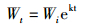 (3)
(3)
式中:Wt为t时鱼的体重,Wi为t=0时的初始体重。
达到α%的稳定同位素周转量所需时间由以下方程计算得到:
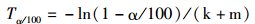 (4)
(4)
令α=50,可求得稳定同位素周转量为一半时所需时间,即半衰期,用T0.5表示[20]。生长和新陈代谢作用对鱼类组织稳定同位素周转的贡献率由k和m与周转常数的比值计算得到,通常用Pg和Pm表示[22]。
黄颡鱼组织与饵料的稳定同位素分馏系数计算方程如下[23]:
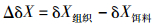 (5)
(5)
生长方程中的生长系数,时间模型中的周转常数利用R3.2.1软件和SPSS 19.0进行数据计算分析。
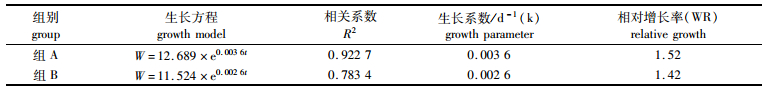
2 结果 2.1 黄颡鱼生长规律组A与组B黄颡鱼的生长均符合指数生长模型(表 1)。组A黄颡鱼的生长系数为0.003 6 d-1,组B为0.0026 d-1,A、B两组生长系数无显著差异(ANOVA,P>0.05)。在为期116 d的实验中,组A与组B的黄颡鱼体质量增加至初始体质量的1.42~1.52倍。
|
表 1 组A和组B黄颡鱼生长方程的拟合结果 Tab.1 Growth model of control and experimental groups |
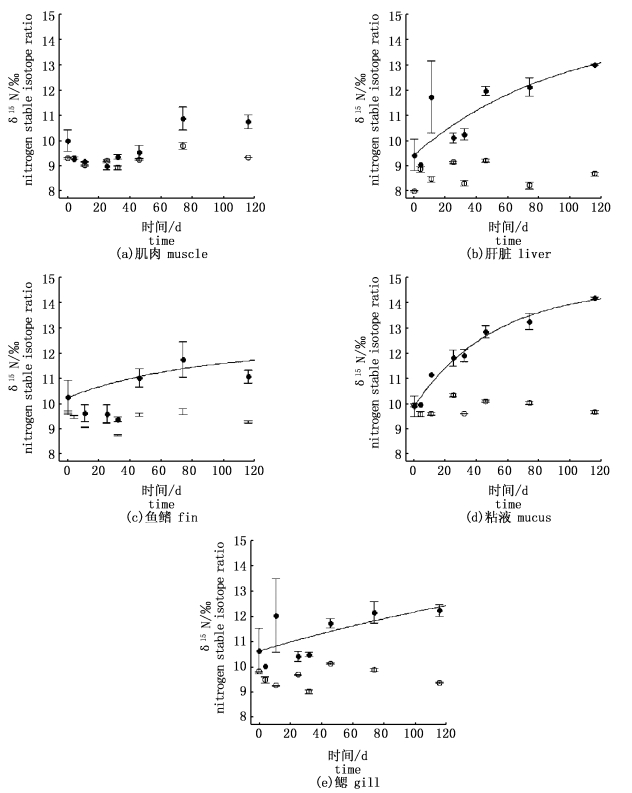
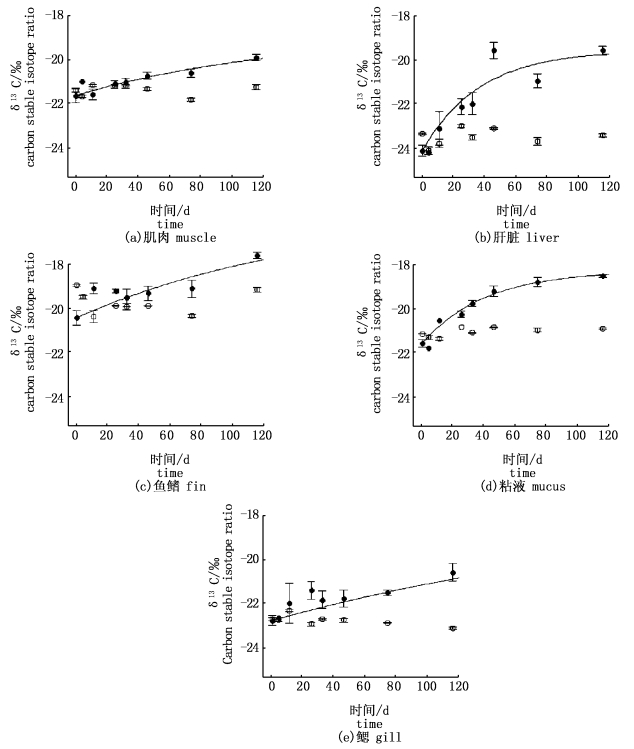
组A和组B中黄颡鱼的5种组织(肌肉、肝脏、鱼鳍、粘液和鳃)的δ15N随时间的变化情况如图 1所示。实验过程中,组A黄颡鱼各组织的δ15N平均值分别为:9.3‰±0.4‰(肌肉),8.6‰±0.6‰(肝脏),9.3‰±0.4‰(鱼鳍),9.8‰±0.4‰(粘液),9.6‰±0.4‰(鳃),各组织δ15N在相同时间点的均值无显著差异(ANOVA,P>0.05)。组B饲料改变后,由于组B饲料δ15N比组A的高,组B黄颡鱼组织δ15N随时间变化而增加。
|
图 1 组A (实心)和组B (空心)黄颡鱼肌肉(a),肝脏(b),鱼鳍(c),粘液(d)和鳃(e)的δ15N随时间变动情况
Fig. 1 Temporal changes in the observed δ15N for muscle (a), liver (b), fin (c), mucus (d) and gill (e) tissues of the group A (empty symbols) and the group B (filled symbols)
|
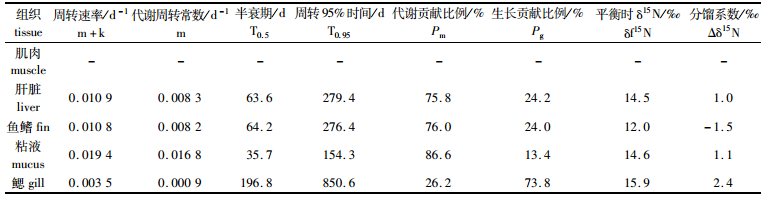
在实验周期内,组B黄颡鱼5种组织氮稳定同位素均未完全达到平衡,根据时间模型(公式2)估计得各组织的稳定同位素周转半衰期:肝脏为63.6 d,鱼鳍为64.2 d,粘液为35.7 d,鳃为196.8 d (表 2)。粘液为氮稳定同位素周转速率最快的组织,而鳃为最慢,肌肉在第74天与初始值有显著性差异(ANOVA,P < 0.05),通过时间模型无法成功拟合,说明15N在黄颡鱼肌肉组织中可能具有较慢的周转速率。
|
表 2 基于时间模型的组B黄颡鱼肝脏、鱼鳍、粘液和鳃的氮稳定同位素周转的参数估算 Tab.2 Parameter estimates and calculations from time-based model of δ15N turnover for liver, fin, mucus and gill of Pelteobagrus fulvidraco of group B under control experiment |
|
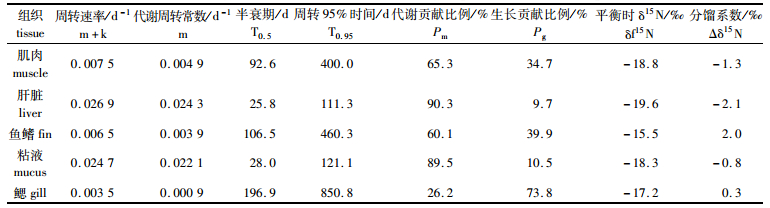
图 2 组B (实心)和组A (空心)黄颡鱼肌肉(a),肝脏(b),鱼鳍(c),粘液(d)和鳃(e)的δ13C随时间变动情况
Fig. 2 Temporal changes in the observed δ13C for muscle (a), liver (b), fin (c), mucus (d) and gill (e) tissues of the group A (empty symbols) and the group B (filled symbols)
|
当黄颡鱼组织δ15N与组B饲料δ15N达到完全平衡时,基于时间模型所预测出的各组织的δ15N分别为:14.5‰(肝脏)、12.0‰(鱼鳍)、14.6‰(粘液)、15.9‰(鳃),基于公式5计算各组织与饵料B的分馏系数分别为1.0‰、-1.4‰、1.1‰、2.4‰(表 2),仅鱼鳍的分馏系数为负值。
2.3 组织碳稳定同位素周转及分馏组A黄颡鱼各组织δ13C较为稳定,实验周期内各组织δ13C平均值为:-21.4‰±0.2‰(肌肉),-23.5‰±0.4‰(肝脏),-21.8‰±0.4‰(鱼鳍),-21.1‰±0.2‰(粘液),-22.8‰±0.2‰(鳃),相同组织不同取样时间的δ13C无显著差异(ANOVA,P>0.05)。组B黄颡鱼δ13C随时间呈上升趋势,组B各组织的δ13C随时间的增加与组A的δ13C差距逐步增大,肝脏、粘液δ13C的半衰期比δ15N的短。鳃δ13C周转半衰期为196.9 d与δ15N周转周期相似(表 3)。
|
表 3 基于时间模型的组B黄颡鱼肌肉、肝脏、鱼鳍、粘液和鳃碳稳定同位素周转的参数估算 Tab.3 Parameter estimates and calculations from time-based model of δ13C turnover for muscle, liver, fin, mucus and gill of Pelteobagrus fulvidraco of group B under control experiment |
黄颡鱼各组织碳稳定同位素的分馏系数为-2.1‰~2.0‰,5个组织中有3个组织的分馏系数为负值,鳃通过时间模型模拟δ13C最终达到平衡时与饵料B的δ13C最为接近。
2.4 生长及新陈代谢作用对黄颡鱼组织稳定同位素周转的贡献生长作用与新陈代谢作用对黄颡鱼各组织的稳定同位素周转贡献比例的结果表明(表 2,表 3),各组织的稳定同位素周转是由生长和新陈代谢两个因素共同作用的结果,这两个因素对不同组织的贡献比例不同,并且新陈代谢在组织周转中不可忽视。新陈代谢对周转快的组织贡献比例大,对于δ15N周转速率最快的粘液(Pm=86.6%)和肝脏(Pm=75.8%),其由新陈代谢贡献均大于70%。对于δ13C的周转也有同样规律,而对于周转缓慢的组织则新陈代谢的贡献比例较小,如鳃(δ15N:Pm=26.18%;δ13C:Pm=26.2%)。
3 讨论 3.1 黄颡鱼组织碳、氮稳定同位素周转速率本研究发现碳、氮稳定同位素在黄颡鱼粘液和肝脏组织的周转速率相对较快。粘液较快的周转速率可能与粘液较强的再生能力有关,CHURCH等对虹鳟(Oncorhynchus mykiss)各组织稳定同位素周转速率分析后也得出了相似结论[24]。因此,有学者提出,粘液可作为揭示鱼类短期摄食情况的研究组织,并且可作为非致命性取样的组织,有利于濒危物种的组织取样[24-25]。研究表明,消费者食物的稳定同位素周转进入器官或组织的速率与其蛋白质周转速率有关[26-29],肝脏的蛋白质周转较快[30],这可能是本研究中黄颡鱼肝脏周转速率较快的原因。黄颡鱼的肌肉、鱼鳍和鳃的稳定同位素周转速率较慢。肌肉是鱼类稳定同位素测定时常用的组织,黄颡鱼肌肉的δ13C和δ15N周转周期均大于3个月,表明其反映黄颡鱼长期的摄食习性。有研究发现鱼鳍周转速率较快且具有较强的再生能力,可作为非致命性取样的组织[31-33],但黄颡鱼的鱼鳍有特殊的硬棘结构,这可能是导致其周转速率较慢的原因。在利用稳定同位素技术研究黄颡鱼摄食习性时,若需研究鱼类对环境的短期响应(2~3个月内),若仅采用肌肉、鳃等周转速率较慢的组织会造成误差,因此也需考虑周转较快的粘液或肝脏组织。此外,若采取多组织比较,还可得到不同时间尺度的鱼类摄食信息。
3.2 生长与新陈代谢对黄颡鱼组织碳、氮稳定同位素周转的作用FRY和ARNOLD提出同位素周转由两个不同的过程组成,即机体生长和组织代谢[34]。机体生长过程中,新合成的组织的稳定同位素组成会稀释原有组织的稳定同位素组成,而代谢过程则产生组织替换作用[35]。生长和代谢作用对于不同生物机体的碳、氮稳定同位素周转的贡献比例有所差异,这两个作用的相对重要性取决于生物能量的分配形式,WOLF等认为对于生长快的小个体生物,生长作用占主导地位,如大西洋鲑鱼幼鱼(Salmo salar),而对于生长缓慢的生物,代谢作用则可能占主导地位[36-38]。黄颡鱼为底栖鱼类,生长速率较慢,其代谢作用对于碳、氮稳定同位素周转具有重要作用,生长较慢的褐虾(Penaeus aztecus)也具有同样规律[39]。除鳃以外的其他组织中,代谢作用对黄颡鱼的氮稳定同位素周转的贡献率占到了75.8%~86.6%,对碳稳定同位素周转的贡献率占到60.1%~90.3%,与鲽鱼(Paralichthys dentatus)肝脏[22]和斑马鱼(Danio rerio)肌肉[39]等的研究结果一致。黄颡鱼鳃的碳、氮稳定同位素周转均以生长作用为主导因素(δ15N:73.8%,δ13C:73.8%),与XIA等对草鱼(Ctenopharyngodon idella)周转速率研究结果一致,该研究结果表明鳃的周转速率最慢,生长作用对鳃的贡献比例(δ15N:86%~90%,δ13C:75%~85%)高于其他组织,可能与鳃较低的代谢率有关[18, 40]。
3.3 黄颡鱼组织碳、氮稳定同位素分馏规律稳定同位素的分馏系数(判别值)在应用混合模型探究生物摄食组成及生物间营养关系时极其重要[38]。本研究通过实验室条件控制实验,发现黄颡鱼组织碳、氮稳定同位素与饵料B的分馏系数分别为Δδ13C:-2.1‰~2.0‰和Δδ15N:-1.4‰~2.4‰,并发现不同组织的稳定同位素分馏系数存在显著差异。REICH等对蠵龟(Caretta caretta)不同组织稳定同位素测定结果分析发现,组织间δ15N差异较大,可能由于不同组织中必需氨基酸组成和含量存在差异[41],鱼类肝脏中的必需氨基酸含量最大,而高的必需氨基酸含量会增加组织中δ15N的分馏率[19]。肝脏是动物储存脂肪的主要器官[42],脂肪中12C含量较多,因而脂肪含量较高的组织δ13C值较小[19, 43],可能是本研究中黄颡鱼肝脏Δδ13C最低(-2.1‰)的原因。
| [1] | HOBSON K A.Tracing origins and migration of wildlife using stable isotopes:a review[J]. Oecologia, 1999, 120(3): 314–326. DOI:10.1007/s004420050865 |
| [2] | GUELINCKX J, MAES J, VAN DEN DRIESSCHE P, et al.Changes in δ13C and δ15N in different tissues of juvenile sand goby Pomatoschistus minutus:a laboratory diet-switch experiment[J]. Marine Ecology Progress Series, 2007, 341: 205–215. DOI:10.3354/meps341205 |
| [3] | FISK A T, SASH K, MAERZ J, et al.Metabolic turnover rates of carbon and nitrogen stable isotopes in captive juvenile snakes[J]. Rapid Communications in Mass Spectrometry, 2009, 23(2): 319–326. DOI:10.1002/rcm.v23:2 |
| [4] | GANNES L Z, O'BRIEN D M, MARTÍNEZ DEL RIO C.Stable isotopes in animal ecology:assumptions, caveats, and a call for more laboratory experiments[J]. Ecology, 1997, 78(4): 1271–1276. DOI:10.1890/0012-9658(1997)078[1271:SIIAEA]2.0.CO;2 |
| [5] | CAUT S, ANGULO E, COURCHAMP F.Variation in discrimination factors (Δ15N and Δ13C):the effect of diet isotopic values and applications for diet reconstruction[J]. Journal of Applied Ecology, 2009, 46(2): 443–453. DOI:10.1111/jpe.2009.46.issue-2 |
| [6] | 袁刚, 茹辉军, 刘学勤.洞庭湖光泽黄颡鱼食性研究[J]. 水生生物学报, 2011, 35(2): 270–275. DOI:10.3724/SP.J.1035.2011.00270 YUAN G, RU H J, LIU X Q.Feeding habits of pelteobagrus nitidus in lake dongting[J]. Acta Hydrobiologica Sinica, 2011, 35(2): 270–275. DOI:10.3724/SP.J.1035.2011.00270 |
| [7] | 谌海虎.赣江南昌段光泽黄颡鱼的年龄、生长和繁殖特性的初步研究[D].武汉:华中农业大学, 2010. CHEN H H. Preliminary studies on age, growth and reproduction of yellow catfish Pseudobagrus nitidus in nanchang section of Ganjiang River[D]. Wuhan:Huazhong Agricultural University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010566.htm |
| [8] | 沙永翠, 张培育, 张欢, 等.栖息地环境对种群营养生态位的影响--以黄颡鱼为例[J]. 生态学报, 2015, 35(5): 1321–1328. SHA Y C, ZHANG P Y, ZHANG H, et al.Impacts of habitat environment on trophic niches of a local population:a case study of yellow catfish[J]. Acta Ecologica Sinica, 2015, 35(5): 1321–1328. |
| [9] | 陈琴.黄颡鱼的生物学特性及养殖技术[J]. 江西水产科技, 2001: 28–30. CHEN Q.Biological characteristics and cultivation technology of Yellow Catfish[J]. Jiangxi Fishery Science and Technology, 2001: 28–30. |
| [10] | 邹社校.洪湖黄颡鱼的生长、食性与渔业地位[J]. 湖北农学院学报, 1999, 19(3): 240–242, 249. ZOU S X.Growth, diet and fishery role of Pelteobagrus fulvidraco in Honghu[J]. Journal of Hubei Agricultural College, 1999, 19(3): 240–242, 249. |
| [11] | WANG Y Y, YU X B, XU J.Decreased trophic position as a function of increasing body size of a benthic omnivorous fish from the largest freshwater lake in China[J]. Environmental Biology of Fishes, 2011, 91(4): 505–512. DOI:10.1007/s10641-011-9808-0 |
| [12] | POST D M.Using stable isotopes to estimate trophic position:models, methods, and assumptions[J]. Ecology, 2002, 83(3): 703–718. DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
| [13] | HOBSON K A, ALISAUSKAS R T, CLARK R G.Stable-nitrogen isotope enrichment in avian tissues due to fasting and nutritional stress:implications for isotopic analyses of diet[J]. The Condor, 1993, 95(2): 388–394. DOI:10.2307/1369361 |
| [14] | HESSLEIN R H, HALLARD K A, RAMLAL P.Replacement of sulfur, carbon, and nitrogen in tissue of growing broad whitefish (Coregonus nasus) in response to a change in diet traced by δ34S, δ13C, and δ15N[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(10): 2071–2076. DOI:10.1139/f93-230 |
| [15] | PERGA M E, GERDEAUX D.Are fish what they eat all year round?[J]. Oecologia, 2005, 144(4): 598–606. DOI:10.1007/s00442-005-0069-5 |
| [16] | 李云凯.稳定同位素技术在鲨鱼摄食和洄游行为研究中的应用[J]. 应用生态学报, 2014, 25(9): 2756–2764. LI Y K.Review on the feeding ecology and migration patterns of sharks using stable isotopes[J]. Chinese Journal of Applied Ecology, 2014, 25(9): 2756–2764. |
| [17] | HEADY W N, MOORE J W.Tissue turnover and stable isotope clocks to quantify resource shifts in anadromous rainbow trout[J]. Oecologia, 2012, 172(1): 21–34. |
| [18] | XIA B, GAO Q F, DONG S L, et al.Carbon stable isotope turnover and fractionation in grass carp Ctenopharyngodon idella tissues[J]. Aquatic Biology, 2013, 19(3): 207–216. DOI:10.3354/ab00528 |
| [19] | PINNEGAR J K, POLUNIN N V C.Differential fractionation of δ13C and δ15N among fish tissues:implications for the study of trophic interactions[J]. Functional Ecology, 1999, 13(2): 225–231. DOI:10.1046/j.1365-2435.1999.00301.x |
| [20] | TIESZEN L L, BOUTTON T W, TESDAHL K G, et al.Fractionation and turnover of stable carbon isotopes in animal tissues:implications for δ13C analysis of diet[J]. Oecologia, 1983, 57(1/2): 32–37. |
| [21] | WITTING D A, CHAMBERS R C, BOSLEY K L, et al.Experimental evaluation of ontogenetic diet transitions in summer flounder (Paralichthys dentatus), using stable isotopes as diet tracers[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(11): 2069–2084. DOI:10.1139/f04-156 |
| [22] | BUCHEISTER A, LATOUR R J.Turnover and fractionation of carbon and nitrogen stable isotopes in tissues of a migratory coastal predator, summer flounder (Paralichthys dentatus)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(3): 445–461. DOI:10.1139/F09-196 |
| [23] | HOBSON K A, CLARK R G.Assessing avian diets using stable isotopes I:turnover of 13C in tissues[J]. The Condor, 1992, 94(1): 181–188. DOI:10.2307/1368807 |
| [24] | CHURCH M R, EBERSOLE J L, RENSMEYER K M, et al.Mucus:a new tissue fraction for rapid determination of fish diet switching using stable isotope analysis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2008, 66(1): 1–5. |
| [25] | MARUYAMA A, SHIMONAK H, ITO T.Quick change in δ15N values of fish mucus confirmed in the field using a migratory goby[J]. Ecology of Freshwater Fish, 2015, 24(1): 162–164. DOI:10.1111/eff.2014.24.issue-1 |
| [26] | LOBLEY G E.Protein turnover-what does it mean for animal production?[J]. Canadian Journal of Animal Science, 2003, 83(3): 327–340. DOI:10.4141/A03-019 |
| [27] | DALERUM F, ANGERBJORN A.Resolving temporal variation in vertebrate diets using naturally occurring stable isotopes[J]. Oecologia, 2005, 144(4): 647–658. DOI:10.1007/s00442-005-0118-0 |
| [28] | WATERLOW J C. Protein turnover[M]. Wallingford, UK: CABI, 2006. |
| [29] | BOECKLEN W J, YARNES C T, COOK B A, et al.On the use of stable isotopes in trophic ecology[J]. Annual Review of Ecology, Evolution, and Systematics, 2011, 42(1): 411–440. DOI:10.1146/annurev-ecolsys-102209-144726 |
| [30] | MCMILLAN D N, HOULIHAN D F.Short-term responses of protein synthesis to re-feeding in rainbow trout[J]. Aquaculture, 1989, 79(1/4): 37–46. |
| [31] | 曾庆飞, 谷孝鸿, 毛志刚, 等.同位素富集-稀释法研究食性转变对鱼类不同组织N同位素转化率的影响[J]. 生态学报, 2012, 32(4): 1257–1263. DOI:10.5846/stxb ZENG Q F, GU X H, MAO Z G, et al.Effect of diet switch on turnover rates of tissue nitrogen stable isotopes in fish based on the enrichment-dilution approach[J]. Acta Ecologica Sinica, 2012, 32(4): 1257–1263. DOI:10.5846/stxb |
| [32] | 邵金辉, 许增禄.鱼鳍的再生[J]. 生命的化学, 2009, 29(2): 265–267. |
| [33] | MCINTYRE P B, FLECKER A S.Rapid turnover of tissue nitrogen of primary consumers in tropical freshwaters[J]. Oecologia, 2006, 148(1): 12–21. DOI:10.1007/s00442-005-0354-3 |
| [34] | FRY B, ARNOLD C.Rapid 13C/12C turnover during growth of brown shrimp (Penaeus aztecus)[J]. Oecologia, 1982, 54(2): 200–204. DOI:10.1007/BF00378393 |
| [35] | CARLETON S A, MARTÍNEZ DEL RIO C.The effect of cold-induced increased metabolic rate on the rate of 13C and 15N incorporation in house sparrows (Passer domesticus)[J]. Oecologia, 2005, 144(2): 226–232. DOI:10.1007/s00442-005-0066-8 |
| [36] | JARDINE T D, MACLATCHY D L, FAIRCHILD W L, et al.Rapid carbon turnover during growth of Atlantic salmon (Salmo salar) smolts in sea water, and evidence for reduced food consumption by growth-stunts[J]. Hydrobiologia, 2004, 527(1): 63–75. DOI:10.1023/B:HYDR.0000043182.56244.f6 |
| [37] | MACAVOY S E, MACKO S A, ARNESON L S.Growth versus metabolic tissue replacement in mouse tissues determined by stable carbon and nitrogen isotope analysis[J]. Canadian Journal of Zoology, 2005, 83(5): 631–641. DOI:10.1139/z05-038 |
| [38] | WOLF N, CARLETON S A, MARTÍNEZ DEL RIO C.Ten years of experimental animal isotopic ecology[J]. Functional Ecology, 2009, 23(1): 17–26. DOI:10.1111/fec.2009.23.issue-1 |
| [39] | TARBOUSH R A, MACAVOY S E, MACKO S A, et al.Contribution of catabolic tissue replacement to the turnover of stable isotopes in Danio rerio[J]. Canadian Journal of Zoology, 2006, 84(10): 1453–1460. DOI:10.1139/z06-136 |
| [40] | XIA B, GAO Q F, LI H M, et al.Turnover and fractionation of nitrogen stable isotope in tissues of grass carp Ctenopharyngodon idellus[J]. Aquaculture Environment Interactions, 2013, 3(2): 177–186. DOI:10.3354/aei00061 |
| [41] | REICH K J, BJORNDAL K A, MARTÍNEZ DEL RIO C.Effects of growth and tissue type on the kinetics of 13C and 15N incorporation in a rapidly growing ectotherm[J]. Oecologia, 2008, 155(4): 651–663. DOI:10.1007/s00442-007-0949-y |
| [42] | 林浩然. 鱼类生理学[M]. 广州: 中山大学出版社, 2011. LIN H R. Fish physiology[M]. Guangzhou: Sun Yat-Sen University Press, 2011. |
| [43] | FOCKEN U, BECKER K.Metabolic fractionation of stable carbon isotopes:implications of different proximate compositions for studies of the aquatic food webs using δ13C data[J]. Oecologia, 1998, 115(3): 337–343. DOI:10.1007/s004420050525 |
2. National Distant-water Fisheries Engineering Research Center, Shanghai 201306, China;
3. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Collaborative Innovation Center for Distant-water Fisheries, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


