2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 农业部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
细菌生物被膜(biofilm)是无柄微生物群落在各种载体上的附着,通过分泌多糖、纤维蛋白、脂质蛋白等胞外基质,将其自身包绕其中而形成的大量高度组织化、系统化的膜样聚合物[1]。在细菌生物被膜的保护下,细菌可以增强自身对抗生素、环境压力及宿主免疫系统攻击的耐受能力。DAVIES[2]研究发现成膜后的细菌,其对化学试剂的敏感程度只有浮游菌的1/10~1/1 000。由于膜状态的细菌耐受性增强,使得常规杀菌方法不能有效彻底地灭菌,给食品安全造成极大的隐患。生物被膜内的细菌表面附着由自身分泌产生的胞外多聚物(extracellular polymeric substances,EPS),既能增强微生物细胞对外界环境的抵抗能力,又是影响生物被膜稳定的关键因素[3]。胞外多糖是EPS主要组成成分之一,DANESE等[4]研究发现对不能合成胞外多糖的突变体纯菌属只能形成短暂的小菌落,难以形成成熟稳定的生物被膜。此外,EPS中胞外蛋白在生物被膜形成及稳定阶段也起着重要的作用,JOHANSSON 等[5]研究表明海藻结合型胞外蛋白是假单胞菌生物被膜形成及稳定的必要组成部分。
单增李斯特菌(Listeria monocytogenes,LM)是一种人畜共患病食源性致病菌,可引发败血症、胃肠炎和脑膜炎等疾病,病死率高达20 % ~ 30 %,被WHO列为关系食品卫生安全的重要病源细菌之一[6]。LM能广泛存在于土壤、污水、动物性食品及饲草等环境中,这与其内部环境调节因子σ家族有密切关系[7]。其中σ家族中的σB因子是最重要的环境调控因子:σB由sigB基因编码,可使LM在多种逆境下生存,并且较快地适应外界环境[8]。张强[9]、STIJN和TJAKKO [10]等研究表明sigB参与LM生物被膜的形成,但其具体的分子机制尚未见完整报道。本研究首先利用结晶紫染色法比较分析了不同温度(4、15、25和37 ℃)、pH(4、5、6和7)及NaCl浓度(0.5 %、2.5 %、4.5 %和6.5 %)对LM野生型菌株(WaX12)与sigB缺失突变型菌株(WaX12-ΔsigB)生物被膜形成能力的影响。其次,为进一步揭示sigB影响单增李斯特菌生物被膜形成的初步机制,比较了WaX12菌株与WaX12-ΔsigB菌株生物被膜活菌数、胞外多糖及胞外蛋白形成的差异,从而为深入研究sigB影响LM生物被膜形成的途径和分子机制提供新的科学依据。
1 材料与方法 1.1 材料 1.1.1 菌株单核细胞增生李斯特菌野生型菌株WaX12由本实验室于生猪肉中分离而得,血清型为4b,经过形态学分析、生化特性以及分子生物学鉴定,由上海海洋大学农业部水产品贮藏保鲜质量安全风险评估实验室保藏。sigB缺失突变型菌株WaX12-ΔsigB 由本实验室构建并保存。
1.1.2 试剂和设备戊二醛、结晶紫、无水乙醇及98 %浓硫酸均购自上海国药化学试剂有限公司;氯化钾购自天津市鼎盛鑫化工有限公司;苯酚购自上海展云化工有限公司;福林-酚及lowry reagent均购自Sigma公司; 脑心浸液培养基(BHI培养基)、PALCAM培养基及脑心浸液琼脂均购自北京陆桥技术有限责任公司;24孔板、96孔微孔板均购自Corning公司;BioTeK 酶标仪,购自美国柏腾仪器有限公司;振荡培养箱,购自上海知楚仪器有限公司;JYP2-IIN超声波细胞粉碎机,购自宁波新芝生物科技股份有限公司;离心机、金属浴,购自美国Eppendorf公司。
1.2 方法 1.2.1 生物被膜的形成与测定参照文献[11]的方法并稍作改进。具体步骤:将WaX12和WaX12-ΔsigB在PALCAM选择性培养基平板上划线,37 ℃静置过夜培养。分别挑取单菌落至5 mL BHI液体培养基于37 ℃、180 r/min 震荡培养4~4.5 h至OD600=0.2 左右。将V(菌悬液)∶V(BHI液体培养基)=1∶100,按每孔1 mL加入到24孔细胞培养板中,测定培养72 h形成的生物被膜。24孔板用封口膜封口,防止培养基蒸发。每组3个平行样,以无菌BHI为空白对照。培养结束后,小心弃去孔中的培养基,用无菌PBS缓冲液洗涤3次,除去尚未形成生物被膜的浮游菌体。室温干燥45 min后,向每个样品孔内加入1 mL 0.1 %结晶紫溶液,染色30 min。染色结束后,用无菌PBS缓冲液洗涤3次。室温风干后,加入1 mL 95 %的乙醇溶液脱色30 min,移取200 μL洗脱液于96孔微孔板,最后用酶标仪检测生物被膜菌的光吸收值(OD600)。
1.2.2 胞外多糖(polysaccharide)及胞外蛋白(extracellular protein)的测定菌株按1.2.1 培养,分别测定WaX12和WaX12-ΔsigB在37 ℃、pH = 6及NaCl浓度为2.5 %条件下培养72 h的生物被膜胞外多糖及胞外蛋白的相对含量。参照文献[14]的方法并稍作改进。具体步骤:培养结束后,首先用酶标仪测定菌液OD595的光吸收值。然后小心弃去孔中的培养基,用无菌PBS缓冲液洗涤3次,以除去尚未形成生物被膜的浮游菌体。加入1 mL 0.01 mol/L的氯化钾溶液重悬5 min,然后每个样品孔超声5 s,间隙5 s,循环5次。超声结束后,将菌液转移至1.5 mL无菌离心管内,于4 ℃条件下,转速为4 000 r/min,离心20 min。随后用直径0.22 μm的滤膜过滤上清液,以除去杂质。胞外多糖的测定:吸取100 μL滤液于1.5 mL 无菌离心管内,加入200 μL 98 %的浓硫酸,室温静置30 min。随后加入25 μL 6 %的苯酚溶液,置于90 ℃ 金属浴中,温育5 min。移取200 μL样品于96孔微孔板内,最后用酶标仪检测OD490的光吸收值,计算OD490/OD595 即为样品多糖相对含量。胞外蛋白的测定:吸取40 μL滤液于1.5 mL 无菌离心管内,加入200 μL lowry reagent溶液,室温静置10 min。然后加入20 μL福林-酚溶液,室温静置30 min。移取200 μL样品于96孔微孔板内,最后用酶标仪检测OD750的光吸收值,计算OD750/OD595 即为样品胞外蛋白的相对含量。
1.2.3 生物被膜活菌计数菌株按1.2.1 培养,分别测定WaX12和WaX12-ΔsigB在37 ℃、pH = 6及NaCl浓度为2.5 %条件下培养72 h的生物被膜活菌数。培养结束后,用0.85 %的生理盐水稀释生物被膜菌,取不同稀释液各0.1 mL,涂布于3个BHI平板上,37 ℃培养24 h,进行平板计数。重复实验3次。
1.2.4 不同培养温度、pH及NaCl浓度对李斯特菌生物被膜形成的影响将培养温度设定为4、15、25和37 ℃,按1.2.1 ,检测不同温度对生物被膜形成的影响。配制pH分别为4、5、6和7的BHI,按1.2.1,比较不同起始pH的生物被膜形成情况。分别配制终浓度为0.5 %、2.5 %、4.5 %和6.5 % NaCl的BHI,按1.2.1,比较不同NaCl浓度下生物被膜的形成情况。
1.3 数据处理采用Origin 8.0、SPSS 17.0软件处理,对相关数据进行统计分析。
2 结果 2.1 不同温度、pH及NaCl浓度对WaX12与WaX12-ΔsigB生物被膜形成能力的影响由图 1a中可知,LM生物被膜的形成与其生长温度密切相关。在25 ℃和37 ℃李斯特菌形成的生物被膜量大,表现出OD600值大,显著高于4 ℃条件下的OD600 (P<0.01)。而在4 ℃条件下,WaX12与WaX12-ΔsigB生物被膜的形成明显受到抑制。另外,在15 ℃ 、25 ℃和37 ℃条件下,WaX12-ΔsigB生物被膜形成量与WaX12相比显著降低(P< 0.05)。
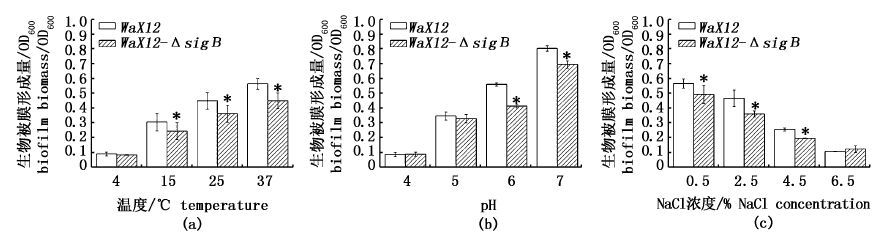
|
图 1 不同培养条件下WaX12与WaX12-ΔsigB生物被膜形成情况
Fig. 1 Biofilm formation by WaX12 and WaX12-ΔsigB under various conditions
|
图 1b显示,当pH=7时,李斯特菌形成生物被膜的OD600最大;当pH=4时,李斯特菌几乎不形成生物被膜。此外,当pH为7及6时,WaX12与WaX12-ΔsigB生物被膜量存在显著差异(P< 0.05),而pH=5时,两者生物被膜量并无显著差异(P>0.05)。从图 1c中可知,NaCl浓度对李斯特菌生物被膜的形成影响显著。当NaCl浓度为0.5 %时,李斯特菌生成的生物被膜量最大;当NaCl浓度在2.5 %和4.5 %时生成的生物被膜量次之;当NaCl浓度达到6.5 %时,其OD600值极显著减少,李斯特菌几乎不能形成生物被膜。此外,WaX12与WaX12-ΔsigB生物被膜形成量在NaCl浓度为0.5 %、2.5 %和4.5 %时,均存在显著差异(P< 0.05)。
进一步利用变异系数分析不同培养条件对WaX12与WaX12-ΔsigB生物被膜形成能力的影响,图 2结果显示,温度、pH及NaCl浓度对两者生物被膜形成能力均有影响,其中温度的影响最大,NaCl浓度次之,pH最弱。图 3分析结果进一步表明,WaX12-ΔsigB生物被膜的形成能力更易受到培养条件的影响。计算WaX12与WaX12-ΔsigB分别在温度、pH及NaCl浓度培养条件影响下成膜能力的CV(%)差值可得:ΔCV(温度)% = 3.25;ΔCV(pH)% = 1.16;ΔCV(NaCl)% = 2.10,可见,温度对WaX12-ΔsigB生物被膜形成能力的影响最大。
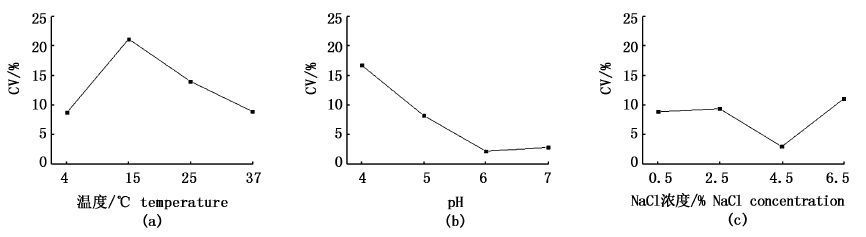
|
图 2 不同培养条件对LM生物被膜形成能力影响的变异系数分析
Fig. 2 Coefficient of variation of LM biofilm formation under various conditions
|
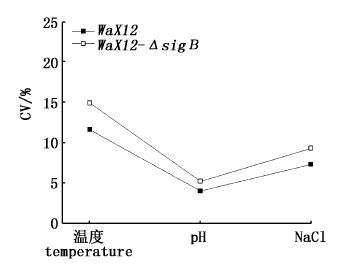
|
图 3 不同培养条件分别对WaX12与WaX12-ΔsigB生物被膜形成能力影响的变异系数分析
Fig. 3 Coefficient of variation of biofilm formation by WaX12 and
WaX12-ΔsigB under various conditions
|
最后,由表 1可知,WaX12与WaX12-ΔsigB分别在37 ℃、pH = 6及2.5 % NaCl培养条件下,两者生物被膜的形成量差异最显著(P< 0.05)。
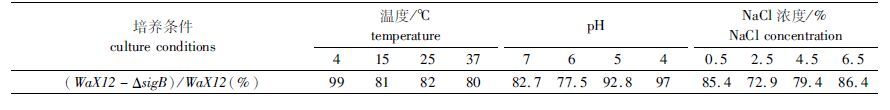
|
表 1 不同培养条件下WaX12-ΔsigB与WaX12生物膜形成量比例 Tab.1 The proportion of biofilm biomass by WaX12-ΔsigB under various conditions |
WaX12与WaX12-ΔsigB分别在37 ℃、pH=6及2.5 % NaCl条件下,培养72 h的生物被膜活菌、胞外多糖及胞外蛋白的测定结果如图 4所示。图 4a显示,WaX12-ΔsigB胞外多糖的相对含量显著降低(P< 0.05)。在pH=6条件下,WaX12与WaX12-ΔsigB胞外多糖的相对含量差异显著(P< 0.05),且与37 ℃及2.5 % NaCl条件相比,两者的胞外多糖相对含量最高;在2.5 % NaCl条件下,WaX12与WaX12-ΔsigB胞外多糖的相对含量差异极显著(P<0.01);而在37 ℃条件下,虽然两者的胞外多糖含量无显著差异(P>0.05),但WaX12-ΔsigB胞外多糖相对含量略低于WaX12。
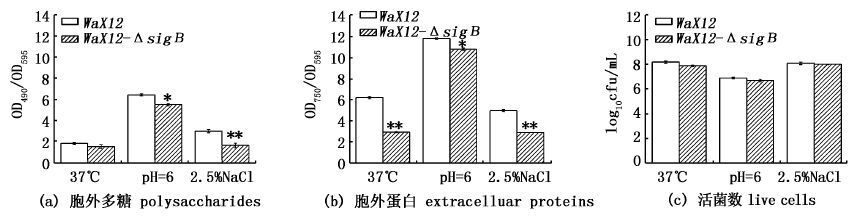
|
图 4 WaX12与WaX12-ΔsigB分别在37 ℃、pH = 6及2.5 % NaCl条件下生物被膜胞外多糖、胞外蛋白及活菌数的测定结果
Fig. 4 Polysaccharides,extracelluar proteins and live cells in biofilm of WaX12 and WaX12-ΔsigB
at 37 ℃,pH = 6 and 2.5 % NaCl,respectively
|
图 4b显示,WaX12-ΔsigB胞外蛋白的相对含量显著降低(P< 0.05)。在pH=6条件下,WaX12与WaX12-ΔsigB胞外蛋白的相对含量差异显著(P< 0.05),且与37 ℃及2.5 % NaCl条件相比,两者的胞外蛋白相对含量最高;而在37 ℃及2.5 % NaCl条件下,WaX12与WaX12-ΔsigB胞外蛋白的相对含量差异极显著(P<0.01)。最后,由图 4c结果可知,WaX12-ΔsigB生物被膜活菌数略低于WaX12,但无显著差异(P>0.05)。
3 讨论σB因子是sigB基因编码的产物,它是革兰氏阳性菌对环境胁迫产生应答反应的主要调控因子。在LM中,σB介导特定基因的表达,使其能在低pH、氧化环境、乙醇、高渗透压、高温、低温和高胆汁酸盐等环境胁迫压力下生存[8]。近年来,有关LM生物被膜的研究主要建立在实验室培养和检测LM生物被膜的标准方法以及分析培养条件(营养、温度、接触面材料性质等)对LM生物被膜形成的影响,另一方面则是利用各种转座系统获得生物被膜形成的突变株,研究LM生物被膜形成的相关基因。然而,有关环境压力应激因子sigB在LM生物被膜形成过程中的调节机制仍不清楚。
众所周知,细菌的粘附和生物被膜的形成受到许多因素的影响,如生长环境中的营养物质、物体接触表面的状况、微生物种类、pH与温度等[15]。LM易在不锈钢片、玻璃及聚苯乙烯等常见食品加工材料表面聚集形成生物被膜,SACHIN等 [16]研究发现温度降低,LM生物被膜形成能力也随之降低,而且在营养贫瘠的培养基中LM生物被膜形成能力反而强于营养富集的培养基,可见细菌生物被膜的形成能力易受到环境条件的影响。本研究利用结晶紫法比较分析了不同培养条件(温度、pH及NaCl浓度)对LM野生型菌株(WaX12)及sigB缺失突变型菌株(WaX12-ΔsigB)生物被膜形成能力的影响,通过变异系数分析结果显示,LM生物被膜形成能力受温度的影响最大。ALEXANDRA等 [17]研究发现肠炎沙门氏菌生物被膜形成能力更易受到pH的影响,可见不同种类细菌成膜能力的变异性受外界环境条件的影响是有很大差异的。目前,有关培养条件对LM生长的影响研究报道颇多,研究表明0~20 ℃范围内,LM菌液的OD600 增长极慢,其最适生长温度为37 ℃;LM在NaCl 浓度为0.5 %~3.5 %范围内生长良好,而当NaCl浓度高于5.5 %时,LM的生长明显受到抑制;LM在低酸环境中不易生长,其最适生长pH为7.5[18]。结合本研究结果可知,LM在不同培养条件下的生长特性与其生物被膜的形成有一定对应关系,可见细菌的生长速率可能直接影响其生物被膜的形成。此外,图 3结果表明,sigB缺失突变型菌株WaX12-ΔsigB生物被膜的形成更易受到培养条件的影响,可见其对外界的耐受力减弱。与浮游菌相比,LM生物被膜内细菌对外界的环境刺激敏感性显著降低,尤其是对抗菌剂的敏感性。目前研究表明,生物被膜内细菌的耐受机制可能是由于生物被膜深层的细菌体积较小并且繁殖能力弱,被胞外聚合物(EPS)包裹,基本处于低营养、低氧分压及高代谢产物的微环境,生长速度相对迟缓[19]。早期研究发现,作为生物被膜骨架的EPS是微生物自身代谢产物,是构成生物被膜三维结构的关键因子,其在生物被膜形成过程中起主要作用的组成成分为多糖、蛋白和胞外DNA[3]。胞外多糖及蛋白在细胞初始粘附及维持生物被膜稳定中起着关键作用,SUTHERLAND等[20]研究混合菌属生物膜结构发现,只要存在能合成胞外多糖的微生物菌属,就能形成成熟稳定的生物膜,而BRANDA等[21]研究表明假单胞菌细胞结合型胞外蛋白CdrA可促进更多的细胞与胞外多糖结合,从而加快其生物被膜的形成。为了进一步揭示sigB影响LM生物被膜形成的初步机制,我们发现缺失突变型菌株WaX12-ΔsigB胞外多糖及胞外蛋白的相对含量显著降低(P< 0.05),推测sigB的缺失可能降低了细胞的粘附性,从而降低了生物被膜的形成,其具体的分子机制仍需进一步研究。
细菌生物被膜的形成一般分为五个阶段:初始粘附(initial attachment),不可逆粘附(irreversible attachment),微菌落形成(microcolony formation),成熟生物被膜(biofilm maturation),播散期(cell dispersion) [22]。近年来,从基因水平分析细菌生物被膜的形成机制是揭示其致病机理的重要研究方向,目前,已报道与LM鞭毛合成及运动相关的基因(flaA、fliG、filE、motA、motB、degU、mogR等),群体感应因子转录调节子(agrA、agrB、agrC等)、主要毒力基因prfA等及热激蛋白转录因子dnaK等 [12],这些基因在LM生物被膜形成的初始粘附及成熟稳定阶段都起着重要的作用。LEMON等[23]研究发现在LM细胞初始粘附阶段,鞭毛运动对生物被膜的形成起着至关重要的作用。细菌的运动性在细菌致病过程中发挥着重要的作用,而鞭毛有助于细菌运动性,并且通过趋化运动对宿主细胞发挥粘附或侵袭作用。细菌一旦完成粘附,成熟生物被膜的形成主要依赖复杂的群体感应系统(Quorum sensing,QS)的调节,多数细菌生物被膜的形成、发展及功能调节需要OS信号分子参与。AURÉLIE等[24]研究表明在LM生物被膜形成的早期,与野生菌株相比,agrA突变菌株在聚苯乙烯上形成生物被膜的能力明显降低。近年来,研究主要毒力基因prfA在LM生物被膜形成过程中的调节机制也是一大热点,这对于揭示其致病原理,具有重要的意义。然而,细菌的毒力和环境适应能力是密切相关的,并不是独立的。研究发现σB对众多的毒力因子也具有调节作用,并且与prfA的关系密切,也是重要的毒力调节因子[25]。细菌生物被膜的形成是多基因共同参与调节的复杂体系,LM生物被膜形成过程中,sigB与其生物被膜相关基因之间是否存在一定的调控关系?下一步本实验室的工作重点将从转录组学水平上具体分析sigB影响LM生物被膜形成的分子机制。
| [1] | FLEMMING H C, WINGENDER J.The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623–633. |
| [2] | DAVIES D.Understanding biofilm resistance to antibacterial agents[J]. Nature Reviews Drug Discovery, 2003, 2(2): 114–122. |
| [3] | JANISSEN R, MURILLO D M, NIZA B, et al.Spatio-temporal distribution of different extracellular polymeric substances and filamentation mediate Xylella fastidiosa adhesion and biofilm formation[J]. Scientific Reports, 2015, 5: 9856. |
| [4] | DANESE P N, PRATT L A, KOLTER R, et al.Exopoly-saccharide production is required for development of Escherichia coli K-12 biofilm architecture[J]. Journal of Bacteriology, 2000, 182(12): 3593–3596. |
| [5] | JOHANSSON E M V, CRUSZ S A, KOLOMIETS E, et al.Inhibition and dispersion of Pseudomonas aeruginosa biofilms by glycopeptide dendrimers targeting the fucose-Specific lectin lecB[J]. Chemistry & Biology, 2008, 15(12): 1249–1257. |
| [6] | WHO/FAO (World Health Organization/Food and Agri-culture Organization of the United Nations). Risk assessment of Listeria monocytogenes in ready-to-eat foods, MRA Series 4& 5[EB/OL]. 2004. http://www.who.int/foodsafety/publications/micro/mra_listeria/en/index.html. |
| [7] | OKADA Y, OKADA N, MAKINO S I, et al.The sigma factor RpoN (σ54) is involved in osmotolerance in Listeria monocytogenes[J]. FEMS Microbiology Letters, 2006, 263(1): 54–60. |
| [8] | WIEDMANN M, ARVIK T J, HURLEY R J, et al.General stress transcription factor sigmaB and its role in acid tolerance and virulence of Listeria monocytogenes[J]. Journal of Bacteriology, 1998, 180(14): 3650–3656. |
| [9] | 张强, 冯飞飞, 王莉, 等.单核细胞增生李斯特菌SigmaB、PrfA因子对生物被膜形成影响的研究[J]. 医学研究杂志, 2010, 39(10): 19–22. ZHANG Q, FENG F F, WANG L, et al.Effect of SigmaB, PrfA on biofilm formation in Listeria monocytogenes[J]. Journal of Medical Research, 2010, 39(10): 19–22. |
| [10] | WAN DER VEEN S, ABEE T.Importance of SigB for Listeria monocytogenes static and continuous-flow biofilm formation and disinfectant resistance[J]. Applied and Environmental Microbiology, 2010, 76(23): 7854–7860. |
| [11] | CHOPRA L, SINGH G, JENA K K, et al.Sonorensin:a new bacteriocin with potential of an anti-biofilm agent and a food biopreservative[J]. Scientific Reports, 2015, 5: 13412. |
| [12] | CHANG Y H, GU W M, FISCHER N, et al.Identification of genes involved in Listeria monocytogenes biofilm formation by mariner-based transposon mutagenesis[J]. Applied Microbiology and Biotechnology, 2012, 93(5): 2051–2062. |
| [13] | MATTILA M, LINDSTRÖM M, SOMERVUO P, et al.Role of flhA and motA in growth of Listeria monocytogenes at low temperatures[J]. International Journal of Food Microbiology, 2011, 148(3): 177–183. |
| [14] | KIM H S, PARK H D.Ginger extract inhibits biofilm formation by Pseudomonas aeruginosa PA14[J]. PLos One, 2013, 8(9): e76106. |
| [15] | DONLAN R M.Biofilms:microbial life on surfaces[J]. Emerging Infectious Diseases, 2002, 8(9): 881–890. |
| [16] | KADAM S R, DEN BESTEN H M W, VAN DER VEEN S, et al.Diversity assessment of Listeria monocytogenes biofilm formation:impact of growth condition, serotype and strain origin[J]. International Journal of Food Microbiology, 2013, 165(3): 259–264. |
| [17] | LIANOU A, KOUTSOUMANIS K P.Strain variability of the biofilm-forming ability of Salmonella enterica under various environmental conditions[J]. International Journal of Food Microbiology, 2012, 160(2): 171–178. |
| [18] | SAUCEDO-REYES D, CARRILLO-SALAZAR J A, REYES-SANTAMARÍA M I, et al.Effect of pH and storage conditions on Listeria monocytogenes growth inoculated into sapote mamey (Pouteria sapota (Jacq) H. E. Moore & Stearn) pulp[J]. Food Control, 2012, 28(1): 110–117. |
| [19] | JONES W L, SUTTON M P, MCKITTRICK L, et al.Chemical and antimicrobial treatments change the viscoelastic properties of bacterial biofilms[J]. Biofouling:The Journal of Bioadhesion and Biofilm Research, 2011, 27(2): 207–215. |
| [20] | SUTHERLAND I W.The biofilm matrix-an immobilized but dynamic microbial environment[J]. Trends in Microbiology, 2001, 9(5): 222–227. |
| [21] | BRANDA S S, CHU F, KEARNS D B, et al.A major protein component of the Bacillus subtilis biofilm matrix[J]. Molecular Microbiology, 2006, 59(4): 1229–1238. |
| [22] | MONDS R D, O'TOOLE G A.The developmental model of microbial biofilms:ten years of a paradigm up for review[J]. Trends in Microbiology, 2009, 17(2): 73–87. |
| [23] | LEMON K P, HIGGINS D E, KOLTER R.Flagellar motility is critical for Listeria monocytogenes biofilm formation[J]. Journal of Bacteriology, 2007, 189(12): 4418–4424. |
| [24] | RIEU A, WEIDMANN S, GARMYN D, et al.Agr system of Listeria monocytogenes EGD-e:role in adherence and differential expression pattern[J]. Applied and Environmental Microbiology, 2007, 73(19): 6125–6133. |
| [25] | KAZMIERCZAK M J, WIEDMANN M, BOOR K J.Contributions of Listeria monocytogenes σB and prfA to expression of virulence and stress response genes during extra-and intracellular growth[J]. Microbiology, 2006, 152(6): 1827–1838. |
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation (Shanghai), Ministry of Agriculture Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


