绿海龟(Chelonia mydas)是《世界自然保护联盟》(IUCN)2012年濒危物种红色名录ver 3.1——濒危(EN)物种,人类活动的日益频繁、重金属污染[1]等都威胁着它们的生存。随着我国海洋科学的迅速发展,绿海受到龟越来越多的关注和重视[2],作为一种与众不同的海洋生物,其对海洋生态有着重要的研究意义。近年来,国内外学者对绿海龟的研究越发深入,FLINT[3]对野生绿海龟的生理生化指标进行了分析,开始了对绿海龟基础生物学信息的探索;LU等[4]从患病绿海龟的肿瘤聚合物中分离发现了一种新的病毒威胁着它们的健康,通过进一步研究,寻找保护绿海龟的新方法。国内学者从另一些角度探索和研究绿海龟生物学信息,甘文强等[5]通过组织学方法观察绿海龟消化道,发现了爬行动物进化分支点的确实证据;李长玲等[6]采集并深入观察比较绿海龟血细胞的形态,为绿海龟造血器官、血细胞发育规律、肝脏的造血功能等的研究奠定了血液学基础;陶翠花等[7]采用RT-PCR和RACE方法从绿海龟肌肉组织中获得了α-actin基因的cDNA全长序列,将绿海龟的研究引入分子生物学水平上。国外研究未对绿海龟的血液生化进行系统分析,仅有野外采集绿海龟血液样本的血液生化数据报道和简单描述。如LEWBART等[8]测得加拉帕格斯绿海龟血液生化、各血气分压,为将来判定海龟健康范围提供数据基础;ANDERSON等[9]和SWARTHOUT等[10]分别为不同地域、不同饲养状态下的绿海龟进行了血液生化检测,但他们所测得的数据因地理、饲养条件等因素存在不同程度的差异。国内鲜有绿海龟血液生化的报道,对绿海龟血液的研究也刚刚起步,张飞燕等[11]比较了玳瑁和绿海龟外周血细胞,确定了绿海龟血细胞的形态和大小,并发现绿海龟有极少的嗜碱性粒细胞,但未能就性别和年龄的影响给出结论。上海海洋大学攀世水族宠物健康中心参与海龟救护和养殖放流工作中,遇到海龟健康状况的临床诊断依据问题,如参考野生样本,则在健康状况的评定[3]上难免有所偏颇,所以本研究对人工饲养的绿海龟进行血液生化指标的研究和分析,预期建立人工养殖绿海龟健康生化指标参考值,为绿海龟的临床和科学研究奠定医学基础。
1 材料与方法 1.1 材料 1.1.1 实验用绿海龟1.5龄海龟幼体:来自上海海洋大学攀世水族宠物健康中心救护并饲养223~251 d的绿海龟(背甲曲线长度为22.1~29.6 cm)27只,性别不明。
2.5龄海龟幼体:来自上海海洋大学攀世水族宠物健康中心救护并饲养223~251天的绿海龟(背甲曲线长度为28.5~35.1 cm)12只,性别不明。
绿海龟成体:来自上海长风海洋世界饲养的绿海龟成体(背甲曲线长度为64.0~70.0 cm)6只,3只雄性,3只雌性,10~20龄。
野生绿海龟:3只均为渔民误捕所得,2只雄性,1只雌性,背甲曲线长度为53 cm、61 cm和48 cm,由上海市渔政监督管理处送上海海洋大学攀世水族宠物健康中心暂养。
1.1.2 海龟的食物与养殖条件每日以龟体质量5%(海龟幼体)和1%~2%(成体)的鱼肉定时投喂。幼龟养殖密度为1只/m3,成龟为0.25只/m3。水温维持在(25±5)℃,海水为天然海水井抽取并过滤的海水,有自制循环过滤系统,海水中NH4+-N与NO2-N均未检出,pH为7.8,DO为(6.02±0.01)mg/L。每周更换50%海水。
1.1.3 绿海龟的健康判定受测人工饲养绿海龟游姿平稳,摄食量稳定,体表及口鼻眼均未有创伤和异样,参考张飞燕等[11]对海龟健康标准判定健康;野生绿海龟参照FLINT等[3]的标准,判定健康。
1.2 方法 1.2.1 血液生化指标检测采样前停食一天,以空腹采血,采用一次性采血针从尾椎静脉和前肢静脉分别抽取血液样本2.5 mL于促凝管中,以5 000 r/min离心5 min分离血清,2 h内进行血液生化检测,使用Beckman AU5800和TNI BECKMAN Access 2对血样进行检测,包括总胆固醇、甘油三酯、碱性磷酸酶、谷丙转氨酶、肌酐、总胆红素和尿酸等17个指标。每隔30天采样一次,连续90 d,共采样3次。以上所有数据采用Microsoft Excel 2013和SPSS 19.0分析软件进行处理分析。
2 结果 2.1 绿海龟前肢静脉和尾静脉血液生化指标采集成体绿海龟前肢和尾静脉血液,进行了心、肝、肾功能相关的生化指标检测。此17项数据根据器官功能划分为4个部分。对两组数据进行配对样本的t检验,结果两组数据无显著差异,证明两个部位采集的血液生化检测结果一致。
2.2 不同年龄绿海龟血液生化指标两组幼体和一组成体海龟3次血液生化指标检测结果如表 1所示,除成体绿海龟的碱性磷酸酶较其他两组有显著差异(P=0.012 5)外,其余16项指标均无显著差异。成体绿海龟的碱性磷酸酶指标明显低于另两组。排除体质量的影响,年龄对绿海龟血液生化指标影响不显著,仅碱性磷酸酶与年龄呈显著负相关(R=-0.93;P=0.010)。

|
表 1 不同年龄绿海龟血浆生化指标比较 Tab.1 The comparison of plasma biochemical indexes between different ages of green turtles |
野生绿海龟血液所检指标见表 2,所测17项指标中6项指标与人工个体差异显著,谷草转氨酶(P=0.002)、白蛋白(P=0.015)和碱性磷酸酶(P=0.010)低于人工个体,谷丙转氨酶(P=0.007 6)、心肌肌钙蛋白I(P=0.001 4)和低密度脂蛋白(P=0.036)高于人工个体,体质量越小差异越明显(R=-0.36;P=0.024)。其余11项指标未有显著差异。

|
表 2 野生与人工绿海龟血浆生化指标比较 Tab.2 The comparison of plasma biochemical indexes between wild and cultured green turtles |
不同性别绿海龟的血液生化指标见表 3,雌性心肌肌钙蛋白I(P=0.022)、肌酸激酶(P=0.038)、肌酐(P=0.048)都较雄性高,而雄性乳酸脱氢酶(P=0.039)和白蛋白(P=0.011)较雌性高。在没有体长因素影响下,绿海龟性别对血液生化指标的影响不显著,只有血清总蛋白与体长呈正相关(R=0.391,P=0.033)。
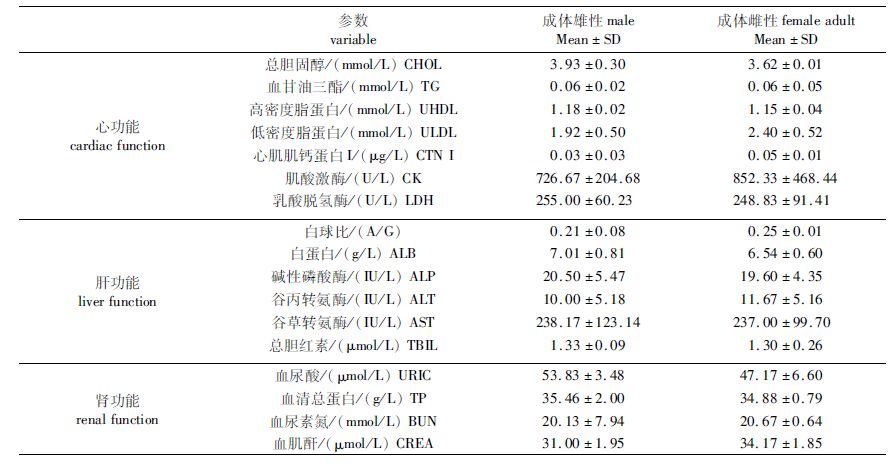
|
表 3 不同性别绿海龟血浆生化指标比较 Tab.3 The comparison of plasma biochemical indexes between different sex of green turtles |
通过对比1.5龄、2.5龄和成体健康绿海龟的血液生化结果和SPSS计算,得出绿海龟健康幼体的血液生化指标范围,见表 4。

|
表 4 健康幼体绿海龟血浆生化指标参考范围 Tab.4 Plasma biochemistry reference intervals (RIs) of healthy young green turtles |
结果表明,同一只绿海龟从前肢静脉和尾静脉采集的血液,生化指标并没有显著差异。该结果虽然有理论基础,但在实际研究中被首次证实。与雷洁[12]研究淡水龟的采血方法得到的结论一致。为了能够更加快速安全地采集目标绿海龟的血液,不同大小的海龟在不同部位采血,稚龟推荐用尾静脉采血,幼体绿海龟可以通过颈静脉、尾静脉和前肢静脉,成龟更适合通过前肢静脉采血,供海龟临床医学技术参考。
3.2 不同年龄对绿海龟血液生化指标的影响本研究结果显示,年龄对绿海龟血液生化指标无显著影响,仅碱性磷酸酶在幼龟中较高,并随着年龄的增长而降低。在禽类[13]和哺乳动物[14]的研究中有提及育龄对碱性磷酸酶的影响,在海龟的研究中尚属首次发现。本研究发现,在稚龟和幼龟期,碱性磷酸酶含量与年龄呈负相关,每一龄的幼龟血清碱性磷酸酶的指标呈线性关系,这一结果有待更多实验进行验证。
本结果为绿海龟的年龄判断提供了新方向,可否通过检测碱性磷酸酶含量而推测绿海龟的年龄,还有待进一步研究。
3.3 人工养殖与野生环境对绿海龟血液生化指标的影响野生绿海龟血液生化指标与人工养殖个体差异显著,所测17项指标中谷草转氨酶等6项指标与人工养殖个体差异显著。本研究结果表明,采用张飞燕等[11]与FLINT等[3]的判断标准仅能够对圈养下绿海龟个体进行健康判断,无法推点及面地评判野生绿海龟的健康状况。ANDERSON等[9]的研究显示绿海龟血清总蛋白含量(34~45 g/L)明显低于HASBUN等[15](47~68 g/L)的结果;白蛋白(13~18 g/L)与HASBUN等[15](12~25 g/L)的相近,却比FLINT等[3]的结果(6.9~17.5 g/L)高;ANDERSON等[9]所得尿素氮指标(26.4~60.0 mmol/L;0.74~1.68 g/L)显著高于HASBUN等[15](0.01~0.42 g/L)和FLINT等[3](0~27.5 mmol/L)。本研究采集了野生绿海龟的血液生化指标,与人工饲养个体进行对比,发现白蛋白、肌酐、尿素氮、谷丙转氨酶、谷草转氨酶等都存在不同,由此推断在不同环境下捕捉到的绿海龟,其血液生化结果不尽相同,很难作为判断健康的标准,人工养殖个体有稳定性佳,采样时应激小等特点,能够更加准确地得到所需血液生化数据,结果更为可靠。
3.4 不同性别对绿海龟血液生化指标的影响本研究结果表明,性别对绿海龟血液生化指标的影响并不明显。雄性的乳酸脱氢酶和总蛋白略高于雌性,雌性的心肌肌钙蛋白、肌酸激酶和血肌酐则较雄性高,这一现象还有待进一步研究。HASBUN等[15]曾对野生绿海龟雌雄个体进行了血液生化研究,雄性肌酸激酶[(702±830.11)U/L]与本研究结果相近,雌性肌酸激酶[(930.67±901.33)U/L]明显高于本研究[(852.33±468.44)U/L]结果;碱性磷酸酶[雄(27.21±9.65)U/L;雌(29.75±16.59)U/L]、乳酸脱氢酶[雄(211.66±139.39)U/L;雌(85.08±39.15)U/L)]、谷草转氨酶[雄(153.5±48.48)U/L;雌(182.35±43.71)U/L)]、总蛋白[雄(57.3±5.5)g/L;雌(63.4±17.0)g/L]等存在较显著差异。BOLTEN[16]等经过研究表示绿海龟雌雄个体血生化差异并不大,而HASBUN[15]等的研究结果表明雌雄个体在多个指标上出现了明显区别。在研究过程中,BOLTEN[16]未对海龟的健康状况进行评定,无法说明研究对象为健康个体。HASBUN等[15]与BOLTEN[16]等的研究出现了矛盾。
3.5 标定人工饲养绿海龟健康幼体血液生化指标参考范围的临床意义目前国内外都未能对人工养殖环境下健康绿海龟的血液生化参数进行系统地分析和标定,对绿海龟健康标准的判断还停留在张飞燕等[11]与FLINT等[3]对绿海龟行为体征的评判,没有更好的判断标准。本研究对养殖幼体绿海龟的心、肝、肾功能的指标进行了系统地分析和标定,补充了心肌肌钙蛋白Ⅰ、高密度脂蛋白、低密度脂蛋白和白球比这几个参数指标,确定了野生绿海龟研究中地域所导致的误差以及年龄、性别对血液生化指标的影响,建立了用血液生化指标来判断绿海龟健康的临床医学技术方法,以此指导养殖过程中的疾病早期诊断和预防,为海龟保育和救护助力。
上海市渔政监督管理处、上海长风海洋世界、上海攀世动物医学科技有限公司对本研究项目大力资助与支持,瑞金医院检验科蔡祺医生对本研究提出了宝贵意见和技术支持,上海海洋大学2011级动物科学专业朱彦洁和王逸参加了部分实验工作,一并感谢!
| [1] | VAN DE MERWE J P, HODGE M, OLSZOWY H A, et al.Using blood samples to estimate persistent organic pollutants and metals in green sea turtles (Chelonia mydas)[J]. Marine Pollution Bulletin, 2010, 60(4): 579–588. |
| [2] | 牟剑锋, 陶翠花, 丁晓辉, 等.中国沿岸海域海龟的种类和分布的初步调查[J]. 应用海洋学学报, 2013, 32(2): 238–242. MOU J F, TAO C H, DING X H, et al.Investigations on the distribution of sea turtle species in the coastal waters of China[J]. Journal of Applied Oceanography, 2013, 32(2): 238–242. |
| [3] | FLINT M, MORTON J M, LIMPUS C J, et al.Development and application of biochemical and haematological reference intervals to identify unhealthy green sea turtles (Chelonia mydas)[J]. The Veterinary Journal, 2010, 185(3): 299–304. |
| [4] | LU Y N, AGUIRRE A, WORK T M, et al.Identification of a small, naked virus in tumor-like aggregates in cell lines derived from a green turtle, Chelonia mydas, with fibropapillomas[J]. Journal of Virological Methods, 2000, 86(1): 25–33. |
| [5] | 甘文强, 张晓雁, 乔健, 等.绿海龟消化道组织学观察[J]. 中国兽医杂志, 2011, 47(11): 23–25. GAN W Q, ZHANG X Y, QIAO J, et al.Histological observation of the digestive rrack of green turtle (Chelonia mydas)[J]. Chinese Journal of Veterinary Medicine, 2011, 47(11): 23–25. |
| [6] | 李长玲, 曹伏君, 黄翔鹄, 等.绿海龟(Chelonia mydas)血细胞发育过程的观察[J]. 海洋与湖沼, 2009, 40(4): 451–459. LI C L, CAO F J, HUANG X H, et al.Observation on the development of blood cells of Chelonla mydas[J]. Oceanologia et limnologia sinica, 2009, 40(4): 451–459. |
| [7] | 陶翠花, 刘莹莹, 赵丽媛, 等.绿海龟α-actin基因的cDNA克隆与序列分析[J]. 海洋科学, 2014, 38(3): 98–103. TAO C H, LIU Y Y, ZHAO L Y, et al.Cloning and sequence analysis of full-length cDNA of α-actin gene from Chelonia mydas[J]. Marine Sciences, 2014, 38(3): 98–103. |
| [8] | LEWBART G A, HIRSCHFELD M, DENKINGER J, et al.Blood gases, biochemistry, and hematology of Galapagos green turtles (Chelonia mydas)[J]. PLoS One, 2014, 9(5): e96487. |
| [9] | ANDERSON E T, MINTER L J, CLARKE Ⅲ E O, et al.The effects of feeding on hematological and plasma biochemical profiles in green (Chelonia mydas) and Kemp's ridley (Lepidochelys kempii) sea turtles[J]. Veterinary Medicine International, 2011: 890829. |
| [10] | SWARTHOUT R F, KELLER J M, PEDEN-ADAMS M, et al.Organohalogen contaminants in blood of Kemp's ridley (Lepidochelys kempii) and green sea turtles (Chelonia mydas) from the Gulf of Mexico[J]. Chemosphere, 2010, 78(6): 731–741. |
| [11] | 张飞燕, 古河祥, 陈华灵, 等.玳瑁和绿海龟幼体外周血细胞的观察与比较[J]. 动物学杂志, 2009, 44(6): 113–121. ZHANG F Y, GU H X, CHEN H L, et al.Blood cells morphology and hematology of Eretmochelys imbricata and Chelonia mydas[J]. Chinese Journal of Zoology, 2009, 44(6): 113–121. |
| [12] | 雷洁. 巴西龟急性中毒和菱斑龟肝病组织病理研究[D]. 上海: 上海海洋大学, 2012. LEI J. Histopathological Study of toxicosis in Trachemys scripta and hepatopathy in Malaclemys terrapin[D]. Shanghai: Shanghai Ocean University, 2012. |
| [13] | 杨伟平, 鄢珣, 藏大存.不同品种鸭血清碱性磷酸酶活力与生长性能的关系研究[J]. 安徽农业科学, 2010, 38(16): 8453–8454. YANG W P, YAN X, ZANG D C.Relationship between serum alkaline phosphatase activity and growth performance in different duck breeds[J]. Journal of Anhui Agricultural Sciences, 2010, 38(16): 8453–8454. |
| [14] | 王秉栋, 经荣斌.猪血清碱性磷酸酶与骨骼生长的关系[J]. 中国畜牧杂志, 1984: 2–3. WANG B D, JING R B.Relationship between serum alkaline phosphatase and bone growth in pig[J]. Chinese Journal of Animal Science, 1984: 2–3. |
| [15] | HASBUN C R, LAWRENCE A J, NALDO J, et al.Normal blood chemistry of free-living green sea turtles,Chelonia mydas, from the United Arab Emirates[J]. Comparative Haematology International, 1998, 8(3): 174–177. |
| [16] | BOLTEN A B, BJORNDAL K A.Blood profiles for a wild population of green sea turtles (Chelonia mydas) in the southern Bahamas: size-specific and sex-specific relationships[J]. Journal of Wildlife Diseases, 1992, 28(3): 407–413. |
 2016,
Vol. 25
2016,
Vol. 25


