2. 上海海洋大学 水产与生命学院, 上海 201306
谷氨酰胺合成酶(glutamine synthetase,GS)广泛存在于动植物细胞中,在甲壳动物氨氮代谢过程中发挥着重要作用[1]。谷氨酰胺合成酶通过将体内过多的氨和谷氨酸转换成谷氨酰胺,降低体内氨氮的浓度,达到解毒代谢的目的。谷氨酰胺是一种中性无毒物质,容易穿透细胞膜,是氨的主要运输方式。排氨动物体内的氨主要是经谷氨酰胺运送到排泄部位,如鳃等,再经鳃内谷氨酰胺酶的分解,借助扩散作用排出体外[2]。
谷氨酰胺合成酶(GS)主要有3种亚型,只有GSⅡ型以真核生物为主要族群[3]。到目前为止,关于GS基因的克隆与功能研究主要集中在脊椎动物,比如在仓鼠(Chinese hamster)[4]、鸡[5]以及人类[6]中都曾有过报道,但在无脊椎动物特别是甲壳动物中研究还比较少。JAMIESON等研究发现,GS在环节动物E. japonensis的原肾管和胆管细胞中均有表达,这与E. japonensis氮代谢产物的排泄有关[1]。目前已从昆虫,如埃及斑蚊(Aedes aegypti)[7]沙蝇(Lutzomyia longipalpis)[8]、果蝇幼虫[9]和成虫[10],昆虫神经系统和肌肉[11]、脂肪体、中肠、马氏管[12]、丝线[13]中发现GS存在;在蚊子的中肠上皮细胞、卵巢、脂肪体中[14]也有发现。在甲壳类动物,如小龙虾(Procambarus clarkiai)[15]、太平洋牡砺(Crassostrea gigas)[16]中也发现了GS的存在,而且甲壳动物的神经组织中GS的表达也己有报道[17-19]。但是到目前为止,对虾中GS基因的克隆也仅见于中国明对虾(Fenneropenaeus chinensis)[3]与凡纳滨对虾(Litopenaeus vannamei)[20],斑节对虾(Penaeus monodon)中GS基因还未见报道。氨氮是水产养殖环境中普遍存在的一种有毒物质,是一种重要的水质指标,其含量高低也是引发病害的一个重要因素。有研究表明,氨氮对甲壳动物机体的免疫系统、生长发育、组织损伤、渗透调节、代谢等都有重要影响[21-24]。但目前我们对斑节对虾氨氮胁迫的应答和氨氮代谢功能的研究尚不够深入,对于其氨氮解毒代谢途径中起到调控作用的关键酶及其基因的研究仍较为缺乏[2]。本研究通过RACE技术克隆得到了谷氨酰胺合成酶基因的cDNA序列全长,分析了其组织表达分布,并对其在氨氮胁迫过程中在斑节对虾肝胰腺与鳃组织内各时间点的表达变化规律进行了分析,希望能为斑节对虾氨氮胁迫应答以及体内氨氮代谢分子调控机理的解析提供一定的基础数据,并为斑节对虾健康养殖的发展提供科学依据。
1 材料与方法 1.1 实验材料实验所用的斑节对虾养殖于南海水产研究所深圳基地。选取体长13~14 cm,体质量为35~40 g的亚成虾用于肝胰腺、脑神经、眼柄神经、肌肉、胃、肠、鳃、淋巴、胸神经和卵巢组织的取样,选取体长6~7 cm,体质量3~4 g的幼虾用于氨氮胁迫实验。取样前分别于27~30 ℃充气的自然海水中暂养3 d,所取组织均用RNA Later(Ambion)保存。
1.2 总RNA 的提取及cDNA 第一链的合成总RNA的提取按照Trizol Reagent(invitrogen)的操作说明书进行操作,提取斑节对虾上述各组织以及氨氮胁迫各时间点样品的总RNA。用于RACE的样品为肌肉、肝胰腺的混合样品。提取的RNA用NanoDrop 2000/2000c分光光度计测定纯度及浓度,通过琼脂糖凝胶电泳确定其完整度。
用于做RACE 的样品为肝胰腺组织与肌肉组织的混合样,按照PrimeScriptⅡ 1stStrand cDNA Synthesis Kit的操作说明书进行反转录。其他进行荧光定量的样品依照PrimeScript RT reagent Kit With gDNA Eraser(Perfect Real-time)(TaKaRa)的使用说明进行反转录。模板为500 ng的总RNA,所得cDNA用β-actin 引物检测后稀释10倍,-80 ℃保存备用。
1.3 斑节对虾谷氨酰胺合成酶基因的cDNA克隆及序列分析对本实验室构建的斑节对虾cDNA文库中的EST序列进行BLAST分析之后,发现其中有一条633 bp的EST序列与中国明对虾谷氨酰胺合成酶序列高度同源(92%)。然后用Primer 5.0软件设计特异性引物,利用RACE技术获得谷氨酰胺合成酶基因的cDNA全长。所用引物见表 1。

|
表 1 实验中所用引物序列 Tab.1 Oligonuleotide primers used in experiments |
利用Emboss(http://emboss.bioinformatics.nl/)软件预测氨基酸序列;用ProtParam软件对推导出的蛋白序列进行蛋白理化特性预测(http://web.expasy.org/protparam/);通过SMART 4.0(http://smart.embl-heidelberg.de/smart/set_mode.cgi?GENOMIC=1)进行蛋白结构域分析;信号肽预测用SingalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)程序;糖基化位点预测利用NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/);磷酸化位点预测用NetPhos(http://www.cbs.dtu.dk/services/NetPhos/);用NCBI中的Blast程序(http://www.ncbi.nlm.nih.gov)搜索用于谷氨酰胺合成酶同源性和相似性分析与系统树构建的氨基酸序列;多重序列比对采用Clustal X程序;利用Clustal X程序和MEGA 6.0软件,构建NJ系统进化树;利用GOR方法(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)进行二级结构预测,三维结构预测采用SWISS-MODEL软件。
1.4 斑节对虾PmGS基因的表达分析 1.4.1 斑节对虾PmGS基因组织表达分析取3尾体长13~14 cm雌虾进行肝胰腺、脑神经、眼柄神经、肌肉、胃、肠、鳃、淋巴、胸神经和卵巢组织的取样(每个样品约10mg),同种组织样品混合均匀,所取组织均用RNA Later(Ambion)保存,用于斑节对虾PmGS基因组织表达分析。
根据斑节对虾谷氨酰胺合成酶基因的全长序列设计荧光定量PCR引物GHD-F和GHD-R(表 1),选β-actin为内参基因(表 1)。以斑节对虾的不同组织(眼柄神经、脑组织、淋巴、肝胰腺、胃、肠、鳃、肌肉、卵巢和胸神经)以及氨氮胁迫各时间的cDNA为模板进行荧光定量RT-PCR扩增。反应体系为10 μL,包括5 μL SYBR Premix Ex Taq(Tli RnaseH Plus)(TaKaRa),0.2 μL引物(10 μmol/L),1.5 μL模板,双蒸水补足10 μL,并以蒸馏水代替模板设置阴性对照,每个样品设3个重复,反应程序为95 ℃预变性30 s;95 ℃变性20 s,60 ℃退火5 s,45个循环;65 ℃延伸15 s;溶解温度从55 ℃升至97 ℃;37 ℃冷却5 min。实验数据采用相对CT法(2-ΔΔCT法)进行谷氨酰胺合成酶mRNA的表达量计算。
1.4.2 斑节对虾PmGS基因氨氮胁迫后的表达分析氨氮胁迫实验于南海水产研究所深圳养殖基地进行,选取标粗池中的6~7 cm的幼虾为实验材料。正式实验开始之前先进行预实验,以确定本次实验所使用的氨氮胁迫浓度。本次预实验共设计6个氨氮浓度梯度,分别是 0、40、80、100、120、140 mg/L。每个浓度梯度一个泡沫箱,每个泡沫箱放 20 L海水,30尾虾。预实验所用的虾都是在混合家系的水泥池中捞取,挑选大小均匀的180尾幼虾随机分布于6个泡沫箱中。96 h 实验期间每隔2小时统计一次每个梯度的死亡数量,捞取死虾。预实验期间不投喂任何饵料。96 h 实验结束后,通过直线内插法[25]算出半致死浓度(LC50)为90 mg/L,并通过公式求出其安全浓度(SC)[26],为9 mg/L。
正式实验共设计3组,分别是高浓度胁迫组,胁迫浓度为半致死浓度90 mg/L;低浓度胁迫组,胁迫浓度为安全浓度9 mg/L;对照组,使用养殖用的海水。每一组都设3个平行,每个平行一个泡沫箱。通过向实验用水中添加氯化铵(分析纯)的方式来控制氨氮浓度,每12 小时换一次实验用水,每次全部换掉,与预实验相同,每个泡沫箱加入20 L海水,放30尾虾,温度为(29.0±1.5)℃,pH为7.0±0.5,盐度为30±0.5。每隔两小时统计一次每个泡沫箱的死亡数据,捞取死虾;分别于胁迫时间 6、12、24、36、48、72和96 h共7个时间点进行取样,每次取样在每个泡沫箱中各选取两条活力较好的个体取其肝胰腺与鳃组织分别混合均匀保存于RNA Later(Ambion)中。
按照前述方法分别提取氨氮胁迫后各个时间点斑节对虾肝胰腺和鳃的总RNA,按照上述方法逆转录合成cDNA。取各个稀释后的cDNA样品为模板,β-actin为内参进行定量表达检测。反应体系,反应程序,数据处理方法同上组织表达。
1.5 统计学分析运用统计学软件 SPSS 18.0 进行相对独立的单因素方差分析(ANOVA),并进行Duncan’s多重比较分析各组织间的差异显著性(P< 0.05为差异显著)。结果表示为平均值±标准差(X±SD)。
2 结果 2.1 斑节对虾谷氨酰胺合成酶cDNA的克隆及序列分析通过克隆得到斑节对虾谷氨酰胺合成酶cDNA全长,命名为PmGS(GenBank登录号:KP984792)。PmGS cDNA全长1 420 bp,开放阅读框(ORF)长度1 086 bp,3′非编码区(UTR)为294 bp,含有27个碱基的poly(A)尾,5′非编码区(UTR)为40 bp。ORF可编码361个氨基酸,预测分子量为40.423 ku,理论等电点为6.19。序列含有一个谷氨酰胺结合结构域(Gln-synt_C),位于107~356aa,8个磷酸化位点,2个糖基化位点(图 1)。

|
图 1 斑节对虾GS基因的cDNA全长序列及推导的氨基酸序列
Fig. 1 Nucleotide and amino acid sequences of Penaeus monodon GS
两边每行标注的序号是指核苷酸和氨基酸的位置;起始密码子(ATG)和终止密码子(TAA)用下划线标出;字体加粗标注为磷酸化位点;灰色阴影标注为糖基化位点;poly(A)尾巴用斜体字标出;方框所示为谷氨酰胺结合结构域。 The serial number on both sides of each row refers to the location of the nucleotide and amino acid; start codon (ATG) and termination codon (TAA) is underlined; eight phosphorylation sites are highlighted in bold; shadow area indicate the glycosylation site; the poly (a) signal is marked in italics; Gln structural domain is shown in the box. |
利用GOR法对PmGS蛋白质二级结构预测后发现,整条氨基酸序列的二级结构由α螺旋与无规则卷曲构成,其中包含61个α螺旋,占16.90%,无β折叠。SWISS-MODEL结果显示,PmGS的三维结构由α螺旋以及连接的无规则卷曲构成,蛋白结构呈圆盘状。并且,PmGS的三维结构与人类的GS的三维结构较相近,同源性达到69.01%(图 2)。

|
图 2 斑节对虾GS蛋白与人类GS蛋白三维结构空间示意图
Fig. 2 The three-dimensional ribbon structure of PmGS protein and Homo sapiens GS
|
斑节对虾GS基因的全长序列经BLAST比对分析发现与其他生物的GS基因具有较高的同源性。从NCBI上检索其他物种的GS氨基酸序列并利用Clustal-X软件对其氨基酸序列进行多重序列比对分析。结果表明:不同物种间的GS序列较为保守,其中,PmGS与中国明对虾(Fenneropenaeus chinensis)同源性最高达到99%,其次是凡纳滨对虾(Litopenaeus vannamei),一致性也达到了93%,与沙漠蝗(Schistocerca gregaria)和黑腹果蝇(Drosophila melanogaster)的相似度分别为72%与71%,与小鼠(Mus musculus)、原鸡(Gallus gallus)和鲤(Cyprinus carpio)的相似度都为70%,与牛(Bos Taurus)和野猪(Sus scrofa)的相似度为69%,与人(Homo sapiens)的同源性为68%(图 3)。

|
图 3 PmGS 的氨基酸序列与其他物种GS的氨基酸多重序列比对
Fig. 3 Multiple alignment of the predicted amino acid sequence of PmGS with other eukaryote GS amino acid sequences
|
利用MEGA 6.0软件,采用NJ法构建了PmGS及其他物种的GS基因的系统进化树(图 4)。从系统树可以看出,无脊椎动物与脊椎动物的谷氨酰胺合成酶明显被区分开来。其中,斑节对虾的GS基因先与中国明对虾的GS基因聚为一支后又与凡纳滨对虾的GS基因聚在一起,最后与其他节肢动物聚合。
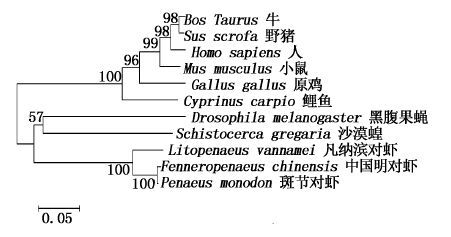
|
图 4 利用MEGA 6.0软件构建的基于PmGS基因所编码氨基酸序列的NJ系统进化树
Fig. 4 NJ phylogenetic tree based on PmGS amino acid sequences by MEGA 6.0
Bos Taurus (牛:NP_001035564.1);Sus scrofa (野猪:NP_999074.1);Homo sapiens (人:AAB30693.1);Mus musculus (小鼠:NP_032157.2);Gallus gallus (原鸡:AAC69361.1);Cyprinus carpio (鲤:AGN52748.1);Drosophila melanogaster (黑腹果蝇:NP_001285122.1);Schistocerca gregaria (沙漠蝗:AEV89758.1);Litopenaeus vannamei (凡纳滨对虾:AEO80035.1);Fenneropenaeus chinensis (中国明对虾:ACB59229.1)。 |
选择β-actin作为参照,利用实时荧光定量PCR技术对GS基因在斑节对虾各组织中以及在氨氮胁迫过程中肝胰脏与鳃组织中的表达进行检测。PmGS在各组织的表达情况如图 5所示,可以看出,PmGS在斑节对虾的脑组织、眼柄神经、鳃组织、淋巴、肝胰腺、胃、胸神经、肠组织、肌肉和卵巢中均有表达,其中淋巴中表达量最高,其次在鳃组织,肠组织,以及肝胰脏中表达量都较高,而在卵巢与胸神经中的表达量最低(图 5)。

|
图 5 斑节对虾GS基因在各组织中表达的情况
Fig. 5 The expression of Penaeus monodon GS in different tissues
L.淋巴; G.鳃; I.肠; HE.肝胰脏; E.眼柄神经; B.脑; M.肌肉; S.胃; O.卵巢; TG.胸神经; 图中数值为平均值±标准差(X±SD),小写字母不同表示差异性显著(P< 0.05)。 L.lymph; G.gill; I.intestines; HE.hepatopancreas; E.eyestalk nerve; B.brain; M.muscle; S.stomach; O.ovary; TG.thoracic ganglia; Values (expressed as mean±SD) with different letters are significantly different from each other (P< 0.05). |
通过RT-PCR检测,在不同浓度氨氮胁迫过程中斑节对虾GS基因在肝胰腺中表达的变化趋势如图 6所示。结果表明,高浓度胁迫组与低浓度胁迫组的表达趋势有所不同。高浓度胁迫组中GS基因反应比较迅速,表达量在6 h就迅速上调,显著高于对照组(P< 0.05);之后在12~24 h期间又有所下降;在48~96 h时间段内又迅速上升并于72 h时到达峰值,显著高于对照组(P< 0.05);72 h后再次下降,但是仍显著高于对照组(P< 0.05)。低浓度组于6~12 h时开始表达上调,并于12 h到达最大值,显著高于对照组(P< 0.05),之后开始下降并趋于稳定,接近正常值(图 6)。
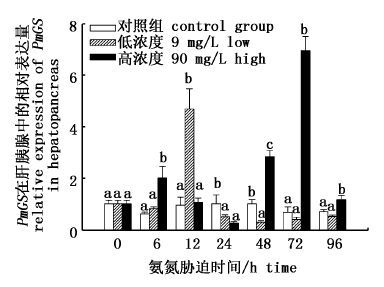
|
图 6 斑节对虾肝胰腺中PmGS基因在氨氮胁迫过程中表达变化情况
Fig. 6 Expression profiles of PmGS gene in Penaeus monodon hepatopancreas during ambient ammonia stresses
图中数值为平均值±标准差(X±SD),同一时间内小写字母不同表示实验组与对照组差异性显著(P< 0.05)。 Values (expressed as mean±SD) with different letters at the same time are significantly different with the control group(P< 0.05). |
在不同浓度氨氮胁迫过程中斑节对虾GS基因在鳃组织中表达的变化趋势如图 7所示。高浓度组与低浓度组几乎呈现同样的趋势,在胁迫过程中GS基因的表达明显被抑制,两组都呈下降趋势。特别是高浓度组,在6~24 h急剧下降,6 h后都显著低于对照组(P< 0.05);低浓度组是在0~12 h时快速下降,在12 h到达最低点,显著低于对照组(P< 0.05);在12 h后逐渐趋于稳定,但是仍显著低于对照组(P< 0.05,图 7)。

|
图 7 斑节对虾鳃组织中PmGS基因在氨氮胁迫过程中表达变化情况
Fig. 7 Expression profiles of PmGS gene in Penaeus monodon gill during ambient ammonia stresses
图中数值为平均值±标准差(X±SD),同一时间内小写字母不同表示实验组与对照组差异性显著(P< 0.05)。 Values (expressed as mean±SD) with different letters at the same time are significantly different with the control group(P< 0.05). |
谷氨酰胺在氨基酸代谢过程中扮演重要的角色,其主要参与谷氨酸分解与合成过程,是氨基酸代谢循环重要的中间转换物质。谷氨酰胺主要由谷氨酸和NH4+经谷氨酰胺合成酶催化合成[27],由此可见谷氨酰胺合成酶是谷氨酰胺合成途径必不可少的关键酶,在机体氨基酸代谢过程中具有重要作用。然而到目前为止对斑节对虾GS基因的研究仍属空白。本研究首次克隆了斑节对虾谷氨酰胺合成酶PmGS 基因,经BLAST发现,该蛋白极为保守,与其他物种的谷氨酰胺合成酶GS一样,具有一个C端结构域,谷氨酰胺结合结构域(Gln-synt_C),位于107~356aa[3, 20]。PmGS与其他物种的GS氨基酸序列比对发现,斑节对虾GS与其他物种的GS序列均具有较高的同源性,说明GS在种间是保守的。系统进化分析表明斑节对虾首先与中国明对虾聚为一支,同源性高达99%,然后又与凡纳滨对虾聚合,其同源性也达到了93%。上述结果表明,该序列是斑节对虾GS基因。
斑节对虾GS基因在各组织中广泛表达,其表达分布趋势与凡纳滨对虾GS基因相类似[20]。其中在淋巴组织中表达量最高,这可能与淋巴是甲壳动物主要免疫与渗透调节器官有关。已有研究表明,谷氨酰胺合成酶可能通过间接的方式参与免疫防御抵抗病原微生物感染,可增强水生动物免疫防御机能和抗病力[3, 28]。除了淋巴组织,PmGS在鳃组织中表达量也很高,可能与其是大多数水生甲壳动物氨氮排泄器官有关[29]。已有的研究表明水生甲壳动物氨基酸的α-氨基形成的氨,主要经过谷氨酰胺的形式运送到排泄部位鳃之后,经鳃内谷氨酰胺酶的分解,游离的氨便可借助扩散作用排出体外[30]。除此之外,PmGS在肠组织中的表达量也很高。已有研究表明,谷氨酰胺可促进水生动物肠上皮细胞的增殖分化[31]与肠上皮细胞雷帕霉素靶蛋白基因的表达,提高细胞蛋白质合成能力[32]和肠黏膜蛋白质合成量[33],并能提高肠上皮细胞的抗氧化能力[34],因此,推断PmGS在斑节对虾肠组织也有类似功能。
甲壳动物为排氨动物,体内氨氮可以通过尿素和尿酸排出体外[35-36]。某些甲壳动物在氨氮胁迫条件下,可通过肝胰腺和鳃组织合成谷氨酰胺以降低体内氨氮浓度,减轻外界高氨环境对组织器官造成的损伤[27, 37-38]。为了研究谷氨酰胺合成酶(GS)在斑节对虾氨氮解毒代谢中的作用,本研究分析了在不同浓度氨氮胁迫过程中斑节对虾GS基因在肝胰腺与鳃组织中表达变化趋势,结果表明在不同浓度氨氮胁迫下,PmGS在肝胰腺中的表达量均有不同程度的上调,且与对照组差异显著。肝胰腺是甲壳动物的主要代谢器官,其中含有大量的酶与蛋白质,而GS参与细胞内多种酶活动,包括氨基酸代谢、谷氨酰胺合成、细胞信号以及神经递质谷氨酸的循环等[2]。本研究的实验结果表明肝胰腺中PmGS基因对于氨氮的刺激反应十分迅速,高浓度组在6 h时就到达第一个峰值,可以推断肝胰腺可能是谷氨酰胺合成酶储存和释放的主要器官以及氨氮解毒代谢场所。此外,PmGS表达量在不同时间点达到峰值,并且高浓度组上调速度与幅度明显大于低浓度组。这一结果表明,在一定范围内,随着氨氮胁迫浓度的提高,PmGS在肝胰腺中的表达也相应地上调。
鳃是大多数水生甲壳动物氨氮排泄器官[30]。与在肝胰腺中不同,不同浓度氨氮胁迫条件下,PmGS在鳃组织中的表达量都呈下降趋势,且高浓度组尤为明显。低浓度组在开始胁迫后就开始下降,在12 h到达最低点并显著低于对照组,之后有所回升并趋于稳定;而高浓度组在12 h后开始几乎一直处于下降趋势,并且出现较大波动,于96 h降到最低点。氨氮胁迫条件下,PmGS在鳃组织中的表达受到抑制,并且氨氮浓度越高抑制作用越明显。推测可能是由于在氨氮胁迫条件下,斑节对虾的鳃组织遭到了破坏,导致PmGS基因在鳃组织中表达下调。已有研究表明,拟穴青蟹(Scylla paramamosain)的鳃组织在氨氮胁迫下会受到氧化损伤,鳃上皮细胞结构受损,并且随着氨氮浓度的升高这种损伤也相应加重[39]。
| [1] | JAMIESON B G M.The ultrastructure of the oligochaeta[M].London: Academic Press Inc. Ltd, 1981. |
| [2] | 李少飞. 中国对虾氨氮代谢酶基因的cDNA克隆及其在氨氮解毒代谢过程中的作用[D]. 大连: 大连海洋大学, 2014. LI S F. cDNA cloning and expression analysis of the enzyme genes related to ammonia metabolism in Fenneropenaeus chinensis and study on effect of these enzymes in the detoxification of ammonia following ambient ammonia stresses[D]. Dalian: Dalian Ocean University, 2014. |
| [3] | 贾玉萍. 中国明对虾SWD抗菌肽, 谷氨酰胺合成酶和Ras基因的表达与功能研究[D]. 济南: 山东大学, 2008. JIA Y P. Expressing and functional analysis of SWD antimicrobial peptide, glutamine synthetase and ras in Chinese shrimp Fenneropenaeus chinensis[D]. Ji'nan: Shandong University, 2008. |
| [4] | HAYWARD B E, HUSSAIN A, WILSON R H, et al.The cloning and nucleotide sequence of cDNA for an amplified glutamine synthetase gene from the Chinese hamster[J]. Nucleic Acids Research, 1986, 14(2): 999–1008. |
| [5] | HAIFENG P, YOUNG A P.The structure of the chicken glutamine synthetase-encoding gene[J]. Gene, 1989, 81(1): 169–175. |
| [6] | GIBBS C S, CAMPBELL K E, WILSON R H.Sequence of a human glutamine synthetase cDNA[J]. Nucleic Acids Research, 1987, 15(15): 6293. |
| [7] | SMARTT C T, CHILES J, LOWENBERGER C, et al.Biochemical analysis of a blood meal-induced Aedes aegypti glutamine synthetase gene[J]. Insect Biochemistry and Molecular Biology, 1998, 28(12): 935–945. |
| [8] | RAMALHO-ORTIGÃO J M, TEMPORAL P, DE OLIVEIRA S M P, et al.Characterization of constitutive and putative differentially expressed mRNAs by means of expressed sequence tags, differential display reverse transcriptase-PCR and randomly amplified polymorphic DNA-PCR from the sand fly vector Lutzomyia longipalpis[J]. Memórias do Instituto Oswaldo Cruz, 2001, 96(1): 105–111. |
| [9] | CAIZZI R, RITOSSA F.The enzyme glutamine synthetase I of Drosophila melanogaster is associated with a modified RNA[J]. Biochemical Genetics, 1983, 21(3/4): 267–285. |
| [10] | DE PINTO V, CAGGESE C, PREZIOSO G, et al.Purification of the glutamine synthetase Ⅱ isozyme of Drosophila melanogaster and structural and functional comparison of glutamine synthetases I and Ⅱ[J]. Biochemical Genetics, 1987, 25(11/12): 821–836. |
| [11] | BOTHAM R P, BEADLE D J, HART R J, et al.Synaptic vesicle depletion and glutamate uptake in a nerve-muscle preparation of the locust, Locusta migratoria L[J]. Experientia, 1978, 34(2): 209–210. |
| [12] | LEVENBOOK L, KUHN J.Properties and distribution of glutamine synthetase in the southern armyworm, Prodenia eridania[J]. Biochimica et Biophysica Acta, 1962, 65(2): 219–232. |
| [13] | HIRAYAMA C, KONNO K, SHINBO H.Utilization of ammonia as a nitrogen source in the silkworm, Bombyx mori[J]. Journal of Insect Physiology, 1996, 42(10): 983–988. |
| [14] | SMARTT C T, KILEY L M, HILLYER J F, et al.Aedes aegypti glutamine synthetase: expression and gene structure[J]. Gene, 2001, 274(1/2): 35–45. |
| [15] | MCKINNON E, HARGITTAI P T, GROSSFELD R M, et al.Glutamine cycle enzymes in the crayfish giant nerve fiber: implications for axon-to-glia signaling[J]. Glia, 1995, 14(3): 198–208. |
| [16] | TANGUY A, BOUTET I, MORAGA D.Molecular characterization of the glutamine synthetase gene in the Pacific oyster Crassostrea gigas: expression study in response to xenobiotic exposure and developmental stage[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 2005, 1681(2/3): 116–125. |
| [17] | LINSER P J, TRAPIDO-ROSENTHAL H G, ORONA E.Glutamine synthetase is a glial-specific marker in the olfactory regions of the lobster (Panulirus argus) nervous system[J]. Glia, 1997, 20(4): 275–283. |
| [18] | ALLODI S, BRESSAN C M, CARVALHO S L, et al.Regionally specific distribution of the binding of anti-glutamine synthetase and anti-S100 antibodies and of Datura stramonium lectin in glial domains of the optic lobe of the giant prawn[J]. Glia, 2006, 53(6): 612–620. |
| [19] | SULLIVAN J M, BENTON J L, SANDEMAN D C, et al.Adult neurogenesis: a common strategy across diverse species[J]. Journal of Comparative Neurology, 2007, 500(3): 574–584. |
| [20] | 孙武卫. 低盐胁迫下凡纳滨对虾消减cDNA文库构建及谷氨酰胺合成酶cDNA克隆和表达[D]. 湛江: 广东海洋大学, 2012. SUN W W. Construction of a SSH cDNA library, cDNA cloning and expresslon of glutamine synthetase In litopenaeus vannamei, Boone induced by hypo-osmotic stress[D]. Zhanjiang: Guangdong Ocean University, 2012. |
| [21] | CHEN J C, CHEN C T.Changes of osmotic and electrolyte concentrations in the haemolymph of Penaeus japonicus exposed to ambient ammonia[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1996, 114(1): 35–38. |
| [22] | 黄建华, 李永, 杨其彬, 等.斑节对虾家系氨氮耐受性的比较[J]. 南方水产科学, 2012, 8(6): 37–43. HUANG J H, LI Y, YANG Q B, et al.Comparison of tolerance to ammonia-N in Penaeus monodon families[J]. South China Fisheries Science, 2012, 8(6): 37–43. |
| [23] | CHENG W, CHEN J C.The virulence of Enterococcus to freshwater prawn Macrobrachium rosenbergii and its immune resistance under ammonia stress[J]. Fish & Shellfish Immunology, 2002, 12(2): 97–109. |
| [24] | 王娟, 曲克明, 刘海英, 等.不同溶氧条件下亚硝酸盐和氨氮对中国对虾的急性毒性效应[J]. 海洋水产研究, 2008, 28(6): 1–6. WANG J, QU K M, LIU H Y, et al.Acute toxic effects of nitrite and non-ion ammonia on Fenneropenaeus chinensis at different dissolved oxygen levels[J]. Marine Fisheries Research, 2008, 28(6): 1–6. |
| [25] | 郑微云, 翁恩琪.环境毒理学概论[M].厦门: 厦门大学出版社, 1993. ZHENG W Y, WENG E Q.Introduction to environmental toxicology[M].Xiamen: Xiamen University Press, 1993. |
| [26] | ZANG W L, XU X C, DAI X L, et al.Toxic effects of Zn2+, Cu2+, Cd2+ and NH3 on cfflnese prawn[J]. Chinese Journal of Oceanology and Limnology, 1993: 254–259. |
| [27] | HONG M L, CHEN L Q, SUN X J, et al.Metabolic and immune responses in Chinese mitten-handed crab (Eriocheir sinensis) juveniles exposed to elevated ambient ammonia[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2007, 145(3): 363–369. |
| [28] | 杜宗君, 刘扬, 姜俊.谷氨酰胺与水产动物免疫防御机能的关系[J]. 水产科学, 2011, 30(12): 794–796. DU Z J, LIU Y, JIANG J.Relationship between glutamine and immune defense functions of aquatic animals: a review[J]. Fisheries Science, 2011, 30(12): 794–796. |
| [29] | 刘胜男, 潘鲁青, 刘茂琪.氨氮胁迫对三疣梭子蟹解毒代谢关键基因表达的影响[J]. 海洋湖沼通报, 2015: 97–104. LIU S N, PAN L Q, LIU M Q.Effects of ammonia exposure on key detoxification metabolism associated genes expression in swimming crab Portunus Trituberculatus[J]. Transactions of Oceanology and Limnology, 2015: 97–104. |
| [30] | 李永. 斑节对虾人工选育及氨氮对其免疫、解毒代谢影响[D]. 上海: 上海海洋大学, 2012. LI Y. Artificial selection of Penaeus monodon and impacts of ammonia-N on immune parameters, detoxification[D]. Shanghai: Shanghai Ocean University, 2012. |
| [31] | JIANG J, ZHENG T, ZHOU X Q, et al.Influence of glutamine and vitamin E on growth and antioxidant capacity of fish enterocytes[J]. Aquaculture Nutrition, 2009, 15(4): 409–414. |
| [32] | 姜俊. 鲤鱼IECs GLS和TOR基因cDNA克隆及Gln对IECs蛋白合成的影响和机理研究[D]. 雅安: 四川农业大学, 2009. JIANG J. Carp Cyprinus carpio IECs GLS and TOR gene cDNA clone and Gln to IECs protein synthesis influence and mechanism research[D]. Ya'an: Sichuan Agricultural University, 2009. |
| [33] | 叶元土, 王永玲, 蔡春芳, 等.谷氨酰胺对草鱼肠道L-亮氨酸, L-脯氨酸吸收及肠道蛋白质合成的影响[J]. 动物营养学报, 2007, 19(1): 28–32. YE Y T, WANG Y L, CAI C F, et al.Effects of the L-glutamine on the absorption of L-leucine, L-proline and the protein synthesis in intestine of grass carp (Ctenopharyngodon Idellus) in vitro[J]. Chinese Journal of Animal Nutrition, 2007, 19(1): 28–32. |
| [34] | CHEN J, ZHOU X Q, FENG L, et al.Effects of glutamine on hydrogen peroxide-induced oxidative damage in intestinal epithelial cells of Jian carp (Cyprinus carpio var. Jian[J]. Aquaculture, 2009, 288(3/4): 285–289. |
| [35] | REGNAULT M.Nitrogen excretion in marine and fresh-water crustacea[J]. Biological Reviews, 1987, 62(1): 1–24. |
| [36] | WEIHRAUCH D, MORRIS S, TOWLE D W.Ammonia excretion in aquatic and terrestrial crabs[J]. Journal of Experimental Biology, 2004, 207(26): 4491–4504. |
| [37] | CHEN J M, CHEN J C.Study on the free amino acid levels in the hemolymph, gill, hepatopancreas and muscle of Penaeus monodon exposed to elevated ambient ammonia[J]. Aquatic Toxicology, 2000, 50(1/2): 27–37. |
| [38] | 岳峰. 三疣梭子蟹在氨氮胁迫下免疫应答与解毒代谢机制的研究[D]. 青岛: 中国海洋大学, 2010. YUE F. Immune response and detoxification mechanism of swimming crab Portunus trituberculatus exposed to ambient ammonia[D]. Qingdao: Ocean University of China, 2010. |
| [39] | 曾媛媛, 陈曦飞, 艾春香, 等. 氨氮胁迫对拟穴青蟹血淋巴生理生化指标及鳃和肝胰腺显微结构的影响[C]//中国甲壳动物学会第十一届年会暨学术研讨会论文摘要集. 济南: 中国海洋湖沼学会, 2011. ZENG Y Y, CHEN X F, AI C X, et al. Effects of Ammonia-N stress on haemolymph physiological and biochemical indexes and microstructure of gill and hepatopancreas of Scylla paramamosain[C]//The 11th Annual Meeting and Academic Seminar of the Chinese Society of Crustaceans. Ji'nan: Chinese Institute of Oceanology and Limnology, 2011. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


