大型海藻是海洋生态系统的组成部分,其腐烂分解作为海洋生态系统物质循环以及能量流动的主要环节之一,对维持海洋生态系统的功能有重要作用。大型海藻在腐烂过程中会释放氮和其他营养物质到周围水环境中[1],造成局部海区缺氧从而降低大型底栖动植物多样性[2],腐烂速率因种类而异[3]。目前国内学者对大型海藻腐烂分解过程及其营养盐释放规律的研究较少,仅对绿潮藻优势种如浒苔、硬毛藻分解及其影响因素有所探讨[4-5],对人工栽培大型经济海藻海带、紫菜和龙须菜的腐烂分解研究限于生理性或病理性病变的描述[6-8]。江蓠属海藻是中国南海的主要海藻栽培品种,近年来被广泛用于养殖海区环境修复[9]。由于江蓠属于“机会种”,一定环境条件下会形成“红潮”,使用不慎会导致修复失败,有必要开展江蓠藻体腐解过程以及对水质的影响研究。
异枝江蓠和芋根江蓠大量生长于粤东海水池塘中。芋根江蓠藻体大,生长快,含胶量高达30%以上,除蛋氨酸以外,其他氨基酸均高于FAO标准,具有很高的营养价值。芋根江蓠有适应高温和中、高盐度以及高营养盐环境条件的特性[10-12],异枝江蓠对低盐的耐受能力高于高盐[13];这些特性使芋根江蓠和异枝江蓠具人工栽培前景,开展芋根江蓠和异枝江蓠养殖基础研究对丰富我国江蓠养殖品种,改善目前南海养殖江蓠本地品种琼胶含量较低且质量差,外来品种龙须菜不耐高温[14]的种质状况有重要意义。
本研究选择生长于同一海区的异枝江蓠和芋根江蓠为材料,在实验室内开展模拟低氮条件下江蓠属海藻残体腐解过程研究,揭示其分解过程特征及分解释放物对水质的影响规律,旨在了解不同种江蓠腐烂对水质影响的程度和过程差异,以期为科学选择江蓠池塘高密度人工栽培品种及海区生态修复物种提供参考依据。
1 材料和方法 1.1 材料两种江蓠采集于广东省湛江市徐闻县五里乡西里村海区(20°14′25.85″N、110°08′49.76″E),采集海区水质环境因子如下:盐度为29,温度为(22±1) ℃,pH=8,NO2--N含量为35.71 μmol/L,NH4+-N含量为14.29 μmol/L,TP含量为1.88 μmol/L。样品低温保存运回实验室后,挑选、分离出完整藻株,综合外部形态特征、组织切片观察以及Rubisco和COⅠ基因序列比对结果,鉴定出所采集的两种江蓠分别为芋根江蓠(G. blodgettii)和异枝江蓠(G. bailinae)。
1.2 方法 1.2.1 腐解实验设计选择健康藻体,用镊子在光照显微镜下仔细除去表面附着的杂藻,用大量消毒海水冲洗以后放在室内水族箱扩大培养,加入经高压灭菌后添加Pro加富培养基的新鲜海水中在室内暂养2周。参考黄中坚等和钟志海等[10, 12-13]的研究结果,设置培养条件为(25±1) ℃,光照强度4 000 lx,光周期12L :12D,盐度 25±2,自然浓缩海水经蒸馏水稀释,pH为 8.0。向1 000 mL烧杯加入500 mL培养液,培养液TP初始浓度为6.93 μmol/L,向培养液中加入NH4NO3,使培养液中TN初始浓度为25 μmol/L。每个烧杯中加入相同部位湿重为5 g的江蓠,实验条件同扩大培养条件相同,实验期间每隔2 h摇动烧杯1次。在实验的第0、1、2、4、6、8、12天,采集藻体样本及水样。用吸水纸擦拭干藻体体表水分,称量藻体湿重后,将一部分藻体经过蒸馏水漂洗,65 ℃烘干至衡重;一部分藻体样放于-20 ℃冰箱内保存。水样保存于-20 ℃冰箱进行水化指标测定;每个指标测定三次,取平均值。
1.2.2 藻体特定生长率、失重率以及分解速率测定采用电子天平精确称量藻体湿重(精确到0.01 g),据此计算特定生长率、失重率及分解速率。
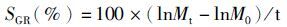 (1)
(1)
 (2)
(2)
江蓠分解速率估算采用 Olson指数衰减模型计算[15]:
 (3)
(3)
式中:SGR为特定生长率;WLR为失重率;Mt为t时间江蓠的质量;M0为江蓠初始质量;k为分解速率常数(d-1);t为分解时间(d)。
1.2.3 水质总氮、总磷测定水样总氮总磷测定方法按我国海洋调查规范规范第4部分:海水化学要素调查(GB/T 12763.4—2007) 进行[16]。营养盐吸收速率和增长速率的计算公式如下:
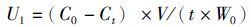 (4)
(4)
 (5)
(5)
式中:U1为营养盐吸收速率;U2为营养盐增长速率;C0 为实验前水体营养物质的浓度;Ct 为t时间营养物质的浓度;V为培养液体积;W0为实验前江蓠质量;t为取样时间。
1.2.4 藻体全氮、全磷及有机碳的测定藻体有机碳采用重铬酸钾-硫酸氧化法测定[17];参照黄道建等[18]藻体通过H2SO4-H2O2消煮后,全氮用奈氏试剂分光光度计比色法测定,全磷用钒钼黄比色方法测定。营养盐释放率公式如下:
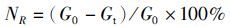 (6)
(6)
式中:NR为营养盐释放率;G0为腐解开始时藻体营养盐含量(mg);Gt为t时间藻体营养盐含量(mg)。
1.2.5 超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量测定参照邹崎[19],藻体超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT) 光化学还原法测定;丙二醛(MDA)含量测定采用硫代巴比妥酸比色法测定。
1.3 数据处理及分析图表绘制采用EXCEL 2003,数据分析采用SPSS 17.0软件完成。
2 结果与分析 2.1 江蓠藻体腐解过程 2.1.1 江蓠藻体腐解过程中的质量变化由表 1可知2种江蓠于培养水体中均先生长了一段时间之后才开始进入腐烂分解过程,芋根江蓠在前2天为生长阶段,日均增重和日均生长率为0.06 g、1.18%,后10天为腐烂分解阶段,腐解起点从第2天算起。异枝江蓠在前4天为生长阶段,日均增重和日均生长率为0.21 g、3.84%,生长大于芋根江蓠,差异极显著(P<0.01) ,后8天为腐解阶段,腐解起点从第4天算起。

|
表 1 江蓠生长阶段和腐解阶段质量变化 Tab.1 The body wet weight of Gracilaria changes in growth and decay phase |
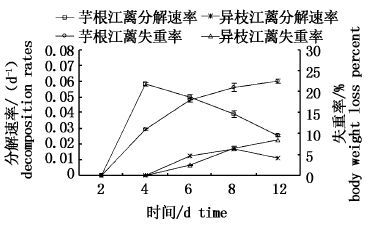
将实验第2天、第4天藻体湿重分别作为芋根江蓠、异枝江蓠腐解的初始值,采用 Olson指数衰减模型估算得出每个时间段内的分解速率k并计算失重率。由图 1可见,2种江蓠失重率均呈现上升的趋势,芋根江蓠失重率明显大于异枝江蓠,差异性显著(P<0.05) 。至实验结束时,芋根江蓠藻体湿重由5.12 g降至3.97 g,失重率达到最大(22.52%);异枝江蓠藻体湿重由5.83 g降至5.33 g,失重率达到最大(8.50%),若将植物最终分解95%的时间看作完全腐烂的时间[4],则说明至本试验结束时失重率分别为22.52%和8.5%的芋根江蓠和异枝江蓠仍处于腐解早期阶段,且芋根江蓠腐烂程度大于异枝江蓠。
|
图 1 腐解阶段2种江蓠的质量失重率和分解速率变化
Fig. 1 The body wet weight and decomposition rates of Gracilaria changes in decay phase
|
江蓠分解速率k值越大说明这个时间段内的分解速率越快。由图 1可知,2种江蓠分解速率基本呈现先快后慢趋势,即腐解过程分为先快后慢两个阶段,芋根江蓠在第2-4天为快速分解阶段,最高分解速率为0.058 /d; 第4-12天为慢速分解期,最低分解速率为0.026 /d;异枝江蓠在第4-8天为快速分解阶段,最高分解速率为0.017 /d,第8-12天为慢速分解期,最低分解速率为0.011 /d。芋根江蓠腐解速率大于异枝江蓠,说明芋根江蓠腐解更快。
芋根江蓠MDA含量高于异枝江蓠,差异极显著(P<0.01) 。芋根江蓠和异枝江蓠的MDA含量在腐解前后变化基本一致(图 2) :先下降后上升,均在第12天达到最大值,分别为57.572、65.306 μmol/g。芋根江蓠MDA含量与其藻体失重率变化趋势相似,在腐解前由45.048 μmol/g下降至27.884 μmol/g,腐解后逐渐上升。异枝江蓠在腐解前MDA含量从28.721 μmol/g下降至18.038 μmol/g,腐解后MDA含量上升极显著(P<0.01) 。
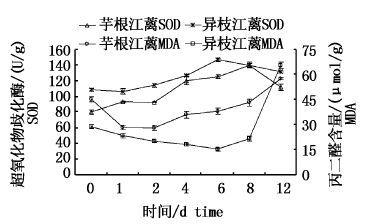
|
图 2 江蓠藻体腐解前后超氧化物歧化酶SOD活性和丙二醛MDA含量变化
Fig. 2 Superoxide dismutase activity and malondialdehyde content of Gracilaria changes before and after decay process
|
芋根江蓠SOD活性低于异枝江蓠但差异不显著(P>0.05) 。2种江蓠SOD活性在腐解前后变化趋势相似(图 2) :先上升后下降。芋根江蓠在腐解前SOD活性由79.858 U/g缓慢增至92.602 U/g,腐解后于快速分解阶段增长到120.000 U/g,进入缓慢腐解阶段后SOD活性下降至111.611 U/g。异枝江蓠在腐解前SOD活性由108.849 U/g缓慢增大到113.947 U/g,快速腐解阶段SOD活性最大为146.549 U/g,并在缓慢腐解阶段下降至131.044 U/g。
芋根江蓠MDA含量大于异枝江蓠,而SOD活性则小于异枝江蓠,说明芋根江蓠膜系统受损程度较大,适应环境胁迫能力较弱。
2.2 江蓠藻体腐解时营养物质释放规律 2.2.1 江蓠藻体氮磷变化由图 3可知,芋根江蓠TN、TP含量实验初始值分别为6.68 mg/g、1.95 mg/g,小于异枝江蓠TN、TP实验初始值9.25 mg/g、3.80 mg/g,差异性极显著(P<0.01) ,说明异枝江蓠自身氮、磷储存量大于芋根江蓠。并且在整个实验过程中,异枝江蓠TN、TP含量均高于芋根江蓠,说明异枝江蓠TN、TP储存能力强于芋根江蓠。

|
图 3 腐解前后藻体氮磷含量的动态变化
Fig. 3 Nitrogen and phosphrous content of Gracilaria changes before and after decay process
|

|
表 2 腐解前后江蓠藻体氮磷释放率变化 Tab.2 The release rate of nitrogen and phosphorus during the decomposition of Gracilaria |
2种江蓠的TN、TP含量腐解前后变化趋势相似,即随时间增加呈现先上升后下降的变化(图 3) 。腐解前藻体TN均有增加,说明藻体对培养液中氮源有短暂吸收。随后芋根江蓠、异枝江蓠从实验第2天、第4天进入腐解阶段,藻体TN开始释放,说明藻体TN释放起始时间和藻体进入腐解的时间一致。由表 2可知,处于快速腐解期的藻体TN日均释放量、日均释放率均大于慢速腐解期,说明藻体TN主要在快速腐解期释放。并且,芋根江蓠TN释放量、释放率为16.30 mg/g、87.51%,大于异枝江蓠的14.74 mg/g、70.83%。江蓠藻体TP在腐解后还有短暂吸收,芋根江蓠藻体从实验第8天即在慢速腐解期才开始释放TP;异枝江蓠从实验第6天开始释放TP,快速分解期的藻体TP日均释放量、日均释放率均大于慢速腐解期。芋根江蓠TP释放量、释放率为1.29 mg/g、31.05%,小于异枝江蓠的1.95 mg/g、37.53%。综上,藻体TN主要在快速腐解期释放,TP在快速腐解期后半阶段甚至慢速腐解期中才开始释放,说明TP释放滞后,且释放率小于TN。相对于异枝江蓠,芋根江蓠TN释放率较大,TP释放率较小。
2.2.2 江蓠藻体C/N变化2种江蓠藻体C/N变化趋势与藻体进入腐解阶段时间和腐解程度变化同步(图 4) ,且芋根江蓠C/N大于异枝江蓠。芋根江蓠C/N初始值为52.11,腐解前快速下降至19.61。进入腐解阶段后,在快速腐解阶段增量为20.20,小于慢速腐解期的增量(80.03) ;异枝江蓠C/N初始值为24.01,腐解前缓慢下降至10.60。进入快速腐解期后增量为16.07,大于慢速腐解期的增量(6.14) 。相关性结果表明,2种海藻C/N均与腐解速率、失重率呈现正相关性,说明C/N越高越会加速腐解进程。

|
图 4 江蓠藻体腐解前后C/N比值随时间的变化
Fig. 4 C/N of Gracilaria changes before and after decay process
|
由图 5可知,2种江蓠培养水体TN、TP在腐解前后含量随时间变化趋势相似,均先下降后上升,说明实验条件下,藻体在腐解前均有吸收氮、磷过程。再由表 3结果可知,芋根江蓠水体氮磷吸收速率小于异枝江蓠,且TN吸收速率>TP吸收速率。
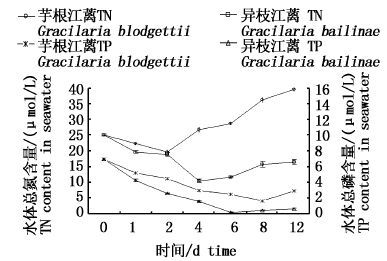
|
图 5 江蓠藻体腐解前后水中总氮、总磷含量的变化
Fig. 5 Total nitrogen and phosphrous content in seawater changes before and after decay process
|
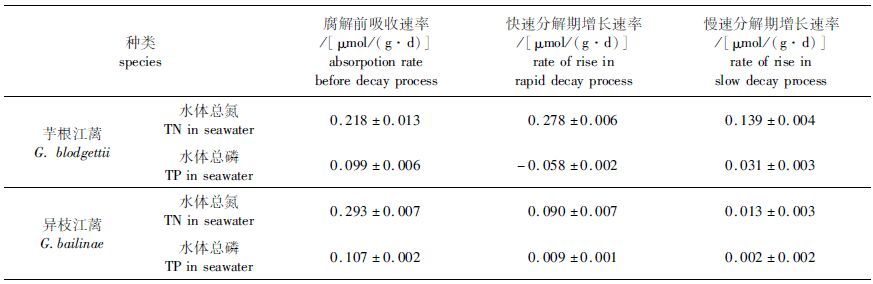
|
表 3 江蓠藻体腐解前后水中氮、磷变化速率 Tab.3 Rate of nitrogen and phosphorus in the seawater during the decomposition of Gracilaria |
进入腐解阶段藻体开始释放氮磷,导致水体氮磷含量不断增加。在实验结束时,芋根江蓠水体TN相对于腐解初始值(19.66 μmol/L)增至39.5 μmol/L,水体TP从第9天由1.6 μmol/L升至2.9 μmol/L,分别增长了2倍和1.8倍。异枝江蓠从第4天进入腐解阶段至实验结束,水体TN由10.47 μmol/L增至16.44 μmol/L,而水体TP从第6天开始由0.2 μmol/L增加到0.6 μmol/L,分别增长了1.57倍和3倍。由表 3可知,江蓠水体TN增长主要发生在快速腐解期,芋根江蓠水体TP增加发生在缓慢分解期中,而异枝江蓠水体TP增加主要发生在快速腐解后阶段,说明进入腐解阶段后TN先于TP增加,增长速率大于TP,说明水体TN、TP增长不同步,正好与藻体TN、TP释放相呼应。
在整个培养过程中,水中TN、TP含量及增长率为:芋根江蓠>异枝江蓠,二者水体 TN含量差异性显著(P<0.05) ,TP含量差异性不显著(P>0.05) 。
3 讨论 3.1 江蓠藻体腐解过程及其营养盐释放规律水生植物分解一般都分为两个阶段,第1个阶段是植物残体的快速溶解阶段,其后是难溶性的物质在微生物以及胞外酶作用下的缓慢分解阶段[20],丁月旻认为浒苔最终分解95%的时间可以看作浒苔完全腐烂的时间,但实验结束时,芋根江蓠、异枝江蓠藻体失重率分别为22.52%、8.50%,说明至本实验结束时,2种江蓠均处于腐解早期阶段,腐解过程分先快后慢两个阶段,与浒苔分解研究得到的结果和水生植物的分解相似。
本研究结果发现:江蓠藻体早期腐解过程中,TN的释放率大于TP,氮磷释放不同步,磷释放滞后,C/N上升;与浒苔、细基江蓠繁枝变种和水生植物分解研究得到的结果基本相似,但C/N变化不同。在浒苔腐烂分解过程研究发现:浒苔在 5~8 d主要对有机氮释放、9~12 d对有机磷释放、13~25 d对有机碳释放,并且氮元素比磷更快地释放到水体中[4]。刘静雯发现受铁限制的细基江蓠繁枝变种相对于起始状态总氮、总碳、总磷含量下降,C/N不变[21]。水生植物经自然腐烂分解后,所含氮、磷70%以上会在短期内被释放进入水体,随着植物体内的氮被不断地释放出来,致使水中总氮浓度升高[22]。本研究江蓠氮释放与藻体湿重量变化相一致,即氮释放随着藻体干物质分解进行,江蓠磷释放滞后于氮,可能是因为有机体内物质形态、组成比例的差异以及各类物质分解的难易程度差异造成的 [23]。至实验结束时芋根江蓠水体TN、TP含量分别增加到39.5μmol/L、2.9μmol/L,异枝江蓠水体TN、TP含量分别达到16.4 μmol/L、0.6 μmol/L,2种江蓠生长海区NO2--N含量为35.71 μmol/L,NH4+-N含量为14.29 μmol/L,芋根江蓠最适合生长氮浓度范围为144~240 μmol/L,本实验江蓠早期腐解的营养盐释放没有对水质产生不良影响。
3.2 影响江蓠藻体腐解和营养盐释放的因素本研究表明:芋根江蓠腐解的时间较长,藻体失重率和分解速率较大,抗氧化能力较弱,TN释放量较多、TP释放量较少,腐解的程度比异枝江蓠大。已有研究发现:藻体的种类、生物量等性状及环境因素被认为是影响藻体分解速率的主要因素[24] ,温度等环境条件对分解过程影响更为显著[5]。实验中2种江蓠来自同一海区,对温度、盐度的适应能力基本一致,实验前芋根江蓠TN、TP含量初始值大于异枝江蓠,且芋根江蓠藻体含水率和C/N较高,粗纤维、总碳水化合物含量比较低[11],适宜总无机氮浓度范围为144~240 μmol/L,远高于本实验培养液中TN为25 μmol/L的初始浓度,喜高营养盐环境条件和对逆境的抗氧化能力较弱等特点可能是其腐解程度较大的原因。
3.2.1 江蓠藻体C/N 和含水率C/N被认为是表征植物分解速率的最理想指标[25],由实验结果可知,芋根江蓠、异枝江蓠藻体初始C/N分别为52.10、24.01,且藻体C/N和腐解速率呈现正相关性,芋根江蓠C/N值比异枝江蓠高,所以C/N值越高,分解越快。植物含水量这一性状可能会影响植物腐解过程。紫菜阴干到含水量为20%~40%,冷藏后再重新张挂到海区栽培可避免紫菜腐烂[26]。芋根江蓠含水率为95%,异枝江蓠含水率为91%,相关性分析得知,藻体含水率与腐解速率呈现极显著正相关性(P<0.01) ,说明藻体含水率越大,分解就越快。
3.2.2 江蓠藻体氮含量植物分解快慢与植物基质成分相关,氮在植物分解过程中起着核心作用,有机氮含量高的浮叶植物分解速率最快,而氮含量低的挺水植物分解速率最慢[27],而Conover研究发现墨角藻氮含量最低,但腐解最慢,TN释放量最多[3]。本研究结果得知,藻体组织氮含量和腐解速率呈负相关,表现为组织氮含量低的芋根江蓠腐解程度大于组织氮含量高的异枝江蓠,且TN释放量大于异枝江蓠,这可能因为异枝江蓠组织氮含量较高,对低氮胁迫环境有较好的耐受性。
3.2.3 低氮胁迫下江蓠藻体抗氧化能力蛋白质与碳水化合物(糖)之比和C/N值常用来衡量藻体是否缺氮。一般认为,江蓠的临界C/N值在10~15,C/N值低于10,预示着藻类开始储存氮,当C/N值大于15 ,藻类生长可能受氮限制[28]。按照这一标准,实验开始时两种海藻生理状态均已经处于氮胁迫状态。此外,芋根江蓠最适合生长氮浓度范围为144~240 μmol/L,2种江蓠生长海区NO2--N含量为35.71 μmol/L,NH4+-N含量为14.29 μmol/L,也说明本实验设置培养液中氮的初始浓度25 μmol/L较低,可能产生了低氮胁迫。
逆境胁迫会造成潮间带的海藻细胞中活性氧的大量积累。SOD是清除活性氧的主要抗氧化酶,MDA含量与清除活性氧的保护系统之间呈负相关[29]。已有研究发现,耐低N、P品系坛紫菜在低N、P环境胁迫下,胁迫前期阶段SOD活性不断增加以清除氧自由基,但膜系统仍因氧化受损,MDA含量先上升[30]。龙须菜在N、P饥饿下抗氧化能力下降、膜脂过氧化及系统受伤害程度加剧[31]。本研究中藻体进入腐解阶段后,抗氧化酶SOD活性先上升以减少低氮胁迫带来的不利影响,但藻体耐胁迫能力有限,故随腐解时间增加,SOD活性减小、MDA含量不断上升,藻体生长受阻并腐烂。相对于芋根江蓠,异枝江蓠SOD活性较大,MDA含量较小,说明低氮胁迫下异枝江蓠有较好的耐受性,膜系统受损相对较小。
综上,相对于芋根江蓠在低氮环境下的腐解表现,异枝江蓠具有氮高效利用的营养特征,异枝江蓠藻体腐烂后向水中释放的营养盐含量低于芋根江蓠,因其腐烂导致水体二次污染的风险可能相对较小。
4 结论在实验室内模拟条件下,对来源于同一海区的芋根江蓠和异枝江蓠开展江蓠腐解过程和氮磷释放规律研究结果表明:(1) 本试验结束时芋根江蓠、异枝江蓠仍处于腐解早期阶段,腐解过程呈现先快后慢两个阶段;芋根江蓠腐解程度大于异枝江蓠,且比异枝江蓠早三天进入腐解阶段。(2) 江蓠藻体腐解过程营养盐释放率为:TN>TP,且氮先于磷释放。相对于异枝江蓠,芋根江蓠藻体TN释放量较多,TP释放量较少;藻体TN、TP含量较低,说明其营养盐储存能力弱于异枝江蓠,而培养水中TN含量相对较高,说明其腐烂后向水中释放的N营养盐量高于异枝江蓠。(3) 藻体含水率、C/N、氮含量等藻体性状和抗氧化胁迫能力的不同可能是导致江蓠藻体腐解以及氮磷释放差异的原因。
| [1] | GRIFFITHS C L, STENTON-DOZEY J.The fauna and rate of degradation of stranded kelp[J]. Estuarine, Coastal and Shelf Science, 1981, 12(6): 645–653. |
| [2] | VIAROLI P, BARTOLI M, BONDAVALLI C, et al.Macrophyte communities and their impact on benthic fluxes of oxygen, sulphide and nutrients in shallow eutrophic environments[J]. Hydrobiologia, 1996, 329(1/3): 105–119. |
| [3] | CONOVER J E. Variability in biomass decay rates and nutrient loss in bloom-forming macroalgal species[D]. Rhode Island:University of Rhode Island, 2011:108. |
| [4] | 丁月旻. 黄海浒苔绿潮中生源要素的迁移转化及对生态环境的影响[D]. 青岛:中国科学院海洋研究所, 2014. DING Y M. Impacts of Ulva (Enteromorpha) prolifera in the green tide on the Yellow Sea ecological environment-Implications from migration and transformation of biogenic elements[D]. Qingdao:Institute of Oceanology, Chinese Academy of Sciences, 2014. |
| [5] | 魏权, 宋鹏鹏, 邵雪琳, 等.温度、曝气和沉积物对绿潮硬毛藻分解的影响[J]. 环境科学学报, 2014, 34(9): 2329–2336. WEI Q, Song P P, SHAO X L, et al.Influence of temperature, aeration and sediment on decomposition of chaetomorpha sp[J]. Acta Scientiae Circumstantiae, 2014, 34(9): 2329–2336. |
| [6] | 张壮志, 丛义周, 曲善村, 等.烟台沿海海带腐烂病原因分析及防治对策[J]. 中国水产, 2006: 57–58. ZHANG Z Z, CONG Y Z, QU S C, et al.Analysis on cause of Laminaria decomposition and its control countermeasures in Yantai costal[J]. China Fisheries, 2006: 57–58. |
| [7] | 吴建绍, 葛辉, 林克冰, 等.福鼎硖门湾海区坛紫菜生理性病变的初步研究[J]. 福建水产, 2014, 36(2): 96–100. WU J S, GE H, LIN K B, et al.Preliminary study on the physiological disorders of Porphyra haitanensis from Fuding Xiamen Bay[J]. Journal of Fujian Fisheries, 2014, 36(2): 96–100. |
| [8] | 彭长连, 温学, 林植芳, 等.龙须菜对海水氮磷富营养化的响应[J]. 植物生态学报, 2007, 31(3): 505–512. PENG C L, WEN X, LIN Z F, et al.Response of Gracilaria lemaneiformis to nitrogen and phosphorus eutrophic seawater[J]. Journal of Plant Ecology, 2007, 31(3): 505–512. |
| [9] | 徐姗楠, 温珊珊, 吴望星, 等.真江蓠(Gracilaria verrucosa)对网箱养殖海区的生态修复及生态养殖匹配模式[J]. 生态学报, 2008, 28(4): 1466–1475. XU S N, WEN S S, WU W X, et al.Bioremediation of caged fish aquaculture by the red alga Gracilaria verrucosa in an integrated multi-trophic aquaculture system[J]. Acta Ecologica Sinica, 2008, 28(4): 1466–1475. |
| [10] | 黄中坚, 宋志民, 杨晓, 等.生态因子对芋根江蓠的生长及生化组分的影响[J]. 南方水产科学, 2014, 10(1): 27–34. HUANG Z J, SONG Z M, YANG X, et al.Effect of ecological factors on growth and biochemical constituents of Gracilaria blodgettii[J]. South China Fisheries Science, 2014, 10(1): 27–34. |
| [11] | 赵素芬, 孙会强, 梁钧志, 等.湛江海域6种常见经济海藻的营养成分分析[J]. 广东海洋大学学报, 2009, 29(1): 49–53. ZHAO S F, SUN H Q, LIANG J Z, et al.Nutrient component analysis of six kinds of economic algae in Zhanjiang sea area[J]. Journal of Guangdong Ocean University, 2009, 29(1): 49–53. |
| [12] | 黄中坚, 钟志海, 宋志民, 等.不同营养盐水平对芋根江蓠的生长及生化组分的影响[J]. 南方水产科学, 2014, 10(5): 30–38. HUANG Z J, ZHONG Z H, SONG Z M, et al.Effect of different nutrient salts on growth and chemical constituents of Gracilaria blodgettii[J]. South China Fisheries Science, 2014, 10(5): 30–38. |
| [13] | 钟志海, 黄中坚, 陈伟洲.不同环境因子对异枝江蓠的生长及生化组分的影响[J]. 渔业科学进展, 2014, 35(3): 98–104. ZHONG Z H, HUANG Z J, CHEN W Z.Effects of various environmental factors on growth and biochemical components of Gracilaria bailinae[J]. Progress in Fishery Sciences, 2014, 35(3): 98–104. |
| [14] | 张学成, 费修绠, 王广策, 等.江蓠属海藻龙须菜的基础研究与大规模栽培[J]. 中国海洋大学学报, 2009, 39(5): 947–954. ZHANG X C, FEI X G, WANG G C, et al.Genetic studies and large scale cultivation of Gracilaria lemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(5): 947–954. |
| [15] | OLSON J S.Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 1963, 44(2): 322–331. |
| [16] | 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12763.4-2007海洋调查规范第4部分:海水化学要素调查[S]. 北京:中国标准出版社, 2008:25-29. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 12763.4-2007 Specifications for oceanographic survey-Part 4:Survey of chemical parameters in sea water[S]. Beijing:China Standards Press, 2008:25-29. |
| [17] | 中国土壤学会农业化学专业委员会.土壤农业化学常规分析方法[M].北京: 科学出版社, 1983: 272-276. Agricultural Chemical Professional Committee of Soil Science Society of China.Routin analysis method of soil agriculture chemical[M].Beijing: Science Press, 1983: 272-276. |
| [18] | 黄道建, 黄小平, 黄正光.海南新村湾海菖蒲TN和TP含量时空变化及其对营养负荷的响应[J]. 海洋环境科学, 2010, 29(1): 40–43. HUANG D J, HUANG X P, HUANG Z G.Spatiotemporal variation of TN & TP contents in Enhalus acoroides and responses to nutrient load in Xincun Bay, Hainan[J]. Marine Environmental Science, 2010, 29(1): 40–43. |
| [19] | 邹琦.植物生理学实验指导[M].北京: 中国农业出版社, 2000: 56-59. ZOU Q.The experimental guide for plant physiology[M].Beijing: China Agriculture Press, 2000: 56-59. |
| [20] | 叶春, 王博.沉水植物黑藻早期分解过程及影响因素研究[J]. 中国农学通报, 2009, 25(17): 260–264. YE C, WANG B.The early decomposition process of the submerged macrophyte Hydrilla verticillata and the factors that have a strong impact on it[J]. Chinese Agricultural Science Bulletin, 2009, 25(17): 260–264. |
| [21] | 刘静雯, 董双林, 冯丽洁.细基江蓠繁枝变型(Gracilaria tenuistipitata var. liui)铁限制的生理生态学反应[J]. 海洋与湖沼, 2004, 35(2): 167–175. Liu J W, DONG S L, FENG L J.Physiological and ecological response of Gracilaria tenuistipitata var. liui to iron stress[J]. Oceanologia et Limnologia Sinica, 2004, 35(2): 167–175. |
| [22] | SHILLA D, ASAEDA T, FUJINO T, et al.Decomposition of dominant submerged macrophytes:Implications for nutrient release in Myall Lake, NSW, Australia[J]. Wetlands Ecology and Management, 2006, 14(5): 427–433. |
| [23] | 李文朝, 陈开宁, 吴庆龙, 等.东太湖水生植物生物质腐烂分解实验[J]. 湖泊科学, 2001, 13(4): 331–336. LI W C, CHEN K N, WU Q L, et al.Experimental studies on decomposition process of aquatic plant material from east Taihu Lake[J]. Journal of Lake Sciences, 2001, 13(4): 331–336. |
| [24] | FROSSARD V, VERSANNE-JANODET S, ALEYA L.Factors supporting harmful macroalgal blooms in flowing waters:A 2-year study in the Lower Ain River, France[J]. Harmful Algae, 2014, 33: 19–28. |
| [25] | LEE A A, BUKAVECKAS P A.Surface water nutrient concentrations and litter decomposition rates in wetlands impacted by agriculture and mining activities[J]. Aquatic Botany, 2002, 74(4): 273–285. |
| [26] | 徐丽宁, 杨锐.紫菜病害及防治[J]. 水利渔业, 2005, 25(6): 103–105. XU L N, YANG R.Laver diseases and control methods[J]. Reservoir Fisheries, 2005, 25(6): 103–105. |
| [27] | 唐金艳, 曹培培, 徐驰, 等.水生植物腐烂分解对水质的影响[J]. 应用生态学报, 2013, 24(1): 83–89. TANG J Y, CAO P P, XU C, et al.Effects of aquatic plants during their decay and decomposition on water quality[J]. Chinese Journal of Applied Ecology, 2013, 24(1): 83–89. |
| [28] | 林贞贤, 宫相忠, 李大鹏.光照和营养盐胁迫对龙须菜生长及生化组成的影响[J]. 海洋科学, 2007, 31(11): 22–26. LIN Z X, GONG X Z, LI D P.Effects of light and the stress of nutrients deficiency on the growth and levels of chemical constituents of Gracilaria lemaneiformis[J]. Marine Sciences, 2007, 31(11): 22–26. |
| [29] | 谢佳, 徐燕, 纪德华, 等.坛紫菜叶状体对失水胁迫的抗氧化生理响应[J]. 中国水产科学, 2014, 21(2): 405–412. XIE J, XU Y, JI D H, et al.Physiological response of the antioxidant system in Pyropia haitanensis to desiccation stress[J]. Journal of Fishery Sciences of China, 2014, 21(2): 405–412. |
| [30] | 周巍巍, 谢潮添, 陈昌生, 等.低氮、磷胁迫对坛紫菜叶状体生理生化特征的影响[J]. 水产学报, 2011, 35(4): 543–550. ZHOU W W, XIE C T, CHEN C S, et al.Effects on physiological and biochemical indexes of gametophytic blades of Porphyra haitanensis under low nitrogen and phosphorus stress[J]. Journal of Fisheries of China, 2011, 35(4): 543–550. |
| [31] | 张皓, 黄鹤忠, 何华敏, 等.不同N、P浓度条件下龙须菜对镉胁迫的生理响应[J]. 海洋科学, 2009, 33(5): 74–79. ZHANG H, HUANG H Z, HE H M, et al.Physiological response of Gracilaria lemaneiformi to stress of heavy metals Cd2+ under the conditions of different nitrogen and phosphorus[J]. Marine Sciences, 2009, 33(5): 74–79. |
 2016,
Vol. 25
2016,
Vol. 25


