2. 广东海洋大学 南海水产经济动物增养殖广东普通高校重点实验室, 广东 湛江 524088;
3. 广东海洋大学 海洋生态与养殖环境湛江市重点实验室, 广东 湛江 524088
我国是对虾养殖大国,其中凡纳滨对虾(Litopenaeus vannamei)产量在对虾养殖产业中占绝对优势,其肉质鲜美,营养价值高,具有重要的经济价值。凡纳滨对虾又称为南美白对虾、白脚虾、白腿对虾、万氏对虾,分类学上隶属于甲壳纲(Crustacea),十足目(Decapoda),对虾科(Penaeidae),滨对虾属(Litopenaeus),具有生长繁殖快、抗逆力强、耐高密度和低盐度养殖环境等优点[1]。人工养殖条件下,凡纳滨对虾雌虾的生长速度远快于雄虾,成年雌虾体重是雄虾的一倍以上[2]。人工繁殖时,由于雌虾卵巢发育较缓慢,不易成熟,通常可通过摘除眼柄促进性腺发育[3]。
在甲壳动物中很多基因参与性腺发育。DMC1(disrupted meiotic cDNA) 蛋白是在真核生物中发现的大肠杆菌(E.coli)RecA 蛋白的同源蛋白[4],广泛存在于从酵母到哺乳动物的许多物种中,在甲壳动物中DMC1仅在性腺中表达[5-7]。VASA属于DEAD-box 家族,是一种依赖ATP的解旋酶,参与RNA的代谢过程,与生殖细胞的迁移和分化有关。从生殖细胞出现到性腺成熟均可检测到其表达,为性腺特异性表达基因,因此可作为生殖细胞的分子标记,在凡纳滨对虾、斑节对虾、日本囊对虾、中国对虾中都检测到VASA基因的表达,推测可能与配子发生有关[8-10]。卵黄蛋白原VTG(Vitellogenin)特异地存在于性成熟的非哺乳类卵生雌性动物体内,是所有卵生动物卵黄蛋白的前体,参与卵黄发生过程[11]。
眼柄是甲壳动物的重要内分泌器官,其分泌神经多肽类物质,如甲壳动物高血糖激素(CHH)、蜕皮抑制激素(MIH)、性腺抑制激素(GIH或VIH)、离子转运肽(ITP)和大颚器抑制激素(Mandibular-Organ-Inhibiting Hormone,MOIH),调控甲壳动物的生长、蜕皮和繁殖等生命活动,其中GIH对性腺发育有重要的调控作用[3]。在雌性个体中,GIH直接作用于卵巢,通过抑制卵黄蛋白原(VTG)的形成来抑制卵巢发育;而在雄性个体,GIH作用于雄腺(AG),雄腺激素促使雄性第二性征的发生 [12]。早在1943年PANOUSE证明了摘除虾眼柄可以诱导性腺成熟[13],随后也有研究表明眼柄激素对甲壳动物性腺发育或性分化产生影响 [14-16],而眼柄激素对凡纳滨对虾生殖相关基因表达的影响很少见报道。本研究通过摘除眼柄与注射眼柄粗提物,探索眼柄中神经激素对凡纳滨对虾DMC1、VASA及VTG基因表达的影响,初步探讨GIH在性腺发育过程中的调控机制,为凡纳滨对虾生殖内分泌研究提供基础资料,并为后续对虾育种、性别调控等应用提供理论依据。
1 材料与方法 1.1 实验材料健康的凡纳滨对虾成虾购自广东海洋大学东海岛研究基地。用组织学方法检测不同发育时期凡纳滨对虾的卵巢和精巢发育,选取性腺发育为Ⅲ期的对虾进行实验,体长约13~15 cm。
1.2 实验方法 1.2.1 眼柄粗提物的制备参照朱春华等[16]的方法制备眼柄粗提物。剪下眼柄,用预冷甲壳动物生理盐水冲洗干净后剥离出眼柄视神经(约40只),放入10 mL 的离心管中,加入5 mL甲壳动物生理盐水,冰浴超声波破碎(400 W,5 s×10 次,间隔5 s),离心15 min(4 ℃、12 000 r/min),取上清液于85 ℃水浴5 min,沉淀非耐热蛋白,冷却后再次离心15 min(4 ℃、12 000 r/min),取上清液经0.22 μm微孔滤膜过滤除菌后,4 ℃保存备用。采用活体注射法检测其GIH活性。
1.2.2 实验设计实验分为0 d空白对照(雌、雄)、未摘除眼柄7 d对照组(雌、雄)、摘除眼柄7 d处理组(雌、雄),注射生理盐水24 h对照组(雌、雄)、注射眼柄粗提物24 h处理组(雌、雄),每组5个平行。单侧眼柄摘除,或于第五步足肌肉注射。在注射眼柄粗提物24 h和摘除眼柄7 d后活体解剖,分别取精巢和卵巢-80 ℃保存备用。
1.2.3 DMC1 、VASA和VTG基因表达利用Trizol 试剂(Invitrogen)一步法提取精巢和卵巢总RNA,利用M-MLV 反转录酶(Promega) 合成cDNA。根据NCBI已公布的凡纳滨对虾DMC1(HQ116385.1)、VASA(DQ095772.2)和VTG(AY283276.1)基因序列设计引物(表 1),采用荧光定量PCR试剂盒(Bio-rad)检测眼柄摘除和注射眼柄粗提物后性腺中性腺发育相关基因(DMC1 、VASA和VTG)表达的变化。

|
表 1 凡纳滨对虾DMC1、 VASA 和VTG荧光定量所用引物 Tab.1 Primers used for expression of DMC1, VASA and VTG in L. vannamei |
用2-ΔΔCt法计算基因相对表达量。数据用SPSS 17.0软件统计,采用单因素方差分析,显著性水平为P<0.05,利用Duncan’s方法进行多重比较分析,结果均以平均值±标准误(X±S.E.)表示。
2 结果 2.1 摘除眼柄与注射眼柄粗提物对DMC1 mRNA表达的影响摘除眼柄后,DMC1在精巢和卵巢中的表达量显著性降低(P<0.05);相反,注射眼柄粗提物后DMC1表达显著性增高(P<0.05),见图 1。

|
图 1 摘除眼柄与注射眼柄粗提物对凡纳滨对虾精巢和卵巢中DMC1表达的影响
Fig. 1 DMC1 relative expression in testis and ovary by eyestalk ablation and injection ofeyestalk hormone in L. vannamei
不同字母表示组间差异显著(P<0.05),图 2、图 3同此。
Different letter indicates significant difference among groups(P<0.05),the same in figure 2 and 3. |
摘除眼柄后,VASA表达量显著增高(P<0.05);而注射眼柄粗提物后VASA表达量显著降低(P<0.05),见图 2。
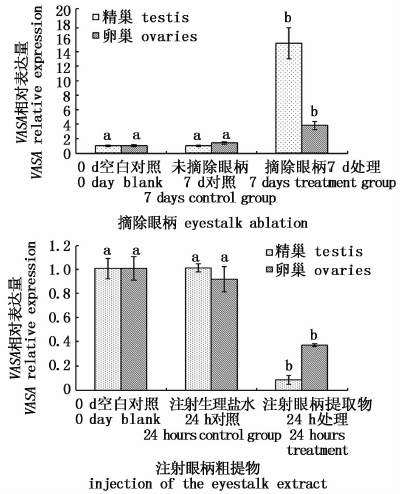
|
图 2 摘除眼柄与注射眼柄粗提物对精巢和卵巢中VASA表达的影响
Fig. 2 VASA relative expression in testis and ovary by eyestalk ablation and injection of eyestalk hormone in L. vannamei
|
摘除眼柄凡纳滨对虾卵巢中VTG表达量显著性增高(P<0.05),注射眼柄粗提物后VTG显著性降低(P<0.05),见图 3。
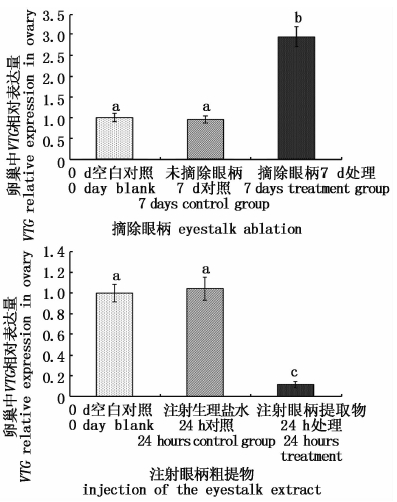
|
图 3 摘除眼柄与注射眼柄粗提物对卵巢VTG表达的影响
Fig. 3 VTG relative expression in ovary by eyestalk ablation and injection ofeyestalk hormone in L. vannamei
|
DMC1基因仅在减数分裂中表达,是减数分裂重组和联会复合体的关键组分。DMC1在凡纳滨对虾精巢和卵巢中均表达,在其他组织中不表达,且精巢中的表达量高于卵巢,这一结果与OKUTSU和KANG对凡纳滨对虾DMC1的研究结果一致[6]。在凡纳滨对虾和中华绒螯蟹中,DMC1在发育前期的性腺中表达量最高,随着发育逐渐下降,发育末期达到最低,与发育前期存在显著差异[6-7]。本实验中,摘除眼柄后精巢和卵巢DMC1表达量显著性降低;相反,注射眼柄提取物后DMC1表达量显著性升高,说明眼柄中物质对DMC1的表达有影响。本实验中摘除眼柄7 d后DMC1比对照显著下降,这与梁羡圆等[14]、吴超等[15]摘除眼柄促进对虾性腺发育的研究结果一致;注射眼柄粗提物24 h后DMC1比对照显著升高,这与朱春华等[16]注射眼柄提取物能抑制凡纳滨对虾性腺发育的结果一致。
迄今在已纯化并进行氨基酸序列结构分析和功能鉴定的眼柄神经肽类激素中,GIH在甲壳动物的生殖活动中起着重要作用。由于GIH的靶器官主要是AG、卵巢和肝脏,因此我们推测,摘除眼柄后雌虾GIH的抑制作用解除,体内雌二醇激素水平增加,激活了鸟苷酸环化系统,抑制了减数分裂过程,从而导致DMC1的表达降低,因此眼柄是通过间接控制性类固醇激素的释放来达到对DMC1表达的调控。黑鲷注射雌二醇后体内DMC1表达量下降,原因可能由于雌二醇激活鸟苷酸环化系统,从而抑制了减数分裂过程[17]。而雄虾摘除眼柄后,GIH对AG的抑制作用解除,AG增生[18],间接促进精巢的发育,随着精巢的发育,DMC1表达量下降,但精巢中DMC1表达量降低是由哪种激素调控尚有待研究。
VASA只在精巢和卵巢中表达,在其他组织中不表达[8-9, 19]。此外,VASA可以作为生殖细胞迁移的一种标记,在卵子发生期和卵黄生成前期的卵细胞中表达最高,在卵黄发生中期逐渐下降,卵黄发生后期几乎不表达,因此VASA被认为用来组装和运输卵黄蛋白原基因mRNA,参与卵巢发育过程[19]。本实验摘除凡纳滨对虾眼柄后,发现精巢和卵巢中的VASA基因表达显著性增强,而注射眼柄粗提物后显著性降低,且VASA在精巢的变化比卵巢中更为显著。同样,卵巢中VTG的表达模式与VASA相似,其中雌虾卵巢VASA随着VTG同增同减,并且水平相当,说明VASA依赖VTG的变化而变化,推测VASA与VTG一样,与凡纳滨对虾卵巢发育周期存在相关性。目前精巢中VASA作用机制尚不清楚。
甲壳动物中,VTG的合成部位通常在卵巢和肝脏,罗氏沼虾和凡纳滨对虾VTG主要在卵巢和肝胰脏中表达,且随着卵巢发育表达量逐渐升高,在卵巢发育完全后降低[20],此外,ARCOS发现凡纳滨对虾血淋巴中存在VTG,且浓度与卵巢发育周期呈正相关[21]。最新的研究表明,用VIH重组蛋白注射和离体培养均抑制凡纳滨对虾VTG的表达[22]。此外,在斑节对虾中,通过GIH的RNA干扰,可显著性增加VTG的表达,而我们通过摘除眼柄和注射眼柄粗提物可抑制或增强凡纳滨对虾卵巢中VTG的表达。可以认为,摘除眼柄后GIH抑制作用解除,雌虾体内VTG的合成作用加强,需要更多的VASA蛋白来组装和运输卵黄蛋白原,而精巢中作用机制不详。
综上所述,眼柄粗提物可促进凡纳滨对虾 DMC1表达,但抑制VASA和VTG的表达,其通过影响生殖相关基因的表达而影响性腺发育。
| [1] | 王兴强, 马甡, 董双林.凡纳滨对虾生物学及养殖生态学研究进展[J]. 海洋湖沼通报, 2004: 94–100. WANG X Q, MA S, DONG S L.Studies on the biology and cultural ecology of Litopenaeus vannamei:a review[J]. Transactions of Oceanology and Limnology, 2004: 94–100. |
| [2] | 王吉桥.南美白对虾生物学研究与养殖[M].北京: 海洋出版社, 2003: 1-10. WANG J Q.Penaeus Vannamei Biology and Aquaculture[M].Beijing: China Ocean Press, 2003: 1-10. |
| [3] | 王克行.虾蟹类增养殖学[M].北京: 中国农业出版社, 1997: 24-35. WANG K X.Breeding and Culture of Shrimps and Crabs[M].Beijing: Chinese Agricultural Press, 1997: 24-35. |
| [4] | MATSUDA Y, HABU T, HORI T, et al.Chromosome mapping of the mouse homologue of DMC1, the yeast meiosis-specific homologous recombination Gene[J]. Chromosome Research, 1996, 4(3): 249–250. |
| [5] | LEELATANAWIT R, KLINBUNGA S, AOKI T, et al.Suppression subtractive hybridization (SSH) for isolation and characterization of genes related to testicular development in the giant tiger shrimp Penaeus monodon[J]. BMB Reports, 2008, 41(11): 796–802. |
| [6] | OKUTSU T, KANG B J, MIWA M, et al.Molecular cloning and characterization of Dmc1, a gene involved in gametogenesis, from the whiteleg shrimp Litopenaeus vannamei[J]. Fisheries Science, 2010, 76(6): 961–969. |
| [7] | 张伟. 中华绒螯蟹精巢组织cDNA文库构建和Dmc1基因的克隆与序列分析[D]. 上海:华东师范大学, 2012. ZHANG W. Construction of cDNA library of Chinese mitten crab, Eriocheir sinensis and cloning and molecular characterization of Dmc1 gene[D]. Shanghai:East China Normal University, 2012. |
| [8] | AFLALO E D, BAKHRAT A, RAVIV S, et al.Characterization of a vasa-like gene from the pacific white shrimp Litopenaeus vannamei and its expression during oogenesis[J]. Molecular Reproduction and Development, 2007, 74(2): 172–177. |
| [9] | SELLARS M J, LYONS R E, GREWE P M, et al.A PL10 vasa-like gene in the Kuruma Shrimp, Marsupenaeus japonicus, expressed during development and in adult gonad[J]. Marine Biotechnology, 2007, 9(3): 377–387. |
| [10] | ZHOU Q R, SHAO M Y, QIN Z K, et al.Cloning, characterization, and expression analysis of the DEAD-box family genes, Fc-vasa and Fc-PL10a, in Chinese shrimp (Fenneropenaeus chinensis)[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(1): 37–45. |
| [11] | 张士璀, 孙旭彤, 李红岩.卵黄蛋白原研究及其进展[J]. 海洋科学, 2002, 26(7): 32–35. ZHANG S C, SUN X T, LI H Y.Review on vitelloginin[J]. Marine Sciences, 2002, 26(7): 32–35. |
| [12] | 宋霞, 周开亚.甲壳类的眼柄神经激素[J]. 动物学杂志, 2000, 35(4): 39–43. SONG X, ZHOU K Y.Development of neurohormones in the eyestalk of Crustacea[J]. Chinese Journal of Zoology, 2000, 35(4): 39–43. |
| [13] | PANOUSE J B.Influence de l'ablation du pédoncule oculaire sur la croissance de l'ovaire chez la crevette leander serratus[J]. CR Acad Sci Paris, 1943, 217: 553–555. |
| [14] | 梁羡圆, 张乃禹, 曹登宫, 等.摘除眼柄诱导中国对虾性腺成熟和提前产卵的初步试验[J]. 海洋与湖沼, 1983, 14(2): 138–147. LIANG X Y, ZHANG N Y, CAO D G, et al.Studies on the induction of ovarian maturity and spawning of Penaeus Orientalis Kishinouye by eyestalk ablation[J]. Oceanologia et Limnologia Sinica, 1983, 14(2): 138–147. |
| [15] | 吴超, 林琼武, 张黎黎, 等.饥饿和切除眼柄对日本囊对虾亲虾性腺发育及血淋巴生化成分含量的影响[J]. 厦门大学学报(自然科学版), 2009, 48(5): 750–755. WU C, LIN Q W, ZHANG L L, et al.The influence of starvation and eyestalk ablation on the development of gonad and biochemical composition in hemolymph of Marsupenaeus japonicus Broodstock[J]. Journal of Xiamen University (Natural Science), 2009, 48(5): 750–755. |
| [16] | 朱春华, 赵光凤, 李广丽.眼柄粗提物对凡纳滨对虾性分化的影响[J]. 广东海洋大学学报, 2011, 31(1): 23–27. ZHU C H, ZHAO G F, LI G L.Effects of eyestalk extracts on the sex differentiation on Litopenaeus vannamei[J]. Journal of Guangdong Ocean University, 2011, 31(1): 23–27. |
| [17] | LAU E L, LEE M F, CHANG C F.Conserved sex-specific timing of meiotic initiation during sex differentiation in the protandrous black porgy Acanthopagrus schlegelii[J]. Biology of Reproduction, 2013, 88(6): 150. |
| [18] | KHALAILA I, MANOR R, WEIL S, et al.The eyestalk-androgenic Gland-testis endocrine axis in the crayfish Cherax quadricarinatus[J]. General and Comparative Endocrinology, 2002, 127(2): 147–156. |
| [19] | FENG Z F, ZHANG Z F, SHAO M Y, et al.Developmental expression pattern of the Fc-vasa-like gene, gonadogenesis and development of germ cell in Chinese shrimp, Fenneropenaeus chinensis[J]. Aquaculture, 2011, 314(1/4): 202–209. |
| [20] | 李媛媛, 蔡生力, 刘红.实时荧光定量PCR检测凡纳滨对虾和罗氏沼虾卵黄蛋白原mRNA在卵巢和肝胰腺中的表达[J]. 水产学报, 2012, 36(11): 1667–1674. LI Y Y, CAI S L, LIU H.Quantitative analysis of vitellogenin mRNA expression in Litopenaeus vannamei and Macrobrachium rosenbergii[J]. Journal of Fisheries of China, 2012, 36(11): 1667–1674. |
| [21] | ARCOS F G, IBARRA A M, RACOTTA L S.Vitellogenin in hemolymph predicts gonad maturity in adult female Litopenaeus (Penaeus) vannamei Shrimp[J]. Aquaculture, 2011, 316(1/4): 93–98. |
| [22] | CHEN T, ZHANG L P, WONG N K, et al.Pacific white shrimp (Litopenaeus vannamei) vitellogenesis-inhibiting hormone (VIH) is predominantly expressed in the brain and negatively regulates hepatopancreatic vitellogenin (VTG) gene expression[J]. Biology of Reproduction, 2014, 90(3): 47. |
2. Key Laboratory of Aquaculture in South China Sea for Aquatic Economic Animal of Guangdong Higher Education Institutes, Guangdong Ocean University, Zhanjiang 524088, Guangdong, China;
3. Zhanjiang Key Laboratory of Marine ecology and environment, Guangdong Ocean University, Zhanjiang 524088, Guangdong, China
 2016,
Vol. 25
2016,
Vol. 25


