2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
副溶血性弧菌(Vibrio parahaemolyticus)是一种嗜盐、革兰氏阴性杆状菌,广泛分布于海洋环境和各种海产品中,食用污染该菌而又未经良好加工处理的海产品会引发突发性食物中毒,可导致伤口感染、肠痉挛、败血症、腹泻、头痛和恶心等反应[1, 2, 3, 4, 5, 6],该病原菌是在中国、日本等许多亚洲国家引发食源性疾病的主要原因之一,并被公认为美国有关海鲜消费引发人类肠胃炎的首要原因[7],因此建立一种快速、准确、便捷的检测方法,对于从源头预防副溶血性弧菌的污染,预防中毒事故的发生具有重要意义。
检测食源性致病菌的方法主要包括传统培养法、分子生物学法、免疫学方法等。传统的检测检验程序较繁琐,在检测时间、灵敏度与特异性等方面也有局限性[8]。随着生物技术的发展,食源性致病菌检测领涌现出很多快捷、灵敏的新技术,如聚合酶链式反应(Polymerase chain reaction,PCR)技术[9, 10, 11]、环介导恒温扩增技术(Loop-mediated isothermal amplification,LAMP)[12, 13, 14, 15, 16, 17]、酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)[18, 19, 20, 21]和免疫层析技术(Lateral flow immunoassay,LFIA)等。LFIA是20世纪80年代初期发展起来的一种快速检测技术[22, 23],目前的研究主要以胶体金为标记物[24],磁性免疫层析试纸条和胶体金试纸条最大的区别在于,可用磁信号阅读仪对磁信号进行读取,而不只是依靠肉眼去判断,并且由于磁信号具有“穿透性”,仪器对磁信号的检测不受膜厚度的影响,能够检测膜中所有的磁珠,使结果的判定更为准确、客观;此外,磁珠只有在磁场中才会表现出磁性,可操作性强,磁信号不易受生物材料干扰,因此可能具有更高的灵敏度。
本研究首先制备了副溶血性弧菌的多克隆抗体,然后利用此多抗与磁性纳米材料偶联制备了磁纳米探针,并以此磁纳米探针为标记物构建了副溶血性弧菌的磁性免疫层析试纸条,优化并研究了层析体系对试纸条检测的影响,建立了副溶血性弧菌的磁纳米探针标记层析试纸法,为今后进一步建立快速简便的副溶血性弧菌现场检测方法奠定了基础。
1 材料与方法 1.1 材料辣根过氧化物酶标记的羊抗兔抗体(IgG-HRP)、山羊抗兔IgG购自上海友科生物科技有限公司;超顺磁性纳米材料来自同济大学生物医学工程与纳米科学研究院;Tween-20、蔗糖、四硼酸钠、硼酸、BSA牛血清白蛋白等购自上海生工生物工程技术服务有限公司;NHS、EDC购自上海延长生化科技发展有限公司;MES购自Alafa公司;硝酸纤维素膜、样品垫、结合垫、吸水纸购自上海捷宁生物科技有限公司;底板、卡槽、覆膜购自美国Magna Bioscience公司;磁性分析仪购自美国Magna Bioscience公司。实验用水均为去离子水,试剂均为分析纯。实验所用菌株皆来自本实验室。
1.2 方法 1.2.1 副溶血性弧菌多克隆抗体的制备、纯化及性能表征多抗的制备采取翁仕强[25]的方法进行,以紫外灭活的副溶血性弧菌 ATCC 33847 (1×107 CFU/mL)为抗原对新西兰大白兔分别进行1次颈背部皮下多点注射免疫和3次强化免疫,抗原注射量皆为1 mL。通过全真空采血器进行耳动脉取血,然后采用硫酸铵多步沉淀法纯化兔抗血清得到副溶血性弧菌多克隆抗体。
将实验所用菌株(n=14)活化培养,各取500 μL各菌株培养液包被酶标板,100 μL/孔,每种菌株4个平行。以1∶10 000稀释的纯化多抗为一抗,辣根过氧化物酶标记的羊抗兔抗体为二抗采用酶联免疫吸附法(ELISA)检测副溶血性弧菌兔多抗的特异性。
1.2.2 磁性免疫层析试纸条的构建磁纳米探针的制备参照黄韵仪等[26]的方法进行。先用EDC和NHS活化磁珠上的羧基,然后加入140 μg的副溶血性弧菌多克隆抗体与磁珠偶联,经活化缓冲液(10 mmol/L MES,0.05% (V/V) Tween-20,pH 5.0)和偶联缓冲液(5 mmol/L BS,0.05% (V/V) Tween-20,pH 9.0)洗涤后,最后加入BSA对磁珠上未偶联抗体的位点进行封闭,封闭后放入保存液中保存待用。按照底板、硝酸纤维素膜、结合垫、样品垫、吸水纸的顺序依次组装试纸条,T线喷涂2 mg/mL 副溶血性弧菌多抗,C线喷涂2 mg/mL的山羊抗兔IgG,30 ℃烘干后在硝酸纤维素膜上贴上覆膜,将组装完成的试纸条进行切割,每条宽0.5 cm,于干燥处保存[27]。
1.2.3 检测流程检测之前,先将偶联好的磁纳米探针加入2倍体积的磁珠悬浮液(含10 mg/mL海藻糖和蔗糖的BST)进行超声形成磁纳米探针悬浮液。检测时,以pH为9.0的50 mmol/L硼酸盐缓冲液(BS)为层析体系的基础缓冲液。阴性样本为不含有副溶血性弧菌的BS缓冲液,阳性样本为BS梯度稀释的副溶血性弧菌悬浮液。每根试纸条,取120 μL样品、10 μL适量层析体系、6 μL磁纳米探针室温混合反应5 min,然后取120 μL混合溶液滴加到样品垫10 min后,肉眼可以观察到清晰的条带进行定性检测,40 min后将试纸条卡入卡槽中置于磁信号分析阅读器中进行磁信号值(MAR)检测以获取定量检测结果。
1.2.4 层析体系优化正交实验采用正交设计L25(53),针对本研究中层析体系中的3个因素(Tween-20、蔗糖、BSA)分别进行5个水平的筛选(表1),25组层析体系的成分组成及正交实验设计见表2。检测采用的阳性样本为用BS梯度稀释的浓度分别为1×106 CFU/mL,2×105 CFU/mL,1×105 CFU/mL的副溶血性弧菌悬浮液,阴性样本为BS缓冲液。将不同浓度得到的结果进行正交分析,得出最优体系组合。将分析得到的最优组合及25组体系中检测结果较好的组合进行反复验证,进而确定最终体系组合。

|
表1 正交实验因素表 Tab. 1 Orthogonal factor level table |
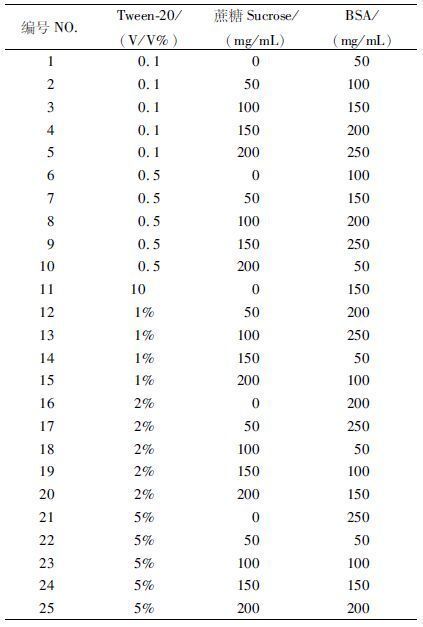
|
表2 层析体系的正交实验设计L25(53) Tab. 2 L25(53) orthogonal design for the factors and levels of immunochromatographic system |
根据以上得到的实验结果进行试纸条检测,C线、T线抗体浓度均为2 mg/mL,偶联时抗体添加量为140 μg。将培养好的菌悬液(8.2×106CFU/mL)用BS进行梯度稀释,得到浓度分别为1.6×105 CFU/mL,8.2×104CFU/mL,4.1×104 CFU/mL,1.6×104 CFU/mL,8.2×103 CFU/mL,4.1×103 CFU/mL的副溶血性弧菌悬浮液,阴性样本为BS缓冲液,对此样本进行检测,分析结果。
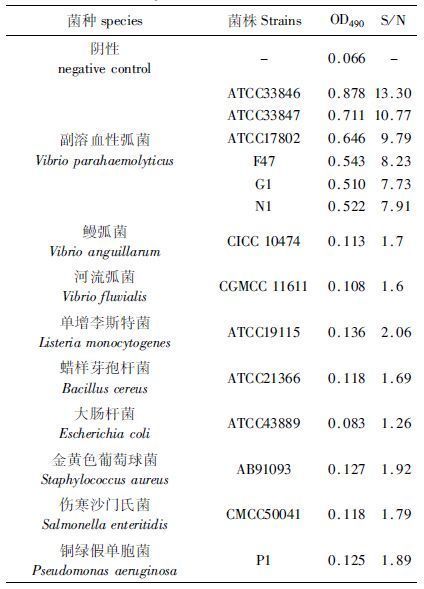
2 结果与讨论 2.1 多抗特异性检测副溶血性弧菌多克隆抗体的间接ELISA分析结果见表3。由表3可知,该多抗对副溶血性弧菌具有特异性反应,对弧菌属其他菌株以及属外菌株均无交叉反应,因此,制备的副溶血性弧菌多抗具有良好的特异性。
|
表3 多抗对不同菌株的ELISA检测结果 Tab. 3 ELISA analysis of polyclonal antibody with different strains |
由于免疫层析试纸条采取双抗夹心的原理,阳性结果呈现两条明显的条带,而阴性结果仅在C线处出现一条带。检测时,若C线处没有条带,则试纸条存在问题,检测结果视为无效结果。把试纸条装入专用的卡槽,插入磁性号分析仪的专用卡槽处读取试纸条T线和C线处的磁信号,以阳性样本与阴性样本的T线定量磁信号间的比值对检测结果进行评价,阳性样本的磁信号值设为S,阴性样本的磁信号值设为N,S/N≥2.1的样品其结果视为阳性,S/N<2.1的样品其结果视为阴性。
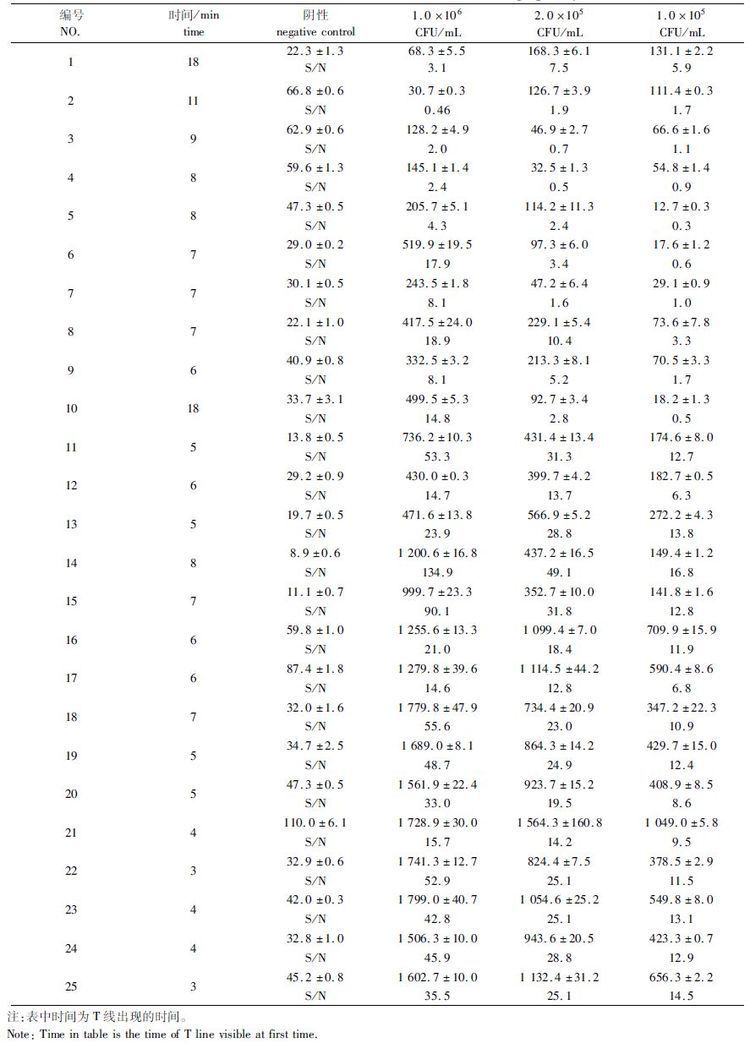
2.3 层析体系优化正交实验林婷婷等[28]的研究结果表明,在层析体系中添加一定浓度的Tween-20、蔗糖、BSA可以实现微生物的快速检测,而体系中各组分的含量则会影响试纸条的检测结果。Tween-20作为表面活性剂可以增加试纸条的毛细涌动力,促进抗原和免疫磁珠在膜中的层析运动,BSA则通过封闭硝酸纤维素膜上的空白位置减少膜上抗体与抗原的非特异性结合,而蔗糖则通过增加层析体系的粘稠度降低层析速度进而使其反应充分提高检测灵敏度。分别将25组层析体系对不同浓度的副溶血性弧菌进行检测,结果如表4所示。
|
表4 不同层析体系检测结果 Tab. 4 The detection results of different immunochromatographic system |
对正交试验结果进行极差分析,结果见表5。在极差分析中,求出每个因素在同一水平下的试验值的平均值(Ki,i=1,2,3,4,5),并求出同一因素在不同水平间的极差R值。R反映了每个因素对层析检测的影响程度,R值越大,表明该因素对试验结果的影响越显著。根据表5可知,3种因素对试纸条检测的影响从大到小依次为: Tween-20、BSA、蔗糖。此外,通过对1×105 CFU/mL检测结果的正交分析得到了新的26号体系组合(5% Tween-20,0 mg/mL 蔗糖,0.2 mg/mL BSA)。

|
表5 T线磁信号值的正交分析结果 Tab. 5 The orthogonal analysis results of magnetic signal of T-lines |
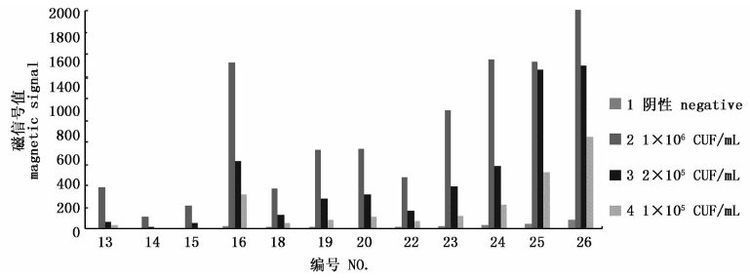
磁信号值低于50时,试纸条上条带肉眼不可见,因此阴性样本的T线磁信号值应该控制在50以下,而阳性样本的T线磁信号值则应越高越好,从而使S/N值增大得到较高的检测灵敏度。根据得到的检测结果,为避免检测的假阳性并提高其灵敏度,同时尽量缩短检测所需时间,选取编号为13、14、15、16、18、19、20、22、23、24、25、26的层析体系进行反复检测验证,得到图1所示结果,很明显,26号体系表现出最好的检测灵敏度,由于BSA在封闭的同时也具有一定的粘度,在26号体系中适宜浓度的BSA取代了蔗糖的作用,使层析体系的组分变的更加简单,因此,最终选取第26组体系为最终层析体系。
|
图1 层析体系检测结果 Fig.1 Test result of immunochromatographic system |
运用得到的优化层析体系对不同浓度的副溶血性弧菌进行定性和定量检测,定性检测结果如图2所示,阴性样本仅在C线出现一条条带,阳性样本出现C线和T线两个条带,而且,随着副溶血性弧菌浓度的降低,T线颜色逐渐变浅,其定性检测限为1.6×104 CFU/mL。定量检测结果如表6所示,结果表明,与磁性分析仪的结合可使最低检测浓度达到4.1×103 CFU/mL。

|
图2 副溶血性弧菌定性检测结果 Fig.2 Qualitative test result for V. parahaemolyticus |

|
表6 副溶血性弧菌定量检测结果 Tab. 6 Quantitative test result for V. parahaemolyticus |
副溶血性弧菌是一种广泛分布于海洋与盐湖的嗜盐性细菌,能引起虾、蟹等海产品患病。1998年以来的数据显示,副溶血性弧菌性食物中毒的发生规模及人群暴露规模呈明显上升趋势,已超过沙门氏菌食物,跃居细菌性中毒的首位[29]。为有效控制病原的发生和扩散,建立一种准确快速的检测手段是关键。
近年来,针对副溶血性弧菌的检测研究越来越多。臧红梅等[30]应用斑点ELISA在5~7 h内可实现1×104 CFU/mL副溶血性弧菌的检测;CHEN等[12]将以toxR基因为基础建立了对副溶血性弧菌的LAMP检测方法,检测灵敏度为1.1×105 CFU/mL,检测时间超过1 h;WANG等[31]联合多重PCR和DNA杂交技术对副溶血性弧菌进行检测,灵敏度高达2 pg DNA/反应,但是其检测过程比较繁琐,且检测时间超过12 h。
本研究制备了高特异性的副溶血性弧菌多克隆抗体,并以磁珠为标记物,建立了用于副溶血性弧菌快速检测的双抗夹心模式免疫层析试纸条,在此基础上通过正交实验对层析体系中Tween-20、蔗糖、BSA的浓度和含量进行了优化,确定了最优的层析体系:5% Tween-20、0 mg/mL蔗糖、0.2 mg/mL BSA。该磁性免疫层析试纸条对副溶血性弧菌的检测灵敏度可达4.1×103 CFU/mL,而检测在40 min内即可完成,在保证灵敏度的前提下,大大缩短了检测的时间,为副溶血性弧菌的检测提供了新的发展方向,同时也为其他食源性致病菌的检测提供了新的思路,有望成为建议的常规检测手段,具有良好的应用前景。
| [1] | WANG J J, SUN W S, JIN M T, et al. Fate of Vibrio parahaemolyticus on shrimp after acidic electrolyzed water treatment[J]. International Journal of Food Microbiology, 2014, 179: 50-56. |
| [2] | XU X K, WU Q P, ZHANG J M, et al. Prevalence, pathogenicity, and serotypes of Vibrio parahaemolyticus in shrimp from Chinese retail markets[J]. Food Control, 2014, 46: 81-85. |
| [3] | 姬华, 韩海红, 王洪新, 等. 副溶血弧菌预测模型与风险评估的研究进展[J]. 食品工业科技, 2009, 30(5): 346-349, 352. JI H, HAN H H, WANG H X, et al. Review about predicting model behavior and risk assessment of Vibrio parahaemolyticus[J]. Science and Technology of Food Industry, 2009, 30(5): 346-349, 352. |
| [4] | 金周浩, 宋达锋, 顾青. 副溶血弧菌致病因子与耐热直接溶血毒素的研究进展[J]. 水产科学, 2008, 27(6): 320-324. JIN Z H, SONG D F, GU Q. Advances of study on virulence factors and thermostable direct hemolysin o f Vibrio parahaemolyticus[J]. Fisheries Science, 2008, 27(6): 320-324. |
| [5] | 宁喜斌, 刘代新, 张继伦. 副溶血性弧菌的致病性及其快速检测[J]. 微生物与感染, 2008, 3(1): 53-56. NING X B, LIU D X, ZHANG J L. Pathogenic and rapid detection of Vibrio parahaemolyticus[J]. Journal of Microbes and Infection, 2008, 3(1): 53-56. |
| [6] | 张昭寰, 郭丹凤, 王敬敬, 等. 改良 K-B 法用于副溶血性弧菌耐药性检测[J]. 微生物学杂志, 2014, 34(1): 78-83. ZHANG Z H, GUO D F, WANG J J, et al. An improved kirby-bauer disk diffusion method to determine drug resistance against Vibrio parahaemolyticus[J]. Journal of Microbiology, 2014, 34(1): 78-83. |
| [7] | SU Y C, LIU C C. Vibrio parahaemolyticus: A concern of seafood safety[J]. Food microbiology, 2007, 24(6): 549-558. |
| [8] | 栗建永, 赵琢, 贾晓川, 等. 食源性致病菌检测分析技术的研究进展[J]. 食品研究与开发, 2013, 34(18): 110-115. LI J Y, ZHAO Z, JIA X C, et al. Advance on detection of foodborne pathogenic bacteria[J]. Food Research and Development, 2013, 34(18): 110-115. |
| [9] | HE P Y, CHEN Z W, LUO J Y, et al. Multiplex real-time PCR assay for detection of pathogenic Vibrio parahaemolyticus strains[J]. Molecular and Cellular Probes, 2014, 28(5-6): 246-250. |
| [10] | WEI J, ZHOU X M, XING D, et al. Rapid and sensitive detection of Vibrio parahaemolyticus in sea foods by electrochemiluminescence polymerase chain reaction method[J]. Food Chemistry, 2010, 123(3): 852-858. |
| [11] | ZHU R G, LI T P, JIA Y F, et al. Quantitative study of viable Vibrio parahaemolyticus cells in raw seafood using propidium monoazide in combination with quantitative PCR[J]. Journal of Microbiological Methods, 2012, 90(3): 262-266. |
| [12] | CHEN S Y, Ge B L. Development of a toxR-based loop-mediated isothermal amplification assay for detecting Vibrio parahaemolyticus[J]. BMC Microbiology, 2010, 10: 41, doi: 10.1186/1471-2180-10-41. |
| [13] | WANG L, SHI L, SU J Y, et al. Detection of Vibrio parahaemolyticus in food samples using in situ loop-mediated isothermal amplication method[J]. Gene, 2013, 515(2): 421-425. |
| [14] | PENGSUK C, LONGYANT S, RUKPRATANPORN S, et al. Development of monoclonal antibodies for simple detection and differentiation of Vibrio mimicus from V. cholerae and Vibrio spp. by dot blotting[J]. Aquaculture, 2010, 300(1-4): 17-24. |
| [15] | PROMPAMORN P, LONGYANT S, PENGSUK C, et al. Rapid identification and differentiation of Vibrio parahaemolyticus from Vibrio spp. in seafood samples using developed monoclonal antibodies[J]. World Journal of Microbiology and Biotechnology, 2013, 29(4): 721-731. |
| [16] | YAMAZAKI W, KUMEDA Y, MISAWA N, et al. Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of the tdh and trh genes of Vibrio parahaemolyticus and related Vibrio species[J]. Applied and Environmental Microbiology, 2010, 76(3): 820-828. |
| [17] | YI M Y, LING L, NEOGI S B, et al. Real time loop-mediated isothermal amplification using a portable fluorescence scanner for rapid and simple detection of Vibrio parahaemolyticus[J]. Food control, 2014, 41: 91-95. |
| [18] | HE Y Q, GUO G P, PAN Y J, et al. Influential factors of indirect ELISA for screening specific antibodies against food-borne pathogens and their application[J]. Immunological Journal, 2010, 26(10): 897-901. |
| [19] | KUMAR B K, RAGHUNATH P, DENEGOWDA D, et al. Development of monoclonal antibody based sandwich ELISA for the rapid detection of pathogenic Vibrio parahaemolyticus in seafood[J]. International Journal of Food Microbiology, 2011, 145(1): 244-249. |
| [20] | ZANG H M, FAN J F, WANG B. Detection of Vibrio parahaemolyticus by Dot-ELISA[J]. Journal of Dalian Fisheries University, 2006, 21(1): 79-82. |
| [21] | WANG W B, LIU L Q, SONG S S, et al. A highly sensitive ELISA and immunochromatographic strip for the detection of Salmonella typhimurium in milk samples[J]. Sensors, 2015, 15(3): 5281-5292. |
| [22] | DZANTIEV B B, BYZOVA N A, URUSOV A E, et al. Immunochromatographic methods in food analysis[J]. Trends in Analytical Chemistry, 2014, 55: 81-93. |
| [23] | PAEK S H, LEE S H, CHO J H, et al. Development of rapid one-step immunochromatographic assay[J]. Methods, 2000, 22(1): 53-60. |
| [24] | PREECHAKASEDKIT P, PINWATTANA K, DUNGCHAI W, et al. Development of a one-step immunochromatographic strip test using gold nanoparticles for the rapid detection of Salmonella typhi in human serum[J]. Biosensors and Bioelectronics, 2012, 31(1): 562-566. |
| [25] | 翁仕强. 副溶血性弧菌特异性抗体的制备研究[D]. 上海: 上海海洋大学, 2011. WENG S Q. Preparation of specific antibodies against Vibrio Parahaemolyticus[D]. Shanghai: Shanghai Ocean University, 2011. |
| [26] | 黄韵仪, 胡连花, 孙力军, 等. 副溶血性弧菌免疫磁珠偶联条件优化及捕获性能评价[J]. 微生物学杂志, 2012, 32(6): 7-11. HUANG Y Y, HU L H, SUN L J, et al. Optimization of immunomagnetic beads coupling conditions of Vibrio parahaemolyticus and its capturing performance evaluation[J]. Journal of Microbiology, 2012, 32(6): 7-11. |
| [27] | 李怀明, 许恒毅, 熊勇华. 免疫层析试纸条技术及其在食源性致病菌检测中应用的研究进展[J]. 食品科学, 2011, 32(17): 380-383. LI H M, XU H Y, XIONG Y H. Research progress on the application of immunochromatographic test strip technology in foodborne pathogen detection[J]. Food Science, 2011, 32(17): 380-383. |
| [28] | 林婷婷, 卢瑛, 潘迎捷. 单增李斯特菌磁性试纸条层析体系的研究[J]. 微生物学杂志, 2012, 32(3): 37-42. LIN T T, LU Y, PAN Y J. Magnetic test paper chromatography syetem for Listeria monocytogenes[J]. Journal of Microbiology, 2012, 32(3): 37-42. |
| [29] | 刘秀梅. 食源性疾病监控技术的研究[J]. 中国食品卫生杂志, 2004, 16(1): 3-9. LIU X M. Studies on the techniques for the monitoring and controlling foodborne illness[J]. Chinese Journal of Food Hygiene, 2004, 16(1): 3-9. |
| [30] | 臧红梅, 樊景凤, 王斌. 应用斑点 ELISA 技术检测副溶血弧菌[J]. 大连水产学院学报, 2006, 21(1): 79-82. ZANG H M, FAN J F, WANG B. Detection of Vibrio parahaemolyticus by Dot-ELISA[J]. Journal of Dalian Fisheries University, 2006, 21(1): 79-82. |
| [31] | WANG R Z, HUANG J D, ZHANG W, et al. Detection and identification of Vibrio parahaemolyticus by multiplex PCR and DNA-DNA hybridization on a microarray[J]. Journal of Genetics and Genomics, 2011, 38(3): 129-135. |
2. Shanghai Engineering Research Center of Aquatic-Product Processing&Preservation, Shanghai 201306, China
 2016, Vol. 25
2016, Vol. 25


