2. 上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学 国际海洋研究中心, 上海 201306;
4. 上海海洋大学 海洋生物系统与神经科学研究所, 上海 201306;
5. 美国马里兰大学工程学院土木和环境工程系, 美国 马里兰 20740;
6. 中国科学院上海应用物理研究所, 上海 201204
平衡囊是头足类生物感知位置信息和协调身体运动平衡的主要器官,能够感受重力和加速度的变化,从而以改变自身的行为模式来应变环境的变化,同时,平衡囊还能够感知水下声音信号[1, 2, 3]。
头足类的平衡囊可以看成是一个感受粒子振动的传感器,因此平衡囊的内部显微形态结构是制作仿生低频传感器数学模型的基础。其中,耳石(statolith)和感觉斑(macula)之间的显微结构关系被认为是关键所在[4]。但是,在对头足纲平衡囊的形态研究比较集中的20世纪60-80年代,在毛细胞和耳石之间的结构关系细节上并没能得到明确的答案;同时,对平衡囊感觉斑(macula) 和感觉脊(crista)的整体形态观察以及神经支配方式,也仍有待进一步的证实和补充。
本研究以长蛸(Octopus variabilis)的平衡囊为实验对象。长蛸,隶属于头足纲(Cephalopodo)、蛸亚纲(Coleoidea)、八腕目(Octopoda)、蛸科(Octopodidae)、蛸属(Octopus),是具有灵活运动能力的近海底栖无脊椎生物,在中国东、南沿海和日本列岛海域都有分布[5, 6]。平衡囊与鱼类内耳之间在形态和功能上具有明显的趋同进化效应[7],对平衡囊的研究也为研究动物听觉与平衡系统的进化,以及为进一步研究脊椎动物和人类结构功能更为复杂的内耳及其神经感觉系统提供科学依据和研究模式。
1 材料与方法 1.1 材料实验用长蛸购自上海市芦潮港镇水产市场,买回后在实验室暂养一周左右,期间投喂鲜虾、螃蟹等活饵料。养殖水温(20±2) ℃,海水盐度1.02±0.02,pH 8.0±0.2,实验时选取健康的长蛸10条,不分雌雄,体质量226.21~438.34 g。
1.2 光镜观察用解剖刀将软骨腔轻微划开,用针管吸取4%中性多聚甲醛轻轻注入到腔内,然后将整个软骨浸泡在固定液中1 h。将解剖完整的平衡囊(囊未破裂、耳石未脱落)在1%的锇酸溶液中固定0.5 h,然后换成0.1 mol/L磷酸盐缓冲液(Phosphate Buffer)冲洗3次,每次15 min。在ZEISS Discovery V12体视显微镜下观察囊表面结构和内部毛细胞区域的分布。
1.3 扫描电镜观察在Olympus LG-61解剖镜下用剪刀沿着平衡囊非毛细胞区域将平衡囊剪开,乙醇逐级脱水处理后经过临界点干燥后喷金上镜,在扫描电子显微镜(Hitachi S-3400N Ⅱ)下观察平衡囊结构并拍照。
1.4 透射电镜观察平衡囊样品在固定液中过夜后转入甲酸甲醛混合脱钙液中进行耳石脱钙处理,0.1 mol/L磷酸盐缓冲液漂洗后用1%锇酸在4 ℃固定2 h。漂洗后经过乙醇梯度脱水,将样品于环氧丙烷中置换乙醇,树脂置换、包埋,37、45、65 ℃依次烘箱过夜,整个过程中保持样品在环境湿度低于65%下操作。样品在上海交通大学医学院电镜室经过定位、切片,然后上机观察。
1.5 同步辐射X射线显微断层成像完整平衡囊在4%中性多聚甲醛固定后将样品经锇酸染色、脱水、置换后包埋在树脂中烘干。在中国科学院上海应用物理研究所、上海光源(BL13wW1)进行同步辐射采集信息并处理图像。同步辐射原理和方法参照和友等文章[8]。
2 结果长蛸的平衡囊包括感觉斑(macula)、耳石(statolith)、感觉脊(crista)、胶质顶(cupula)4部分。平衡囊的形态以及各结构的描述、命名依据YOUNG等的描述[9, 10]。
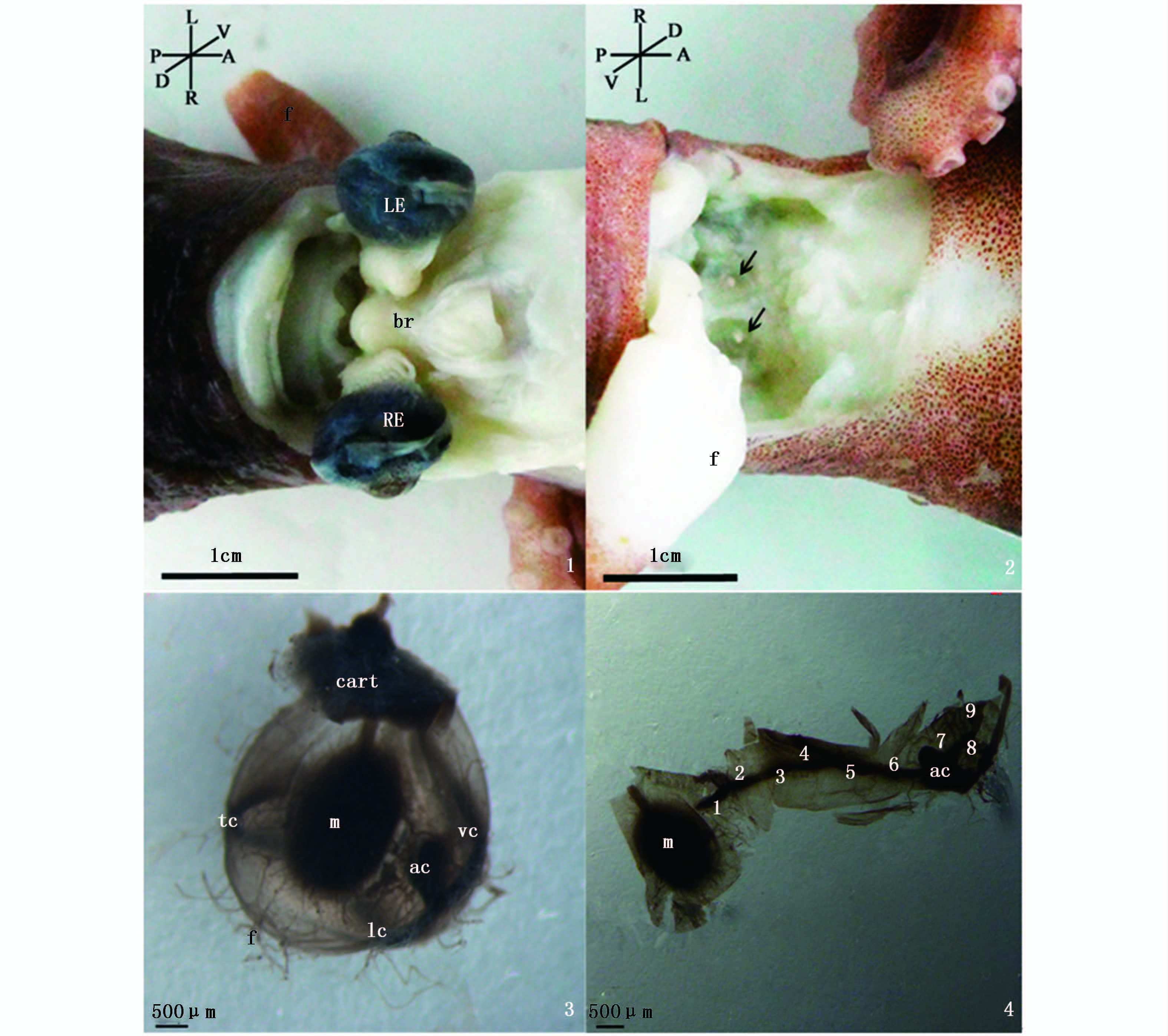
2.1 平衡囊位置与形态长蛸的平衡囊为不规则的卵圆形,大小在2.5~4.1 mm,位于头部软骨脑腔的后腹侧,眼球的下方(图版Ⅰ-1),透过头部腹侧透明的软骨可以看到囊内的耳石(图版Ⅰ-2)。
|
图版 Ⅰ >1.平衡囊位置背侧观, RE:右侧眼球, LE:左侧眼球, br:大脑, f:漏斗, L:左侧, R:右侧, D:背侧, V:腹侧, A:前侧, P:后侧; 2.平衡囊位置腹侧观, f:漏斗, L:左侧, R:右侧, D:背侧, V:腹侧, A:前侧, P:后侧, 箭头指向平衡囊; 3.平衡囊整体图, cart:软骨, m:感觉斑, f:纤维, tc:横向脊, lc:纵向脊, vc:垂直脊, ac:相对感觉脊; 4.剖开图, m:感觉斑, ac:相对感觉脊, 1-9:感觉脊(crista)的九个毛细胞片段。 Plate Ⅰ 1.Dorsal view of statocyst location , RE:right eye, LE:left eye, br:brain, 2.Ventral view of statocyst location, f:funnel, L-left, R-right, D-dorsal, V-ventral, A-anterior, P-posterior, arrows indicate the statocysts; 3.Statocyst of Octopus variabilis, cart:cartilage, f:fiber, tc:transverse crista, lc:longitudinal crista, vc:vertical crista, ac: anticristal; 4.Cut-away view, m:macula, ac:anticrista, 1-9 indicate the nine hair cells segments of crista. |
软骨腔中和平衡囊内都充满淋巴液,囊表面被大量纤维丝缠绕。平衡囊内部包括耳石和感觉上皮毛细胞分布。锇酸染色发现感觉毛细胞的分布主要为两个区域,一是位于耳石的腹侧呈椭圆形的感觉斑,另外一个是带状的感觉脊(图版Ⅰ-3、4)。
感觉脊区域呈螺旋型环绕整个平衡囊,在空间上分为相互垂直的3个区域:横向脊(transverse crista)、纵向脊(longitudinal crista)、垂直脊(vertical crista),每个区域分别包括3个毛细胞片段,共9段(图版Ⅰ-4),每段毛细胞之间有明显的间隙作为区分标志。
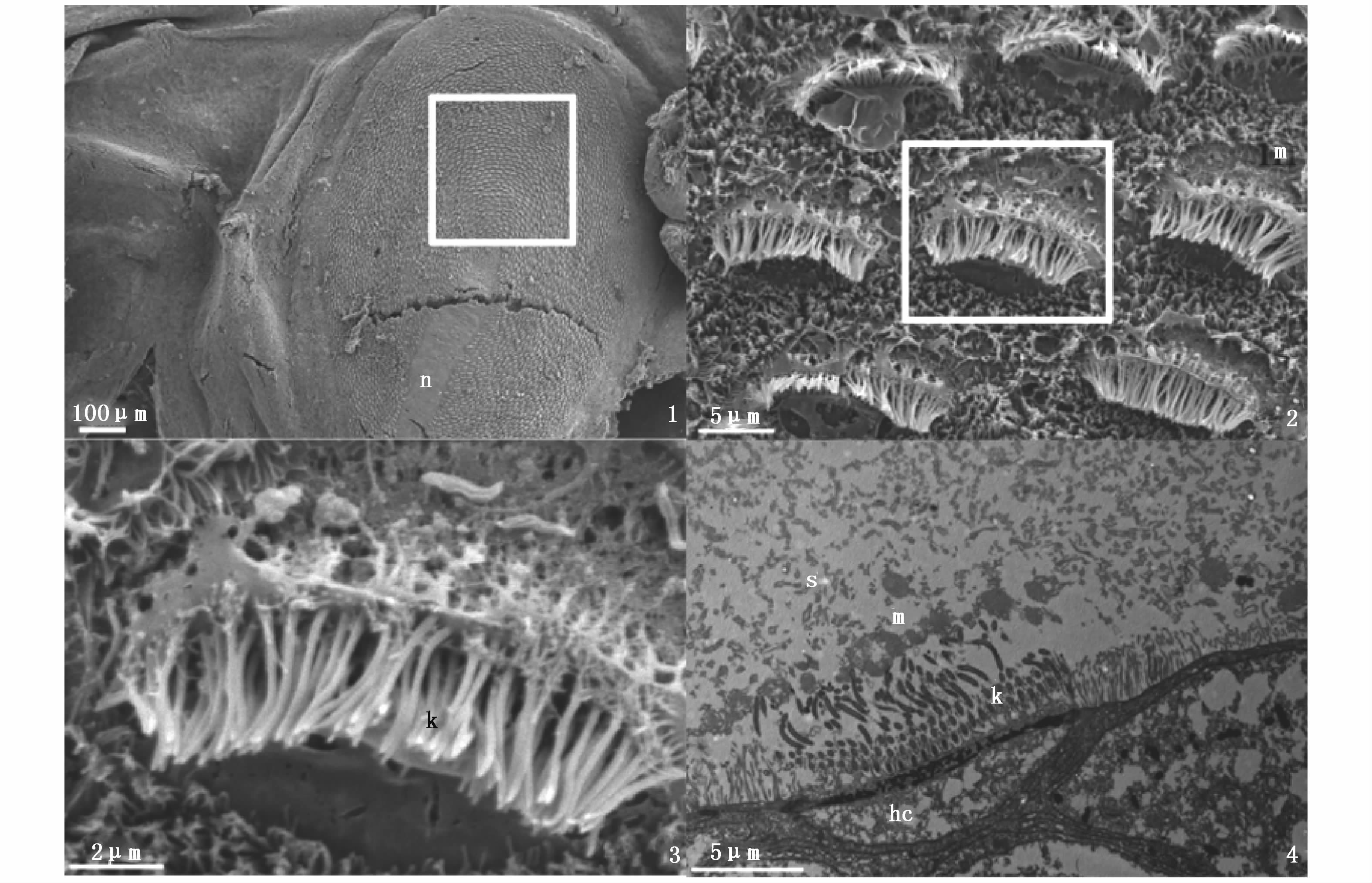
2.2 毛细胞的形态结构通过扫描电镜观察感觉斑区域,发现毛细胞由内而外呈环形排列。每个毛细胞顶部长有长度相等的动纤毛,排列成线状,长度约5 μm,动纤毛数量150根左右,没有静纤毛,有短小的微绒毛(图版Ⅱ-2、3);毛细胞的动纤毛全部都向圆心方向倾斜。感觉斑毛细胞群底部的中央有一股由许多小神经纤维聚成的神经束,从椭圆形的一端向中央延伸,神经束进入途中的区域没有毛细胞分布(图版Ⅱ-1)。
|
图版 Ⅱ 1.感觉斑(macula)整体图, n:感觉斑(macula)神经; 2.图1放大, m:微绒毛; 3.图2放大,k.动纤毛; 4.耳石和毛细胞之间显微结构, k:动纤毛, m:微绒毛, s:耳石, hc:毛细胞。 Plate Ⅱ 1.morphology of macula, n:macula nerve; 2.magnification of picture1, m:microvilli; 3.magnification of picture 2, k:kinocilium; 4.microstructure between statolith and hair cells, k:kinociliums, m: microvilli, s:statolith, hc:hair cell. |
透射电镜观察耳石-感觉斑结构,发现毛细胞的动纤毛顶端无序的深入耳石的缝隙当中,动纤毛和耳石颗粒之间有粘液质的物质存在。动纤毛的结构是9+2式微管结构,耳石底端到毛细胞层的距离约为5~7 μm(图版Ⅱ-4)。
通过扫描电镜观察感觉脊区域,发现毛细胞成线状排列,动纤毛的排列方向和细胞排列方向一致。9个感觉脊的毛细胞片段中奇数段和偶数段的毛细胞形态有一定的差异。
偶数段感觉脊的毛细胞从分布位置上可区分为背侧毛细胞(dorsal hair cells,dhc)、腹侧毛细胞(ventral hair cells,vhc)、大型毛细胞(large hair cells,lhc)、相对较大毛细胞(fairly large hair cells,flhc),见图版Ⅲ-5。其中腹侧毛细胞一般有1到3排,在片段中间区域最多,向两侧递减,动纤毛的排列整齐,数量和长度介于大型毛细胞和背侧毛细胞的动纤毛之间,大约有100根左右(图版Ⅲ-3、4);背侧毛细胞的排列相对不规则,动纤毛成圆形环绕,数量大约30根,长度约为2 μm(图版Ⅲ-5、6);大型毛细胞和相对较大毛细胞各自都只有一排,排列整齐,位于dhc和vhc中间区域,flhc细胞排列没有lhc那么规整,细胞与细胞之间排列紧密,界限不明显。大型毛细胞的动纤毛长约5 μm,数量约为150根左右(图版Ⅲ-5),相对较大毛细胞的动纤毛长度和背侧毛细胞相当,数量约为50根左右(图版Ⅲ-5)。

|
图版 Ⅲ 1.偶数段感觉脊(crista), g:段间间隙; 2.图1放大; 3.图2放大, vhc:腹侧毛细胞, lhc:大型毛细胞; 4.腹侧毛细胞vhc(图3放大); 5.大型毛细胞(lhc)、相对大毛细胞(flhc)和背侧毛细胞(dhc)位置; 6.背侧毛细胞(dhc)(图5放大); 7.奇数段感觉脊; 8.相对感觉脊(ac)。 Plate Ⅲ 1.even crista section, g:gap between even and odd segment; 2.magnification of picture1; 3.magnification of picture 2; 4.ventral hair cell(Magnification of picture 3); 5.location of large hair cell and fairly large hair cell and dorsal hair cell; 6.dorsal hair cell(magnification of picture 5); 7.odd section crista; 8.anticrista; vhc:ventral hair cell, lhc:large hair cell, flhc:fairly large hair cell, dhc:dorsal hair cell, ac:anticrista. |
奇数段感觉脊区域毛细胞大致与偶数段相同,最明显的区别在于奇数段的大型毛细胞是固定的两排,没有相对较大毛细胞(图版Ⅲ-7)。相对感觉脊并没有毛细胞分布(图版Ⅲ-8)。
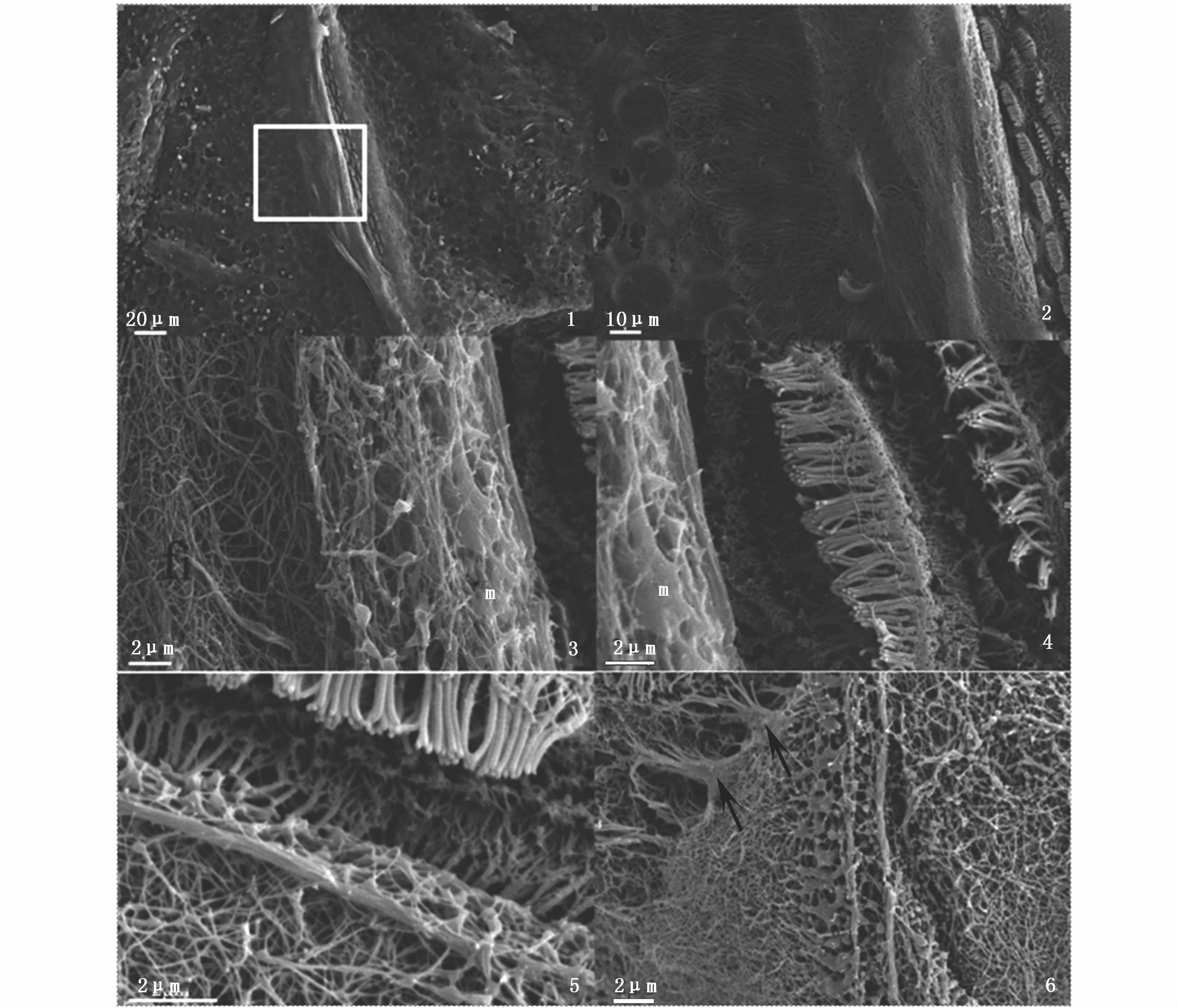
每一段感觉脊的感觉毛细胞表面都被胶质顶覆盖(图版Ⅳ-1),经过扫描电镜过程的处理,胶质顶只有大量的纤维丝留下,底部保留少量的粘液状物质(图版Ⅳ-3、4),胶质顶底部的纤维束纵横交错,容易将毛细胞动纤毛夹住缠绕(图版Ⅳ-4、5),在动纤毛的表面发现仍有纤维丝的存在,交缠在动纤毛之间(图版Ⅳ-4)。胶质顶和动纤毛的相互作用是发生在粘液环境当中(图版Ⅳ-6),动纤毛深入到胶质顶的纤维层内部,伴随着纤维束的摆动发生形变。
|
图版 IV 1.胶质顶覆盖在整段感觉脊; 2.图1放大; 3.胶质顶纤维和粘液结构; 4.胶质顶底部毛细胞; 5.胶质顶底部结构和毛细胞动纤毛; 6.动纤毛与纤维丝连接(箭头方向); fi:胶质顶纤维; m:粘液。 Plate IV 1.crista covered with cupula; 2.magnification of picture 1; 3.fiber and mucus of cupula; 4.hair cells under cupula; 5.relationship between cupula and kinociliums; 6.arrows indicate the connection between kinociliums and cupula. fi:fiber; m:mucus. |
光镜和扫描电镜发现平衡囊感觉斑神经只有一条,从椭圆形的毛细胞群底部的中央向一端延伸,穿过软骨腔进入中枢神经组织。
通过同步辐射断层扫描,我们可以得到平衡囊按任何一个方向开始的多个平行平面当中的连续信息。从平衡囊神经传入方向的多个连续平面中我们发现感觉脊神经束主要分为三条,即前感觉脊神经(图版Ⅴ-an)、中间感觉脊神经(图版Ⅴ-mn1、mn2)、后感觉脊神经(图版Ⅴ-pn),这3条从平衡囊表面穿过软骨层传入大脑。其中,中间感觉脊神经从软骨穿出后又有明显的两条分支(图版Ⅴ-2),前感觉脊神经和中间感觉脊神经是从同一条神经束中延伸出来(图版Ⅴ-2、3)。

|
图版 V 1.平衡囊所有神经束分支; 2.中感觉脊神经的两条分支汇聚; 3.前感觉脊神经和中感觉脊神经汇聚并穿过软骨层; 4.平衡囊神经入脑; cart:软骨; pn:后感觉脊神经; mn:感觉斑神经; an:前感觉脊神经; mn1:中感觉脊神经分支; mn2:中感觉脊神经分支。 Plate V 1.all nerve through statocyst; 2.two branchs of medial crista nerve; 3.anterior crista nerve and medial crista nerve converge into the cartilage; 4.nerve into brain. Cart:cartilage; pn.posteror crista nerve; mn:macula nerve; an:anterior crista nerve; mn1:medial crista nerve 1; mn2:medial crista nerve 2. |
长蛸的平衡囊结构在头足纲生物(八腕目、十腕目)中相对简单,这和它适应近海底栖生活相关,适合爬行或者缓行,很少做快速的、长距离的洄游活动[12]。长蛸的平衡囊与软骨完全分开,只有背侧神经传入区域相连接。感觉斑是单独的感觉区域;感觉脊区域分为三个部分,在空间上相互垂直,每个部分包括三个片段。在十腕目乌贼的平衡囊中,平衡囊与软骨连接紧密,它们的感觉斑分化成3个形态不同的区域;感觉脊分为4个部分在空间排布[13]。
平衡囊毛细胞动纤毛的倾斜方向非常特异,感觉斑区域毛细胞动纤毛全部向中心倾斜,感觉脊区域背侧毛细胞动纤毛向腹侧倾斜,腹侧毛细胞和大型毛细胞的动纤毛朝向背侧倾斜。动纤毛的这种倾斜方式和细胞的极化方向密切相关,既能满足感觉斑对所有方向的信息感知,也使得感觉脊的三个相互垂直区域感知各自区域相对方向的信息[9、14-15]。
3.2 感觉脊的神经支配感觉脊的毛细胞区域在空间上分为相互垂直的三部分,类似螺旋结构,起初认为每一部分都由一条神经支配[10]。BUDELMANN等[9]使用钴离子注射法证实3条神经对感觉脊3部分的毛细胞一端的支配方式,发现并不是每一条神经平均支配3个片段,中感觉脊神经同时支配横向脊的部分毛细胞和纵向脊的毛细胞。
本实验通过同步辐射的方法观察到感觉脊的神经共有4条,前感觉脊神经因为在进入平衡囊后就分散在囊表面,很难观察到神经纤维束在毛细胞方向的走向[9],但是在其入脑方向可以观察到明显的神经束。前感觉脊神经和中感觉脊神经的两条分支最终融合在一条神经束中穿过软骨层入脑,后感觉脊神经单独入脑。该结果再一次证明了中感觉脊神经同时支配着横向脊和纵向脊。前感觉脊神经和中感觉脊神经是否是同一根神经的两个分支仍然有待于进一步的确定,很可能二者只是并行的两股神经,只是在进入平衡囊时选择不同的走向。
3.3 感觉脊毛细胞胶质顶胶质顶与动纤毛之间的连接并不清楚,BUDELMANN等[7]猜测动纤毛的顶端和胶质顶底部的无定型物质连接,促成二者之间的相互作用。本文发现胶质顶底部纤维纵横交错,类似栅栏结构,毛细胞动纤毛被锁在这些结构当中,这种结构保证了二者在机械运动中信号的及时传导,使毛细胞能够迅速感知到平衡囊的活动状态;胶质顶底部的无定型物质可能是粘液成分,是连接动纤毛和胶质顶纤维丝的重要媒介。
平衡囊表面着生的纤维丝能够支撑、缓冲平衡囊的摆动,保证平衡囊在感知振动和运动过程中始终处于一定的动态范围,同时,平衡囊的稳定性也加强了对外界信息的传导性,使之更灵敏、更精确地感知信息的传递。由于头足纲生物的平衡囊对低频振动的感知比较灵敏[11],因此为设计低频传感器提供了良好的生物模型[4]。文章展示了平衡囊的许多细节结构,包括毛细胞动纤毛的长度以及细胞层和耳石之间的显微结构,这些显微形态结构关系的确证,为认识平衡囊的功能与机制的关键提供了答案;为建立数学模式和仿生低频传感器模型的建立提供了依据和基础;也促进了新型交叉学科综合研究关系的建立。
感谢林昱、李超、谢伟、张博在实验和采样中提供的帮助。
| [1] | ANDRÉ M, SOLÉ M, LENOIR M, et al. Low-frequency sounds induce acoustic trauma in cephalopods[J]. Frontiers in Ecology and the Environment, 2011, 9(9): 489-493. |
| [2] | HU M Y, YAN H Y, CHUNG W S, et al. Acoustically evoked potentials in two cephalopods inferred using the auditory brainstem response (ABR) approach[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 153(3): 278-283. |
| [3] | MYRBERG A N JR. Sound communication and interception in fishes[M]//TAVOLGA W N, POPPER A N, FAY R R, eds. Hearing and Sound Communication in Fishes. New York: Springer, 1981: 395-426. |
| [4] | ZHANG Y F, SHI F, SONG J K, et al. Hearing characteristics of cephalopods: Modeling and environmental impact study[J]. Integrative Zoology, 2014, 10(1): 141-151. |
| [5] | 陈新军, 刘必林, 王尧耕. 世界头足类[M]. 北京: 海洋出版社, 2009: 5-698. CHEN X J, LIU B L, WANG Y G. The world cephalopods[M]. Beijing: The Ocean Publishing Company, 2009: 5-698. |
| [6] | 宋海棠, 丁天明, 徐开达. 东海经济头足类资源[M]. 北京: 海洋出版社, 2009: 81-82. SONG H T, DING T M, XU K D. The resource of economic cephalopod in east China sea[M]. Beijing: The Ocean Publishing Company, 2009: 81-82. |
| [7] | BUDELMANN B U, BARBER V C, WEST S. Scanning electron microscopical studies of the arrangements and numbers of hair cells in the statocysts of Octopus vulgaris, Sepia officinalis and Loligo vulgaris[J]. Brain Research, 1973, 56: 25-41. |
| [8] | 和友, 肖体乔, MOENNER M. 同步辐射硬X射线成像用于小动物脑血管结构与功能的研究[J]. 生命科学, 2013, 25(8): 803-811. HE Y, XIAO T Q, MOENNER M. Application of synchrotron hard X-ray based imaging on small animal’s cerebral vasculature and function studies[J]. Chinese Bulletin of Life Sciences, 2013, 25(8): 803-811. |
| [9] | BUDELMANN B U, SACHSE M, STAUDIGL M. The angular acceleration receptor system of the statocyst of Octopus vulgaris: Morphometry, ultrastructure, and neuronal and synaptic organization[J]. Philosophical Transactions of the Royal Society B Biological Sciences, 1987, 315(1174): 305-343. |
| [10] | YOUNG J Z. The statocysts of Octopus vulgaris[J]. Proceedings of the Royal Society of London B Biological Sciences, 1960, 152(946): 3-29. |
| [11] | PACKARD A, KARLSEN H E, SAND O. Low frequency hearing in cephalopods[J]. Journal of Comparative Physiology A, 1990, 166(4): 501-505. |
| [12] | 董正之. 头足类若干结构的形态比较[J]. 动物学报, 1993, 39(4): 348-354. DONG Z Z. Morphological comparison of the several structures of cephalopods[J]. Acta Zoologica Sinica, 1993, 39(4): 348-354. |
| [13] | FERGUSON G, MESSENGER J, BUDELMANN B U. Gravity and light influence the countershading reflexes of the cuttlefish Sepia officinalis[J]. Journal of Experimental Biology, 1994, 191(1): 247-256. |
| [14] | BUDELMANN B U. Hair cell polarization in the gravity receptor systems of the statocysts of the cephalopods Sepia officinalis and Loligo vulgaris[J]. Brain Research, 1979, 160(2): 261-270. |
| [15] | BUDELMANN B U, WILLIAMSON R. Directional sensitivity of hair cell afferents in the Octopus statocyst[J]. Journal of Experimental Biology, 1994, 187: 245-259. |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Shanghai Ocean University, Shanghai 201306, China;
3. International Center of Marine Study, Shanghai Ocean University, Shanghai 201306, China;
4. Institute for Marine Biosystem and Neurosciences, Shanghai Ocean University, Shanghai 201306, China;
5. Department of Civil and Environmental Engineering, University of Maryland, College Park, Maryland 20740, USA;
6. Shanghai Synchrotron Radiation Facility, Shanghai Institute of Applied Physics, Chinese Academy of Science, Shanghai 201204, China
 2016, Vol. 25
2016, Vol. 25


