2. 中国水产科学研究院东海水产研究所 农业部东海与远洋渔业资源开发利用重点实验室, 上海 200090
海水养殖中,盐度变化往往引起多种生理应激反应,并会伴随着活性氧分子(ROS)的过量产生[1],对鱼类的存活、代谢及免疫防御影响显著[2]。总抗氧化能力(T-AOC)是用于衡量机体抗氧化系统功能状况的综合性指标,其大小可代表机体对外来刺激的代偿能力并反映机体自由基代谢的状态[3]。抗氧化系统在机体中分为抗氧化酶系统和非酶促系统,其中酶促系统主要包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等,这3种酶协同作用构成防止活性氧损伤的有效防护体系[4] ,在清除活性氧自由基方面发挥着重要作用[5]。通常认为,SOD在清除活性氧的过程中最早发挥作用,通过歧化作用分解超氧阴离子自由基(·O2-),是超氧阴离子自由基(·O2-)的清除剂[6]。SOD清除·O2-后产生H2O2,CAT与GSH-Px均能将H2O2转化为H2O,从而使细胞免于遭受H2O2的毒害,对机体起到保护作用[7]。同时,GSH-Px还能清除如脂肪酸等脂质过氧化物来维持细胞膜的正常功能。生物体内活性氧自由基攻击生物膜中的多不饱和脂肪酸时,会引发脂质过氧化,并最终降解产生丙二醛(MDA),通常认为MDA含量能间接地反映自由基攻击细胞的严重程度。因此,SOD、CAT、GSH-Px、T-AOC与MDA是研究鱼类受盐度胁迫下抗氧化的重要指标。然而,机体抗氧化系统与免疫系统密不可分[8]。已有研究表明血液SOD、CAT、GSH-Px活性与免疫指标总血细胞数、细胞吞噬作用和TNF-γ、IL-1β、TNF-α等细胞因子表达正相关[9, 10]。
非特异性的体液免疫系统是鱼类抵抗外来病原入侵的第一道防线,溶菌酶(Lysozyme,LSZ)是体液免疫因子,能水解革兰氏阳性细菌的细胞壁中粘肽的乙酰氨基多糖,并使之裂解并释放出来形成一个水解酶体系,破坏和消除侵入体内的异物,从而担负起机体防御的功能[11],是研究鱼类受盐度胁迫后免疫反应的重要指标[12]。
盐度对斜带石斑鱼(Epinephelus coioides)及点带石斑鱼(Epinephelus malabaricus)仔、稚、幼鱼存活率和生长性能的研究已有报道[13, 16],但对云纹石斑鱼(Epinehelus moara)的研究则较少。本实验试图通过检测云纹石斑鱼在急性盐度(27、21、15、9)胁迫下肝脏中抗氧化酶SOD、CAT、GSH-PX、T-AOC活力及MDA含量,并结合血清LZM活力,旨在明确其对盐度变化胁迫的响应,为养殖环境因子调控提供参考。
1 材料与方法 1.1 实验用鱼和条件实验于2014 年9 月在上海启东养殖基地进行。实验用鱼由黄海水产研究所提供,平均体长(10.43±1.08) cm,平均体质量(16.73±4.47) g。鱼运抵后先在水温(27±1.0) ℃、盐度27的环境中暂养2 周。暂养密度为20 尾/m3,每天 8:00和17:00各饱食投喂由日本林兼株式会社生产的“鱼宝牌”6# 配合饲料,不间断充气,每天换同盐同温水 25 %,同时吸去底部污物及残饵。实验用水为净化处理后的天然海水。
1.2 实验设计实验在直径1.0 m、深度0.8 m的圆形玻璃缸中进行。盐度梯度设为27、21、15、9,以盐度27暂养海水为对照组,低盐度海水(盐度21、盐度15、盐度9 )用曝气后自来水兑天然海水配置,实验用水配制稳定48 h后使用。每个盐度梯度设3 个平行,共12 个桶。实验开始时,随机从暂养群体中捞取个体直接放入各盐度组(含对照组)水体中,每个平行20 尾鱼。实验期间的投喂和管理与暂养期间相同,每天观察鱼的活动状况,及时捞出死鱼,统计死亡情况。从实验鱼放入各实验组水体作为起始 0 h并开始计时,在1、2、3、7 d各盐度梯度组中分别取样,每平行每次取3 尾。
1.3 取样和指标测定取样前停喂饲料1次,用 MS-222 (200 mg/L)将鱼麻醉后,用1 mL注射器(预冷)从尾部动脉抽取血液,4 ℃下静置 12 h,2 500 r/min离心 5 min,取上清液,置于1.5 mL 离心管中-20 ℃保存,用以检测LSZ含量。取完血样后将鱼置于冰盘上解剖,取出肝脏,用预冷生理盐水冲洗,并用吸水纸吸干,置于 1.5 mL离心管中-20 ℃保存,在30 d 内检测超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)、总抗氧化能力(T-AOC)及丙二醛(MDA)含量。测定前,先将肝脏在匀浆介质(pH 7.4,0.01 mol/L Tris-HCl,0.0001 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8 % NaCl)中剪碎,用匀浆机 15 000 r/min 研磨制成匀浆。用低温离心机4 ℃下1 500 r/min,离心5 min。根据需要,取上清液稀释后进行酶活力及总蛋白测定。
总蛋白采用考马斯亮兰法(南京建成试剂盒)进行测定。酶活力均采用南京建成试剂盒检测,按照说明书进行操作。其中,SOD活力测定采用黄嘌呤氧化酶法,活力单位定义为每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1 个SOD活力单位。CAT采用可见光法,活力单位定义为每毫克组织蛋白每秒分解1 mol H2O2的量为1 个活力单位。GSH-Px采用比色法测定,活力单位定义为每毫克蛋白质每分钟扣除非酶反应的作用,使反应体系中GSH-Px浓度降低1 mol/L为一个酶活力单位。
1.4 数据统计与分析实验结果用 SPSS 19.0 软件进行统计与分析。运用单因素方差分析,先进行方差齐性检验,不满足方差齐性时,对数据进行自然对数或平方根转换,然后采用Duncan’s检验进行多重比较,P<0.05为有显著性差异,数据以平均值±标准差(Mean±SD)表示。用 Excel 2007 绘制图表。
2 结果 2.1 云纹石斑鱼在盐度骤降条件下的活动能力和存活状况云纹石斑鱼在盐度骤降的水体中活动能力和摄食能力随盐度降低呈减弱的趋势。除盐度15 组在72 h内有4 尾鱼死亡、盐度9组在53 h内全部死亡外,其他盐度组均无死亡(表1)。盐度9 组在24 h时实验鱼的活动能力开始下降,主要表现为多静卧缸底、游动迟缓、身体失衡、大部分个体停食,有3 尾死亡。48 h时,全部停食,有6 尾死亡。当胁迫时间达到53 h,全部死亡。

|
表 1 不同盐度梯度下云纹石斑鱼幼鱼活动和存活的状况 Tab.1 Activities of juvenile Epinehelus moara reared at different salinitie |
随着盐度骤降的幅度增大和胁迫时间的不断延长,肝脏SOD活力的变化见图1。盐度21 组的SOD活力呈先下降后上升的趋势,第3天出现峰值且为各值中的最高点(P<0.05);盐度15 组SOD活力呈下降趋势,且下降后一直处于较低水平(P<0.05);盐度9 组SOD活力呈先下降后上升的趋势,但均未超过初始值(P<0.05)。对于同一时间的不同实验组:随着盐度的降低,第1天和第7天均呈下降趋势,酶活力最高点均出现在盐度27 组;第2天和第3天呈波动变化趋势。

|
图 1 不同盐度下云纹石斑鱼肝脏超氧化物歧化酶(SOD)活性 Fig.1 The activity of SOD in the liver of Epinehelus moara reared at different salinities |
肝脏CAT活力的变化见图2。盐度21 组与盐度15 组CAT活力呈先下降后上升的趋势,第3天均出现峰值且为各值中的最高点(P<0.05);盐度9 组CAT活力呈先下降后上升的趋势,但均未超过初始值(P<0.05)。不同实验组在各时间点内CAT变化无规律,第1天随着盐度降低CAT酶活力下降,且盐度15、盐度9 与其他各组之间差异显著(P<0.05)。

|
图 2 不同盐度下云纹石斑鱼肝脏过氧化氢酶(CAT)活性 Fig.2 The activity of CAT in the liver of Epinehelus moara reared at different salinities |
肝脏GSH-PX活力的变化见图3。盐度 27 对照组GSH-Px活力变化不显著(P>0.05);盐度21 组与盐度15组GSH-Px活力呈先上升后下降的趋势,第1天均出现峰值(P<0.05);盐度9 组GSH-Px活力呈上升的趋势,且第2天为各值中最高点(P<0.05)。对于同一时间的不同实验组:随着盐度的降低,第1天呈先上升后下降的趋势,酶活力最高点出现在盐度21 组;第2、3天均呈先下降后上升的变化趋势;第7天呈下降趋势。

|
图 3 不同盐度下云纹石斑鱼肝脏谷胱甘肽过氧化物酶(GSH-Px)活性 Fig.3 The activity of GSH-Px in the liver of Epinehelus moara reared at different salinities |
肝脏T-AOC活力的变化见图4。盐度21组T-AOC活力呈先下降后上升再下降的趋势,第3天出现峰值(P<0.05);盐度15组T-AOC活力呈先上升后下降的趋势,第2天出现峰值(P<0.05);盐度9组T-AOC活力呈先下降后上升的趋势,但均未超过对照组(P<0.05)。对于同一时间的不同实验组:随着盐度的降低,第1、2、7天均呈波动的变化趋势,第1天与第7天酶活力峰值均出现在盐度27对照组,第2天酶活力最高点出现在盐度15组;第3天呈先上升后下降的变化趋势;第7天呈下降趋势。
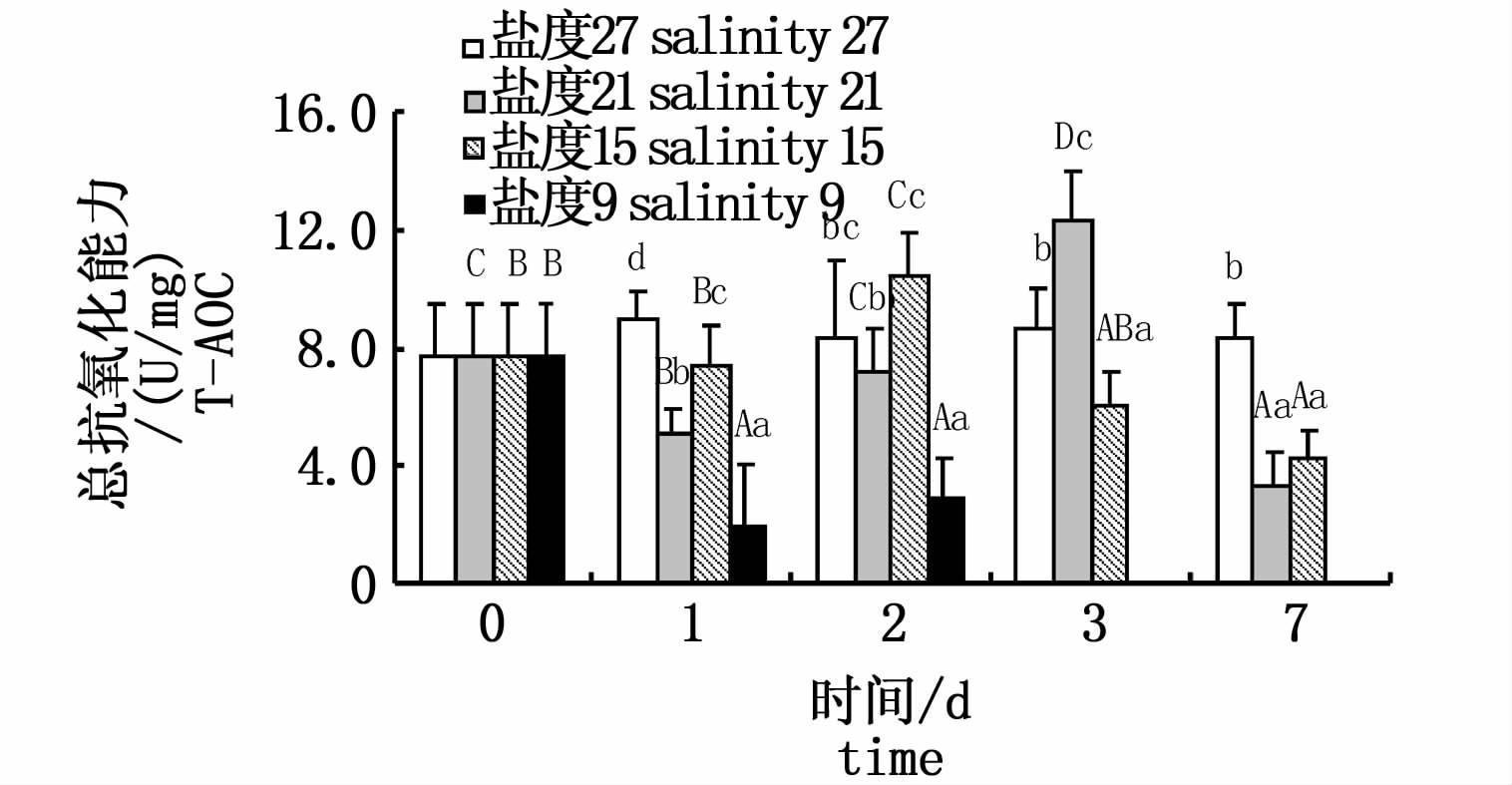
|
图 4 不同盐度下云纹石斑鱼肝脏总抗氧化能力(T-AOC)活性 Fig.4 The activity of T-AOC in the liver of Epinehelus moara reared at different salinities |
随着盐度的逐步下降和处理时间的不断延长,肝脏中MDA的含量变化见图5。盐度21组与盐度15组MDA含量均呈先上升后下降的趋势,均在第1天出现峰值(P<0.05);盐度9组MDA含量呈下降的趋势,但均未超过对照组(P<0.05)。对于同一时间的不同实验组:随着盐度的降低,第1天呈先上升后下降的趋势,峰值出现在盐度21组,第2天均呈波动的变化趋势,第3天与第7天均呈下降趋势。
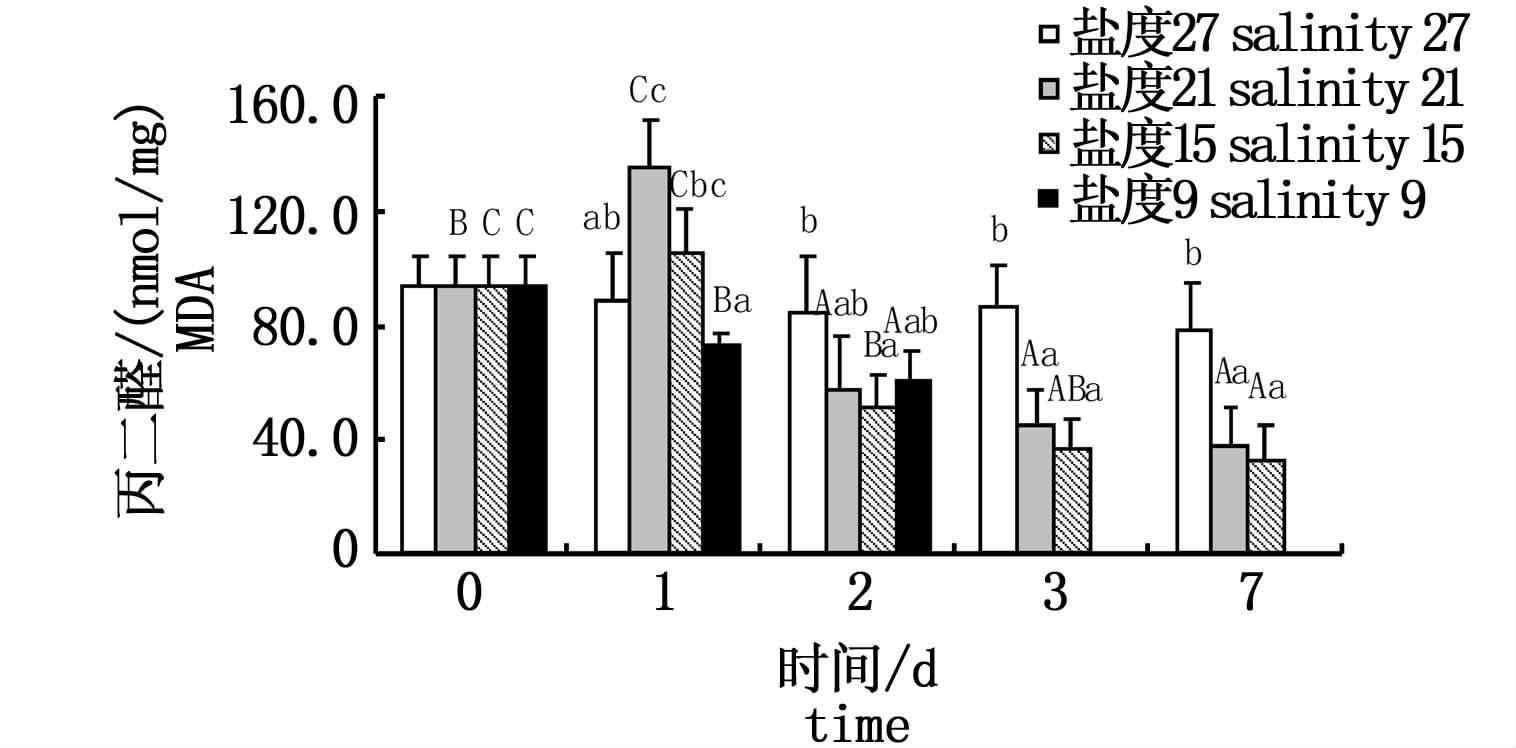
|
图5 不同盐度下云纹石斑鱼肝脏丙二醛(MDA)含量 Fig.5 The contents of MDA in the liver of Epinehelus moara reared at different salinities |
随着盐度的逐步下降和处理时间的不断延长,肝脏中LSZ的含量变化见图6。盐度21组LSZ含量均呈先上升后下降的趋势,第1天出现峰值(P<0.05);盐度15 组和9 组LSZ含量呈下降的变化趋势,但均未超过对照组(P<0.05)。对于同一时间的不同实验组:随着盐度的降低,第1天呈先上升后下降的趋势,峰值出现在盐度21 组,第2天呈下降的变化趋势,第3天与第7天均呈波动的变化趋势。

|
图6 不同盐度下云纹石斑鱼血清溶菌酶(LSZ)活性 Fig.6 The activity of LSZ in the liver of Epinehelus moara reared at different salinities |
曾文阳[17]指出点带石斑鱼成鱼可以适应的盐度为11~41;余燕等[18]通过逐级降低水体盐度的研究方法表明点带石斑鱼的低盐区临界盐度在8~13 之间,盐度15 以下,一些抵抗力较低的幼鱼就不能存活。本实验过程中,盐度15 组石斑鱼72 h内死亡4尾;盐度9 组实验鱼至53 h时全部死亡。表明云纹石斑鱼的盐度骤降临界梯度在9~15 之间。因此在实际养殖过程中,盐度波动不能太大,最好保持在15 以上,否则将对幼鱼的生长产生不利影响。
3.2 不同盐度对云纹石斑鱼抗氧化酶活力的影响有研究显示,鱼类在应对盐度变化的过程中,抗氧化酶SOD、CAT和GSH-Px会随着盐度的降低而升高。舌齿鲈(Dicentrarchus labrax)的培育盐度从37 降到5,血清中SOD活力在处理12 h后显著增高[19];许氏平鲉(Sebastes schlegeli)血液中SOD、CAT的比活力随海水盐度降低呈逐渐上升趋势[20];同样在军曹鱼(Rachycentron canadum)肌肉中SOD、CAT和GSH-Px活力均随着盐度的降低而增高[21]。但本实验研究结果与这些研究并不完全一致。本实验中,随着盐度降低,SOD与CAT活力第1天均呈下降趋势,直至第3天盐度21 组的SOD和盐度21、15 组的CAT大幅度升高,随后第7天下降恢复正常水平。即本实验在最初阶段,未出现抗氧化酶活力与盐度呈反相关的变化,而是相反呈正相关的变化,直到中期阶段抗氧化酶活力大幅升高。
对于初期SOD与CAT活力下降并低于对照组的情况,可能与盐度变化对水生生物产生较强的应激反应有关。如虾夷扇贝(Patinopecten yessoensis)在盐度逐渐降低时血清中SOD活力显著下降后逐渐恢复[22];盐度突降时栉孔扇贝(Chlamys farreri)血液中SOD总体也呈下降趋势[23];低盐度胁迫下三疣梭子蟹(Portunus trituberculatus)血清中SOD活性降低[24];盐度升高后施氏鲟(Acipenser schrenckii)不同组织器官中SOD和CAT活力先降低后升高[25]。因此推测,盐度骤降起初对云纹石斑鱼的SOD与CAT活力产生了一定的抑制作用,但随时间延长SOD活力出现恢复,且SOD清除·O2-后产生的H2O2也不断增高,因此,石斑鱼体内的CAT活力水平也跟着增高,与SOD在第3天时大幅升高以消除机体中积累的大量自由基,保护机体免受伤害。
虽CAT与GSH-Px均能将H2O2转化为H2O,但有研究表明两者变化并不完全一致。如斑节对虾(Penaeus monodon)在低盐度下,幼虾肌肉中CAT与GSH-Px活力表现出相反的变化趋势[26],本研究结果与此相似,GSH-Px活力在盐度骤降后第1天显著升高,除盐度9组呈上升趋势,其他实验组随后均不断下降。因此推断,盐度骤降在实验初期并未抑制GSH-Px活力,反而云纹石斑鱼在应激反应中可能产生了大量的脂质过氧化物,故GSH-Px活力大幅上升以清除过量的脂质过氧化物。随后积累的大量自由基由SOD与CAT活力恢复后消除。
MDA的含量能间接反映自由基攻击细胞的严重程度。如盐度从12 降低到8 时凡纳滨对虾(Penaeus vannamei) 仔虾肌肉中MDA的含量无显著变化,而盐度从12 骤降到5 时MDA则显著升高[27];多鳞四指马鲅(Eleutheronema rhadinum)幼鱼肝脏中MDA含量随盐度的降低而降低[28],随时间的延长也呈降低趋势。本实验中,MDA含量随盐度的降低及时间的延长均呈先升高后降低的变化趋势,总体变化与上述研究结果相似,其变化趋势与SOD、CAT活性变化趋势相反,恰好说明,盐度骤降抑制SOD、CAT活力时,MDA含量升高,机体受到自由基的损伤较大,随着SOD与CAT活力的恢复,自由基减少,MDA含量降低。
机体防御体系的总抗氧化能力的强弱与健康程度存在着密切联系。本实验中,云纹石斑鱼的T-AOC呈先下降后上升的趋势,与SOD、CAT活力变化趋势一致。
3.3 不同盐度对云纹石斑鱼血清溶菌酶活力的影响有研究表明,盐度降低时,鱼体中LSZ活力会呈先升高后降低的变化趋势。如FEVOLDEN等[29]认为LSZ活性可作为鱼类应激的信号;牙鲆(Paralichthys olivaceus)的培育盐度降低后,溶菌酶活力升高,第5天达到最高值,随后逐渐降低[30];军曹鱼在低盐处理后,溶菌酶活力变化与牙鲆相似[31];许氏平鲉的溶菌酶活力随海水盐度的降低在处理24 h后达到峰值,之后逐渐下降[20]。本研究结果与这些研究结果相似,处理初期,溶菌酶活力增加以应对外源压力,但随胁迫时间延长,鱼体内多种生理功能发生紊乱,从而降低了自身的抵抗力,溶菌酶活力下降,影响鱼体的生长甚至存活情况。故溶菌酶在云纹石斑鱼非特异性免疫中具有重要的作用。
4 小结本实验通过对云纹石斑鱼在盐度骤降下的存活状况进行观察,并检测不同盐度下其肝脏中抗氧化酶活力、MDA含量、血清LSZ随时间变化的情况,探讨了云纹石斑鱼肝脏抗氧化指标和血清溶菌酶活力对盐度骤降的响应。发现云纹石斑鱼的盐度骤降临界梯度在9~15 之间,SOD与CAT酶活力初期会受到抑制,随后恢复,以抵御胁迫伤害。溶菌酶活力随时间延长先升高后降低,在非特异性免疫中发挥重要作用。本研究使用的鱼规格较小,盐度骤降对鱼体生长影响大,因此在云纹石斑鱼幼鱼的养殖生产中应避免养殖水体盐度大幅度降低。
| [1] | CHOI C Y, AN K W, AN M I. Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder (Paralichthys olivaceus)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 149(3): 330-337. |
| [2] | HOWELL B R, DAY O J, ELLIS T, et al. Early life stages of farmed fish[M]//BLACK K D, PICKERING A D. Biology of Farmed Fish. Sheffield: Sheffield Academic Press, 1998: 27-66. |
| [3] | 张春玲, 胡俊峰, 王丕文, 等. 苯并(a)芘对鲫鱼肝脏总抗氧化能力的影响[J]. 环境与健康杂志, 2004, 21(5): 325-326. ZHANG C L, HU J F, WANG P W, et al. Effects of B(a)P on T-AOC in liver of Carassius auratus[J]. Journal of Environment and Health, 2004, 21(5): 325-326. |
| [4] | 连灵君. 用多项生物标志物评价铅对小鼠的氧化损伤[D]. 杭州: 浙江大学医学院, 2006. LIAN L J. Evaluation of oxidative damage induced by lead in mice using multi-biomarkers[D]. Hangzhou: Medical College of Zhejiang University, 2006. |
| [5] | DA SILVA A Z, ZANETTE J, FERREIRA J F, et al. Effects of salinity on biomarker responses in Crassostrea rhizophorae (Mollusca, Bivalvia) exposed to diesel oil[J]. Ecotoxicology and Environmental Safety, 2005, 62(3): 376-382. |
| [6] | 徐立红, 张甬元, 陈宜瑜. 分子生态毒理学研究进展及其在水环境保护中的意义[J]. 水生生物学报, 1995, 9(2): 171-185. XU L H, ZHANG Y Y, CHEN Y Y. The advance of molecular ecotoxicology and its significance in water environment protection[J]. Acta Hydrobiologica Sinica, 1995, 9(2): 171-185. |
| [7] | 吴海一. 重金属对扁额细首纽虫抗氧化防御系统及脂质过氧化作用的影响[D]. 青岛: 中国海洋大学, 2008. WU H Y. Effects on antioxidant defense system and lipid peroxidation of nemertean, cephalothrix simila by heavy metals[D]. Qingdao: Ocean University of China, 2008. |
| [8] | 李昊阳, 钟荣珍, 房义, 等. 动物氧化应激与免疫的研究进展[J]. 动物营养学报, 2014, 26(11): 3217-3221. LI H Y, ZHONG R Z, FANG Y, et al. Research progress on oxidative stress and immunity of animals[J]. Chinese Journal of Animal Nutrition, 2014, 26(11): 3217-3221. |
| [9] | SINGARAM G, HARIKRISHNAN T, CHEN F Y, et al. Modulation of immune-associated parameters and antioxidant responses in the crab (Scylla serrata) exposed to mercury[J]. Chemosphere, 2013, 90(3): 917-928. |
| [10] | XU H, SHAO X L, ZHANG Z, et al. Oxidative stress and immune related gene expression following exposure to di-n-butyl phthalate and diethyl phthalate in zebrafish embryos[J]. Ecotoxicology and Environmental Safety, 2013, 93: 39-44. |
| [11] | 李凌, 吴灶和. 鱼类体液免疫研究进展[J]. 海洋科学, 2001, 25(11): 20-22. LI L, WU Z H. Development of the humoral immunology in fish[J]. Marine Sciences, 2001, 25(11): 20-22. |
| [12] | 艾春香, 陈立侨, 高露姣, 等. Vc对河蟹血清和组织中超氧化物歧化酶及碱性磷酸酶活性的影响[J]. 台湾海峡, 2002, 21(4): 431-438. AI C X, CHEN L Q, GAO L J, et al. Effect of vitamin C on SOD, ALP and ACP activities of Chinese mitten-handed crab, Eriocheir sinensis[J]. Journal of Oceanography in Taiwan Strait, 2002, 21(4): 431-438. |
| [13] | 刘冬娥. 斜带石斑鱼早期发育阶段的生物学研究[D]. 厦门: 集美大学, 2007. LIU D E. Study on biology of Epinephelus coioides during early developmental stage[D]. Xiamen: Jimei University, 2007. |
| [14] | 张海发, 刘晓春, 王云新, 等. 温度、盐度及pH对斜带石斑鱼受精卵孵化和仔鱼活力的影响[J]. 热带海洋学报, 2006, 25(2): 31 -36. ZHANG H F, LIU X C, WANG Y X, et al. Effects of temperature, salinity and pH on hatch and larval activity of Epinephelus coioides[J]. Journal of Tropical Oceanography, 2006, 25(2): 31 -36. |
| [15] | 张雅芝, 刘冬娥, 方琼珊, 等. 温度和盐度对斜带石斑鱼幼鱼生长与存活的影响[J]. 集美大学学报(自然科学版), 2009, 14(1): 8-13. ZHANG Y Z, LIU D E, FANG Q S, et al. Effects of temperature and salinity on growth and survival of Young Epinephelus coioides[J]. Journal of Jimei University (Natural Science), 2009, 14(1): 8-13. |
| [16] | 林建斌, 李金秋, 朱庆国, 等. 盐度对点带石斑鱼生长、肌肉成分和消化率的影响[J]. 海洋科学, 2009, 33(3): 31-35. LIN J B, LI J Q, ZHU Q G, et al. Effects of salinity on the growth, muscle composition and digestibility of Epinephelus coioides[J]. Marine Sciences, 2009, 33(3): 31-35. |
| [17] | 曾文阳. 石斑鱼养殖学[M]. 高雄: 前程出版社, 1988: 109-111. ZENG W Y. Aquaculture of Grouper[M]. Gaoxiong: Qiancheng Press, 1988: 109-111. |
| [18] | 余燕, 徐维娜, 刘兆普, 等. 低盐度胁迫对点带石斑鱼幼鱼消化酶、抗应激酶和存活率的影响[J]. 渔业科学进展, 2009, 30(4): 21-26. YU X, XU W N, LIU Z P, et al. Effect of low salinity stress on activities of digestive and anti-stress enzymes, and survival rate of juvenile Epinephelus malabaricus[J]. Progress in Fishery Sciences, 2009, 30(4): 21-26. |
| [19] | ROCHE H, BOGE G. Fish blood parameters as a potential tool for identification of stress caused by environmental factors and chemical intoxication[J]. Marine Environmental Research, 1996, 41(1): 27-43. |
| [20] | 王晓杰, 张秀梅, 李文涛. 盐度胁迫对许氏平鲉血液免疫酶活力的影响[J]. 海洋水产研究, 2005, 26(6): 17-21. WANG X J, ZHANG X M, LI W T. Effect of salinity stress on the non-specific immuno-enzymetic activity of Sebastes schlegeli[J]. Marine Fisheries Research, 2005, 26(6): 17-21. |
| [21] | 杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J]. 广东海洋大学学报, 2007, 27(4): 25-29. YANG J, CHEN G, HUANG J S, et al. Effects of temperature and salinity on the growth and activities of antioxidant enzymes of cobia (Rachycentron canadum) juveniles[J]. Journal of Guangdong Ocean University, 2007, 27(4): 25-29. |
| [22] | 刘美剑, 常亚青, 杨云菲, 等. 盐度渐变对虾夷扇贝(Patinopecten yessoensis)免疫指标的影响[J]. 中国农业科技导报, 2011, 13(3): 129-135. LIU M J, CHANG Y Q, YANG Y F, et al. Effects of gradual salinity Changes on immune parameters of scallop (Patinopecten yessoensis)[J]. Journal of Agricultural Science and Technology, 2011, 13(3): 129-135. |
| [23] | 马洪明, 刘晓伟, 麦康森, 等. 盐度突降对栉孔扇贝(Chlamys farreri)抗病力指标的影响[J]. 高技术通讯, 2006, 16(7): 746-751. MA H M, LIU X W, MAI K S, et al. Effects of abrupt salinity decline on anti-disease ability of scallop Chlamys farreri[J]. Chinese High Technology Letters, 2006, 16(7): 746-751. |
| [24] | 郑萍萍, 王春琳, 宋微微, 等. 盐度胁迫对三疣梭子蟹血清非特异指标性免疫因子的影响[J]. 水产科学, 2010, 29(11): 634-638. ZHENG P P, WANG C L, SONG W W, et al. Effect of salinity stress on Serum non-specific immune factors in Swimming Crab Portunus trituberculatus[J]. Fisheries Science, 2010, 29(11): 634-638. |
| [25] | 赵峰, 庄平, 章龙珍, 等. 施氏鲟不同组织抗氧化酶对水体盐度升高的响应[J]. 海洋水产研究, 2008, 29(5): 65-69. ZHAO F, ZHUANG P, ZHANG L Z, et al. Responses of antioxidases in different tissues of Acipenser schrenckii to increased salinity in water[J]. Marine Fisheries Research, 2008, 29(5): 65-69. |
| [26] | WANG W N, WU J, SU S J. Effects of salinity stress on antioxidant enzymes of Penaeus monodon of two different life stages[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2008, 148(4): 466. |
| [27] | 季延滨, 于雯雯, 孙金辉, 等. 盐度骤降对南美白对虾仔虾抗氧化机能的影响[J]. 天津农学院学报, 2008, 15(4): 19-23. JI Y B, YU W W, SUN J H, et al. Effects of sudden drop in salinity on activities of antioxidant enzymes of Litnpenaeus vannamei[J]. Journal of Tianjin Agricultural University, 2008, 15(4): 19-23. |
| [28] | 张琴星, 张涛, 侯俊利, 等. 盐度变化对多鳞四指马鲅幼鱼鳃丝Na+/K+-ATP酶及肝脏抗氧化酶活性的影响[J]. 海洋渔业, 2013, 35(3): 324-330. ZHANG Q X, ZHANG T, HOU J L, et al. Effects of salinity on activities of gill Na+/K+-ATPase and liver antioxidase in juvenile Eleutheronema rhadinum[J]. Marine Fishery, 2013, 35(3): 324-330. |
| [29] | FEVOLDEN S E, ROED K H. Cortisol and immune characteristics in rainbow trout (Oncorhynchus mykiss) selected for high or low tolerance to stress[J]. Journal of Fish Biology, 1993, 43(6): 919 -930. |
| [30] | 魏然, 张士璀, 王长法, 等. 盐度对牙鲆非特异性免疫功能的影响[J]. 海洋科学进展, 2003, 21(2): 209-213. WEI R, ZHANG S C, WANG C F, et al. Effects of changes in salinity on nonspecific immune function of Japanese flounder Paralichthys olivaceus[J]. Advances in Marine Science, 2003, 21(2): 209-213. |
| [31] | 冯娟, 徐力文, 林黑着, 等. 盐度变化对军曹鱼稚鱼相关免疫因子及其生长的影响[J]. 中国水产科学, 2007, 14(1): 120-125. FENG J, XU L W, LIN H Z, et al. Effects of salinity on growth and several immune parameters of juvenile cobia, Rachycentron canadum[J]. Journal of Fishery Sciences of China, 2007, 14(1): 120-125. |
2. Key and Open Laboratory of Marine and Estuarine Fisheries, Ministry of Agriculture, East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China
 2016, Vol. 25
2016, Vol. 25


