2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海市水产养殖工程技术研究中心, 上海 201306;
4. 上海海洋大学 水产动物遗传育种中心, 上海 201306
以蚕豆饲喂草鱼(Ctenopharyngodon idellus),可使其肉质坚实而有韧性[1-4],称为“脆化草鱼”。然而,高速巡游后的脆化草鱼会出现皮肤、肌肉充血,肝、肾等脏器淤血,血管破裂而导致机体死亡的现象[5]。邝雪梅等[6]发现脆化草鱼红细胞中的葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)的活性和含量均显著下降,而该酶催化的产物烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate,NADPH)作为氧化型谷胱甘肽(GSSG)的唯一还原力,对于机体氧化还原平衡的维持有着不可替代的作用。 已有研究表明,G6PD活性降低会引起机体氧化还原能力的下降[7],同时G6PD在一定程度上维持着抗氧化酶如过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)等的活性。
研究发现影响G6PD活性的因素很多:河水污染导致杰伊汉河内巴罗二须鲃(Capoeta Barroisi)肝胰脏G6PD活性[8]显著升高;季节变化也会影响鳟鱼(Squaliobarbus ourriculus)肝胰脏和鳃组织内抗氧化系统,不同季节G6PD的酶活差异显著,且肝胰脏内的G6PD活性显著高于鳃[9]。在草鱼的研究表明,草鱼在摄食蚕豆30、60和90 d时的血清和肝胰脏总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)活力高于普通草鱼,而肝胰脏中谷胱甘肽GSH在30与60 d时趋势完全相反[10],但该报道中缺乏酶促体系中其他因素的系统研究,而从血液学及组织内氧化还原能力角度系统研究的报道尚不多见。
上述结果表明,脆化草鱼在高速巡游后的死亡可能与G6PD活性降低、红细胞携氧能力下降和机体抗氧化能力降低直接相关。目前,关于脆化草鱼的研究主要集中在蚕豆对草鱼生长性能[11]、血清生化指标[12]、肌肉品质[2, 13-15]及结构变化[16]、营养组成[4, 6] 以及基因表达分子调控[17] 等方面,尚缺乏草鱼在肉质脆化过程中的血液学指标及机体抗氧化能力动态变化的系统研究。本实验拟从草鱼脆化过程的4、8、12 w的血液学指标和机体氧化还原的动态变化角度开展研究,为揭示草鱼肉质脆化的生化机理提供依据,避免或减少养殖生产上可能出现的氧化损伤。
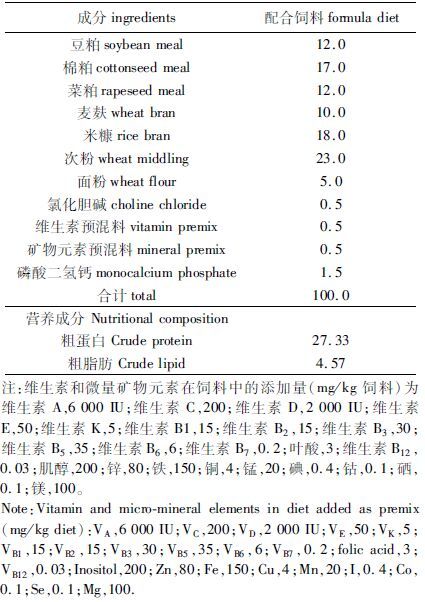
1 材料与方法 1.1 实验设计和实验饲料本实验共设2个处理组,以投饲配合饲料为对照组,以投饲浸泡蚕豆为蚕豆组。配合饲料的配方组成见表 1。各原料经粉碎过40目筛,混合均匀后经饲料颗粒机(浙江新昌城关陈氏机械厂KL系列105A-4-2型)制成直径3 mm的沉性颗粒饲料;蚕豆购自上海市惠南滨海镇,为当年产蚕豆,晾干备用,其粗蛋白、粗脂肪含量分别为29.2%、2.79%。
1.2 实验用鱼和饲养管理实验用鱼购自上海市东海农场,平均体质量为(936.7±6.1) g,共90尾,分别饲养于6口长方形水泥池(5 m×3 m×1.2 m),共2个处理组,每处理组3个重复(池),每池15尾鱼。 养殖实验于上海海洋大学滨海水产养殖场进行,养殖周期为12 w。依据鱼口径的大小将浸泡24 h的蚕豆切成适合鱼体口径的碎块,每天于9:30、13:00和17:30分别投喂配合饲料和蚕豆,投饲量为鱼体重的3%左右,并据天气和摄食情况作适当调整;养殖期间昼夜充气,每周吸污、换水一次,换水量约1/3,NH3-N<0.35 mg/L,水温为20~31 ℃,pH为 6.8~7.6,溶氧DO>4.5 mg/L。
1.3 测定指标与方法分别于养殖4、8、12w末,将鱼体饥饿24 h后,每池随机取鱼3尾,分别采集血液、肝胰脏、肌肉及鳃组织。
血液学指标:采集尾静脉处血液,用肝素钠抗凝剂按1∶1 (V/V)稀释,通过迈瑞BC-2800Vet血细胞分析仪测定血液学指标,包括红细胞、白细胞、单核细胞、淋巴细胞及血栓细胞数量,以及血红蛋白含量、红细胞压积、红细胞分布宽度变异系数等。所用血细胞分析仪配套试剂购自迈瑞医疗国际公司。
组织抗氧化指标:分别采集肝、鳃、肌肉(背鳍下方侧线上方部分)组织于-80 ℃冰箱冻存。取适量组织与0.86%的生理盐水按4∶1的质量比于冰水浴中匀浆,并根据实验需要稀释至所需浓度于分光光度计上测定过氧化氢酶(CAT)、超氧化物歧化酶(SOD)酶活性与丙二醛(malonic aldehyde,MDA)、谷胱甘肽含量。其中总谷胱甘肽(T-GSH)与氧化型谷胱甘肽(GSSG)所用稀释液由南京建成提供。所有药品购自国药集团化学试剂有限公司,试剂盒购自南京建成生物工程研究所。CAT活性采用钼酸铵法测定;SOD活性采用黄嘌呤氧化酶法测定;MDA采用硫代巴比妥酸(TBA)法测定;总谷胱甘肽(T-GSH)、氧化型谷胱甘肽(GSSG)采用DTNB循环反应法测定,于美国伯腾Synergy H1全功能酶标仪上完成测定;根据两分子的还原型谷胱甘肽(GSH)氧化合成一分子GSSG的原理,通过公式GSH=T-GSH-2×GSSG计算得出GSH的含量(式中GSH,T-GSH,GSSG分别代表还原型谷胱甘肽,总谷胱甘肽和氧化型谷胱甘肽含量)。
|
表 1 配合饲料配方组成及营养成分含量 Tab.1 Ingredients and proximate composition of formula diet% |
采用 SPSS 17.0 对实验所得数据进行双因素方差分析(Two-way ANOVA),用 Duncan’s进行多重比较,P< 0.05表示差异显著,统计数据均以平均值±标准差(Means±SD)表示。
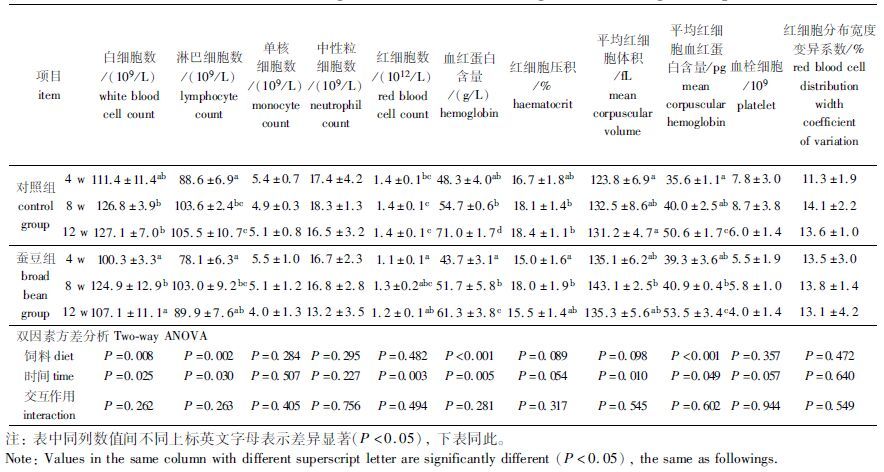
2 结果与分析 2.1 血液学指标由表 2可知,白细胞数、淋巴细胞数、血红蛋白含量及平均红细胞血红蛋白含量受到蚕豆和饲喂时间的双重影响;随饲喂时间延长,两组草鱼的血红蛋白含量、平均红细胞血红蛋白含量均显著增加(P< 0.05) ;在12 w时,蚕豆组草鱼的白细胞数、淋巴细胞数、红细胞数和血红蛋白含量均较对照组显著下降(P< 0.05) ;而单核细胞数、中性粒细胞数、血栓细胞及红细胞分布宽度变异系数在两个处理组间及不同饲喂时间上均无显著差异(P>0.05) 。
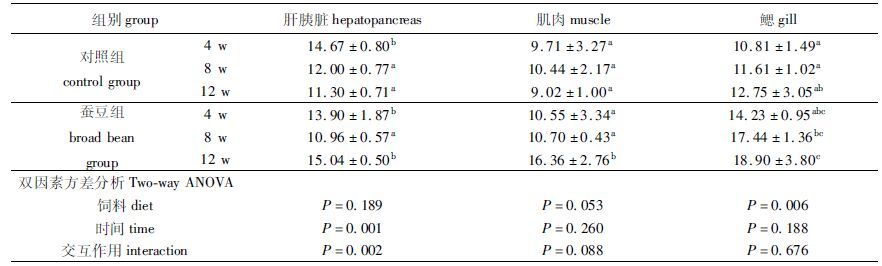
2.2 超氧化物歧化酶(SOD)由表 3可知,随着养殖时间的延长,对照组草鱼肝胰脏在8 w时SOD 活性较4 w显著下降(P< 0.05) ,肌肉、鳃组织则没有明显变化(P>0.05) ;蚕豆组肝胰脏、肌肉组织SOD活性在12 w时较8 w时显著提高(P< 0.05) ,而鳃组织无显著变化(P>0.05) 。
4w时,两处理组肝胰脏、肌肉与鳃中SOD活性无显著差异 (P>0.05) ;8 w时,两处理组肝胰脏与肌肉中SOD活性无显著差异(P>0.05) ,但蚕豆组鳃SOD活性较对照组显著升高(P< 0.05) ;12 w时,蚕豆组肝胰脏、肌肉与鳃中SOD活性较对照组均显著升高(P< 0.05) 。
投喂饲料与饲喂周期的交互作用对肝胰脏中SOD活性有显著影响(P< 0.05) ,而对肌肉和鳃SOD活性的影响不显著(P>0.05) 。
2.3 过氧化氢酶(CAT)由表 4可见,随着饲喂周期的延长,蚕豆组草鱼肌肉中CAT活性呈现升高的趋势,而肝胰脏、鳃CAT活性变化相对较平稳;与对照组相比,蚕豆组肝胰脏CAT活性在8 w、12 w时,鳃CAT活性在4 w、8 w时均无显著差异(P>0.05) ;在4 w时,蚕豆组肝胰脏CAT活性较对照组显著升高(P< 0.05) ;8 w时蚕豆组肌肉中CAT活性呈现升高趋势(P>0.05) ,12 w时蚕豆组肌肉、鳃CAT活性均较对照组显著升高(P< 0.05) 。
投喂饲料和饲喂周期对于肝胰脏与肌肉中CAT酶活有交互作用(P< 0.05) ,对肌肉中CAT活性无交互作用(P>0.05) 。
|
表 2 草鱼脆化过程中的血液学指标变化 Tab.2 Effects of feeding broad bean on haematological indexes of grass carp |
|
表 3 草鱼脆化过程中超氧化物歧化酶(SOD)活性变化 Tab.3 Effects of feeding broad bean on SOD activity in different tissues of grass carp U/mg prot |

|
表 4 草鱼脆化过程中过氧化氢酶(CAT)酶活性变化 Tab.4 Effects of feeding broad bean on CAT activity in different tissues of grass carp U/mg prot |
由表 5可见,在8 w时,蚕豆组肝胰脏T-GSH、GSH含量和GSH/T-GSH、GSH/GSSG均显著低于对照组(P< 0.05) ;而在4 w、12 w时,两组在上述指标上无显著差异(P>0.05) 。

|
表 5 草鱼脆化过程中谷胱甘肽含量变化 Tab.5 Effects of feeding broad bean on glutathione content in different tissues of grass carpU/mg prot |
在肌肉中,4、8、12 w时,两组在T-GSH、GSSG含量和GSH/T-GSH上无显著差异(P>0.05) ;在4 w时,蚕豆组GSH含量显著低于对照组(P< 0.05) ;在4 w、8 w时,蚕豆组GSH/GSSG较对照组显著下降(P< 0.05) 。
在鳃中,蚕豆组T-GSH含量在4 w时低于对照组(P< 0.05) ,8 w时则高于对照组(P< 0.05) ,在4、8、12 w时,蚕豆组GSH含量和 GSH/T-GSH、GSH/GSSG均显著低于对照组(P< 0.05) 。随着饲喂周期的延长,两组GSH/T-GSH、GSH/GSSG均呈下降趋势(P< 0.05) 。
投喂饲料及饲喂周期对于肝胰脏与鳃中GSH含量,GSH/T-GSH、GSH/GSSG系数及肌肉中的GSH/GSSG系数均有交互作用。
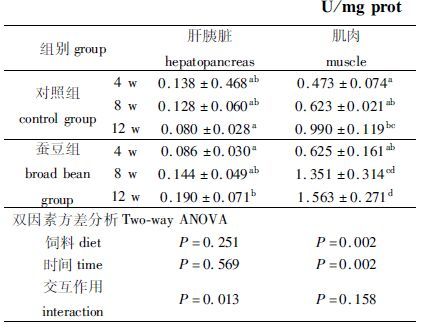
2.5 丙二醛(MDA)由表 6可见,对照组和蚕豆组肌肉MDA,蚕豆组肝胰脏MDA含量随着饲喂周期的延长显著上升(P< 0.05) ,而对照组肝胰脏内MDA含量则相对稳定(P>0.05) ;4 w时,蚕豆组肝胰脏、肌肉MDA含量与对照组无显著差异(P>0.05) ;8 w时,蚕豆组肝胰脏MDA 已表现出较对照组增加的趋势(P>0.05) ,而肌肉MDA 含量则显著增加(P< 0.05) ;12 w时,蚕豆组肝胰脏、肌肉MDA含量均较对照组显著增加(P< 0.05) 。
|
表 6 草鱼脆化过程中丙二醛(MDA)含量变化 Tab.6 Effects of feeding broad bean on MDA content in different tissues of grass carp U/mg prot |
鱼类的血细胞是反映鱼体免疫能力的一个重要指标,具有吞噬、分泌等功能,可参与机体的伤口修复、防御等生理机制[18],因此血液指标可以为检验机体的生理状态健康提供一定的依据。
研究发现红细胞的携氧能力受多因素影响,其中包括低氧刺激[19]、高铁血红蛋白含量[20-21]、机体内环境pH[22]、温度[23]等。本次研究表明,草鱼在生长过程中红细胞数目基本稳定,而血红蛋白含量增多,说明随着鱼体增长,鱼体携氧能力增强,此结果与张玉蓉[24]一致;摄食蚕豆后,草鱼红细胞与血红蛋白较对照组减少,这与伦峰[25]等的研究结果一致。谭乾开[5]等研究表明,长期摄食蚕豆后,鱼体的氧化还原平衡被打破,导致红细胞数与血红蛋白含量减少,这可能是蚕豆中具有强氧化性的生理活性物质[26]进入鱼体后,使内环境处于缺氧状态所致。还原型谷胱甘肽(GSH)是保持血红蛋白稳定性及维持红细胞膜完整性的必要条件[27],本研究中,饲喂蚕豆的草鱼肌肉、鳃组织中GSH含量显著降低,这可能是造成红细胞及血红蛋白减少的重要原因,从而出现类似人类“蚕豆病”的溶血现象。
白细胞是机体防御系统的一个重要组成部分,在吞噬异物产生抗体、抵抗病原入侵等防御反应中发挥着重要作用。研究认为白细胞参数与营养、饲喂季节、性别、年龄和生理状况等密切相关[28-29]。本实验中,在养殖12 w后,蚕豆组草鱼的白细胞、淋巴细胞数量较对照组显著下降,这说明草鱼在脆化过程中机体本身的免疫机制可能降低。然而毛盼[14]及唐湘北[30]的研究结果表明,草鱼摄食蚕豆后血液中红细胞和白细胞的数量显著增多,出现这种结果差异的原因尚不清楚,可能与饲喂季节、饲喂周期及水环境的差异有关,有待进一步研究。
血栓细胞通过分泌凝血酶发挥凝血和止血作用,对血管损伤有止血作用,同时还具有较弱的吞噬作用[31]。本次实验中,摄食蚕豆草鱼的血栓细胞和红细胞体积分布宽度与对照组草鱼并无显著差异,这与唐湘北[31]等的研究结果一致。
3.2 草鱼脆化过程中不同组织抗氧化指标的变化机体在正常代谢过程中会产生许多活性氧(ROS)物质,正常情况下ROS的形成与清除处于动态平衡,但当机体ROS过度累积时会产生氧化应激,导致机体氧化和抗氧化系统失衡[32],最终导致组织氧化损伤[33]。正常生理状态下,机体可防御氧化应激使其处于一个动态的氧化还原平衡状态[34]。研究发现,氧化应激影响着鱼体渗透压[35]、激素分泌[36- 37]和生长性能[38]。机体自身抗氧化的防御体系由酶促和非酶促两个体系协同发挥抗氧化作用[39],酶促系统在自由基、ROS清除过程中起着关键作用[40],主要由CAT、SOD及GSH-PX组成。这些因子相互协同,通过分解过氧化物、阻断过氧化链,除去起催化作用的金属离子而完成抗氧化作用,从而保障机体的正常代谢功能[41]。
SOD是广泛存在的防御氧化损伤的抗氧化酶,CAT也是细胞应对氧化应激的重要抗氧化酶之一,主要功能是去除细胞中产生的过氧化氢(H2O2)。本研究结果表明,投喂蚕豆12 w后,草鱼肝胰脏、肌肉及鳃SOD活性显著提高;投喂蚕豆4 w时的肝胰脏CAT活性和12 w时的肌肉、鳃CAT活性均较对照组显著增加,其原因可能是随养殖时间延长,蚕豆中氧化物质在体内不断积累,刺激机体抗氧化系统产生SOD以抵御氧化应激,而CAT在对抗氧化物的刺激方面,其作用效果不及SOD强烈,且表现出不同组织间的差异性。目前草鱼上相关研究较少,有研究表明,脆化草鱼血清和肝胰脏中SOD活性均普遍高于普通草鱼[10]。
谷胱甘肽在体内有还原型 (GSH)和氧化型 (GSSG)两种形式:GSH几乎存在于机体的每一个细胞中,具有抗氧化和整合解毒作用;GSSG 由2 分子 GSH 脱氢氧化而成,不具有抗氧化作用。本实验发现,摄食蚕豆后,草鱼肝胰脏、肌肉和鳃中的GSH含量降低,肌肉和鳃GSSG含量升高,说明饲喂蚕豆导致草鱼组织内产生了氧化应激,同时饲喂周期对于草鱼不同组织内的GSH与GSSG含量也有一定的影响。谷胱甘肽作为内源性氧化还原态调控因子,其合成受到多种因素的干扰,如氨基酸摄入减少[42]、肝功能障碍[43]等。正常生理状态下,GSH含量远高于GSSG,而在氧化应激时,GSH被氧化成GSSG,使GSH/GSSG下降,机体抗氧化能力减弱,因此GSH/GSSG可以用来评估脂质过氧化损伤情况[44]。本实验结果表明,草鱼摄食蚕豆后,肝胰脏、肌肉及鳃内GSH/GSSG系数均表现出不同程度下降,尤以鳃组织变化最为明显,在4、8、12 w时,蚕豆组均显著低于对照组,这进一步表明蚕豆降低了草鱼机体的抗氧化能力。有研究表明,草鱼脆化过程会出现类似人类“蚕豆病”的溶血现象[5],邝雪梅[6]等发现,脆化草鱼血细胞中的G6PD活性及含量均显著下降。G6PD是PPP的限速酶,其催化产生的NADPH是GSH再生的唯一还原力[45],因而,G6PD活性的显著下降可能是蚕豆组草鱼组织内GSH/GSSG系数下降的主要原因。
MDA 是多不饱和脂肪酸过氧化物的降解产物,毒性较大,会引起蛋白质、核酸等生命大分子的交联聚合,其生成量可以直接反映机体脂质过氧化水平。本实验中,随养殖时间延长,蚕豆组草鱼肝胰脏、肌肉MDA含量较对照组逐渐升高,至12 w时,达到显著水平,这一现象说明蚕豆中的氧化性物质加剧了脂肪的过氧化,对肝胰脏、肌肉产生了一定的氧化损伤,且这种氧化损伤表现出累积效应。
本次实验中,草鱼摄食蚕豆后,鳃中各项氧化还原型指标变化较其他组织差异显著,可能是由于鳃既是鱼的呼吸器官,又有排泄代谢产生的CO2、无机盐以及易扩散的氨氮等有害产物的功能,故对于内外环境的应激反应较其他组织更敏感。
总体来看,草鱼摄食蚕豆后,在肌肉品质发生改变的同时,机体抗氧化能力也表现出下降的现象,如何控制这种渐进积累式和不利于健康的抗氧化能力的降低,获得肌肉品质改变与降低机体损伤的平衡,是脆化草鱼养殖过程中值得思考的一个问题,添加一些还原型的营养元素是一种值得考虑的方法。
| [1] | 伍芳芳, 林婉玲, 李来好, 等.草鱼脆化过程中肌肉品质变化[J]. 南方水产科学, 2014, 10(4): 70–77. WU F F, LIN W L, LI L H, et al.Quality change of grass carp (Ctenopharyngodon idellus) muscle during crisping process[J]. South China Fisheries Science, 2014, 10(4): 70–77. |
| [2] | 关磊, 朱瑞俊, 李小勤, 等.普通草鱼与脆化草鱼的肌肉特性比较[J]. 上海海洋大学学报, 2011, 20(5): 748–753. GUAN L, ZHU R J, LI X Q, et al.Muscle characteristics comparison between grass carp and crisped grass carp[J]. Journal of Shanghai Ocean University, 2011, 20(5): 748–753. |
| [3] | 朱志伟, 李汴生, 阮征, 等.脆肉鲩鱼肉与普通鲩鱼鱼肉理化特性比较研究[J]. 现代食品科技, 2007, 24(2): 109–119. ZHU Z W, LI B S, RUAN Z, et al.Differences in the physicochemical characteristcs between the muscles of Ctenopharyngodon idellus C. et V and Ctenopharyngodon idellus[J]. Modern Food Science and Technology, 2007, 24(2): 109–119. |
| [4] | 肖调义, 刘建波, 陈清华, 等.脆肉鲩肌肉营养特性分析[J]. 淡水渔业, 2004, 34(3): 28–30. XIAO T Y, LIU J B, CHEN Q H, et al.Analysis of nutritive composition in muscle of crisped grass carp[J]. Freshwater Fisheries, 2004, 34(3): 28–30. |
| [5] | 谭乾开, 黎华寿.脆化草鱼(Ctenopharyngodon idellus C. et V)的病理生理生态学[J]. 生态学报, 2006, 26(8): 2749–2756. TAN Q K, LI H S.Preliminary study on the ecology, physiology and pathology of crisped grass carp (Ctenopharyngodon idellus C. et V)[J]. Acta Ecologica Sinica, 2006, 26(8): 2749–2756. |
| [6] | 邝雪梅, 张环, 陈斌, 等.草鱼脆化前后肌肉营养成分及其红细胞中葡萄糖-6-磷酸脱氢酶含量的比较[J]. 海南大学学报(自然科学版), 2004, 22(3): 258–261. KUANG X M, ZHANG H, CHEN B, et al.Comparison on the content of the nutrient composition in grass carp's muscle and the glucose-6-phosphodehydrogenase in its erythrocyte from the beginning to the end of making grass carp's meat crisp to the taste[J]. Natural Science Journal of Hainan University, 2004, 22(3): 258–261. |
| [7] | BICAKCI Z.A hemolysis trigger in glucose-6-phosphate dehydrogenase enzyme deficiency. Vicia sativa (Vetch)[J]. Saudi Medical Journal,, 2009, 30(2): 292–294. |
| [8] | KURUTASE B, ŞAHAN A, ALTUN T.Oxidative stress biomarkers in liver and gill tissues of spotted barb (Capoeta Barroisi Lortet, 1894) living in Ceyhan river, Adana-Turkey[J]. Turkish Journal of Biology, 2009, 33(4): 275–282. |
| [9] | ARAS N M, BAYIR A, SIRKECIOGLU A N, et al.Seasonal changes in antioxidant defence system of liver and gills of Salmo trutta caspius, Salmo trutta labrax and Salmo trutta macrostigma[J]. Journal of Fish Biology, 2009, 74(4): 842–856. |
| [10] | 吴康, 黄晓声, 金洁南, 等.饲喂蚕豆对草鱼抗氧化能力及免疫机能的影响[J]. 水生生物学报, 2015, 39(2): 250–258. WU K, HUANG X S, JIN J N, et al.Effects of feeding with faba bean (Vicia faba Linn.) on the antioxidant capability and immune functions of grass carp (Ctenopharyngodon idellus)[J]. Acta Hydrobiologica Sinica, 2015, 39(2): 250–258. |
| [11] | 别鹏, 时彦民, 张超, 等.投喂蚕豆对草鱼生长及肌肉营养特性分析[J]. 水产养殖, 2012, 33(7): 40–43. BIE P, SHI Y M, ZHANG C, et al.Analysis of feeding broad bean on growth and flesh nutrition of grass carp (Ctenopharyngodon idellus)[J]. Journal of Aquaculture, 2012, 33(7): 40–43. |
| [12] | 李忠铭, 冷向军, 李小勤, 等.脆化草鱼生长性能、肌肉品质、血清生化指标和消化酶活性分析[J]. 江苏农业科学, 2012, 40(3): 186–189. LI Z M, LENG X J, LI X Q, et al.Analysis of growth performance, flesh quality and blood biochemical parameters of crisp grass carp[J]. Jiangsu Agricultural Sciences, 2012, 40(3): 186–189. |
| [13] | 秦自清.不同饲料原料对草鱼生长和肌肉品质的影响[J]. 福建水产, 2010: 81–85. QIN Z Q.Effects of feeding different raw materials on growth and flesh quality of grass carp Ctenopharyngodon idellus[J]. Journal of Fujian Fisheries, 2010: 81–85. |
| [14] | 毛盼, 胡毅, 郇志利, 等.投喂蚕豆饲料和去皮蚕豆饲料对草鱼生长性能、肌肉品质及血液生理生化指标的影响[J]. 动物营养学报, 2014, 26(3): 803–811. MAO P, HU Y, HUAN Z L, et al.Effects of feeding broad bean and dehulling broad bean diets on growth performance, muscle quality and blood physiological biochemical indices of grass carp (Ctenopharyngodon idellus)[J]. Chinese Journal of Animal Nutrition, 2014, 26(3): 803–811. |
| [15] | 刘邦辉, 王广军, 郁二蒙, 等.投喂蚕豆和普通配合饲料草鱼肌肉营养成分比较分析及营养评价[J]. 南方水产科学, 2011, 7(6): 58–65. LIU B H, WANG G J, YU E M, et al.Comparison and evaluation of nutrition composition in muscle of grass carp Ctenopharyngodon idellus fed with broad bean and common compound feed[J]. South China Fisheries Science, 2011, 7(6): 58–65. |
| [16] | LIN W L, ZENG Q X, ZHU Z W.Different changes in mastication between crisp grass carp (Ctenopharyngodon idellus C. et V) and grass carp (Ctenopharyngodon idellus) after heating:the relationship between texture and ultrastructure in muscle tissue[J]. Food Research International, 2009+, 42(2): 271–278. |
| [17] | 吕池波. 基于TGF-β/Smads信号通路探讨蚕豆调节草鱼肌肉Ⅰ型胶原的分子机制[D]. 上海:上海海洋大学, 2013. LV C B. Mechanism of Faba bean upregulating type I Collagen expression of grass carp based on the TGF-β/Smads signal pathway[D]. Shanghai:Shanghai Ocean University, 2013. |
| [18] | 周玉, 郭文场, 杨振国.鱼类血细胞的研究进展[J]. 动物学杂志, 2001, 36(6): 55–57. ZHOU Y, GUO W C, YANG Z G.The progress of studies on fish blood cells[J]. Chinese Journal of Zoology, 2001, 36(6): 55–57. |
| [19] | 谢芬, 李涛, 何建平.低氧对甘肃鼢鼠体内ACTH及血液生理指标的影响[J]. 动物学杂志, 2012, 47(5): 119–123. XIE F, LI T, HE J P.Effect of hypoxia on ACTH and blood parameters in Gansu Zokor[J]. Chinese Journal of Zoology, 2012, 47(5): 119–123. |
| [20] | 阚雪梅, 尤国兴, 赵莲, 等.高铁血红蛋白含量测定方法研究进展[J]. 军事医学科学院院刊, 2010, 34(4): 385–388. KAN X M, YOU G X, ZHAO L, et al.Advances in research on the method for methemoglobin determination[J]. Bulletin of the Academy of Military Medical Sciences, 2010, 34(4): 385–388. |
| [21] | 洪民, 宋文俊, 李士云, 等.聚乙二醇大分子化猪血红蛋白对其携氧特性的影响[J]. 生物工程学报, 2000, 16(1): 22–26. HONG M, SONG W B, LI S Y, et al.The influence on oxgen-carrying capacity of porcine hemoglobin while attached PEG to increase its total molecular weight[J]. Chinese Journal of Biotechnology, 2000, 16(1): 22–26. |
| [22] | 阮萍, 黄耀熊, 屠美, 等.红细胞在不同pH值下膜动力学特性与携氧能力的变化[J]. 第四军医大学学报, 2003, 24(23): 2119–2121. RUAN P, HUANG Y X, TU M, et al.Change of membrane dynamic characteristics and oxygen carrying ability in erythrocytes with different pH[J]. Journal of the Fourth Military Medical University, 2003, 24(23): 2119–2121. |
| [23] | 姚成灿, 李校坤, 黄耀熊.温度对单个活态人红细胞携氧能力的即时影响[J]. 光谱学与光谱分析, 2005, 25(4): 613–616. YAO C C, LI X K, HUANG Y X.Instant effect of temperature on the oxygen carrying capacity of single living intact red blood cell[J]. Spectroscopy and Spectral Analysis, 2005, 25(4): 613–616. |
| [24] | 张玉蓉, 黄庆达, 刘书婷, 等.不同大小草鱼血液学指标研究[J]. 重庆师范大学学报(自然科学版), 2013, 30(1): 38–41. ZHANG Y R, HUANG Q D, LIU S T, et al.Effect of body length on haematological parameters in Mylopharyngodon piceus[J]. Journal of Chongqing Normal University (Natural Science), 2013, 30(1): 38–41. |
| [25] | 伦峰, 冷向军, 李小勤, 等.投饲蚕豆对草鱼生长和肉质影响的初步研究[J]. 淡水渔业, 2008, 38(3): 73–76. LUN F, LENG X J, LI X Q, et al.Effect of feeding broad bean on growth and flesh quality of grass carp (Ctenopharyngodon idella)[J]. Freshwater Fisheries, 2008, 38(3): 73–76. |
| [26] | 李雪琴, 裘爱泳.蚕豆生理活性物质研究进展[J]. 粮食与油脂, 2002: 34–35. LI X Q, QIU A Y.Research advances in activitive substances of broad bean[J]. Cereals & Oils, 2002: 34–35. |
| [27] | 陈正炎, 罗侃, 王继红, 等.临床生物化学和生物化学检验实验指导[M].北京: 人民卫生出版社, 1999: 178-179. CHEN Z Y, LUO K, WANG J H, et al.The guideline of clinical biochemistry and biochemistry test[M].Beijing: People's Medical Publishing House, 1999: 178-179. |
| [28] | 朱心玲, 贾丽珠, 张明瑛.草鱼血液学的研究Ⅰ.九项血液常数的周年变化[J]. 水生生物学报, 1985, 3(3): 248–257. ZHU X L, JIA L Z, ZHANG M Y.Haematological studies on the grass carp I. year-round changes in nine Haematological parameters[J]. Acta Hydrobiologica Sinica, 1985, 3(3): 248–257. |
| [29] | 林光华, 张丰旺.性别和繁殖对兴国红鲤血液指标的影响[J]. 水生生物学报, 1989, 13(1): 91–93. LIN G H, ZHANG F W.The effect of sex and reproduction on the blood indices of Xingguo Red Carp[J]. Acta Hydrobiologica Sinica, 1989, 13(1): 91–93. |
| [30] | 唐湘北, 肖调义, 彭正宁.脆肉鲩血常规及血清游离氨基酸分析[J]. 内陆水产, 2004, 29(5): 36–37. TANG X B, XIAO T Y, PENG Z N.Analysis of blood routine and serum free amino acids of crisp grass carp[J]. Inland Aquatic Product, 2004, 29(5): 36–37. |
| [31] | BARBER D L, MILLS WESTERMANN J E, WHITEM G.The blood cells of the Antarctic icefish Chaenocephalus aceratus L nnberg:light and electron microscopic observations[J]. Journal of Fish Biology, 1981, 19(1): 11–28. |
| [32] | MILLER J K, BRZEZINSKA-SLEBODZINSKA E, MADSEN F C.Oxidative stress, antioxidants, and animal function[J]. Journal of Dairy Science, 1993, 76(9): 2812–2823. |
| [33] | CEDERBERG J, BASU S, ERIKSSON U J.Increased rate of lipid peroxidation and protein carbonylation in experimental diabetic pregnancy[J]. Diabetologia, 2001, 44(6): 766–774. |
| [34] | SEYFRIED J, EVERT B O, SCHWARZ C S, et al.Gene dosage-dependent effects of bcl-2 expression on cellular survival and redox status[J]. Free Radical Biology and Medicine, 2003, 34(12): 1517–1530. |
| [35] | BABITHA G S, SUBHASH PETER M C.Cortisol promotes and integrates the osmotic competence of the organs in North African catfish (Clarias gariepinus Burchell):evidence from in vivo and in situ approaches[J]. General and Comparative Endocrinology, 2010, 168(1): 14–21. |
| [36] | ALURU N, VIJAYAN M M.Stress transcriptomics in fish:a role for genomic cortisol signaling[J]. General and Comparative Endocrinology, 2009, 164(2/3): 142–150. |
| [37] | RUANE N M, KOMEN H.Measuring cortisol in the water as an indicator of stress caused by increased loading density in common carp (Cyprinus carpio)[J]. Aquaculture, 2003, 218(1/4): 685–693. |
| [38] | 黄凯, 阮栋俭, 战歌, 等.氧化油脂对奥尼罗非鱼生长和抗氧化性能的影响[J]. 淡水渔业, 2006, 36(6): 21–24. HUANG K, RUAN D J, ZHAN G, et al.Effects of oxidized oils on the growth and antioxidant activities of Juvenile Tilapia[J]. Freshwater Fisheries, 2006, 36(6): 21–24. |
| [39] | 刘赟, 翁恩琪, 张颖, 等.极低频电磁场及与铅联合作用对小鼠抗氧化系统的影响[J]. 中华劳动卫生职业病杂志, 2002, 20(1): 263–265. LIU Y, WENG E Q, ZHANG Y, et al.Effects of extremely low frequency electromagnetic field and its combination with lead on the antioxidant system in mouse[J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2002, 20(1): 263–265. |
| [40] | OLTRA A M, CARBONELL F, TORMOS C, et al.Antioxidant enzyme activities and the production of MDA and 8-oxo-dG in chronic lymphocytic lerkenia[J]. Free Radical Biology and Medicine, 2001, 30(11): 1286–1292. |
| [41] | 吴秋萍, 王姣, 乐国伟, 等.加热或丙二醛氧化大豆蛋白对小鼠体内自由基水平及抗氧化能力的影响[J]. 营养学报, 2011, 33(1): 14–18. WU Q P, WANG J, LE G W, et al.Effects of soybean protein modified by heat or malondialdehyde on the level of free radicals and antioxidant capability in mice[J]. Acta Nutrimenta Sinica, 2011, 33(1): 14–18. |
| [42] | TAYLOR C G, BAUMAN P F, SIKORSKI B, et al.Elevation of lung glutathione by oral supplementation of L-2-oxothiazolidine-4-carboxylate protects against oxygen toxicity in protein-energy malnourished rats[J]. The FASEB Journal, 1992, 6(12): 3101–3107. |
| [43] | CHAWLA RK, LEWIS FW, KUTNER MH, et al.Plasma cysteine, cystine, and glutathione in cirrhosis[J]. Gastroenterology, 1984, 87(4): 770–776. |
| [44] | 宋玉果, 王涤新.谷胱甘肽作为脂质过氧化损伤指标的研究[J]. 中华预防医学杂志, 1999, 33(5): 317–319. SONG Y G, WANG D X.A study of Glutathione as index reflecting for lipid peroxidation damage[J]. Chinese Journal of Preventive Medicine, 1999, 33(5): 317–319. |
| [45] | HUANG Y X, CHOI M Y, AU S W N, et al.Purification and detailed study of two clinically different human glucose-6-phosphate dehydrogenase variants, G6PD Plymouth and G6PD Mahidol:evidence for defective protein folding as the basis of disease[J]. Molecular Genetics and Metabolism, 2008, 93(1): 44–53. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
4. Shanghai Ocean University Aquatic Animal Breeding Center, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


