2. 上海海洋大学 海洋生物系统与神经科学研究所, 上海 201306;
3. 上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306;
4. 上海海洋大学 国际海洋研究中心, 上海 201306
褐菖鲉(Sebasticus marmoratus)隶属鲉形目(Scorpaeniformes),鲉科(Scorpaenidae),菖鲉属(Sebastiscus),为暖温岩礁性鱼类,定居性强,在遭遇入侵的敌害或同类时,可通过鱼鳔两侧的发声肌快速收缩带动鱼鳔振动发出声音进行防御[1-2]。鱼类的发声肌被认为是一种收缩速度极快的肌肉,收缩频率可达100~200 Hz[3-4]。发声肌纤维的结构和生化特性是影响其快速收缩的重要因素。最近研究表明,对于脉冲型发声鱼类,在其发声的脉冲间隔内,肌浆内的小清蛋白通过提高钙离子转运速度,从而保证发声肌的快速收缩[5];对于连续型发声鱼类,小清蛋白的促进作用不太显著,但肌纤维的形态特异性可能是其快速收缩的基础[5]。褐菖鲉的发声是单个脉冲发声和连续发声同时存在的混合型发声模式[1-2],其发声肌的快速收缩机制仍不清楚。本文旨在确定褐菖鲉发声肌的分布模式及类型,比较褐菖鲉发声肌与白色肌肉的小清蛋白含量和超微结构的差异,以确定褐菖鲉发声肌快速收缩的机制。同时为鲉形目鱼类的发声模式、发声肌快速收缩的机制提供基础参考资料。
1 材料与方法 1.1 实验材料实验用褐菖鲉于2013年10-12月,购自浙江省舟山枸杞岛(122°45. 787′E,30°43. 235′N)渔民渔获物,共30尾健康成体,体长为15.3~18.1 cm,体质量为52.7~106.4 g,运至实验室内暂养一周。暂养槽规格为100 cm×40 cm×45 cm,水温为20~24 ℃,暂养期间投喂活体杂鱼和人工配合颗粒饲料。4条褐菖鲉用适量三卡因甲基磺酸盐(MS-222)麻醉后杀死,放在冰上解剖,用于观察褐菖鲉发声肌的形态和位置;20条褐菖鲉用于蛋白质印迹实验;6条褐菖鲉用2.5%戊二醛固定,用于透射电镜观察。
1.2 实验方法 1.2.1 肌肉蛋白提取将发声肌(404~502 mg)和躯干白色肌肉(460~620 mg)分别置于研钵中,加液氮,把肌肉研磨成粉末。各取280 mg肌肉粉末放入1.5 mL离心管中,加入1 mL的RIPA裂解液,用匀浆器适当搅拌。把含有样品的离心管放入4 ℃冰箱中裂解2.5 h后,即刻用离心机在4 ℃、12 000 r/min条件下离心15 min,取0.5 mL上清分装于1.5 mL离心管中,加入0.5 mL的2×上样缓冲液,离心管置于95 ℃水浴锅中煮10 min。最后放入-40 ℃冰箱待用。取剩余上清蛋白用BCA蛋白浓度试剂盒测定蛋白浓度。
1.2.2 SDS-PAGE检测各取发声肌和躯干白色肌肉15 μL样品进行SDS-聚丙烯酰胺凝胶(4%~15%梯度胶)电泳分离,电压为240 V,当溴酚蓝距离分离胶底端1 cm时停止电泳。取下凝胶进行考马斯亮蓝染色,最后用蒸馏水脱色观察蛋白条带。
1.2.3 Western blot检测各取发声肌和躯干白色肌肉15 μL样品进行SDS-聚丙烯酰胺凝胶(4%~15%梯度胶)电泳分离,电压为240 V,当溴酚蓝距离分离胶底端1 cm时停止电泳。分离的蛋白在200 mA条件下转膜70 min,将目的蛋白转移到PVDF膜上,用TBST洗膜,室温下用新鲜的5%脱脂奶粉封闭2 h,TBST洗膜后分别加入TBST稀释的一抗[Monoclonal Anti-Parvalbumin antibody(1:3 000)和GAPDH(1:2 000)]4 ℃过夜;TBST洗涤20 min×3次,加入TBST稀释的辣根过氧化物酶(HRP)标记的羊抗小鼠二抗(1:2 000)室温孵育2 h,TBST洗涤20 min×3次,化学发光2 min,在暗室中感光。以GAPDH为内参,统计各组蛋白与GAPDH吸光度的比值。
1.2.4 统计学分析实验结果用X±SE表示。应用SPSS 13.0进行统计分析,采用单因素方差分析。实验组与对照组比较采用t检验,P<0.05为具有显著差异,P<0.01为具有极显著差异。
1.2.5 透射电镜观察分别取发声肌和躯干白色肌肉1 mm×1 mm,用0.1 mol/L的PB清洗组织,前固定在4 ℃、2.5%戊二醛中2 h以上。用0.1 mol/L的PB漂洗20 min×2次后固定在1%锇酸中2 h。用ddH2O漂洗20 min×3次。用30%、50%的乙醇依次脱水,每次10 min,然后把组织放在4 ℃、70%乙醇+3%醋酸双氧铀混合液中脱水过夜。用80%乙醇脱水10 min,95%乙醇脱水10 min,100%乙醇脱水10 min×3次,环氧丙烷置换15 min×2次,环氧丙烷与812树脂包埋液[812环氧树脂:4.5 g,DDSA(十二烯基琥珀酸酐):4.5 g,DBP(邻笨二甲酸二丁酯):0.15 g,DMP-30(2,4,6-三苯酚):0.007 5 mL]以1:1比例浸透组织2~4 h,然后环氧丙烷与812树脂包埋液以1:2比例浸透组织过夜。用812树脂包埋液纯浸透组织6 h,然后用812树脂包埋液包埋组织,37 ℃烘箱过夜,45 ℃烘箱过夜,65 ℃烘箱至完全凝固。切片机(LKB-V型,瑞典)切成超薄切片(60~80 nm),铅铀染色后透射电镜( PHILIP,CM—120)观察并拍照。
2 结果 2.1 褐菖鲉发声肌的形态及分布雄性和雌性褐菖鲉都有一对外在发声肌,左右对称地分布在鱼鳔两侧。褐菖鲉发声肌呈细长状,白色且有光泽,发声肌的前端与鱼颅的翼耳骨相连,后端与鱼鳔末端相连(图 1)。

|
图 1 褐菖鲉及其发声肌和鱼鳔
Fig. 1 Sebasticus marmoratus and its sonic muscles and swim bladder
1.褐菖鲉俯视图; 2.褐菖鲉的发声肌和鱼鳔。 Pto.翼耳骨; SM.发声肌; SB.鱼鳔。
1. The dorsal view of Sebasticus marmoratus; 2. The sonic muscles and swim bladder of Sebasticus marmoratus; Pto. pterotic bone; SM. sonic muscles; SB. swim bladder. |
褐菖鲉发声肌肉、白色肌肉的SDS-PAGE电泳结果见图 2。依据之前的研究[4]以及褐菖鲉发声肌和白色肌肉Western blot结果,发声肌和白色肌肉中小清蛋白分子量大小为11~14 ku。
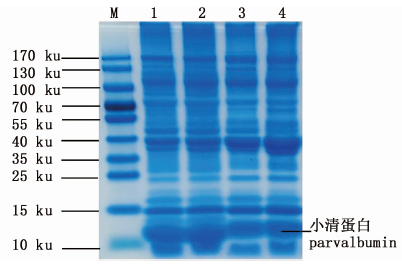
|
图 2 褐菖鲉发声肌和白色肌肉的SDS-PAGE检测
Fig. 2 SDS-PAGE of Sebasticus marmoratus’s sonic muscle and white muscle
M. protein marker; 1. 雄鱼发声肌; 2. 雌鱼发声肌; 3. 雄鱼白肌; 4. 雌鱼白肌。
1. the sonic muscles of males; 2. the sonic muscles of females; 3. the white muscles of males; 4. the white muscles of females. |

|
图 3 Western blot检测褐菖鲉发声肌和白色肌肉中小清蛋白表达的条带
Fig. 3 The expressive banding of parvalbumin of Sebasticus marmoratus’s sonic muscles and white muscles
1. 雄鱼发声肌; 2. 雌鱼发声肌; 3. 雄鱼白肌; 4. 雌鱼白肌。
1. the sonic muscles of males; 2. the sonic muscles of females; 3. the white muscles of males; 4. the white muscles of females. |
在实验组中,雄性、雌性褐菖鲉发声肌肉中Parvalbumin/GAPDH吸光度比值分别为0.087±0.04、0.288±0.29(图 4)。在对照组中,雄性、雌性褐菖鲉白色肌肉中Parvalbumin/GAPDH吸光度比值分别为1.124±0.08、1.354±0.13(图 4)。实验组与参照组相比发现,雄鱼白色肌肉中小清蛋白含量显著高于雄鱼发声肌中小清蛋白含量(P<0.01),雌鱼白色肌肉中小清蛋白含量显著高于雌鱼发声肌中小清蛋白含量(P<0.01)。暗示小清蛋白在褐菖鲉发声肌快速收缩中可能没起到重要作用。

|
图 4 小清蛋白/甘油醛-3-磷酸脱氢酶的比率(n=4)
Fig. 4 The ratio of Parvalbumin/GAPDH(n=4)
1. 雄鱼发声肌; 2. 雌鱼发声肌; 3. 雄鱼白肌; 4. 雌鱼白肌。
1. the sonic muscles of males; 2. the sonic muscles of females; 3. the white muscles of males; 4. the white muscles of females. |
在褐菖鲉白色肌肉纤维中,三联体(一个T小管+两个肌质网终池) 在Z膜处(图版-1)。这在鱼类白色肌肉中是一个普遍现象。 在发声肌肉中,三联体不仅在Z膜处,也在A带与I带交联处(图版-2)。这种情况极其少见,可能有特殊作用。发声肌中的肌质网比白色肌肉中的肌质网更宽[发声肌肌质网宽度(314.29±35.45) nm,白色肌肉肌质网宽度(142.86±26.49 nm)](图版-1,2)。与褐菖鲉白色肌肉相比,发声肌的肌膜更加发达(图版-3,4)。在褐菖鲉发声肌中,线粒体多,并且聚集在一起。在白色肌肉中,线粒体相对比较少且分散(图版-3,4)。暗示发声肌的快速收缩有大量能量提供。

|
图 褐菖鲉白色肌肉和发声肌的透射电镜图片
Fig. The TEM micrographs illustrating the white muscle fibers and sonic muscle fibers in Sebasticus marmoratus
1.白色肌肉的横截面(×50 000); 2.发声肌的横截面(×50 000); 3.白色肌肉的纵截面(×50 000); 4.发声肌的纵截面(×50 000);T:T小管;SR:肌质网;Z:Z膜;M:线粒体。
1. the horizontal section of white muscles(×50 000); 2. the horizontal section of sonic muscles(×50 000); 3. the cross section of white muscles(×50 000); 4. the cross section of sonic muscles(×50 000). T:T tubule; SR:sarcoplasmic reticulum; Z: Z-line; M: mitochondria. |
发声肌分为外在性发声肌和内在性发声肌。外在发声肌起源于鱼鳔外部,邻近或者连接着鱼鳔,被发现的物种有:潜鱼科、金鳞鱼科和石首鱼科[6-8]。内在发声肌完全附着在鱼鳔上,被发现的物种有:毒棘豹蟾鱼(蟾鱼科)和锯鲂鮄(鲂鮄科)[9-10]。
褐菖鲉的发声是利用发声肌快速收缩带动鱼鳔振动产生的。发声肌的生化特性和肌纤维的结构是影响其快速收缩的重要因素。
发声肌的收缩-舒张循环是由肌浆内钙离子浓度改变控制的。小清蛋白作为维持细胞内钙离子交换的钙结合蛋白,是脊椎动物体内肌浆蛋白的主要组成部分,在调节细胞内钙离子交换中起重要作用。在肌肉放松阶段,钙离子在肌质网中,肌浆内的小清蛋白结合着镁离子;一旦有动作电位产生,肌质网释放钙离子,肌浆内的钙离子会先和肌钙蛋白C结合,导致肌肉收缩;随着镁离子的解离,小清蛋白会搬走肌钙蛋白C上的钙离子,导致肌肉处在一种收缩和放松之间的过渡状态;在放松阶段,小清蛋白解离钙离子,钙离子通过Ca2+-ATP泵回到肌质网中,镁离子结合小清蛋白[11]。之前有研究表明小清蛋白含量和肌肉放松速度呈正相关[12],还有研究表明小清蛋白有能力使肌肉放松加快[13]。
有文献报道,毒棘豹蟾鱼(Opsanus tau)发声主频100 Hz,脉冲周期400 ms,脉冲间隔5~15 s[14]。小清蛋白在毒棘豹蟾鱼发声肌中的含量是白色肌肉中的3倍,这可能跟发声肌快速收缩有关[4, 15]。在毒棘豹蟾鱼发声肌收缩-舒张过渡阶段,大量ATP水解,释放出能量,驱动肌浆内的钙离子泵入肌质网腔中储存起来。 为了缓解此刻能量的不足,大量小清蛋白结合了大量钙离子,在脉冲间隔以0.1 s的解离率解离钙离子,肌浆内所有钙离子耗时3~5 s经Ca2+-ATP泵回到肌质网中[4]。褐菖鲉发声包括有间隔脉冲和连续脉冲[1-2],间隔脉冲主频168 Hz,脉冲周期30 ms,脉冲间隔0.05~0.08 s,发声肌中小清蛋白含量少于白色肌肉中的含量,但含有大量线粒体。由于脉冲间隔较短,导致小清蛋白长期处于钙饱和状态,使其对钙离子的转移没起作用,这时,大量的线粒体提供了充足的能量使钙离子泵入肌质网腔。类似的情况,斑光蟾鱼(Porichthys notatus)发声主频80~100 Hz,能持续发声一个多小时,没有脉冲间隔[5]。发声肌中小清蛋白的含量少于白色肌肉中的含量[5],但是发声肌中含有大量线粒体。由于没有脉冲间隔,小清蛋白也长期处于钙饱和状态,使其对钙离子的转移没起作用,大量的线粒体提供了充足的能量使钙离子泵入肌质网腔。
另外,小清蛋白是一种进化蛋白,一些亚型可存在于单一的肌肉细胞中。几种小清蛋白亚型已经被鉴定存在于鱼的骨骼肌肉中。针潜鱼(Carapus acus)发声肌包括3种小清蛋白(PA)亚型(PA1、PA2、PA3),白色肌肉包括两种PA亚型(PA2、PA3)[16]。毒棘豹蟾鱼发声肌包括5种PA亚型(PA1、PA1a、PA2、PA3、PA3a),白色肌肉包括3种PA亚型(PA1、PA2、PA3)[5]。在斑光蟾鱼中,发声肌和白色肌肉都包括3种PA亚型(PA1、PA2、PA3)[5]。但是,小清蛋白PA1在毒棘豹蟾鱼、斑光蟾鱼、针潜鱼发声肌的含量高于白色肌肉,暗示小清蛋白PA1可能在发声肌快速收缩中起着重要作用[5, 16]。
尽管小清蛋白并不是在所有发声肌收缩中起主要作用,但不同发声鱼类可能衍生了不同的机制来适应发声肌快速收缩。对褐菖鲉发声肌结构超微观察发现4个特点:三联体发达,肌膜发达,肌质网发达,线粒体多且集中。
三联体(一个T小管+两个肌质网终池)的功能是将肌膜的兴奋经T小管和三联体连接传至肌质网膜,引起钙泵活动,使肌浆网储存的钙离子迅速释放到肌浆内,为肌肉收缩创造必备条件。在硬骨鱼白色肌肉中,三联体通常在Z膜处[17]。在毒棘豹蟾鱼发声肌中,三联体在A带与I带交联处,这有助于加快钙离子的扩散与吸收[18],在骨骼肌纤维中,膜表面动作电位沿着T小管向内传播,引起肌质网终池释放钙离子。三联体位于A带与I带交联处的每一个肌节包括4个肌质网终池,三联体位于Z膜处的每个肌节只包括4个肌质网终池,在此基础上,三联体位于A带与I带交联处的肌节更适合钙离子的快速扩散和吸收[19]。在褐菖鲉白色肌肉中,三联体仅仅在Z膜处。在褐菖鲉发声肌中,三联体不仅在Z膜处,也在A带与I带交联处,在脊椎动物肌肉中,这种适应很特别,很可能有助于钙离子的扩散,也可能有助于发出各种模式的声音。
与褐菖鲉白色肌肉相比,发声肌的肌膜更加发达。更有助于动作电位的传播,引起钙离子的快速释放和吸收。在褐菖鲉白色肌肉中,线粒体相对较少且分散。褐菖鲉发声肌中,线粒体多,并且聚集在一起,这种特征保证了充足能量的供应 [20-22],允许发声肌比白色肌肉有更好的抗疲劳能力[17],也有助于长时间发声[9]。与褐菖鲉白色肌肉相比,褐菖鲉发声肌肌质网更加发达,暗示发声肌能适应快速收缩[23]和拥有抗疲劳能力[24]。
发声肌似乎发育出了一全套复杂的系统来适应快的收缩速度,现在没有足够的信息来说明这套复杂系统中的一些是物种普遍拥有的还是某些物种特有的。例如,在硬骨鱼发声肌中,呈径向分布的纤维和直径小的纤维通常是普遍的[3, 20-21, 25]。从代谢角度来看,褐菖鲉发声肌和斑光蟾鱼发声肌拥有大量线粒体,但是毒棘豹蟾鱼发声肌没有大量线粒体[20-21]。 其他研究者发现,毒棘豹蟾鱼发声肌肉中的肌球蛋白轻链、肌钙蛋白、肌质网ATP酶都经过高度修饰[15, 23, 26]。
我们的研究显示:在褐菖鲉发声肌的快速收缩中,小清蛋白可能没有起重要作用,而是发达的肌膜、三联体和肌质网结构确保了该特殊肌肉快速收缩和放松的发声功能与行为,同时,大量聚集的线粒体保证了其发声肌的持续工作能力。
| [1] | 张旭光, 谢伟, 郭弘艺, 等.褐菖鲉发声系统形态结构及其发声特征研究[J]. 上海海洋大学学报, 2013, 22(5): 672–677. ZHANG X G, XIE W, GUO H Y, et al.The morphology of sonic system and sound characteristics of the marbled rockfish Sebasticus marmoratus[J]. Journal of Shanghai Ocean University, 2013, 22(5): 672–677. |
| [2] | ZHANG X G, GUO H Y, ZHANG S Y, et al.Sound production in marbled rockfish (Sebastiscus marmoratus) and implications for fisheries[J]. Integrative Zoology, 2015, 10(1): 152–158. |
| [3] | LOESSER K E, RAFI J, FINE M L.Embryonic, juvenile, and adult development of the toadfish sonic muscle[J]. The Anatomical Record, 1997, 249(4): 469–477. |
| [4] | ROME L C.Design and function of superfast muscles:new insights into the physiology of skeletal muscle[J]. Annual Review of Physiology, 2006, 68(1): 193–221. |
| [5] | TIKUNOV B A, ROME L C.Is high concentration of parvalbumin a requirement for superfast relaxation?[J]. Journal of Muscle Research and Cell Motility, 2009, 30(1/2): 57–65. |
| [6] | PARMENTIER E, DIOGO R. Evolutionary trends of swimbladder sound mechanisms in some teleost fishes[M]//LADICH F, COLLIN S P, MOLLER P, et al. Fish Communication. USA:Science Publisher, 2006:43-68. |
| [7] | CARLSON B A, BASS A H.Sonic/vocal motor pathways in squirrelfish (Teleostei, Holocentridae)[J]. Brain Behavior and Evolution, 2000, 56(1): 14–28. |
| [8] | SPRAGUE M W.The single sonic muscle twitch model for the sound-production mechanism in the weakfish, Cynoscion regalis[J]. Acoustical Society of America, 2000, 108(5): 2430–2437. |
| [9] | BASS A H, MARCHATERRE M A.Sound-generating (sonic) motor system in a teleost fish (Porichthys notatus):sexual polymorphism in the ultrastructure of myofibrils[J]. Journal of Comparative Neurology, 1989, 286(2): 141–153. |
| [10] | CONNAUGHTON M A.Sound generation in the searobin (Prionotus carolinus), a fish with alternate sonic muscle contraction[J]. Journal of Experimental Biology, 2004, 207(10): 1643–1654. |
| [11] | HEIZMANN C W.Parvalbumin, and intracellular calcium-binding protein; distribution, properties and possible roles in mammalian cells[J]. Experientia, 1984, 40(9): 910–921. |
| [12] | KLUG G A, LEBERER E, LEISNER E, et al.Relationship between parvalbumin content and the speed of relaxation in chronically stimulated rabbit fast-twitch muscle[J]. Pflügers Archiv, 1988, 411(2): 126–131. |
| [13] | SZATKOWSKI M L, WESTFALL M V, GOMEZ C A, et al.In vivo acceleration of heart relaxation performance by parvalbumin gene delivery[J]. The Journal of Clinical Investigation, 2001, 107(2): 191–198. |
| [14] | WAHR P A, MICHELE D E, METZGER J M.Parvalbumin gene transfer corrects diastolic dysfunction in diseased cardiac myocytes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(21): 11982–11985. |
| [15] | APPELT D, SHEN V, FRANZINI-ARMSTRONG C.Quantitation of Ca ATPase, feet and mitochondria in superfast muscle fibers from the toadfish, Opsanus tau[J]. Journal of Muscle Research & Cell Motility, 1991, 12(6): 543–552. |
| [16] | PARMENTIER E, GENNOTTE V, FOCANT B, et al.Characterization of the primary sonic muscles in Carapus acus (Carapidae):a multidisciplinary approach[J]. Proceedings of Biological Sciences, 2003, 270(1530): 2301–2308. |
| [17] | AKSTER H A.Ultrastructure of muscle fibres in head and axial muscles of the perch (Perca fluviatilis L.)[J]. Cell and Tissue Research, 1981, 219(1): 111–131. |
| [18] | EICHELBERG H.The fine structure of the drum muscles of the tigerfish, Therapon jarbua, as compared with the trunk musculature[J]. Cell and Tissue Research, 1976, 174(4): 453–463. |
| [19] | PORTER K R.The sarcoplasmic reticulum Its recent history and present status[J]. The Journal of Biophysical and Ciochemical Cytology, 1961, 10(4): 219–226. |
| [20] | ONO R D, POSS S G.Structure and innervation of the swim bladder musculature in the weakfish, Cynoscion regalis (Teleostei:Sciaenidae)[J]. Canadian Journal of Zoology, 1982, 60(8): 1955–1967. |
| [21] | FINE M L, BERNARD B, HARRIS T M.Functional morphology of toadfish sonic muscle fibers:relationship to possible fiber division[J]. Canadian Journal of Zoology, 1993, 71(11): 2262–2274. |
| [22] | CONNAUGHTON M A, FINE M L, TAYLOR M H.The effects of seasonal hypertrophy and atrophy on fiber morphology, metabolic substrate concentration and sound characteristics of the weakfish sonic muscle[J]. The Journal of Experimental Biology, 1997, 200(18): 2449–2457. |
| [23] | FEHER J J, WAYBRIGHT T D, FINE M L.Comparison of sarcoplasmic reticulum capabilities in toadfish (Opsanus tau) sonic muscle and rat fast twitch muscle[J]. Journal of Muscle Research & Cell Motility, 1998, 19(6): 661–674. |
| [24] | BASS A H, MCKIBBEN J R.Neural mechanisms and behaviors for acoustic communication in teleost fish[J]. Progress in Neurobiology, 2003, 69(1): 1–26. |
| [25] | HIRSCH J E, BIGBEE J W, FINE M L.Continuous adult development of multiple innervation in toadfish sonic muscle[J]. Journal of Neurobiology, 1998, 36(3): 348–356. |
| [26] | HAMOIR G, GERARDIN-OTTHIERS N, FOCANT B.Protein differentiation of the superfast swimbladder muscle of the toadfish Opsanus tau[J]. Journal of Molecular Biology, 1980, 143(1): 155–160. |
2. Institute for Marine Biosystem and Neuroscience, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China;
4. Shanghai Ocean University International Center for Marine Studies(SHOU-ICMS), Shanghai Ocean University, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


