异时性(heterochrony)是指在不同生物的发生过程中,两个发育事件发生的时间点有相对的改变[1, 2, 3]。异时性基因控制着整个发育过程的时间性和空间性,决定细胞的命运,从而保证各种器官的准确定位和适时发育[4]。目前在Caenorhabditis elegans中研究最多的异时性基因有:lin-14[5]、lin-28[6]、lin-41[7]、hbl-1[8, 9]、lin-42[10]、lin-29[4, 7, 11]和microRNA lin-4[12, 13]、let-7[13, 14]等。
lin-29 基因编码一种锌指蛋白,这种锌指蛋白含有半胱氨酸(Cys)2和组氨酸(His)2,且具有5种锌指结构(zf1-zf5),该蛋白在线虫中控制缝线细胞从幼虫第四期到成虫蜕变期的终末分化,是幼虫发育到成虫的开关,主要抑制第四期幼虫皮下细胞中的表皮基因,激活成虫的表皮基因来决定皮下细胞分化的命运[11, 15, 16, 17]。遗传学分析表明:lin-29 的功能缺失型突变体会使线虫的表皮细胞停止蜕皮和分化[18]。在线虫中,lin-29与lin-28、let-7、lin-41和hbl-1等组成时空性发育调控网络,控制幼虫到成虫的发育,lin-29在lin-28、let-7和lin-41等异时性基因的下游,lin-28可以负调控lin-29 ,下调LIN-41蛋白水平会解除对lin-29的抑制,促进线虫从第四期幼虫向成虫的转变[7]。在人、小鼠、非洲爪蟾和斑马鱼等脊椎动物中,lin-29又叫zinc finger protein基因,但其是否参与脊椎动物的时序性发育调控并未见报道。在牙鲆中,目前未见lin-29基因的相关研究。
牙鲆是一种冷温性底栖鱼类,因其个体大、生长快、繁殖能力强的特点,成为我国重要的海洋经济鱼类之一,不但是重要的捕捞对象,也是主要的海水增养殖鱼类[19]。长期以来,国内的许多水产科研工作者对鲆鲽鱼的人工选育、雌核发育、基因组辅助育种以及相关经济性状基因的功能等开展了大量的工作[20, 21, 22]。牙鲆早期发育中,有一个胚后仔鱼向稚鱼发育中的典型变态现象,变态前后其形态、组织器官结构以及生活习性等都发生了显著的改变[23]。近年来,牙鲆的胚后变态发育引起了许多学者的关注,特别是其变态发育机制的研究。lin-29 是否也在牙鲆的早期发育中起作用?至今尚未见有报道。因此,本研究克隆了lin-29 基因及以定量PCR方法检测lin-29 在牙鲆成鱼组织、牙鲆胚胎、仔鱼各发育时期的表达水平,研究了TH 、TU 对lin-29 在牙鲆发育过程中表达的影响,以期为进一步阐明lin-29 在牙鲆发育过程中的功能研究奠定基础。
1 材料与方法 1.1 实验材料与试剂牙鲆成鱼:购自上海市铜川路水产品市场;牙鲆胚胎和仔鱼:采集于中国水产科学研究院北戴河中心实验站。实验试剂:总 RNA 提取试剂(Trizol Reagent)购自 Invitrogen 公司;M-MLV、Taq DNA 聚合酶、DNaseI、dNTP、PrimeScriptTM 1st Strand cDNA Synthesis kit、3′-RACE 和5′-RACE试剂盒以及 pMD19-T 载体购自大连 TaKaRa 生物工程有限公司;IQTM SYBR Green Supermix 购自 BIO-RAD;DNA Marker、琼脂糖、DNA 纯化回收试剂盒、大肠杆菌 DH5α 购自天根生化科技有限公司;TH(0.1 mg /L)、TU(0.1 mg /L)购自Sigma 公司。
1.2 实验鱼和样品采集成鱼组织取样:将牙鲆成鱼(3尾)解剖后取其脑、鳃、肌肉、心脏、肝脏、脾、胃、肾、肠、性腺组织,经DEPC 水洗净后迅速置于液氮中,再存于 - 80 ℃冰箱中备用。
胚胎细胞采集和仔鱼孵化:牙鲆成鱼饲养于(16 ± 1) ℃的过滤海水中,在产卵期进行人工授精,受精卵于(15 ± 1) ℃的过滤天然海水中孵化(3 d)出膜,孵化后至仔鱼变态结束期间投入轮虫、卤虫无节幼体进行饲养。按照MINAMI[24]的牙鲆早期发育阶段划分方法采样,即分别采集未受精卵(E0)、受精后0.5 h的受精卵(E1)、受精后26 h (原肠胚期 E2)、受精后71 h(心跳期 E3)、出膜后 3 d(3 dph)、9 d(9 dph)、14 d(14 dph)、17 d(17 dph,变态前,眼睛即将开始移位)、20 d(20 dph,右眼已经开始移位)、23 d(23 dph,前变态,右眼移至背侧但从左眼侧还无法看到右眼)、29 d(29 dph,变态高潮,右眼可在左眼侧看到但还未移至背中线处)、36 d(36 dph,后变态,右眼位于背中线处)和 41 d(41 dph,两只眼睛均位于头部左侧)的仔鱼迅速在液氮中速冻后存于-80 ℃备用。
激素处理:用外源性TH(0.1 mg/L)和TU(30 mg/L)[25]处理14 dph的仔鱼,处理后第3、9、15、22和27天后,即牙鲆出膜后17 dph、23 dph、29 dph、36 dph和41 dph取样(n = 3),迅速用 DEPC 水冲洗干净后立即放入RNAstore 保存液中或置于-80 ℃保存备用。
1.3 RNA 抽提和反转录依照TrizolReagent 试剂盒说明书中方法提取牙鲆各时期样品以及成鱼各组织总RNA。用 Agilent 2100 Bioanalyzer测定总RNA的OD260 / OD280 均在 1.8 ~ 2.0之间。用 1.5 % 琼脂糖凝胶电泳检测RNA的完整性及其质量,满足实验要求,置于 - 80 ℃保存备用。
以DNase Ⅰ(Promega)处理后的总RNA为模板,按以下体系与程序进行反转录:在除酶离心管中加入 2 μg 总 RNA,0.5 μL Oligo dT Primer(50 mol/L),0.5 μL Random Primers,补充 DEPC ddH2O 至总体积10 μL;70 ℃放置5 min 后立即置于冰上5 min;然后向上述反应体系中加入以下试剂:M-MLV RT 5 × buffer 5 μL,RNAsin(40 U / μL)0.65 μL,M- MLV Rtase(200 U / μL)1 μL,dNTPs (2.5 mmol/L)5 μL,补充DEPC ddH2O 至总体积25 μL;混匀后于 PCR 仪上反转录,反应条件为25 ℃ 10 min,37 ℃ 1 h,95 ℃ 5 min。得到的 cDNA 保存于-20 ℃备用。
1.4 牙鲆lin-29的克隆根据NCBI ( http://www.ncbi.nlm.nih.gov)上发布的已知物种同源序列,设计多对lin-29引物(表1),用牙鲆各时期总混合的 cDNA 为模板进行 PCR 扩增。扩增条件为:94 ℃预变性5 min,94 ℃变性30 s,50~60 ℃退火30 s(根据引物不同设置温度梯度),72 ℃延伸 30 ~ 60 s(根据克隆片段长短不同设置),共 34 个循环。PCR 扩增产物经1%琼脂糖凝胶电泳分离后的目的条带用 Gel Extraction Kit(Tiangen,China)纯化回收。后将纯化产物连接到 pMD 19-T Vector 上,16 ℃连接过夜后转化入大肠杆菌 DH5 菌株中,固体培养基上37 ℃培养后挑选合适菌落进行培养,再经菌落PCR 验证后取阳性克隆送上海生工生物工程有限公司测序。

|
表1 用于 PCR 扩增的引物序列 Tab. 1 The primer sequences for PCR amplification |
根据克隆出的牙鲆lin-29 片段设计 3′-RACE 和 5′-RACE 的特异性引物(表1)并依照5′-Full RACE Kit ( TaKaRa) 和 3′-Full RACE Kit 试剂盒说明书进行 RACE PCR 扩增。1%琼脂糖凝胶电泳回收RACE PCR 产物,进行连接、转化、克隆和测序。
1.5 序列和进化树分析用 DNAMAN 软件将已得牙鲆lin-29片段除去序列间重叠部分、RACE 试剂盒添加的两端引物部分,拼接得到基因全长。用 Primer Premier 5 软件及 SMS(The Sequence Manipulation Suite)(http://www.bio-soft.net/sms/index.html)预测并生成lin-29 编码的氨基酸序列(图1),再用 SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)分析得到牙鲆lin-29 编码翻译的主要二级结构(图2)。用SWISS-MODEL(http://swissmodel.expasy.org/)预测牙鲆 lin-29基因的蛋白质三级结构(图3)。将预测得到的牙鲆lin-29 编码的氨基酸序列与 NCBI 数据库的其他生物lin-29编码的氨基酸序列进行比对并通过MEGA 5.0[16] 软件和DNAMAN 软件分别绘得氨基酸序列的系统进化树[采用 NJ(Neighbor-Joining 1000 bootstrap)法](图4)和各物种间氨基酸序列比对图(图5)。从 NCBI 数据库提取的与牙鲆 lin-29 氨基酸序列相关的代码如下:zinc finger protein 362-like isoform X2 [Larimichthys crocea](XP_010730702.1);zinc finger protein 362-like isoform X1 [Oreochromis niloticus](XP_003444842.1);zinc finger protein 362-like isoform X1 [Cynoglossus semilaevis](XP_008316855.1);zinc finger protein 362-like isoform X2 [Maylandia zebra](XP_004554194.1);zinc finger protein 362-like [Oryzias latipes](XP_004070413.1);unnamed protein product [Oncorhynchus mykiss](CDQ66707.1);zinc finger protein 362 [Danio rerio](NP_001083017.1);zinc finger protein 362 [Orcinus orca](XP_004266543.1);zinc finger protein 362 [Bos taurus](NP_001179097.1);zinc finger protein 362 isoform X2 [Callithrix jacchus](XP_008999100.1);zinc finger protein 362 [Otolemur garnettii](XP_003801314.1);zinc finger protein 362 isoform X2 [Ficedula albicollis](XP_005057594.1);zinc finger protein 362 isoform X3 [Cavia porcellus](XP_005004277.1);zinc finger protein 362 [Falco peregrinus](XP_005237631.1);zinc finger protein 362 [Mus musculus](NP_001074567.1);zinc finger protein 362 (ZNF362),mRNA[Homo sapiens](NM_152493.2);zinc finger protein 362 (znf362),mRNA[Xenopus (Silurana) tropicalis](NM_001078882.1);Protein LIN-29,isoform a (lin-29) mRNA,complete cds[Caenorhabditis elegans](NM_064144.5);ISE/inbred ISE genomic scaffold,scaffold_pathogens_Hcontortus_scaffold_18。

|
图1 牙鲆lin-29的 cDNA 全长及其预测氨基酸序列 Fig.1 The full-length cDNA and deduced amino acid sequences of lin-29 in Paralichtys olivaceus * 表示终止密码子。 * indicates stop codon. |

|
图2 牙鲆lin-29编码的6个主要保守性结构域 Fig.2 Principal conservative domains of Flounder lin-29 amino acid sequence |

|
图3 预测的牙鲆LIN-29蛋白的相似三级结构 Fig.3 Predicted tertiary structure of Flounder LIN-29 |

|
图4 LIN-29氨基酸序列构建的系统进化树 Fig.4 A phylogenetic tree for amino acid sequences of LIN-29 分支上的数字是 Bootstrap值。 Bootstrap values are shown at the branch points. |

|
图5 牙鲆 LIN-29 和其他物种的氨基酸序列对比 Fig.5 Amino acid sequence alignment of Paralichtys olivaceus LIN-29 with that of other species 黑色表示这些物种间的氨基酸高度保守。 Light black blocks show identical amino acids residues between those sequences shown. P.o:Paralichtys olvaceus;C.s:Cynoglossus semilaevis;D.r:Danio rerio;H.s:Homo sapiens;L.c:Larimichthys crocea;O.l:Oryzias latipes;F.a:Ficedula albicollis;X.t:Xenopus tropicalis;O.n:Oreochromis niloticus;C.p:Cavia porcellus. |
设计高效特异的引物(表1),在 CFX96 TouchTM Real-Time PCR Detection System(Bio-Rad,USA)上进行实时定量检测。
绘制目的基因和内参基因(β-actin)的标准曲线,反应体系共 20 μL:1 μL cDNA(100 ng ~ 0.8 ng,5倍浓度梯度稀释),上下游特异性引物(lin-29 qPCR-F 和lin-29 qPCR-R)各0.5 μL,2 × iQTM SYBR Green Supermix(Bio-Rad,USA)10 μL 及 dH2O 8 μL。反应程序:95 ℃ 3 min,95 ℃ 10 s和61 ℃ 20 s,采集荧光 39 次(两步法),65 ℃ 0.05 s。熔解曲线的扩增、标准曲线结果显示目的基因和内参基因的 R 值均大于0.99,相应的扩增效率(E)均介于95 % ~ 100 %之间,并且目的基因和内参基因的 M 值相差小于0.1。随后对所有样品进行定量检测,RT-PCR 反应体系和程序同上,重复实验 3 次。
1.7 统计分析运用 2-ΔΔCT 方法计算牙鲆lin-29的相对表达水平,其数值用平均值 ± 标准误差(mean ± SE)表示,n = 3。牙鲆胚胎和仔鱼不同发育时期样品以未受精卵(E0)中的相对 mRNA 量为对照,牙鲆成鱼不同组织以肌肉中的相对 mRNA 量为对照。试验数据采用 SigmaPlot 12.5 软件进行方差分析和相对表达分析,当P<; 0.05 时表示差异显著。
2 结果 2.1 lin-29基因的克隆及结构分析以牙鲆各时期总 RNA 池为模板,以其兼并引物(表1)、3′- RACE和5′- RACE 法克隆获得牙鲆lin-29 cDNA序列。基因全长1 769 bp,包括112 bp 的5′-UTR、328 bp 的3′-UTR 和1 329 bp 的开放阅读框,并预测其编码442 个氨基酸(图1)。lin-29氨基酸序列分析后得到其蛋白质二级结构(图2),有 6 个主要的锌指结构(ZnF_C2H2),各锌指结构分别由氨基酸序列中的第249~271、277~299、305~327、333~357、363~385 及393~415 个氨基酸构成。这与其他物种中已知的类似氨基酸序列形成的锌指结构蛋白
(zinc finger protein 362-like,NCBI数据库)相似。预测得到的牙鲆LIN-29 蛋白质的三级结构图(图3)中,蛋白由 α-ββα-ββα-ββα-ββα-ββα 构成,是一种锌指成对间隔排列的锌指蛋白。
2.2 LIN-29序列比对及进化树构建由 NJ 系统进化树(图4)可知牙鲆LIN-29氨基酸序列与鱼类系统进化关系最近,该图同时也表明LIN-29从低等的无脊椎动物秀丽隐杆线虫到高等脊椎动物到人类的系统进化关系。通过多物种LIN-29氨基酸序列比对(图5)分析表明:牙鲆LIN-29基因与大黄鱼、尼罗罗非鱼、半滑舌鳎、青鳉、斑马鱼、白领姬鹟、豚鼠、非洲爪蟾和人类的同源性依次为95.25%、94.12%、93.47%、92.53%、81.49%、71.11%、70.88%、69.30%和68.42%。
2.3 lin-29基因在牙鲆早期发育阶段和成体组织中的表达定量结果显示,牙鲆 lin-29基因在牙鲆未受精卵、胚胎期和仔鱼发育的各个阶段均有表达,并且多个发育时间点表达水平有显著差异(图6)。在牙鲆早期发育过程中,牙鲆lin-29基因在原肠胚期(E2)表达量最高;随着发育时间变化,到心跳期,lin-29的表达量迅速下降,出膜后 3 天(3 dph)时降到最低;随后lin-29的表达又开始逐渐增加,到孵化后 17 天(17 dph)时表达量再次下降,孵化后 29 天(29 dph)表达量达到 E2 期的41.2 %左右,再逐步减少。
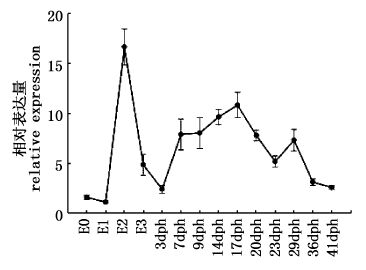
|
图6 牙鲆lin-29在早期发育中的相对表达 Fig.6 Relative levels of lin-29 mRNA during early development of flounder 这些数据以参照组未受精卵(E0)为基础,其数值用平均值 ± 标准误差(mean ± SE)表示。E1:受精后0.5 h;E2:原肠胚期;E3:心跳期。 Expression values were normalized to those of β-actin,and data are expressed as the means ± Standard Error ( SE ) (n = 3) from the calibrator group (E1). E1: the fertilized stage; E2: gastrula stage; E3: heart-beating stage. |
图7表明牙鲆lin-29基因在所检测的组织中广泛表达;在几个不同组织中的表达有显著差异:lin-29基因在脑中表达量最高,约是肌肉中(最低)的 152 倍、心脏中的 17 倍、肠中的 6 倍(P<; 0.05);牙鲆lin-29在鳃、肾、胃、肝脏和性腺中的表达水平没有显著差异。

|
图7 牙鲆成鱼组织中lin-29基因的表达 Fig.7 elative expression levels of lin-29 mRNA in adult tissues of flounder 这些数据以参照组(肌肉)为基础,其数值用平均值 ± 标准误差(mean ± SE)表示。相同字母表示差异不显著(P> 0.05)。 The data are expressed as the means ± Standard Error (SE) (n = 3) from the calibrator group (Muscle) and expression values were normalized to those of β-actin. The same letters represented the difference is not significant (P> 0.05). |
本实验已有研究表明甲状腺激素(TH)能够促使牙鲆仔鱼变态发育,在此基础上运用外源性的 TH 和 TU 处理变态前仔鱼,然后对不同变态阶段的仔鱼进行lin-29基因定量检测,结果表明,lin-29基因的水平明显受到 TH、TU 的影响(图8)。在 TH 处理后 2 d(17 dph)和5 d(20 dph),TH 组的lin-29表达水平显著低于对照组,TH 处理后 21 d(36 dph)和26 d(41 dph)时 TH 组的表达水平显著高于对照组,TH 处理后 8 d(23 dph)和14 d(29 dph)的lin-29表达量与对照组没有明显差异(P<; 0.05); TU 处理后的每个检测时期lin-29基因的表达量都显著高于对照组,且除了 TU 处理后26 d(41 dph)外,各个检测时期 TU 组的 lin-29 基因表达量也明显高于 TH 组。
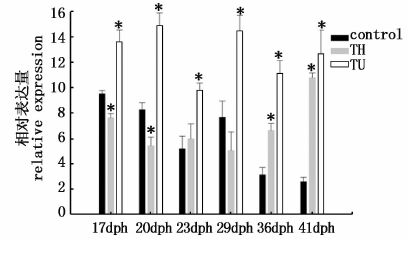
|
图8 lin-29 在TH 和TU 处理的仔鱼变态期的相对表达 Fig.8 Relative expression levels of lin-29 in TH and TU-treated larvae during flounder metamorphosis 这些数据以参照组(对照组 41 天)为基础,其数值用平均值±标准误差(mean ± SE)表示。Control:未处理组;TH和TU 分别表示甲状腺激素和硫脲处理组;*:有显著差异(P<; 0.05)。 Expression values were normalized to those of β-actin,and data are expressed as the means ± Standard Error (SE) (n = 3) from the calibrator group (41 d-Control). Control displayed the untreated group; TH and TU displayed the thyroid hormone and thiourea-treated group. The asterisks represented the statistical significant differences (P<; 0.05). |
本研究克隆了牙鲆lin-29基因 cDNA 序列,全长1 769 bp,开放阅读框编码 442 个氨基酸。氨基酸序列同源比对分析显示,牙鲆lin-29基因的氨基酸序列与大黄鱼的一致性最高,达到95.25%,其次与尼罗罗非鱼、半滑舌鳎和青鳉的一致性都在 90 % 以上,与斑马鱼的一致性为81.49%,而与两栖类的非洲爪蟾、鸟类的白领姬鹟和哺乳类的豚鼠的一致性在70% 左右,与人类的一致性为 68.42 %;系统进化树分析显示牙鲆与各种鱼类处于同一大分支,与线虫的进化距离最远。这些结果表明lin-29基因的氨基酸序列在物种的系统进化中是相对保守的。
通过对牙鲆lin-29基因的氨基酸序列和蛋白结构预测分析显示,LIN-29是一种多锌指结构的蛋白,含有6个典型的锌指结构域,其蛋白结构由6个 α 螺旋和10个 β 折叠构成,属于锌指蛋白家族中的一员。锌指蛋白是一类具有手指状结构域的转录因子,可以结合 DNA 和 RNA、DNA-RNA 杂交双链分子、其他锌指蛋白或自身结合,在基因表达调控、细胞分化、胚胎发育、增强物种适应性等方面具有重要的作用[26, 27]。目前,有关lin-29基因功能研究主要是在线虫中的异时性调控作用,其作为一种异时性基因,控制着线虫第四期幼虫向成虫的发育。研究证实,在线虫中lin-29 的功能缺失型突变体会使线虫的表皮细胞停止蜕皮和分化,导致幼虫向成虫的发育过渡失败[18]。该研究中,通过对牙鲆lin-29基因的序列和蛋白结构分析,推测其可能在牙鲆早期发育中扮演着重要的作用。
3.2 牙鲆lin-29基因的表达模式lin-29 是一种异时性基因,它在线虫发育阶段的研究已经比较深入,lin-29、lin-28、let-7、lin-41和hbl-1等组成了线虫的时空性发育调控网络[7]。有研究发现,hbl-1和lin-41会协同阻遏lin-29的表达,而hbl-1和lin--41是let-7 mRNA 的靶基因,在线虫幼虫后期阶段,let-7表达作用于其靶基因hbl-1和lin-41的3′-UTR使其不能正常作用,最终使得lin-29表达量增加[8, 9, 28]。下调LIN-41蛋白水平也会解除对lin-29 的抑制[7]。在牙鲆早期发育中的表达谱分析显示,lin-29基因在多个发育时间点的表达水平有显著差异。lin-29基因在原肠胚期(E2)表达量最高,其作为转录因子可能与合子基因的启动以及胚胎三胚层的形成有关,还有待进一步研究。出膜后lin-29的表达水平逐渐升高,在17 dph后又逐渐降低,这可能与仔鱼早期的摄食、适应性、变态前的能量蓄积以及变态前仔鱼向变态期仔鱼的过渡调节有关,这些推论有待进一步研究。
lin-29在牙鲆各组织中广泛表达,它在牙鲆大脑里的表达要显著高于其他组织,已有研究表明lin-29 在线虫阴门肌肉细胞、缝合细胞、咽、头部神经元、腹索神经元、肛门节、末端细胞、锚定细胞、阴门细胞、雄性特异的连接细胞和尾部细胞中均有表达;它主要表达于头部的咽和神经元、尾部的直肠细胞 B、F 和 U 中及在性成肌细胞和其后代也有表达[29],牙鲆中lin-29 在各组织中的表达情况与此一致,大脑表达量也是最高,这可能与大脑的神经生理活动和内分泌调控有关。
3.3 lin-29基因在TH、TU处理的牙鲆各发育阶段的表达牙鲆的变态发育像许多其他生物一样受到多种激素的调控,在牙鲆变态阶段,甲状腺激素的水平显著升高,并且其浓度分布具有明显的组织和时间特异性[30]。研究表明,外源性 TH 能显著诱导牙鲆仔鱼的提前变态,而硫脲则抑制其仔鱼的变态[25]。本研究中检测了lin-29基因在外源TH诱导和TU抑制的仔鱼中的表达水平,在17 dph 和20 dph 外源性TH 显著下调lin-29的表达,而在36 dph 和 41 dph 外源性TH显著上调lin-29 的表达,硫脲在整个变态过程中都显著上调lin-29基因的水平,由此我们推测:TH可能间接调控lin-29基因的表达,并且在表达早期,外源性TH下调lin-29的水平可能与仔鱼的提前变态存在关联;而在TU抑制组中,lin-29的高水平表达可能与仔鱼的变态抑制有关。这些结果初步表明,在TH调控牙鲆仔鱼变态的分子信号通路中,lin-29基因可能在仔鱼变态发育中扮演着重要的角色,其相关的功能和作用机制还有待进一步研究。
| [1] | LIU Z C, AMBROS V. Heterochronic genes control the stage-specific initiation and expression of the dauer larva developmental program in Caenorhabditis elegans[J]. Genes &Development, 1989, 3(12B): 2039-2049. |
| [2] | SMITH K K. Time's arrow: Heterochrony and the evolution of development[J]. International Journal of Developmental Biology, 2003, 47(7-8): 613-621. |
| [3] | AMBROS V, HORVITZ H R. Heterochronic mutants of the nematode Caenorhabditis elegans[J]. Science, 1984, 226(4673): 409-416. |
| [4] | AMBROS V, MOSS E G. Heterochronic genes and the temporal control of C. elegans development[J]. Trends in Genetics, 1994, 10(4): 123-127. |
| [5] | LEE R C, FEINBAUM R L, AMBROS V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843-854. |
| [6] | MOSS E G, TANG L J. Conservation of the heterochronic regulator Lin-28, its developmental expression and microRNA complementary sites[J]. Developmental Biology, 2003, 258(2): 432-442. |
| [7] | SLACK F J, BASSON M, LIU Z C, et al. The lin-41 RBCC gene acts in the C. elegans heterochronic pathway between the let-7 regulatory RNA and the LIN-29 transcription factor[J]. Molecular Cell, 2000, 5(4): 659-669. |
| [8] | LIN S Y, JOHNSON S M, ABRAHAM M, et al. The C.elegans hunchback homolog, hbl-1, controls temporal patterning and is a probable microRNA target[J]. Developmental Cell, 2003, 4(5): 639-650. |
| [9] | ABRAHANTE J E, DAUL A L, LI M, et al. The Caenorhabditis elegans hunchback-like gene lin-57/hbl-1 controls developmental time and is regulated by microRNAs[J]. Developmental Cell, 2003, 4(5): 625-637. |
| [10] | JEON M, GARDNER H F, MILLER E A, et al. Similarity of the C. elegans developmental timing protein LIN-42 to circadian rhythm proteins[J]. Science, 1999, 286(5442): 1141-1146. |
| [11] | PAPP A, ROUGVIE A E, AMBROS V. Molecular cloning of lin-29, a heterochronic gene required for the differentiation of hypodermal cells and the cessation of molting in C. elegans[J]. Nucleic Acids Research, 1991, 19(3): 623-630. |
| [12] | MOSS E G, LEE R C, AMBROS V. The cold shock domain protein LIN-28 controls developmental timing in C. elegans and is regulated by the lin-4 RNA[J]. Cell, 1997, 88(5): 637-646. |
| [13] | BAGGA S, BRACHT J, HUNTER S, et al. Regulation by let-7 and lin-4 miRNAs results in target mRNA degradation[J]. Cell, 2005, 122(4): 553-563. |
| [14] | PASQUINELLI A E, REINHART B J, SLACK F, et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA[J]. Nature, 2000, 408(6808): 86-89. |
| [15] | ROUGVIE A E, AMBROS V. The heterochronic gene lin-29 encodes a zinc finger protein that controls a terminal differentiation event in Caenorhabditis elegans[J]. Development, 1995, 121(8): 2491-2500. |
| [16] | EULING S, BETTINGER J C, ROUGVIE A E. The LIN-29 transcription factor is required for proper morphogenesis of the Caenorhabditis elegans male tail[J]. Developmental Biology, 1999, 206(2): 142-156. |
| [17] | HARRIS D T, HORVITZ H R. MAB-10/NAB acts with LIN-29/EGR to regulate terminal differentiation and the transition from larva to adult in C. elegans[J]. Development, 2011, 138(18): 4051-4062. |
| [18] | BETTINGER J C, EULING S, ROUGVIE A E. The terminal differentiation factor LIN-29 is required for proper vulval morphogenesis and egg laying in Caenorhabditis elegans[J]. Development, 1997, 124(21): 4333-4342. |
| [19] | 田永胜, 陈松林, 徐田军, 等. 牙鲆不同家系生长性能比较及优良亲本选择[J]. 水产学报, 2009, 33(6): 901-911. TIAN Y S, CHEN S L, XU T J, et al. The comparison of growth performances of Japanese flounder (Paralichthys olivaceus) families and selection of parents with good trait[J]. Journal of Fisheries of China, 2009, 33(6): 901-911. |
| [20] | CHEN S L, ZHANG G J, SHAO C W, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle[J]. Nature Genetics, 2014, 46(3): 253-260. |
| [21] | 刘海金, 王常安, 朱晓琛, 等. 牙鲆单倍体、三倍体、雌核发育二倍体和普通二倍体胚胎发育的比较[J]. 大连水产学院学报, 2008, 23(3): 161-167. LIU J H, WANG C A, ZHU X C, et al. Embryonic development of gynogenetic diploid and triploid Japanese flounder Paralichthys olivaceus[J]. Journal of Dalian Fisheries University, 2008, 23(3): 161-167. |
| [22] | NAKAMURA A, SHIKANO L, MIZUTA A, et al. Melanophore development during metamorphosis in pseudo-albinic clone of Japanese flounder Paralichthys olivaceus[J]. Nippon Suisan Gakkaishi, 2005, 71(5): 729-735. |
| [23] | FU Y S, SHI Z Y, WU M L, et al. Identification and differential expression of microRNAs during metamorphosis of the Japanese flounder (Paralichthys olivaceus)[J]. Plos One, 2011, 6(7): e22957. |
| [24] | MINAMI T. The early life history of a flounder Paralichthys olivaceus[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1982, 48(11): 1581-1588. |
| [25] | INUI Y, MIWA S. Thyroid hormone inducesmetamorphosis of flounder larvae[J]. General and Comparative Endocrinology, 1985, 60(3): 450-454. |
| [26] | MILLER J, MCLACHLAN A D, KLUG A. Repetitive zinc-binding domains in the protein transcription factor IIIA from Xenopus oocytes[J]. The Embo Journal, 1985, 4(6): 1609-1614. |
| [27] | LEE M S, GIPPERT G P, SOMAN K V, et al. Three-dimensional solution structure of a single zinc finger DNA-binding domain[J]. Science, 1989, 245(4918): 635-637. |
| [28] | CONRAD R, BARRIER M, FORD L P. Role of miRNA and miRNA processing factors in development and disease[J]. Birth Defects Research Part C: Embryo Today: Reviews, 2006, 78(2): 107-117. |
| [29] | 余刚. 异时性基因在Caenorhabditis elegans寿命调控中的作用及在小鼠发育中的表达研究[D]. 厦门: 厦门大学, 2009. YU G. Heterochronic genes regulate the lifespan of Caenorhabditis elegans and the expression in the development of mouse[D]. Xiamen: Xiamen University, 2009. |
| [30] | DE JESUS E G, HIRANO T, INUI Y. Changes in cortisol and thyroid hormone concentrations during early development and metamorphosis in the Japanese flounder, Paralichthys olivaceus[J]. General and Comparative Endocrinology, 1991, 82(3): 369-376. |
 2016, Vol. 25
2016, Vol. 25


