浙江省温州市瓯飞围填海区位于温州东部沿海瓯江河口至飞云江河口外海域,规划用海面积为8 853.72 hm2,分一期、二期实施,一期实施龙湾片区,用海面积为4 429.13 hm2,二期实施瑞安片区,用海面积为4 424.59 hm2,规划用海类型主要为围海养殖,功能分区中的休闲观光区和养殖生产配套区用海方式为填海造地,工程周边环境敏感区主要为瑞安铜盘岛省级海洋特别保护区,且该规划用海面积大、工期长,工程实施后对该区域的水文及水质等都将可能带来不同程度的改变,对渔业资源的影响具有不确定性。因此,开展围填海区渔业资源群落结构调查和分析,对研究渔业资源的保护、估计渔业资源的发展趋势具有重要意义。
生态位 (niche) 概念是现代生态学的中心概念之一,它能体现自然生态系统中一个族群在时间空间上的位置、相关种(类) 群之间的功能关系及利用资源的能力[1, 2]。自 GRINNELL[3]在1917 年提出生态位的概念这一理论以来,经过ELTON[4]、HUTCHINSON[5]、 MAY[6]等多位专家深入应用研究,生态位理论及其定义得到不断深化和发展,有力地推动了现代生态学理论的进步。在我国,生态位理论的研究已被广泛地应用于对生物多样性、群落结构及演替、物种种间关系、种群进化和生物与环境关系等方面的研究[7, 8],主要针对对象为陆生生物群落。近几年,生态位理论已逐步被应用于海洋生物资源的研究中,主要集中于对海洋浮游生物的生态位等方面的研究[9, 10],应用于海洋渔业资源群落结构的研究还相对较少,仅见对长江口及黄海中南部及长江口主要鱼种的生态位分析[11, 12]。本研究拟对瓯飞围填海区渔业资源情况进行相应的调查,运用生态位理论方法对渔业资源进行研究,以确定围垦工程可能对渔业资源结构带来的影响。
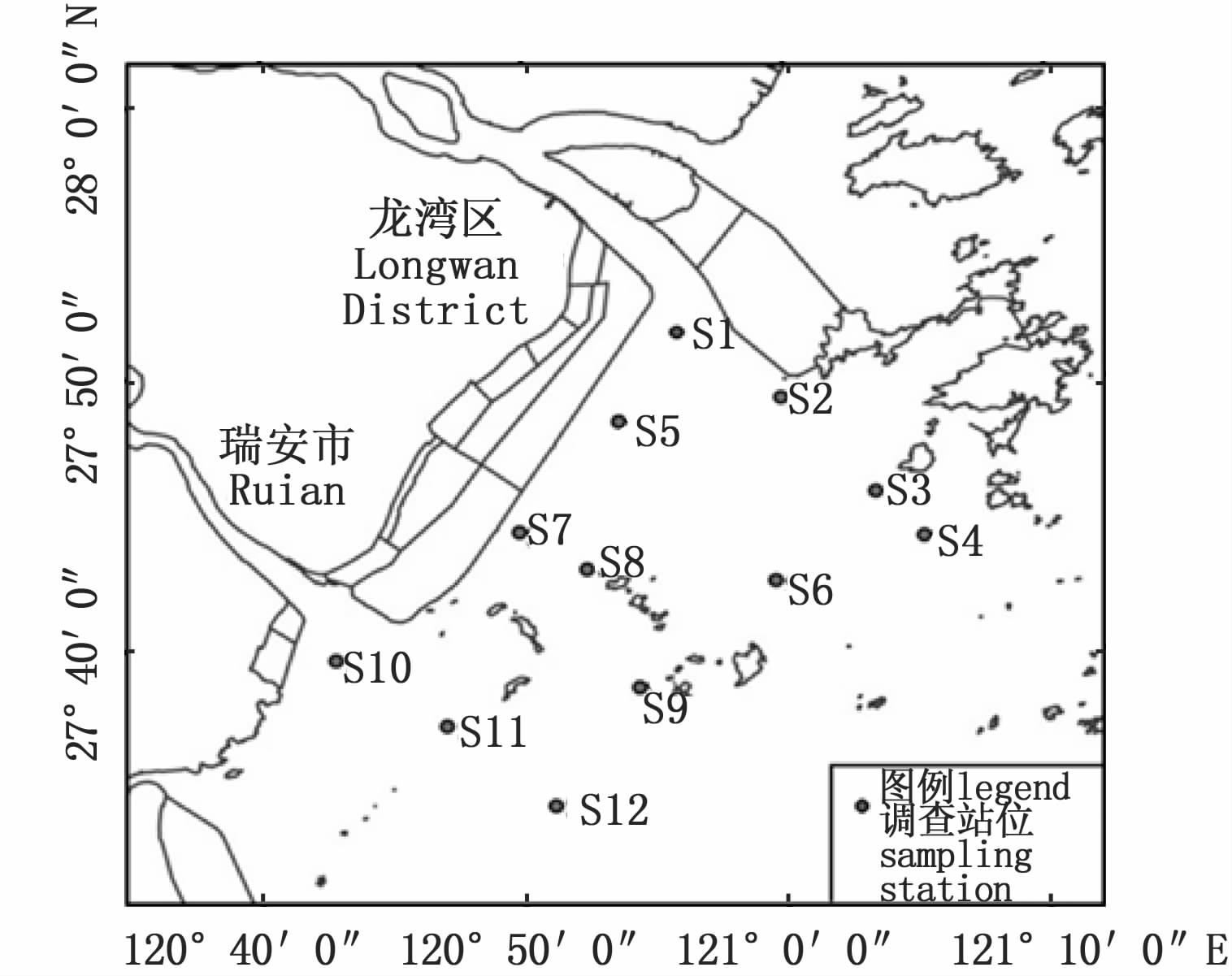
1 材料与方法 1.1 调查区域根据瓯飞工程一期施工工况及工程本底调查资料和动态监测工作总体方案要求,以《海洋生物资源影响评价技术方法》(SC/T9110—2007)的布点原则为指导,于2014年5月对相关海域(27.68°-27.87°N,120.87°-121.11°E)进行渔业资源拖网调查,共设调查断面4条,12个站点(图1)。此次拖网采样网具为网宽3 m、网高2 m,网囊网目20 mm的单船型底拖网,网囊加有比网目大20 mm左右的衬网。拖网调查拖速控制在3节,拖网取样时间以拖网着底或纲拉紧时为起始时间,结束时间以起网收纲时间来计算,每站调查时间为0.5 h,随后进行种类鉴定和计数。
|
图1 调查站位图 Fig.1 Survey station |
同时采用多功能温深仪(Conductivity temperature depth system,CTD)对水温、悬浮物、盐度、pH等参数进行现场同步测定,叶绿素a(Chl.a)的测定按照《海洋监测规范》进行。
1.2 数据处理采用PINKAS等[13]提出的相对重要性指数(IRI)来确定群落的优势种,计算公式为:

生态位宽度[16, 17]是指一个种群在群落中所利用的各种不同资源的总和,物种生态位越宽,则表示对环境的适应能力越强,表示该物种数量分布越均匀,具有较强的空间竞争能力:

生态位重叠指数[18, 19, 20, 21, 22]能反映出物种间对资源利用的相似程度,同时也可以反映物种间潜在的竞争关系:
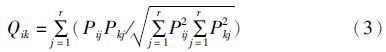
应用Excel软件对相对重要性指数、生态位宽度指数和生态位重叠指数进行计算,并以相对重要性指数确定的优势种作为研究对象,应用Primer 6.0对它们的生态位宽度进行聚类分析,根据它们的丰度数据进行非度量多维标度(Non-metric multidimensional scaling,MDS)分析,通过压力系数(Stress)值表征相似性等级与标序图中相应的距离等级不一致程度,其中压力系数小于0.05代表吻合极好,小于0.1代表吻合较好,小于0.2为代表吻合度一般,小于0.3代表吻合较差[23]。应用Canoco软件对相关环境因素与优势种间的关系进行典范对应分析(Canonical correspondence analysis,CCA)及排序图绘制。
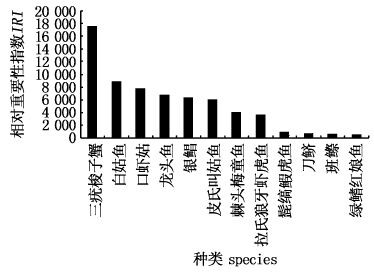
2 结果与分析 2.1 群落优势种本航次瓯飞围填海区拖网调查共鉴定渔获物59种,鱼类、虾类、蟹类和头足类分别为41、10、3和5种。根据相对重要性指数计算结果,其中IRI>500的渔获物种类总共有12种,分别为三疣梭子蟹(Portunus trituberculatus)、白姑鱼(Argyrosomus argentatus Houttuyn)、口虾姑(Squilla orarotia)、龙头鱼(Harpadon nehereus)、银鲳(Pampus argenteus)、皮氏叫姑鱼(Johnius belangerii)、棘头梅童鱼(Collichthys lucidus)、拉氏狼牙虾虎鱼(Odontambly opusrubicundus)、髭缟鰕虎鱼(Tridentiger obscurus)、刀鲚(Coilia macrognathos)、班鰶(Clupanodon punctatus)、绿鳍红娘鱼(Lepidotrigla scale dsearobins),从图2可看出,三疣梭子蟹相对重要性指数值最大,白姑鱼、口虾姑、龙头鱼、银鲳、皮氏叫姑鱼、棘头梅童鱼、拉氏狼牙虾虎鱼7种鱼相对重要性指数值相近,髭缟鰕虎鱼、刀鲚、班鰶、绿鳍红娘鱼4种相对重要性指数值相近。
|
图2 优势种相对重要性指数 Fig.2 IRI of dominant species |
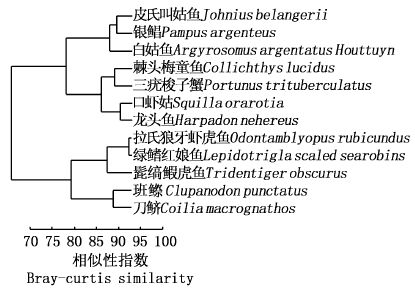
采用生态位宽度指数计算公式计算得到的主要优势种的生态位宽度结果显示,其变化范围为0.31~2.32。对其生态位宽度进行Bray-Curtis聚类分析显示(图3),12种优势种可分为2组,第一组为生态位宽度较宽的白姑鱼、皮氏叫姑鱼、银鲳、口虾姑、三疣梭子蟹、棘头梅童鱼和龙头鱼,其中白姑鱼、皮氏叫姑鱼、银鲳的生态位相对较宽,分别为2.32、2.02和1.76。第二组包括刀鲚、班鰶、拉氏狼牙虾虎鱼、髭缟鰕虎鱼和绿鳍红娘鱼,它们生态位较窄,其中班鰶和刀鲚的生态位最小,为0.36和0.31,其余几种生态位在0.53~0.68。
|
图3 优势种生态位宽度聚类分析 Fig.3 Clustering analysis of niche breadth of dominant species |
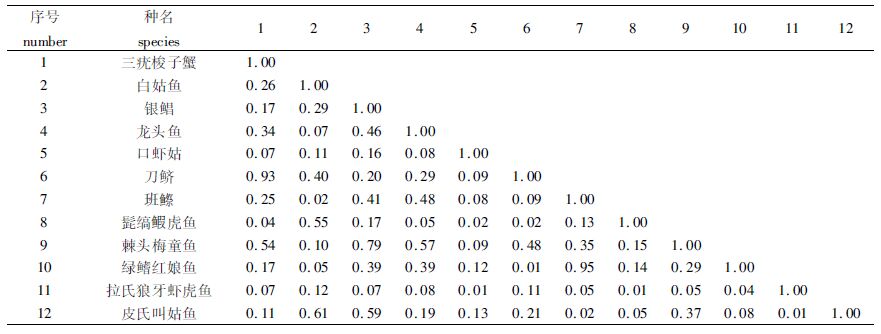
主要优势种的生态位重叠值分析结果表明(表1),12个主要优势种之间生态位重叠值介于0.01~0.95之间,绿鳍红娘鱼与班鰶的重叠值最高,为0.95。刀鲚与三疣梭子蟹的重叠值其次,为0.93。此外,棘头梅童鱼还与三疣梭子蟹、银鲳、龙头鱼有较高的生态重叠。
|
表1 优势种的生态位重叠 Tab.1 Ecological niche overlap of dominant species |
对其生态重叠度进行非度量多维标度分析 (MDS)得到的压力系数为0.09(图4),说明吻合度较好,其中,绿鳍红娘鱼和班鰶的分布最为相似,银鲳、龙头鱼、棘头梅童鱼与其他9个物种的分布关系具有较高的相似性,而拉氏狼牙虾虎鱼、髭缟鰕虎鱼、口虾姑相似性较低,与生态位重叠的分析结果基本一致。

|
图4 优势种生态位重叠MDS图 Fig.4 MDS plots of niche overlap ofthe dominant species |
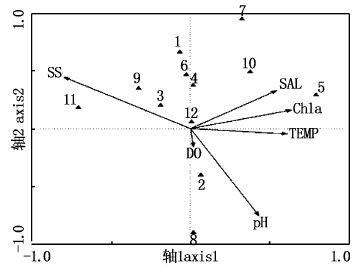
围填海区渔业资源种类与相关环境因子之间的CCA分析见图5和表2。蒙特卡洛检验(Monte Carlo test)结果表明,CCA分析中的轴1和所有轴均有显著差异,证明该排序结果是可信的。
|
图5 优势种典范对应排序图 Fig.5 Ordination diagrams based on canonical correspondence analyses of dominant species 1.三疣梭子蟹(Portunus trituberculatus); 2.白姑鱼(Argyros omusargentatus houttuyn); 3.银鲳(Pampus argenteus); 4.龙头鱼(Harpadon nehereus); 5.口虾姑(Squilla orarotia); 6.刀鲚(Coilia macrognathos); 7.班鰶(Clupanodon punctatus); 8.髭缟鰕虎鱼(Tridentiger obscurus); 9.棘头梅童鱼(Collichthy slucidus); 10.绿鳍红娘鱼(Lepidotrigla scale dsearobins); 11.拉氏狼牙虾虎鱼(Odontambly opusrubicundus); 12.皮氏叫姑鱼(Johnius belangerii) |
|
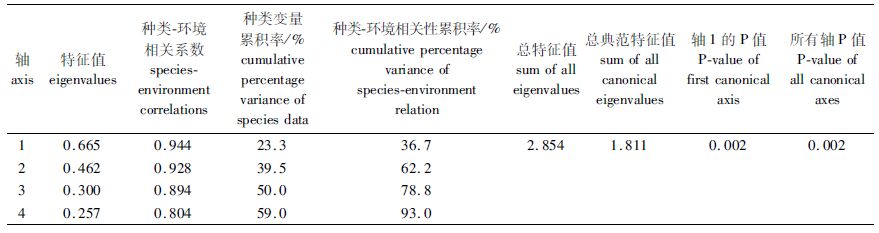
表2 优势种CCA排序结果 Tab.2 Result of CCA for the dominant species |
CCA排序中的环境因子水温(TEMP)、盐度(SAL)、悬浮物(SS)、溶解氧(DO)、pH和叶绿素a(Chla)共解释了该区域渔业资源群落种类组成59%的总变异。轴1和轴2的特征值分别为0.665和0.462,分别解释了总变异的23.3%和16.2%。轴1和轴2的种类-环境相关系数分别为0.944和0.948,表明这6个环境因子与该区域渔业资源群落种类组成存在显著相关性。
结合各环境因子与排序轴的相关性大小(表2),分析图5可知,与第一轴关系最密切的依次是悬浮物(-0.750 5)、叶绿素(0.601 2)、水温(0.576 8)、盐度(0.512 5)、pH(0.406 8)和溶解氧(0.019 0)。CCA轴1基本反映了悬浮物、叶绿素a、水温、盐度的变化:沿轴1从左至右,温度、盐度和叶绿素a逐渐升高,悬浮物浓度逐渐降低。与第二排序轴相关性较大的为pH(-0.701 9),其次为悬浮物(0.414 2)和盐度(0.306 7),其他环境因子与第二轴的相关系数较低。沿第二轴从下至上,溶解氧、pH逐渐降低。
除少数几种分布在排序图的下侧外,大部分种类几乎都分布在图的上侧,且分布较分散,分布主要受悬浮物、叶绿素a、盐度、和pH的影响,其中受悬浮物的影响最大,溶解氧对种群的分布影响较小。沿第一排序轴,排序图左侧的拉氏狼牙虾虎鱼种群倾向于分布在低温、低盐、高悬浮物的海域,这与其生活习性完全吻合。位于排序轴右侧的口虾姑种群,倾向于分布在高温、高盐和叶绿素a含量高的水域。皮氏叫姑鱼分布于环境变量的原点周围,表明其分布对环境没有特别的偏好。
3 讨论 3.1 生态优势度与生态位宽度优势度指标(相对重要性指数)反映了物种在群落中的数量权重和对栖息地的占有范围,对温州瓯飞围填海区渔业资源调查结果显示,其相对重要性指数大于500的12种优势种75%为底层鱼类,且多为暖水种。2007年工程开始前沈盎绿、徐兆礼等[24, 25, 26]对该区域的调查结果显示,该海区暖水性鱼类约占总种数的70%,渔获物中底层和近底层鱼类占多数,说明工程前后该海区优势种差异不大。
此次调查中白姑鱼在瓯飞围填海区的渔业资源群落中有着较高的生物量和较广的分布范围,相对重要性值仅次于三疣梭子蟹(图2),说明其在群落中的优势度较高,同时其生态位宽度指数也是群落中最高的,为2.32,表明白姑鱼是该海域群落中最主要的优势种,其分布均匀且活动区域较大,与2007年围垦开始前所调查的主要优势种相一致[24],进而说明围填海工程发生后主要优势种的种类没有发生变化。对生态位宽度的聚类分析的结果表明,该区中12种优势种的数量和分布可分为两种类型(图3),第一组白姑鱼、皮氏叫姑鱼等7种优势种的分布范围较大,数量分布均匀,具有较强的空间竞争能力。而第二组的刀鲚、班鰶等5种优势种分布范围较第一组小,且分布的均匀度也较第一组小,竞争性相对较小。这说明了生态位宽度的聚类分析可以反映出群落中物种的数量分布格局,与李显森等[12]的研究结果一致。
3.2 生态位重叠本研究发现,瓯飞围填海区渔业资源群落优势种之间的生态位重叠指数差异较大,最高的0.95,最小的仅为0.01,各种优势种间存在不同程度的重叠,这可能与该区域的生境多样化并且各种优势种对环境适应能力的差异有关。一般认为,生态位宽度小的种群对资源的利用能力有限,因而与其他物种产生竞争的概率也较小,导致其与其他种群的重叠值也较小;而生态位宽度较宽的种群对资源的利用能力较强且分布范围广,因此与其他种群的重叠值也较大。而本研究发现结果不尽如此,本研究中生态位宽度属于倒数第二和第三的班鰶与绿鳍红娘鱼,重叠度最高,生态位较宽的三疣梭子蟹与生态位最窄的刀鲚重叠度其次。出现这种现象的原因可能是因为一些生态位宽度值较小的优势种(类)群对环境的要求近似或互补而表现出较高的生态重叠度[27]。此外,结合典范对应分析(CCA)图可知,班鰶与绿鳍红娘鱼距离最近,与其他种类距离较远,表明其在资源位点上分布的差异较大,缓解了与其他物种间对资源的竞争,更突显出其与绿鳍红娘鱼对环境的相似或互补性。三疣梭子蟹和刀鲚分属不同分类群,而不同分类群、食性和生活型等方面存在差异也是引起重叠度高的原因之一[28, 29, 30]。结合优势种典范对应排序图(图5)可知,它们所处的资源环境也较为相似,但物种之间是否存在资源利用竞争,还取决于其所处区域共用资源的分布和供应情况。综上也充分说明生态位宽度与生态位重叠之间的关系较为复杂,并非只是简单的正相关关系,需视情况而定,不可一概而论,在相关研究中亦有出现该种现象[31]。
3.3 生态位分化典范对应分析(CCA)是以环境因子为主体,通过排序来判断物种在生境中的生态分化情况的一种手段,其能对通过生态位及生态位重叠度无法合理解释的结果作出补充说明[27],如拉氏狼牙虾虎鱼,其生态位宽度并非最窄,但与其他优势种间的重叠度却极低,相对其他优势种其分布的海区具有低盐、高悬浮物的特点,其生态适应性不同,导致时空分布差异,进而造成其与其他优势种重叠度低的特点。从排序图可看出,刀鲚的环境需求与多数种类相近,因此生态位的分化也恰恰解释了刀鲚的生态位宽度最窄,却和多种优势种有较高的生态重叠度的原因。此外,通过CCA排序图轴1的分析表明,水中的悬浮物是影响瓯飞围填海区渔业资源群落结构的最主要的因子,这刚好与围填海工程的性质相吻合。水体中的悬浮物对渔业生物的生存和分布,可通过影响水体的透明度,进而影响渔业生物饵料的繁生来实现[32]。通过对叶绿素a与其他相关环境因子的相关性分析,显示与叶绿素相关性最大的为悬浮物,相关系数为-0.434 3,亦证明了悬浮物对相关生物饵料的繁生将带来影响。
本研究结果表明,CCA排序中的环境因子悬浮物、叶绿素、pH、水温、盐度和溶解氧反映了该区域渔业资源群落组成59%的总变异,余下41%的总变异可能是由未调查到的其他生物和非生物因素所引起的,这需要进一步调查和分析。
| [1] | LEIBOLD M A. The niche concept revisited: Mechanistic models and community context[J]. Ecology, 1995, 76(5): 1371-1382. |
| [2] | 覃林. 统计生态学[M]. 北京: 中国林业出版社, 2009: 123-187. QIN L. Statistical ecology[M]. Beijing: China Forestry Press, 2009: 123-187. |
| [3] | GRINNELL J. The niche-relationships ofthe California thrasher[J]. The Auk, 1917, 34(4): 427-433. |
| [4] | ELTON C S. Animal ecology[M]. London: Sedgwick and Jackson, 1927: 232-233. |
| [5] | HUTCHINSON G E. Concluding remarks: Population studies and animal ecology and demography[M]//Cold Spring Harbor Symposia on Quantitative Biology.New York: The Biological Laboratory, 1957: 415-427. |
| [6] | MAY R. Theoretical ecology: principles and applications[M]. Oxford:Blackwell Scientific, 1976: 163-186. |
| [7] | 田大伦. 高级生态学[M]. 北京: 科学出版社, 2008: 150-180. TIAN D L. Advanced ecology[M]. Beijing: Science Press, 2008: 150-180. |
| [8] | 张金屯. 数量生态学[M]. 北京: 科学出版社, 2004: 120-240. ZHANG J T. Quantitative ecology[M]. Beijing: Science Press, 2004: 120-240. |
| [9] | 徐凤洁, 俞秋佳, 王昊彬, 等. 淀山湖夏秋季浮游植物优势种生态特征分析[J]. 华东师范大学学报(自然科学版), 2014, (6): 90-100, 120. XU F J, YU Q J, WANG H B, et al. Ecological characteristics analysis of phytoplankton's dominant species in summer and autumn in the Dianshan Lake, China[J]. Journal of East China Normal University(Natural Science), 2014, (6): 90-100, 120. |
| [10] | 王翠红, 张金屯. 汾河水库及河道中优势硅藻生态位的研究[J]. 生态学杂志, 2004, 23(3): 58-62. WANG C H, ZHANG J T. Niche analysis of diatoms in Fenhe river and Fenhe reservoir[J]. Chinese Journal of Ecology, 2004, 23(3): 58-62. |
| [11] | 于振海, 金显仕, 李显森. 黄海中南部主要鱼种的生态位分析[J]. 渔业科学进展, 2010, 31(6): 1-8. Yu ZH, Jin X S, Li X S. Analysis of ecological niche for major fish speciesin the central and southern Yellow Sea[J]. Progress inFishery Sciences, 2010, 31(6): 1-8. |
| [12] | 李显森, 于振海, 孙珊, 等. 长江口及其毗邻海域鱼类群落优势种的生态位宽度与重叠[J]. 应用生态学报, 2013, 24(8): 2353-2359. JIN X S,YU Z H, SUN S, et al. Ecological niche breadth and niche overlap of dominant species of fish assemblage in Yangtze River estuary and its adjacent waters[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2353-2359. |
| [13] | PINKAS L, OLIPHANT MS, IVERSON ILK. Food habits of albacore,bluefin tuna, and bonito in Californian waters[J]. Fisheries Bulletin, 1971, 152: 1-105. |
| [14] | 程济生. 东、黄海冬季底层鱼类群落结构及其多样性[J]. 海洋水产研究, 2000, 21(3): 1-8. CHENG J S. The structure and diversity of demersal fish communities in winter in the East China Sea and the Yellow Sea[J]. Marine Fisheries Research, 2000, 21(3): 1-8. |
| [15] | 程济生. 黄渤海近岸水域生态环境与生物群落[M]. 青岛: 中国海洋大学出版社, 2004: 209-244. CHENG J S. The ecological environment and biological communities in the coastal waters of Bohai Sea and Yellow Sea[M]. Qingdao: Ocean University of China Press, 2004: 209-244. |
| [16] | HUTCHINSON G E. A treatise on limnology[M]. New York: Wiley, 1957. |
| [17] | SHANNON C E, WIENER W. The mathematical theory of communication[M]. Urbana:University of Illinois Press, 1963. |
| [18] | MURIE D J. Comparative feeding ecology of two sympatric rockfish congeners, Sebastes caurinus (copper rockfish) and S. maliger (quillback rockfish)[J]. Marine Biology, 1995, 124(3): 341-353. |
| [19] | COLWELL R K, FUTUYMA D J. On the measurement of niche breadth and overlap[J]. Ecology, 1971, 52(4): 567-576. |
| [20] | 殷宝法, 淮虎银, 张镱锂, 等. 可可西里地区藏羚羊、藏原羚和藏野驴的营养生态位[J]. 应用生态学报, 2007, 18(4): 766-770. YIN B F, HUAI H Y, ZHANG Y L, et al. Trophic niches of Pantholops hodgsoni, Procapra picticaudata and Equus kiang in Kekexili region[J]. Chinese Journal of AppliedEcology, 2007, 18(4): 766-770. |
| [21] | 刘加珍, 陈亚宁, 张元明. 塔里木河中游主要植物种群的生态特征分析[J]. 地理研究, 2003, 22(5): 663-670. LIU J Z, CHEN Y N, ZHANG Y M. Analysis on ecological characteristics of main plants in middle reaches ofTarim River[J]. Geographical Research, 2003, 22(5): 663-670. |
| [22] | PIANKA E R. The structure of lizard communities[J]. Annual Review of Ecology and Systematics, 1973, 4: 53-74. |
| [23] | CLARKE K R, WARWICK R M. Changes in marine communities: An approach to statistical analysis and interpretation[M]. Plymouth: Plymouth Marine Laboratory, 1994. |
| [24] | 沈盎绿, 徐兆礼. 瓯江口海域夏秋季鱼类初步调查[J]. 海洋渔业, 2008, 30(3): 285-290. SHEN A L, XU Z L. Preliminary investigation on the fishes of Oujiang river estuary[J]. Marine Fisheries, 2008, 30(3): 285-290. |
| [25] | 徐兆礼. 瓯江口海域夏秋季鱼类多样性[J]. 生态学报, 2008, 28(12): 5948-5956. XU Z L. Analysis of fish diversity in the waters off the Oujiang estuary in summer and autumn[J]. Acta Ecologica Sinica, 2008, 28(12): 5948-5956. |
| [26] | 唐启升. 中国专属经济区海洋生物资源与栖息环境[M]. 北京: 科学出版社, 2006: 974-990. TANG Q S. Marine living resources andhabitat environment in China's exclusive economiczone[M]. Beijing: Science Press, 2006: 974-990. |
| [27] | 郑挺, 林元烧, 曹文清, 等. 北部湾北部生态系统结构与功能——浮游动物空间生态位及其分化[J]. 生态学报, 2014, 34(13): 3635-3649. ZHENG T, LIN Y S, CAO W Q, et al. Ecosystem structure and function in northern Beibu Gulf: Zooplankton spatialniche and its differentiation[J]. Acta Ecologica Sinica, 2014, 34(13): 3635-3649. |
| [28] | 徐晓群, 曾江宁, 陈全震, 等. 浙江三门湾浮游动物优势种空间生态位[J]. 应用生态学报, 2013, 24(3): 818-824. XU X Q, ZENG J N, CHEN Q Z, et al. Spatial niches of dominant zooplankton species in Sanmen Bay, Zhejiang Province of East China[J]. Chinese Journal ofApplied Ecology, 2013, 24(3): 818-824. |
| [29] | 葛宝明, 鲍毅新, 郑祥, 等. 灵昆岛潮间带大型底栖动物群落结构与生态位分析[J]. 生态学报, 2005, 25(11): 3037-3043. GE B M, BAO Y X, ZHENG X, et al. The structure of the macrobenthic community and niche analysis at a tidal flat of Linkun Island[J]. Acta Ecologica Sinica, 2005, 25(11): 3037-3043. |
| [30] | 彭松耀, 李新正, 王洪法, 等. 南黄海春季大型底栖动物优势种生态位[J]. 生态学报, 2015, 35(6): 1917-1928. PENG S Y, LI X Z, WANG H F, et al. Niche analysis of dominant species of macrozoobenthic community in the southern Yellow Sea in spring[J]. Acta Ecologica Sinica, 2015, 35(6): 1917-1928. |
| [31] | 刘巍, 曹伟. 长白山云冷杉群落主要种群生态位特征[J]. 生态学杂志, 2011, 30(8): 1766-1774. LIU W, CAO W. Niche characteristics of main plant species in spruce-fir forests in Changbai Mountains[J]. Chinese Journal of Ecology, 2011, 30(8): 1766-1774. |
| [32] | 苏锦祥. 鱼类学与海水鱼类养殖[M]. 2版. 北京: 中国农业出版社, 1995: 253-262. SU J X. Fish and marine fish culture[M]. 2nd ed. Beijing: China Agriculture Press, 1995: 253-262. |
 2016, Vol. 25
2016, Vol. 25


