2. 上海海洋大学 上海市水域环境生态上海高校工程研究中心, 上海 201306
随着人们生活水平的提高和工农业的发展,大量氮磷等营养物质进入水体,导致水体富营养化加剧,水华频发,进而引起水中溶氧量下降、水质恶化,有些藻类还释放毒素,导致部分水生生物死亡,并危及饮用水安全。 常见的淡水水华藻类主要有栅藻(Scenedesmus)、小球藻(Chlorella vulgaris)、盘星藻(Pediastrum)和铜绿微囊藻(Microcystis aeruginosa)等[1],赤潮藻类有塔玛亚历山大藻(Alexandrium tamarense)、赤潮异弯藻(Heterosigma akashiwo)、双突角毛藻(Chaetoceros didymus Ehrenberg)、柔弱角毛藻(Chaetoceros debilis Cleve)和新月菱形藻等(Nitzschiaceae closterium)[2]。目前常用的控藻方法有物理方法如过滤法[3]、撒播黏土法[4]、人工打捞法[5]等,虽然短时间内见效快,但程序复杂,不能彻底根除隐患,很难大规模投入使用;化学方法如投加硫酸铜和双氧水等无机除藻剂、二氯苯二甲脲等有机除藻剂[6]、电化学法[7]、催化氧化法[8]等,虽然见效快,但易引发二次污染,也难大规模投入使用;生物方法如投加微生物制剂[9]、生物操控的上行效应[10]、下行效应[11]和投放可释放化感物质的植物[12]等。实际在控藻过程中,需要兼顾技术、经济与自然环境状况,对不同方案进行效益分析,以选择最优方案[13]。目前生物方法,尤其是利用植物化感物质抑制藻类滋生具有良好的应用前景[14]。
研究发现陆生植物如大麦秆(Hordeum vulgare)[15]、广玉兰(Magnolia grandiflora)[16]、红树植物(Mangrove plants)[17]、黑荆树(Acacia mearnsii)[18]等,以及一些水生植物如芦苇(Phragmites communis)[19]、黄花水龙(Jussiaea stipulacea Ohwi)[20]、凤眼莲(Eichhornia crassipes)[21]、轮藻( Charophyceae)[22]、狐尾藻(Myriophyllum spicatum)[23]等均可释放化感物质以抑制藻类的生长。狐尾藻为被子植物门(Angiospermae)、双子叶植物纲(Dicotyledoneae)、小二仙草科(Haloragidaceae)、狐尾藻属(Myriophyllum) 沉水植物,广泛分布于世界各地,能吸收水中营养元素,且其水浸提液对藻类致死率效果明显,因此常被用于净化水质,修复生态环境。
常用的化感物质提取方法包括溶剂浸提法、水蒸气蒸馏法和厌氧腐解法。HONG等研究发现芦竹(Arundo donax)水浸提液对产毒铜绿微囊藻(Microcystis aeruginosa)的生长具有显著的抑制作用,其EC50为4.7 g/L[24]。LI等利用有机溶剂浸提法从芦苇中提取出对蛋白核小球藻(Chlorella pyrenoidosa)和铜绿微囊藻具有抑制作用的化感物质2-甲基乙酰乙酸乙脂[25]。胡晓佳等利用水蒸气蒸馏法从一枝黄花(Solidago canadensis L.)中提取的化感物质对铜绿微囊藻有抑藻作用[26]。本实验主要研究利用超声波-纤维素酶法提取狐尾藻抑藻有效成分的可行性,通过单因素和正交试验法优化提取工艺,并与水浸提法相比较,以期获得可有效抑制铜绿微囊藻生长的化感物质提取方法,为有害藻类的控制提供实用技术指导。
1 材料与方法 1.1 实验材料狐尾藻植株于冬季取自上海太和水环境科技发展有限公司滴水湖基地,采集后经自来水和蒸馏水清洗干净,然后自然风干,人工研磨粉碎,过20目筛后备用。
铜绿微囊藻取自上海海洋大学水产与生命学院藻种室,镜检无杂藻且生长良好,用BG-11培养基[27]扩繁。培养条件为恒温25 ℃,光照强度约3 000 lx,光暗比12 h∶12 h,每天人工摇动6次,摇匀后,用血球计数板法计算藻细胞的数量,当细胞生物量达到对数生长期时进行实验。实验期间所用器皿和培养液均经灭菌处理,所有操作过程在洁净工作台上进行。
实验仪器包括:数控超声波清洗器(KQ-3200DB ,150 W,40 kHz,昆山市超声仪器有限公司),电热恒温水浴锅(DK-S24型,上海精宏实验设备有限公司),Eppendorf高速冷冻离心机(5810r,深圳市赛亚泰科仪器设备有限公司),漩涡振荡器(CHA-S,常州国华),纯水机(0S007XXM1,上海诚铭科技有限公司),光照培养箱(宁波莱福科技有限公司),可见分光光度计(UV-2102C,美国),电子天平(AE200,日本),光学显微镜(OLYMPUS,日本),自动灭菌锅(LDZX-30KBS,上海申安医疗器械厂),洁净工作台(PSE-660,苏州真田洁净设备有限公司),血球计数板等。
实验试剂包括:K2HPO4·3H2O、MgSO4·7H2O、CaCl2·2H2O、柠檬酸、柠檬酸铁铵、NaNO3、EDTA-Na2、无水乙醇,纤维素酶。
1.2 实验方法 1.2.1 化感物质提取步骤称取3 g狐尾藻粉末、60 mL经0.1 mol/L HCl调节pH至w的水溶液和m%纤维素酶(纤维素酶质量/藻粉质量=m%)于100 mL锥形瓶中,密封放置于恒温水浴振荡器,反应条件为:酶解温度t ℃,转速120 r/min,酶解时间x h,然后放入超声温度t ℃,超声功率g %,超声时间u h的超声波清洗器中得粗提液,将粗提液转入50 mL塑料离心管中,4 ℃、5 000 r/min离心20 min,取上清液保存。参考汪家政等[28]的方法,于-20 ℃无水乙醇冰浴条件下,多次重复去除上清液中的蛋白质,最后在恒温水浴振荡器中,以温度t ℃使上清液挥发浓缩结晶,并用蒸馏水定容至50 mL,保存于冰箱中备用。此法得到狐尾藻化感物质的质量浓度为60 g/L(以狐尾藻粉末质量计),提取步骤如图1所示。
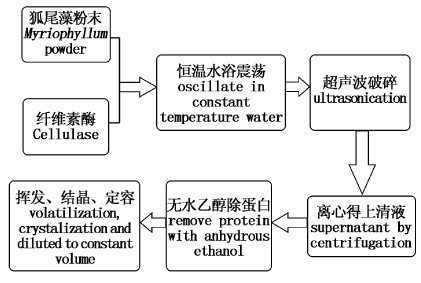
|
图 1 狐尾藻化感物质提取步骤 Fig.1 Extraction steps of allelo-chemicals from Myriophyllum spicatum |
选择酶解温度(20、30、40、50、60、70 ℃)、酶解pH(2.0、3.0、4.0、5.0、6.0、7.0)、酶解时间(0.5、2、4、8、16、32 h)、酶用量(0.5%、1.0%、3%、6%、9%、15%)、超声功率(40%、50%、60%、70%、80%、90%)、超声时间(0.5、1、2、3、4、5h)6个因子,按照图1所示步骤提取狐尾藻化感物质,测定所得提取液对铜绿微囊藻的生长阻碍率,并以生长阻碍率为指标确定最适的单因子工艺条件。每组实验取3个平行,同时取无水乙醇组做试剂空白对照。
1.2.3 正交试验根据单因素试验结果,优化提取工艺。设计酶解温度、酶解pH、酶作用时间、酶用量和超声波功率5因素4水平L(45)正交试验,以提取液对铜绿微囊藻的最大生长阻碍率为指标,评价各组提取效率,并在最优工艺条件下重复操作,观察稳定性。正交设计如表1所示。
| 表 1 正交试验因素和水平 Tab. 1 Factors and levels of orthogonal experimental design |
取4.17 mL不同条件下获得的狐尾藻提取液、2.5 mL处于对数生长期的铜绿微囊藻溶液和5 mL浓缩10倍BG-11 培养液置于100 mL锥形瓶中,蒸馏水定容至50 mL,各溶液中化感物质浓度(以狐尾藻粉末质量计)均为5 g/L。实验设3个平行,另设乙醇试剂空白对照,将锥形瓶置于25 ℃光照培养箱内,光照强度约3000 lx、光暗比12 h∶12 h,每天人工摇动6 次,每隔24 h观察计数。
按照国际经合组织(OECD)规定的标准方法计算藻类生长阻碍率[29]:
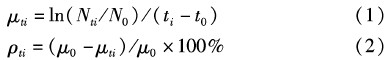
狐尾藻水浸出液的制备 取20 g狐尾藻茎部干粉加入400 mL蒸馏水中,在室温条件下浸泡48 h,4 ℃、4 000 r/min离心30 min,多次离心将浸出液浓缩结晶,用蒸馏水定容200 mL得提取液A,保存于4 ℃冰箱内备用,所得提取液化感物质的质量浓度为100 g/L(以狐尾藻粉末质量计)。
超声波-纤维素酶法提取液的制备 取20 g狐尾藻茎部干粉加入400 mL pH=3.0的水溶液中,按照图1所示步骤,根据正交试验最优工艺条件得狐尾藻超声波-纤维素酶法提取液,实验温度条件下将提取液浓缩结晶后用蒸馏水定容至200 mL得提取液B,保存于4 ℃冰箱内备用,所得提取液化感物质的质量浓度为100 g/L(以狐尾藻粉末质量计)。
实验时,分别将0 、2.5 、5 、10 、15 和20 mL 的提取液A或提取液B,2.5 mL处于对数生长期的铜绿微囊藻溶液和5 mL浓缩10倍的BG-11培养液置于100 mL锥形瓶中,蒸馏水定容至50 mL,相应的化感物质浓度(以狐尾藻粉末质量计)分别为0 、5、10、20、30和40 g/L。设立3个平行试验组,将锥形瓶置于25 ℃光照培养箱内,光照强度约3 000 lx、光暗比12 h∶12 h,每天人工摇动6次,每隔24 h观察计数。
1.2.6 数据分析所有数据采用平均值±标准差表示。用Excel统计分析实验数据,用SPSS 17.0进行方差分析和差异性研究,用SigmaPlot 10.0软件绘图,取P < 0.05为差异显著。
2 结果 2.1 超声波-纤维素酶法单因素实验结果 2.1.1 酶解温度对提取液灭藻效果的影响实验发现,试剂空白对照组溶液对铜绿微囊藻生长无明显影响。由表2可知,随着酶解温度的升高,提取液对铜绿微囊藻的生长阻碍率先升高再降低,当酶解温度为30 ℃时,生长阻碍率达到最高,显著高于其他组,故适宜酶解温度为30 ℃。同时,随着提取液作用时间的延长,其对铜绿微囊藻的抑制作用持续降低,各组间差异逐渐缩小,说明提取液对铜绿微囊藻的抑制作用在早期更为明显。
| 表 2 不同酶解温度下所得提取液对铜绿微囊藻生长阻碍率的影响 Tab. 2 Growth inhibition rate of M. aeruginosa treated with extraction obtained under different enzymatic hydrolysis temperature |
由表3可知,随着酶解pH的升高,提取液对铜绿微囊藻的生长阻碍率先升高后降低,当pH为3.0时,提取液对铜绿微囊藻的生长阻碍率最高,显著高于其他酶解pH组,同时,随着提取液作用时间的延长,其对铜绿微囊藻的生长阻碍率持续降低。作用时间为96 h,酶解pH为2和3时所得提取液对铜绿微囊藻有抑制作用,前者抑制作用明显小于后者,而其他酶解pH组所得提取液对铜绿微囊藻的生长无抑制作用,故适宜酶解pH为3.0。
| 表 3 不同酶解pH下所得提取液对铜绿微囊藻生长阻碍率的影响 Tab. 3 Growth inhibition rate of M. aeruginosa treated with extraction obtained under different enzymatic hydrolysis pH |
由表4可知,随着酶解时间的增加,提取液对铜绿微囊藻的生长阻碍率先升高再降低,当酶解时间为4 h时,提取液对藻细胞的生长阻碍率最高,显著高于其他酶解时间组,而且随着提取液作用时间的延长,其对铜绿微囊藻的抑制作用持续降低,各组间差异逐渐缩小,提取液对铜绿微囊藻的抑制作用在早期更为明显,故适宜酶解时间为4 h。
| 表 4 不同酶解时间下所得提取液对铜绿微囊藻生长阻碍率的影响 Tab. 4 Growth inhibition rate of M. aeruginosa treated with extraction obtained under different enzymatic hydrolysis time |
由表5可知,随着酶用量的增加,提取液对铜绿微囊藻的生长阻碍率持续升高,当酶用量为15%时,提取液对铜绿微囊藻的生长阻碍率最高,与其他组存在显著差异,故最适酶用量为15%。随着提取液作用时间的延长,其对铜绿微囊藻的生长抑制作用持续下降,各组间差异逐渐缩小,提取液对铜绿微囊藻的抑制作用在早期更为明显。
| 表 5 不同酶用量下所得提取液对铜绿微囊藻生长阻碍率的影响 Tab. 5 Growth inhibition rate of M. aeruginosa treated with extraction obtained under different enzymatic hydrolysis dosage |
由表6可知,随着超声功率的增加,提取液对铜绿微囊藻的生长阻碍率先升高后降低,当超声功率为80%时,提取液对铜绿微囊藻的生长阻碍率最高,显著高于其他超声功率组,故最适超声功率为80%,即超声功率为120 W。而且,随着提取液作用时间的延长,其对铜绿微囊藻的生长抑制作用持续降低,各组间差异逐渐缩小,提取液对铜绿微囊藻的抑制作用在早期更为明显。
| 表 6 不同超声功率下所得提取液对铜绿微囊藻生长阻碍率的影响 Tab. 6 Growth inhibition rate of M. aeruginosa treated with extraction obtained under different ultrasonic power |
由表7可知,随着超声时间的增加和提取液作用时间的延长,各组提取液对铜绿微囊藻的生长阻碍率未呈现规律性变化,经显著差异性分析,各组间无显著差异(P>0.05),故超声时间不参与正交试验设计,在实际提取工艺中取超声时间为1 h。
| 表 7 不同超声时间下所得提取液对铜绿微囊藻生长阻碍率的影 Tab. 7 Growth inhibition rate of M. aeruginosa treated with extraction obtained under different ultrasonic time |
根据表8的R值可知,各组提取液对铜绿微囊藻的生长阻碍率影响程度依次为B>A>E>D>C。根据k3、k4和酶作用时间可知,酶作用时间4 h的提取液与5 h的提取液对铜绿微囊藻的生长阻碍率不存在显著差异,故酶作用时间为4 h。由表9可见,酶解温度、酶解时间、pH、酶用量和超声时间对铜绿微囊藻的生长阻碍率影响均达到显著性差异水平(P < 0.05),影响程度最大是酶解pH,然后是酶解温度,以提取液对铜绿微囊藻的生长阻碍率为评价指标,5个因素的最优组合是A2B2C4D4E3,即pH为3.0,酶解温度30 ℃,纤维素酶用量21%,超声波功率80%(120 W),酶作用时间4 h。此优化工艺条件下,进行3次验证实验,提取液对铜绿微囊藻的生长阻碍率均值达180.32%。
| 表 8 正交实验设计与结果 Tab. 8 The orthogonal table L16(45)and experimental results |
| 表 9 方差分析表 Tab. 9 Analysis of variance for the growth inhibition rate of the algae |
由图2可知,随着水浸提液浓度的增加,其对铜绿微囊藻的生长阻碍率持续升高,当浓度为40 g/L,作用时间24 h时,最大生长阻碍率为129.78%。同时,随着提取液作用时间的延长,其对铜绿微囊藻的抑制作用持续降低,各组间差异逐渐缩小,7 d后,各浓度组提取液对铜绿微囊藻生长的抑制作用消失。

|
图 2 水浸提液对铜绿微囊藻生长阻碍率的影响 Fig.2 Influence of water extraction on the growth inhibition rate of M.aeruginosa |
由图3可知,随着超声波-纤维素酶提取液浓度的增加,其对铜绿微囊藻的生长阻碍率持续升高,当浓度为40 g/L,作用时间2 4h时,最大生长阻碍率为271.74%。同时,随着提取液作用时间的延长,其对铜绿微囊藻的抑制作用持续降低,说明提取液对铜绿微囊藻的抑制作用在早期更为明显。与水浸提液相比,仅低浓度组(5 g/L、10 g/L)在7 d后对铜绿微囊藻抑制作用消失,其他各组仍保留着比水浸提液更高的抑制能力,尤其是40 g/L浓度组,在第13天,对铜绿微囊藻的生长阻碍率仍达20%以上,显著高于其他组别(P<0.05)。
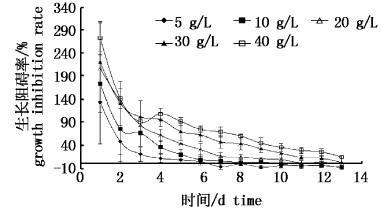
|
图 3 超声波-纤维素酶提取液对铜绿微囊藻生长阻碍率的影响 Fig.3 Influence of extraction of ultrasonic-cellulase on the growth inhibition rate of M. aeruginosa |
由图4可知,随着反应时间的延长,藻密度不断增加。藻密度随着提取液浓度上升而下降。40 g/L浓度组藻密度与其他浓度组存在显著性差异(P<0.05),与对照组存在显著差异(P<0.05)。
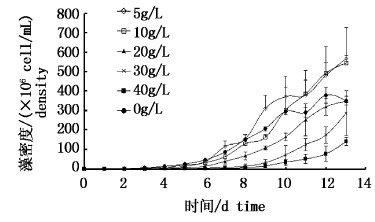
|
图 4 不同浓度超声波-纤维素酶提取液下铜绿微囊藻的生长曲线 Fig.4 Growth curves of M. aeruginosa at the different concentration of extraction of ultrasonic-cellulase |
狐尾藻茎部细胞壁的主要成分是纤维素,纤维素酶可水解纤维素,破坏细胞结构,加速细胞内容物的释放,超声波也可以破坏植物细胞结构。本研究中发现,随着酶解温度升高,提取液对铜绿微囊藻的生长阻碍率先升高后降低,30 ℃达到最高,这与石亚中等[30]对酶解温度的研究相类似,可能是由于纤维素酶是一种蛋白质,温度对其活性产生影响,适宜的温度可以增强酶活性,温度过高或者过低会使酶活性降低或者失活,从而导致提取液中有效成分含量降低。随着酶解pH升高,提取液对铜绿微囊藻的生长阻碍率先升高后降低,3.0达到最高,可能是因为适宜pH有助于酶和底物的有效结合,增强酶的活性,提高化感物质提取率,反之则破坏酶的结构,导致纤维素酶活性降低或失活,从而影响其对纤维素的降解作用[31]。随着酶解时间延长,提取液对铜绿微囊藻的生长阻碍率先升高后降低,4h达到最高,可能是因为酶解时间过短,纤维素分解不完全,有效抑藻成分含量低;酶解时间过长,藻细胞分解完全,但抑藻成分间相互作用,导致有效成分的含量降低[30]。随着酶用量的增加,提取液对藻细胞的生长阻碍率持续上升,这可能是因为只有当酶量达到纤维素饱和状态,作用效果才更高,才能够彻底分解藻细胞,加速内容物的释放,这与李梦雪等[31]对纤维素酶用量的研究结论相一致。40 kHz频率下,随着超声功率增加,提取液对铜绿微囊藻的生长阻碍率先升高后降低,这可能是因为超声功率在一定范围内可促进酶介导的反应,如果功率过大,酶结构可能会发生不可逆的变化,而且功率过大,也可能会降解化感物质中的有效成分。
徐艳等研究发现利用超声-酶法提取黄柏中小檗碱具有提取率高、省时、高效、节能等优点[32]。本研究中超声波-纤维素酶提取液与水浸提液相比,仅低浓度组(5 g/L、10 g/L)在7 d后对铜绿微囊藻抑制作用消失,其他各组仍保留着比水浸提液更高的抑制能力,尤其是40 g/L浓度组,在第13天,对铜绿微囊藻的生长阻碍率仍达30%以上,显著高于其他组别(P<0.05),表明超声-酶法提取液抑藻效果好于水浸提液。本实验中,狐尾藻水浸提液对铜绿微囊藻的抑制效率与崔莉凤等[33]对狐尾藻的研究结论存在差异,可能是因为本文中提取狐尾藻化感物质用的是蒸馏水,而后者用的是培养液,也有可能是因培养条件不同而导致。何连生等发现荷茎叶浸出液对铜绿微囊藻的生长抑制率在6 d内先升高后降低,最高可达60%左右[34]。NAKAI等发现穗花狐尾藻与铜绿微囊藻共生培养下,短期内对铜绿微囊藻有抑制作用[35]。而本研究中超声波-纤维素酶狐尾藻提取液对铜绿微囊藻有持续抑制作用,20 g/L及以上各组在7 d后仍保持着比水浸提液更高的抑制能力。因此,超声波-纤维素酶法提取狐尾藻化感物质具有较强的抑藻作用,可为今后控藻研究提供一种研究方法,也为今后实际应用提供一些指导。
| [1] | 邹华, 邓继选, 朱银.植物化感作用在控制水华藻类中的应用[J].食品与生物技术学报, 2012, 31 (2):134-140. ZOU H, DENG J X, ZHU Y. Application of plant allelopathy in controlling of algal bloom[J]. Journal of Science and Biotechnology, 2012, 31(2):134-140. |
| [2] | 李玉瑛, 李冰.鼠李糖脂对赤潮藻类的防治作用[J].中国环境科学, 2010, 30(s):24-28. LI Y Y, LI B. The effect of rhamnolipid on the mitigation of red tide algae[J].China Environmental Science, 2010, 30(s):24-28. |
| [3] | 张学礼, 季爱玲.超滤膜在富营养化水处理中的应用前景[J].辽宁化工, 2011, 40(2):148-155. ZHANG X L, JI A L. Application prospect of ultrafiltration membrane in treatment of eutrophic water[J]. Liaoning Chemical Industry, 2011, 40(2):148-155. |
| [4] | 余志, 王仕汇.天然粘土治理赤潮的研究进展[J].山西建筑, 2008, 34(1):191-192. YU Z, WANG S H. Research advancement on controlling red tide by natural clay[J]. Shanxi Architecture, 2008, 34(1):191-192. |
| [5] | 潘攀, 刘德启, 李海青, 等.藻类打捞对水体营养循环的影响及其生态效果研究[J].环境工程学报, 2012, 4(7):1509-1512. PAN P, LIU D Q, LI H Q, et al. Study on influence and ecological effect of water nutrient cycle caused by algae salvage[J].Chinese Journal of Environmental Engineering, 2012, 4 (7):1509-1512. |
| [6] | 李今, 华江环.几种除藻剂对铜绿微囊藻生长的毒性效应[J].沈阳师范大学学报:自然科学版, 2011, 29(3):444-448. LI J, HUA J H. Toxic effect of Cu2+, H2O2 and 3-1, 1- dimethylurea(DCMU) to Microcystis aeruginosa[J]. Journal of Shenyang Normal University :Natural Science, 2011, 29 (3): 444 -448. |
| [7] | 白敏冬, 白希尧, 吕吉斌, 等.强电离先进氧化OH.治理赤潮试验[J].应用与环境生物学报, 2004, 10(5): 626-630. BAI M D, BAI X Y, LÜ J B, et al. Treating red tide using strong ionization advanced oxidation OH. |
| [8] | 尹平河, 黄风, 赵玲.载Fe3+纳米TiO2薄膜去除球形棕囊藻赤潮生物的研究[J].热带海洋学报, 2010, 29(4):102-106. YI P H, HUANG F, ZHAO L.Study on visible photocatalysis removal of Phaeocystis globosa by use of Fe3+-doped Nano-TiO2 film[J]. Journal of tropical Oceanography, 2010, 29(4): 102 -106. |
| [9] | MAYALI X, AZAM F. Algicidal bacteria in the sea and their impact on algal blooms[J]. The Journal of eukaryotic microbiology, 2004, 51(2):139-144. |
| [10] | 许海, 朱广伟, 秦伯强, 等.氮磷比对水华蓝藻优势形成的影响[J].中国环境化学, 2011, 31 (10): 1676-1683. XU H, ZHU G W, QIN B Q, et al. Influence of nitrogen-phosphorus ratio on dominance of bloom-forming cyanobacteria(Microcystis aeruginosa)[J]. China Environmental Science, 2011, 31(10): 1676-1683. |
| [11] | 张丽彬, 王金鑫, 王启山, 等.浮游动物在生物操作法除藻中的作用研究[J].生态环境, 2007, 16(6): 1648-1653. ZHANG L B, WANG J X, WANG Q S, et al. Effect of zooplankton on removing algae in bio-manipulation[J]. Ecology and Environment, 2007, 16(6): 1648 -1653. |
| [12] | 李小路, 潘慧云, 徐洁, 等.金鱼藻与铜绿微囊藻共生情况下的化感作用[J].环境科学学报, 2008, 28(11):2243-2249. LI X L, PAN H Y, XU J, et al. Allelopathic effects of Ceratophyllum demersum and Microcystis aeruginosa in co-cultivation[J]. Acta Scientiae Circumstantiae, 2008, 28 (11): 2243-2249. |
| [13] | 张义龙, 慕永通.基于生态系统的渔业管理理论探讨[J].中国渔业经济, 2006(3):34-36. ZHANG Y L, MU Y T. The theoretical research about the ecosystem-based fishery management[J]. Chinese Fisheries Economics, 2006(3):34-36. |
| [14] | 洪喻, 胡洪营.水生植物化感抑藻作用研究与应用[J].科学通报, 2009, 54(3):287-293. HONG Y, HU H Y. Research and application of inhibitory allelopathy from aquatic plants on algae[J].Chinese Science Bulletin, 2009, 54(3):287-293. |
| [15] | TERLIZZID E, FERRIER M D, ARMBRESTER E A, et al. Inhibition of dinoflagellate growth by extracts of barley straw(Hordeum vulgare)[J]. Journal of Applied Phycology, 2002, 14:275-280. |
| [16] | DONG K M, ZHOU X J, JIN C L, et al. Research on algistatic activities of allelochemicals in Magnolia Grandiflora Leaves and GC-MS analysis[J]. Agricultural Science& Technology, 2011, 12(8):1191-1194. |
| [17] | 孙志伟, 段璐洋, 周静韵, 等.红树植物干粉和新鲜组织水提物对两种赤潮藻的化感抑制效应[J]. 生态科学, 2012, 31(2):109-114. SUN Z W, DUAN L Y, ZHOU J Y, et al. Allelopathic effects of water extracts from mangrove plants dry powder and fresh tissue on two red-tide algae[J]. Ecological Science, 2012, 31(2):109-114. |
| [18] | 罗凯, 刘丹丹, 周丽蓉, 等.黑荆树提取物对铜绿微囊藻的化感抑制效应[J].深圳大学学报:理工版, 2014, 31(2):205-209. LUO K, LIU D D, ZHOU L R, et al. Allelopathic inhibitory effect of the Acacia mearnsii extracts on Microcystis Aeruginosa[J]. Journal of Shenzhen University Science and Engineering, 2014, 31(2):205-209. |
| [19] | 门玉洁, 胡洪营.芦苇化感物质EMA对铜绿微囊藻生长及藻毒素产生和释放的影响[J].环境科学, 2007, 28(9):2059-2062. MENG Y J, HU H Y. Effects of allelochemical ema from reed on the production and release of cyanotoxins in Microcystis aeruginosa[J]. Environmental Science, 2007, 28 (9): 2059-2062. |
| [20] | 吴湘, 吴昊, 叶金云.黄花水龙化感物质对铜绿微囊藻生长及藻毒素产生和释放的影响[J]. 海洋与湖沼, 2014, 45(4):783-788. WU X, WU H, YE J Y. Influences of allelochemical extracted from Jussiaea stipulacea Ohwi on growth, microcystins production, and release of Microcystis aeruginosa[J]. Oceanologia et Limnologia Sinica, 2014, 45(4):783-788. |
| [21] | 刘光涛, 周长芳, 孙利芳, 等.凤眼莲化感物质对铜绿微囊藻、斜生栅藻生长及细胞数相对比例的影响[J]. 环境科学学报, 2011, 31(10):2303-2311. LIU G T, ZHOU C F, SUN L F, et al. Effects of Eichhornia crassipes allelochemicals on the growth of two mono-and co-cultured algae Microcystis aeruginosa and Scenedesmus obliquus[J]. Acta Scientiae Circumstantiae, 2011, 31(10):2303-2311. |
| [22] | 李一葳, 黄彩红, 孟睿, 等.轮藻浸出液对铜绿微囊藻生长特性的影响[J].湿地科学, 2013, 11(3):388-391. LI Y W, HUANG C H, MENG R, et al.Effect of charophyceae extract on growth characteristicsof Microcystis aeruginosa[J].Wetland Science, 2013, 11(3):388-391. |
| [23] | HU W, ZHANG D, RAN Y X, et al. The allelopathy of myriophyllum spicatum on freshwater algae[J]. Journal of Anhui Nomal University (Natural Science), 2011, 34 (4): 359 -364. |
| [24] | HONG Y, HU H Y. Effects of the aquatic extract of Arundo donax L. (giant reed) on the growth of freshwater algae[J]. Allelopathy Journal, 2007, 20(2): 315-325. |
| [25] | LI F M, HU H Y. Isolation and characterization of a novel antialgal allelochemical from Phragmites communis[J]. Applied Environmental Microbiology, 2005, 71(11):6545-6553. |
| [26] | 胡晓佳, 魏月姑, 孙小红, 等.加拿大一枝黄花提取物对铜绿微囊藻的抑制作用[J].环境科学与技术, 2012, 35(1): 55-58. HU X J, WEI Y G, SUN X H, et al. Inhibitive effects of extracts of Solidago canadensis L.on Microcystis aeruginosa[J]. Environmental Science &Technology, 2012, 35(1): 55-58. |
| [27] | STANIER R Y, KUNISAWA R, MANDEL M, et al. Purification and properties of unicellular blue-green algae (Order Chroococcales )[J]. Bacteriological Review, 1971, 35(2):171-205. |
| [28] | 汪家政, 范明.蛋白质技术手册[M].北京:科学出版社, 2000, 313:68-69. WANG J Z, FAN M. Protein technology manual[M].Beijing:Science Press, 2000, 313:68-69. |
| [29] | 刘静铃, 郎佩珍.硝基芳烃类对斜生栅列藻的毒性及中毒症状[J].环境科学, 1995, 16 (2): 7-10. LIU J L, LANG P Z. Toxicities of nitroaromatic compound to Scenedesmus obliquus and toxic symptoms[J]. Environmental Science, 1995, 16(2):7-10. |
| [30] | 石亚中, 方娇龙, 钱时权, 等.响应曲面法优化纤维素酶酶解提取工艺[J].食品科学, 2013, 34 (4):75-79. SHI Y Z, FANG J L, QIAN S Q, et al. Response surface methodology for the optimization of enzymatic extraction of resveratrol grape pomace with cellulase[J]. Food Science, 2013, 34 (4):75-79. |
| [31] | 李梦雪, 张志军, 孙子文, 等.紫苏秸秆纤维素酶水解工艺优化研究[J].食品工业科技, 2013, 34(15):193-195. LI M X, ZHANG Z J, SUN Z W, et al. Process optimization on cellulose enzymatic hydrolysis of Perilla frutescens stalk[J]. Science and Technology of food industry, 2013, 34 (15):193-195. |
| [32] | 徐艳, 刘少霞, 孙娟.超声-酶法提取黄柏中小檗碱的工艺研究[J].时珍国医国药, 2007, 18 (6):1460-1462. XU Y, LIU S X, SUN J. Extraction study of berberine from cortex Phellodendri by ultrasonic wave-cellulase[J]. Lishizhen Medicine and Materia Medica Research, 2007, 18 (6):1460-1462. |
| [33] | 崔莉凤, 赵硕, 吴溶, 等.穗花狐尾藻浸出液对铜绿微囊藻生长和产毒的影响[J].环境科学与技术, 2010, 33(12F):50-54. CUI L F, ZHAO S, WU R, et al.Effects of extracts from Myriophyllum spicatum L. on the production and release of cyanotoxins in Microcystis aeruginosa[J].Environmental Science & Technology, 2010, 33(12F):50-54. |
| [34] | 何连生, 孟繁丽, 刁晓君, 等.白洋淀荷茎叶提取液对铜绿微囊藻及四尾栅藻化感效应[J]. 环境科学, 2013, 34(7):2637-2641. HE L S, MENG F L, DIAO X J, et al. Allelopathic effect of nelumbo nucifera stem and leaf tissue extract on the growth of Microcystis aeruginosa and Scenedesmus quadricanda[J]. Environment Science, 2013, 34(7):2637-2641. |
| [35] | NAKAI S, INOUE Y, HOSOMI M, et al. Growth inhibition of blue-green algae by allelopathic effects of macrophytes[J]. Water Science and Technology, 1999, 39(8):47-53. |
2. Research and Engineering Center on Aquatic Environment Ecosystem, Shanghai Ocean University, Shanghai 201306, China
 2015, Vol. 24
2015, Vol. 24


