2. 上海海洋大学 海洋科学学院, 上海 201306;
3. 国家海洋局北海环境监测中心, 山东 青岛 266033;
4. 国家海洋局东海监测中心, 上海 200137
绿潮(green tides)是一种在世界各沿岸国家中频繁发生的有害藻华(harmful algae blooms),是一种可以产生次生环境危害的生态异常现象[1, 2, 3]。绿潮一般由石莼属(Ulva)、刚毛藻属(Cladophora)、硬毛藻属(Chaetomorpha)等属的大型定生绿藻引起[4]。绿潮主要发生在春夏两季,一般在夏季高温时期结束,少数绿潮可持续到秋季。河口内湾、泻湖以及富营养化程度相对较高的海域易发生绿潮[5]。2000-2006 年期间,我国东海、黄海以及渤海海域均无明显浒苔绿潮发生迹象[6]。但自2007年至今,我国黄海已连续8年发生超大规模绿潮。通过形态和分子鉴定,黄海绿潮优势种已确定为浒苔(Ulva prolifera)[7]。
浒苔是一种潮间带藻类,广泛分布于世界各地,是一种生态幅较宽的广温、广盐性藻类,对环境适应能力及繁殖能力较强[8]。且浒苔具有无性生殖(包括营养生殖和孢子生殖)、有性生殖(配子接合)和单性生殖(配子直接萌发)等多种繁殖方式,浒苔在生活史任何一个阶段都可以发育成完整植株,这种多样繁殖方式使浒苔可以很好地适应环境胁迫,并在恶劣环境中繁衍生息[9, 10, 11]。
目前国内外主要对黄海绿潮优势种类鉴定、浒苔生活史、生长发育、繁殖特性、光合生理、暴发源头、暴发机制等方面进行了大量研究[12, 13, 27],然而在漂浮机制方面尚未有研究报道。我们在2012-2014年连续3年对黄海绿潮暴发过程进行了船舶现场监测,发现在江苏滨海至山东青岛海域漂浮的浒苔藻体具有悬挂分枝特性。本文则针对这种悬挂分枝现象进行了研究,分析了海面漂浮及悬挂分枝这两种不同漂浮状态的浒苔藻体形态、细胞显微结构、叶绿素荧光参数以及叶绿素含量的差异性,以揭示黄海绿潮漂浮浒苔长距离漂浮机制。
1 材料与方法 1.1 青岛海区漂浮绿潮监测与形态观察2014年7月,对青岛海域漂浮绿潮藻进行监测,对绿潮藻漂浮藻体进行观测,观察到一种浒苔的气囊-分枝复合漂浮方式,即由主枝形成气囊暴露在空气中长期漂浮于海面上,其管状分枝悬挂其下完全浸泡在海水里。采集后用毛刷刷去杂物和杂藻后用干净的海水冲洗,阴至半干(含水40%~50%),用低温保种箱带回。将漂浮气囊与悬挂分枝各随机挑选5 棵藻株,记录外部形态特征,包括藻体颜色、外形轮廓、主枝有无、分枝粗细及数目。随机取10 棵新鲜藻株,在Olympus BX61 显微镜下观察藻体的表面细胞排列、形状、大小及内含物情况并拍照记录。
1.2 不同漂浮状态浒苔藻体荧光参数测定用德国walz公司生产的PHYTO-PAM 浮游植物荧光仪完成浒苔叶绿素荧光各个参数的测定,并且利用Phyto-Win软件收集、分析和储存数据。测量前浒苔暗适应8 min,先用检测光照射测得初始荧光Fo,再用强饱和脉冲光激发,测得最大荧光参数Fm,然后,光化光被打开,使样品开始进行光合作用,光照样品的最大荧光值(Fm′)被记录,从而计算出浒苔 PSⅡ在不同处理条件下的最大光化学效率Fv/Fm和实际光化学效率Y(Ⅱ)[14, 15, 16]:
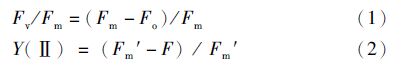
所有实验均进行5次重复。
1.3 不同漂浮状态浒苔藻体叶绿素含量测定将绿潮藻样品漂浮气囊及悬挂分枝分离后,吸干表面水分后分别取每份0.2 g藻体,每组3份测定藻体叶绿素含量。本实验中采取浸提法,浸提液为V(丙酮)∶V(无水乙醇)=1∶1。每份样品置于10 mL浸提液中,于室温黑暗中浸泡10 h,再用滤纸过滤洗脱入25 mL的定容量瓶中,定容至25 mL。用分光光度计测量样品在645 nm和663 nm波长下的吸光度,并计算出叶绿素的含量[16]:
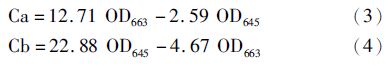

将气囊主枝与管状分枝分离,分别置于VSE培养液中[17],温度25 ℃,光照80 μmol/(m2·s),光暗比12 h∶12 h,每3天更换一次培养液。培养10 d后再次对两组不同状态绿潮藻细胞显微结构进行观察。
1.5 数据处理所有数据采用Excel 进行简单分析处理。采用 SPSS 10数据分析软件进行统计分析,并对数据进行方差性分析,数据为平均值±方差。
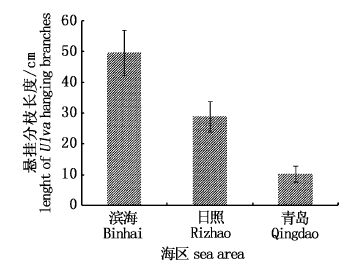
2 结果 2.1 黄海绿潮藻漂移过程中的囊枝悬挂现象2012-2014年监测结果显示黄海绿潮漂浮浒苔在江苏滨海至山东青岛海域漂移过程中呈现悬挂分枝现象。图1为2014年绿潮暴发过程海上漂浮浒苔现场照片,藻体主枝明显,基本都已形成气囊,且除基部较细以外,其余部位直径均相近,有较多细长分枝,分枝直径明显小于主枝,基部常缢缩。漂浮浒苔的分枝多呈管状,悬挂于气囊主枝下方。图2 显示了不同海区漂浮浒苔悬挂分枝的长度,从图中可以看出,漂浮藻体在由南至北漂移过程中,其悬挂分枝的长度呈递减趋势。

|
图1 漂浮浒苔悬挂分枝现象 Fig.1 Phenomenon of Ulva prolifera hanging branches 左:海区漂浮藻体;右:单株漂浮浒苔藻体。 Left:free-floating Ulva in the sea area; right: the individual Ulva algae floating thallus. |
|
图2 不同海区漂浮浒苔悬挂分枝长度 Fig.2 Length of Ulva prolifera hanging branches in different sea areas |
图3为同一株漂浮浒苔气囊与分枝的光合荧光参数的比较,悬挂分枝藻体的光合荧光参数

|
图3 漂浮浒苔气囊藻体与悬挂分枝藻体Fv/Fm值及YⅡ值的比较 Fig.3 Floating air-sac of Ulva prolifera algae and hangingbranches Fv/Fm and YⅡ value comparison |
Fv/Fm和YⅡ均明显高于囊状主枝,其中,悬挂分枝藻体的最大光化学效率(Fv/Fm)平均值为0.6±0.017,是囊状主枝的2.08倍,悬挂分枝藻体的实际光化学效率(YⅡ)平均值0.445±0.071,是囊状主枝的2.42倍。
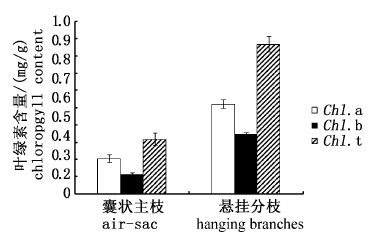
2.3 漂浮浒苔气囊藻体与悬挂分枝藻体的叶绿素含量比较将青岛海域采集的漂浮浒苔分成气囊主枝与悬挂分枝两组后分别测量叶绿素浓度并进行比较,由图4可见叶绿素含量的变化趋势与光合荧光参数变化趋势结果相同,气囊藻体主枝的叶绿素含量显著低于悬挂分枝藻体。其中,悬挂分枝藻体的叶绿素a、叶绿素b及总叶绿素含量分别为(0.523±0.027)、(0.347±0.011)和(0.871±0.045) mg/g,分别是气囊藻体的2.55、3.07和2.74倍。
|
图4 漂浮浒苔气囊藻体与悬挂分枝藻体的叶绿素含量比较 Fig.4 Floating air-sac of Ulva prolifera algae and hanging branches chlorophyll content comparison |
漂浮浒苔藻体主枝均已形成气囊,且气囊藻体中发白面积比例较大并呈斑块状(图版Ⅰ-1)。进一步通过细胞显微结构观察,发现发白藻体的细胞可以分为3种状态:(1)藻体细胞质向一边偏移或向中央萎缩变色(图版Ⅰ-2,3);(2)藻体细胞质颗粒化后褪色变白,失去活性(图版Ⅰ-4,5);(3)营养细胞形成生殖细胞囊后,放散出繁殖体成空细胞(图版Ⅰ-6)。而悬挂分枝则多为管状,少部分为丝状,颜色较绿且无明显斑块(图版Ⅰ-7),细胞内容物充盈,多呈营养细胞状态,仅少部分细胞细胞壁增厚、细胞质萎缩(图版Ⅰ-8,9)。可见,悬挂分枝藻体的细胞多呈活跃生长状态,而气囊藻体的细胞处于逐渐死亡状态。
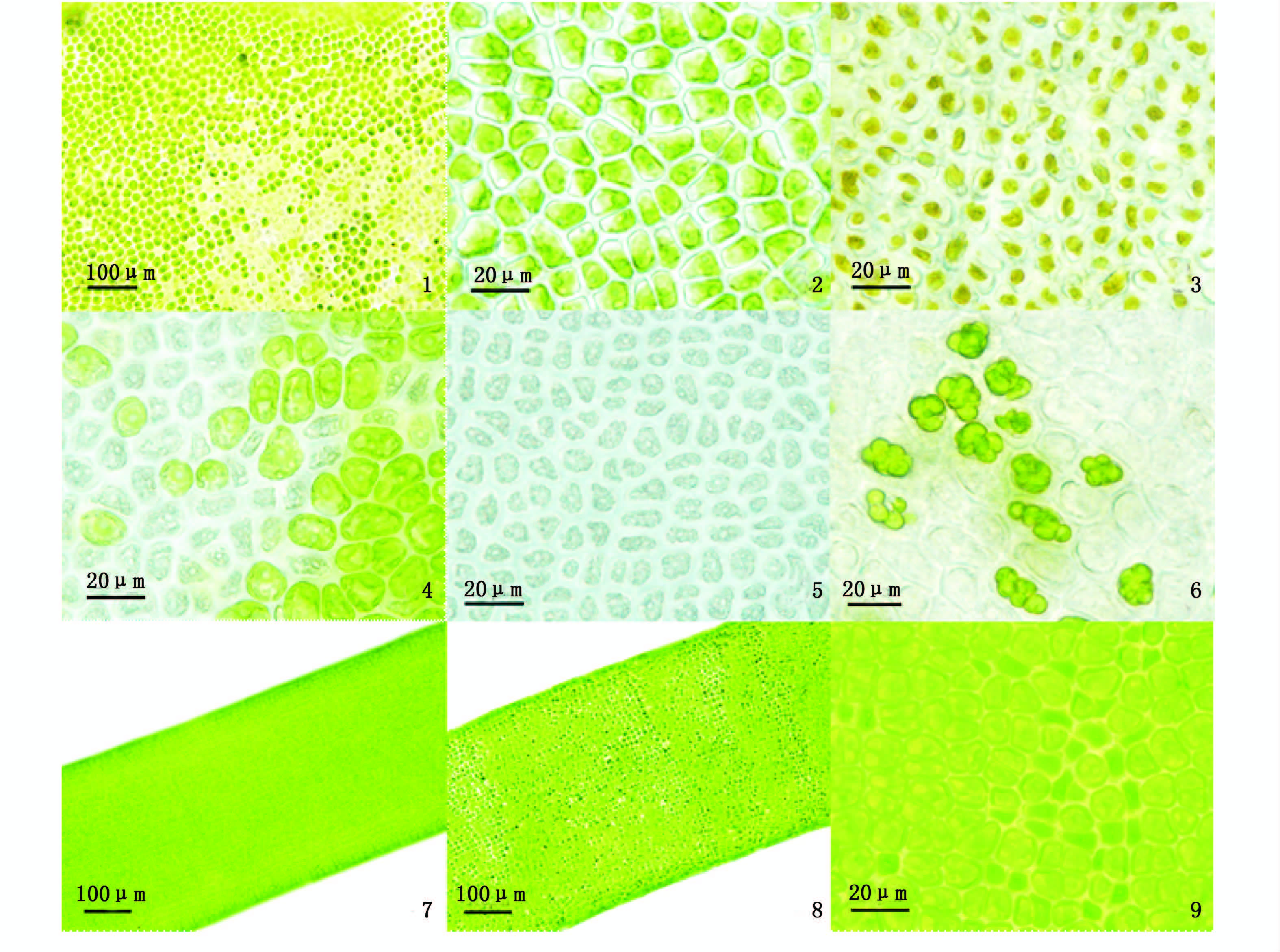
|
图版Ⅰ 漂浮浒苔细胞显微结构 Plate Ⅰ Floating Ulva proifera cell microstructure 1.漂浮气囊藻体上的白色斑块; 2.藻体细胞质向一边偏移; 3.藻体细胞质萎缩变色; 4.部分细胞质颗粒化后褪色; 5.细胞质颗粒化后变白死亡; 6.藻体形成生殖细胞囊; 7.悬挂分枝藻体呈健康营养细胞状态; 8.部分藻体细胞质萎缩发白; 9.少部分细胞细胞质萎缩。 1.Floating air-sac white patches on the body; 2.Cell mass migration to one side; 3.Cell mass atrophy; 4.Part of the cytoplasm after graining fade; 5.White granular cytoplasm after death; 6.Algae body form germ cell capsule; 7.Hanging branches algae body health and nutrition cell state; 8. Part of the cell mass atrophy pale; 9.A small number of cell cytoplasm. |
将气囊与悬挂分枝分别培养一周后观察其细胞形态变化。气囊主枝经过最适条件培养后,藻体仍然呈白绿色且白色斑块范围进一步扩大(图版Ⅱ-1),显微镜下观察到其细胞部分已死亡,细胞壁增厚,细胞间隙增大,藻体有解体分离趋势(图版Ⅱ-2);未死亡的细胞都已形成生殖细胞囊,且多数细胞已经放散出繁殖体形成空细胞(图版Ⅱ-3,4),在藻体周围的海水中也存在大量的活跃繁殖体(图版Ⅱ-5,6)。悬挂分枝经培养后,藻体细胞仍处于营养细胞状态,且细胞质萎缩部分减少(图版Ⅱ-7-9)。

|
图版Ⅱ 培养10 d后漂浮气囊及悬挂主枝显微细胞结构 PlateⅡ Cell microstructure of floating air-sac and major hanging branches after cultivation for ten days 1.漂浮气囊藻体白色斑块面积较大; 2.细胞壁增厚且间隙增大; 3.形成生殖细胞囊; 4.部分繁殖体未放散完全; 5.漂浮气囊藻体周围海水中的繁殖体; 6.繁殖体聚集固着; 7.悬挂分枝藻体呈健康绿色; 8.健康营养细胞; 9.少部分细胞细胞质略萎缩。 1.Floatingair-sac body white patch area is larger; 2.Cell wall thickening and clearance increases; 3.Capsule formation of reproductive cells; 4.Tossing in reproductive body not fully; 5.Balloon floating algae breeding in the surrounding water bodies; 6. Propagule gathered fixation; 7. A healthy green algae hanging branches; 8. Health and nutrition cells; 9. A small number of cell cytoplasm shrink slightly. |
在海水潮流和风力的共同作用下,浒苔由黄海南部向北部漂移并大量聚集[18, 19, 20]。我们在2011-2014年海上监视绿潮暴发时,在江苏滨海、日照、青岛等海域均发现漂浮浒苔存在悬挂分枝现象。
在实验室室内培养的绿潮藻优势种浒苔的适应光强为20~400 μmol/(m2·s),最适生长条件为100~120 μmol/(m2·s),当光照强度大于400 μmol/(m2·s)时藻体进入衰亡状态直至完全死亡[21, 22]。而在对绿潮的跟踪监测过程中测量所得野外自然光辐照强度平均在1 000 μmol/(m2·s)以上,在此条件下浒苔应皆处于衰亡状态甚至全部死亡。由于漂浮气囊的遮荫效果,悬挂分枝在海水中所承受的光照强度大大减弱。
由于苏北浅滩水深较浅,海底沉积物易受到风浪的搅动,南黄海海水透明度远低于北黄海(图5),并且由于冬季海上风速较夏季更快,因而冬季黄海的透明度远高于夏季。绿潮藻在夏季向北黄海漂移的过程中所接受的光照强度不断增强,经过日照海域的绿潮藻颜色显著变浅,已处于衰亡状态。漂移在北黄海漂浮的绿潮藻已开始进入衰亡期,藻体状态较差,生长率较低。绿潮藻漂浮于海面上时,其囊状藻体直接接触阳光且部分暴露在空气中,而悬挂分枝完全浸没在海水中并有囊状藻体替其遮挡阳光。
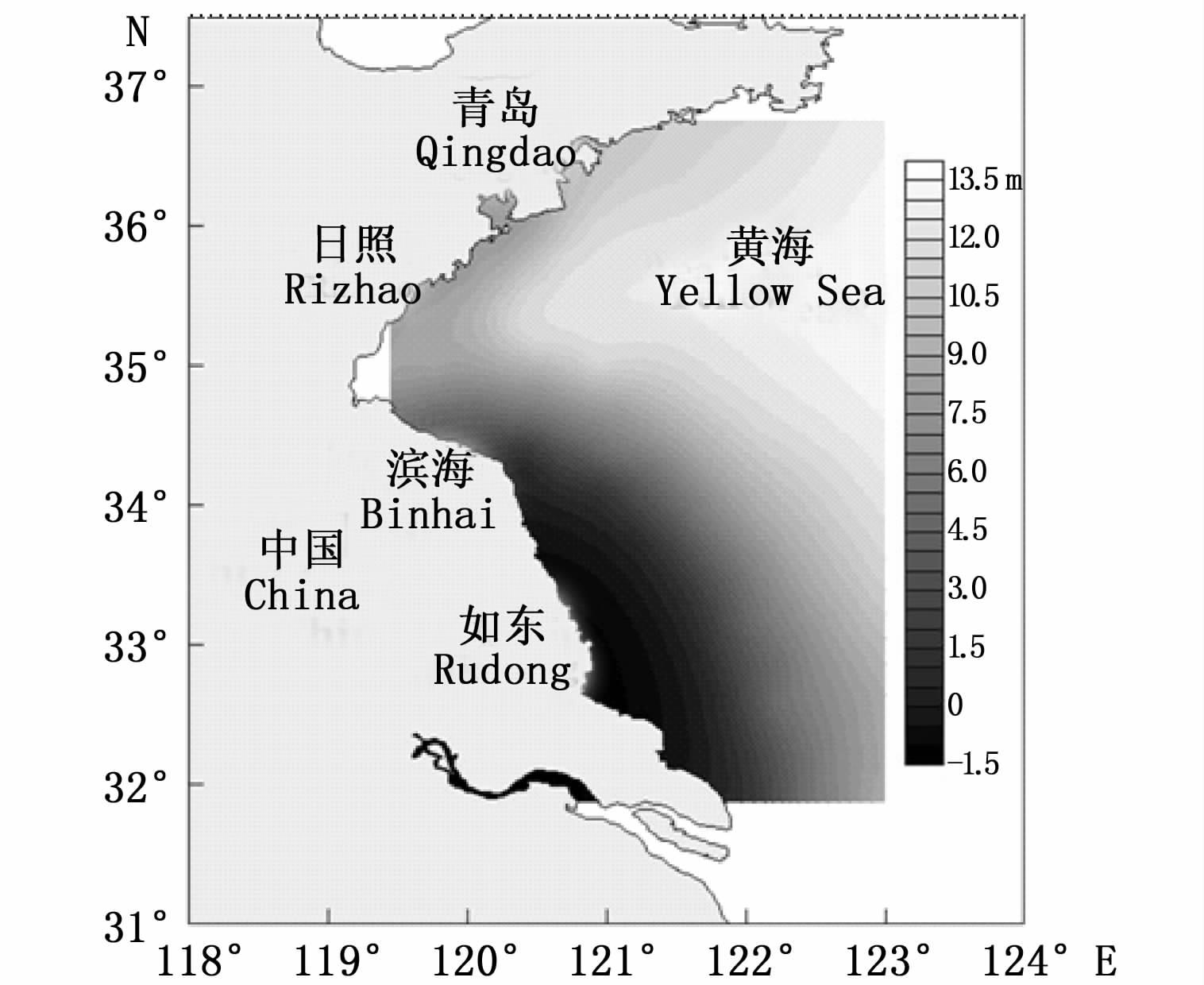
|
图5 中国黄海海水透明度 Fig.5 Seawater transparency in the Yellow Sea |
叶绿素荧光参数与光合作用中各个反应过程都紧密相关,任何逆境对光合作用中各过程的影响都可以通过叶绿素荧光参数的变化反映出来。因此,叶绿素荧光参数可作为逆境条件下植物抗逆反应的重要指标之一[23]。当光照、温度、盐度等环境因子处于过高或者过低的极端水平时,会对浒苔产生不利的影响。叶绿素荧光技术的优点为:活体测定,在不损伤藻体的前提下进行迅速测定,且灵敏度高,操作简便[24]。本研究利用叶绿素荧光仪Phyto-PAM (德国walz)测定不同状态浒苔的叶绿素荧光参数,Fv/Fm反映的是当所有PS Ⅱ反应均处于开放状态时的量子产量[25, 26],反映了植物的潜在最大光合能力,是检测植物体生长状态最重要和最常用的参数。非环境胁迫条件下浒苔叶状体的荧光参数Fv/Fm变化极少,不受生长条件的影响,即在正常生理状态下,Fv/Fm是一个很稳定的值,通常认为绿藻的Fv/Fm介于0.7~0.75 之间[21,27]。Y(Ⅱ)反映了当前光照下PS Ⅱ的实际量子产量,即植物的实际光合效率。当Fv/Fm和 Y(Ⅱ)数值下降时,表明植物受到了胁迫。
在石莼属海藻体内,光系统Ⅱ(PS Ⅱ)对环境条件的胁迫极为敏感,因此它常被用于指示藻类对上述指标的响应程度。通过对叶绿素荧光参数变化的监测来间接观察光合作用的变化是一种非常简便、快捷、可靠的方法。浒苔产生气囊后可以长期漂浮于海面上,随着水流风浪向北方海域漂移。在强烈的日光下,漂浮的气囊主枝交缠在一起,可以替悬挂其下的分枝遮挡部分光照,从而保证了浒苔的生存。漂浮气囊光合作用较差,细胞开始衰亡,藻体处于胁迫状态。经过适宜条件培养后释放繁殖体或直接死亡解体;悬挂分枝生理状态较好,叶绿素含量显著高于漂浮气囊,光合效率也较高,细胞结构饱满,属于健康藻体。悬挂分枝呈管状或丝状藻体,藻龄较低,在适宜条件下能够保持健康状态,在漂浮分枝保护下可以悬浮在海水中避光并持续生长,若受到光照刺激也可以生成气囊,继续漂浮并保护其他分枝。
这种漂浮-悬挂的复合漂浮方式大大增加了浒苔的生存能力,是浒苔成为绿潮藻优势种的原因之一。此外,本研究中还发现藻体叶绿素含量与藻体健康等级及光合活性Fv/Fm呈显著正相关,这一结论也与国外学者研究相一致[28]。
3.3 漂浮藻体悬挂分枝藻体的显微结构研究悬挂分枝在形态上与健康浒苔藻体相一致,呈深绿色或鲜绿色,由单层细胞组成中空管状体,体长可达 1 m,直径可达 2~3 mm,主枝明显且高度分枝,有些藻体分枝密集呈羽毛状,细胞形状多为圆形或多角形,细胞直径20~40 μm,具有较多蛋白核[29]。浒苔的截面观察具有典型的单层细胞管状结构,细胞位于单层藻体中央,管状叶状体被一层蛋白聚糖覆盖,厚度能够达到 5 μm,且每个细胞都含有一个或多个蛋白核。然而浒苔为了适应环境的变化(营养、盐度等),会发生一些形态上的改变,从而更好地适应不断改变的生存环境,在形态上有较强的可塑性[30]。
3.4 漂浮绿潮耐高光强适应性研究研究发现,在基本稳定的环境条件下绿藻主要以营养生殖的方式增加其生物量,而环境因子的剧烈变化可造成其生殖方式的改变[31]。1 cm2单层浒苔藻体叶片可以产生约6.62×106~2.65×107个生殖细胞,且放散出的生殖细胞中91.6%~96.4%可以成功萌发形成新藻体[32]。在绿潮暴发高峰期1 g浒苔藻体形成的生殖细胞囊完全放散生殖细胞后,可以产生至少2.8×108株新藻体。浒苔这种惊人的繁殖潜力是绿潮在海区中能够大规模暴发的重要原因之一。 悬挂分枝在漂浮气囊的遮荫效果下可以大量聚集生长,为黄海绿潮暴发的巨大生物量提供了物质基础。而漂浮气囊在强烈光照下放散出的繁殖体可以附着在悬挂分枝上发育成新的藻株,同时也为下一次绿潮暴发提供了种源基础。
| [1] | BLOMSTER J, BACK S, FEWER DP, et al. Novel morphology in Enteromorpha(Ulvophyceae) forming green tides[J]. American Journal of Botany, 2002, 89(11): 1756-1763. |
| [2] | ANDERSON D M, GLIBERT P M, BURKHOLDER J M. Harmful algal blooms and eutrophication: Nutrient sources, composition, and consequences[J]. Estuaries, 2002, 25(4): 704-726. |
| [3] | NELSON T A, LEE D J, SMITH B C. Are“greentides”harmful algal blooms Toxic properties of water-soluble extracts from two bloom-forming macroalgae, Ulva fenestrata and Ulva riaobscura(Ulvophyceae)[J]. Journal of Phycology, 2003, 39(5): 874-879. |
| [4] | ZHANG J H, HUO Y Z, YU K F, et al. Growth characteristics and reproductive capability of green tide algae in Rudong coast, China[J]. Journal of Applied Phycology, 2013, 25(3): 795-803. |
| [5] | HODGKISS I J, LU S H. The effects of nutrients and their ratios on phytoplankton abundance in Junk Bay, Hong Kong[J]. Hydrobiologia, 2004, 512(1): 215-229. |
| [6] | 李大秋, 贺双颜, 杨倩, 等. 青岛海域浒苔来源与外海分布特征研究[J]. 环境保护, 2008(16): 45-46. LI D Q, HE S Y, YANG Q, et al. Analysis on the impact factors of detecting green tides by remote sensing[J]. Environmental Protection, 2008(16): 45-46. |
| [7] | LELIAERT F, MALTA E J, ENGELEN A H, et al. Quindao algal bloom culprit identified[J]. Marine Pollution Bulletin, 2008, 56(9): 1516. |
| [8] | FOYN B. Diploid gametes in Ulva[J]. Nature, 1962, 193(4812): 300-301. |
| [9] | LITTLER M M, LITTLER D S. The evolution of thallus form and survival strategies in benthic marine macroalgae: Field and laboratory tests of a functional form model[J]. The American Naturalist, 1980, 116(1): 25-44. |
| [10] | KIIRIKKI M, LEHVO A. Life strategies of filamentous algae in the northern Baltic Proper[J]. Sarsia, 1997, 82(3): 259-267. |
| [11] | HIRAOKA M, ENOMOTO S. The induction of reproductive cell formation of Ulva pertusa Kjellman (Ulvales, Ulvophyceae)[J]. Phycological Research, 1998, 46(3): 199-203. |
| [12] | ZHANG J H, HUO Y Z, ZHANG Z L, et al. Variations of morphology and photosynthetic performances of Ulva prolifera during the whole green tide blooming process in the Yellow Sea[J]. Marine Environmental Research, 2013, 92: 35-42. |
| [13] | 姜红霞, 倪雪, 胡宝云, 等. 黄海海域漂浮浒苔的生理特性[J]. 江苏农业科学, 2015, 43(2): 355-357. JIANG H X, NI X, HU B Y, et al. Photosynthetic characteristics of free-floating Ulva prolifera in Yellow Sea[J]. Jiangsu Agricultural Sciences, 2015, 43(2): 355-357. |
| [14] | 苏正淑, 张宪政. 几种测定植物叶绿素含量的方法比较[J]. 植物生理学通讯, 1989(5): 77-78. SU Z S, ZHANG X Z. A comparison of several methods of measurement of chlorophyll in plants[J]. Plant Physiology Communications, 1989(5): 77-78. |
| [15] | 谌素华, 王维民, 蔡清. 绿藻石莼叶绿素提取工艺的研究[J]. 食品科技, 2008(2): 172-175. CHEN S H, WANG W M, CAI Q. Study on the optimum extraction condition ofthe chlorophyll from Ulva pertusa[J]. Food Science and Technology, 2008(2): 172-175. |
| [16] | 杨振德. 分光光度法测定叶绿素含量的探讨[J]. 广西农业大学学报, 1996, 15(2): 145-150. YANG Z D. Studies on the determination of chlorophyll contentby spectrophotometric method[J]. Journal of Guangxi Agricultural University, 1996, 15(2): 145-150. |
| [17] | 孙立娥. 绿潮遥感探测影响因素分析[D]. 青岛: 青岛大学, 2012. SUN L E. Analysis on the impact factors of detecting green tides by remote sensing[D]. Qingdao: Qingdao University, 2012. |
| [18] | SUN S, WANG F, LI CL, et al. Emerging challenges: massive green algae blooms in the Yellow Sea[J/OL]. Nature Proceedings, 2008, http://precedings.nature.com/documents/2266/version/1. |
| [19] | LIU D Y, KEESING J K, XING Q G, et al. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China[J]. Marine Pollution Bulletin, 2009, 58(6): 888-895. |
| [20] | JIANG P, WANG J F, CUI Y L, et al. Molecular phylogenetic analysis of attached Ulvaceae species and free-floating Enteromorpha from Qingdao coasts in 2007[J]. Chinese Journal of Oceanology and Limnology, 2008, 26(3): 276-279. |
| [21] | 崔建军, 朱文荣, 施建华, 等. 浒苔规模化人工育苗技术研究[J]. 上海海洋大学学报, 2014, 23(5): 697-705. CUI J J, ZHU W R, SHI J H, et al. Studies on the technology of artificial breeding of Ulva prolifera on a largescale[J]. Journal of Shanghai Ocean University, 2014, 23(5): 697-705. |
| [22] | 王建伟. 浒苔生态因子研究及发育形态学观察[D]. 苏州: 苏州大学, 2007. WANG J W. Effect of ecological impacts and morphological development in Enteromorpha prolifera(Chlorophyta)[D]. Suzhou: Soochow University, 2007. |
| [23] | 殷秀敏.酸雨、UV-B和光强胁迫对5种常绿阔叶树幼苗叶绿素荧光和生长特性的比较研究[D]. 杭州: 浙江农林大学, 2010. YIN X M.The comparising research on chlorophy II fluorescence characteristics and growth of five evergreen broad-leaved seedlings under the stress of acid rain, UV-B and light stress[D]. Hangzhou: Zhejiang A&F University, 2010. |
| [24] | LOGAN B A. Chlorophyll a fluorescence: A signature of photosynthesis[J]. The Journal of the Torrey Botanical Society, 2005, 132(4): 650-652. |
| [25] | 王阳阳, 霍元子, 曹佳春, 等. 低温、低光照强度对扁浒苔生长的影响[J]. 中国水产科学, 2010, 17(3): 593-599. WANG Y Y, HUO Y Z, CAO J C, et al. Influence of low temperature and low light intensity on growth of Ulva compessa[J]. Journal of Fishery Sciences of China, 2010, 17(3): 593-599. |
| [26] | 汤文仲, 李信书, 黄海燕, 等. 不同光强和温度对长石莼(缘管浒苔)光合作用和叶绿素荧光参数的影响[J]. 水产学报, 2009, 33(5): 762-769. TANG W Z, LI X S, HUANG H Y, et al. Effects of different light intensity and temperature treatment onphotosynthesis and chlorophyll fluorescence in Ulvalinza[J]. Journal of Fisheries of China, 2009, 33(5): 762-769. |
| [27] | GAO S, SHEN SD, WANG GC, et al. PSI-driven cyclic electron flow allows intertidal macro-algae Ulva sp. (Chlorophyta) to survive in desiccated conditions[J]. Plant & Cell Physiology, 2011, 52(5): 885-893. |
| [28] | ARNON D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24(1): 1-15. |
| [29] | 王建伟, 林阿朋, 李艳燕, 等. 浒苔(Enteromorpha prolifera)藻体发育的显微观察[J]. 生态科学, 2006, 25(5): 400-404. WANG J W, LIN A P, LI Y Y, et al. Microscopic observation on the development of Enteromorpha prolifera(Chlorophyta)[J]. Ecological Science, 2006, 25(5): 400-404. |
| [30] | MSHIGENI K E, KAJUMULO AA. Effects of the Environment on Polymorphism in Ulva fasciata Delile(Chlorophyta, Ulvaceae)[J]. Botanica Marina, 1979, 22(3): 145-148. |
| [31] | 王浩东. 浒苔(Ulva prolifera)生殖遗传学的初步研究[D]. 青岛: 中国海洋大学, 2012. WANG H D. Preliminary study on reproductive genetics of Ulva prolifera[D]. Qingdao: Ocean University of China, 2012. |
| [32] | 陈群芳, 何培民, 冯子慧, 等. 漂浮绿潮藻浒苔孢子/配子的繁殖过程[J]. 中国水产科学, 2011, 18(5): 1069-1076. CHEN Q F, HE P M, FENG Z H, et al. Reproduction of spores/gametes of floating green tide algae Ulva prolifera[J]. Journal of Fisheries Science of China, 2011, 18(5): 1069-1076. |
2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. The State Oceanic Administratiaon of the North Sea Environmental Monitoring Center, Qingdao 266033, Shandong, China;
4. East China Sea Branch of State Oceanic Administration, Shanghai 200137, China
 2016, Vol. 25
2016, Vol. 25


