2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306
黄鳍金枪鱼(Thunnus albacores)广泛分布于三大洋的热带和温带水域[1]。在太平洋,黄鳍金枪鱼商业性捕捞始于20世纪50年代[2],近几年(2010-2013)年均产量达到76.4万吨[3]。我国也是该海域黄鳍金枪鱼资源的主要开发国[4]。黄鳍金枪鱼主要被围网、延绳钓和竿钓等渔具捕获[5],是我国远洋金枪鱼渔业的主要捕捞对象之一。
截至目前,太平洋黄鳍金枪鱼种群划分的观点未统一。日本学者早年认为至少存在3个相对独立的种群:即西部、中部和东部种群[6];最近有学者根据等位基因研究认为存在东太平洋和中西太平洋两个种群[7];但也有学者基于同工酶和线粒体DNA技术,认为太平洋黄鳍金枪鱼仍是一个种群[8]。种群划分不确定,使黄鳍金枪鱼生活史参数(如生长、繁殖)的区域比较研究显得尤为重要。不同区域的生物学特征是否存在差异,也在一定程度上为种群划分提供了辅助信息。
种群的繁殖生物学特征,随个体增长而变化,往往存在一定的函数关系[9, 10]。繁殖生物学参数(如50%成熟体长)是资源评估的重要模型参数之一。目前在太平洋,黄鳍金枪鱼的资源评估是分中西太平洋和东太平洋分别进行,采用的繁殖生物学参数也有所不同。
以往有关黄鳍金枪鱼的繁殖生物学研究,涉及性比、成熟个体大小、生殖力、产卵时间、周期和频率等方面[11, 12, 13],但对其繁殖生物学特征的认识仍不够全面。主要存在以下问题:(1)以往的研究缺少全年性采样[5, 14];(2)采样的区域性分布不够广泛,尤其是缺少对中部太平洋群体的采样,因而缺乏中西太平洋和东太平洋的繁殖生物学差异性比较;(3)之前在东太平洋开展一项较为深入的研究[12],其样品采集是在1990年以前,缺乏最近的更新。研究表明,一个长期遭受捕捞的种群,其生物学特征可能随着时间的变化而变化,如成熟延迟[15]、成熟体长变小[12]等。
本文根据2010-2013年的热带太平洋黄鳍金枪鱼雌性性腺样品,基于组织切片法,研究其成熟度、性腺成熟指数、成熟的区域性差异、产卵高峰期等繁殖生物学特性。本研究初步查明了热带太平洋黄鳍金枪鱼的成熟度分布特征,比较了中西太平洋和东太平洋黄鳍金枪鱼繁殖活动的差异,为其资源评估提供了最新的生物学资料。
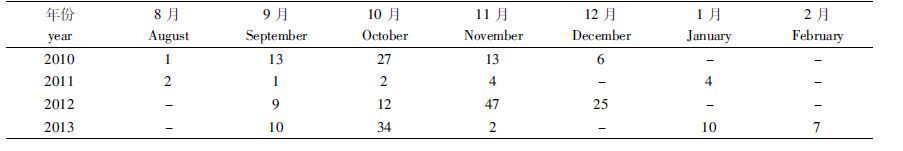
1 材料与方法 1.1 采样时间和区域黄鳍金枪鱼样品由科学观察员随延绳钓生产渔船随机采集。时间跨度涵盖2010-2013年(表1),采集经纬度范围涵盖14°01′S-11°41′N、158°43′E-150°W(中西太平洋,WCPO),14°01′S-11°41′N、128°24′W-150°W(东太平洋,EPO),以150°W为界划分(也是目前WCPO和EPO金枪鱼资源评估和管理的分界线)。共采集黄鳍金枪鱼样本229尾(图1),性腺样品切取后保存在10%福尔马林溶液中。观察员记录的数据包括性别、个体长度(本文均指叉长,LF,cm)、性腺重(WG,g),并解剖后用肉眼观察成熟度。样本的卵巢重范围为15~2 025 g,长度范围为80~163 cm。

|
图1 黄鳍金枪鱼的采样区域 Fig.1 The sampling area for yellowfin tuna (T. albacores) |
在实验室里,将性腺样品转入Bouin氏液中固定24 h,而后入70%的乙醇保存。从70%的乙醇开始,依次进行80%、85%、95%、95%、100%浓度的梯度乙醇脱水、二甲苯透明和石蜡包埋后切片,切片厚度5 μm,经过苏木素和伊红染色后,中性树脂封片,显微镜下观察并拍照[16]。
通过石蜡组织切片法来观察判断是否达到性成熟,可将性腺发育阶段(性成熟度)划分为5个时期[15, 16, 17, 18, 19, 20]。
1.3 数据分析统计各个成熟期的长度分布范围,比较各成熟期的平均长度差异(t检验)。
利用Logistic模型,采用非线性拟合方法,建立成熟比率与个体长度的关系曲线,即成熟度曲线,Logistic公式为:

利用性腺重量,计算每尾样品鱼的性腺成熟指数(Gonadosomatic index,GSI),计算公式[23, 24]为:

根据性腺成熟指数,结合样品成熟度的月份分布、经纬度上的变化、中西太平洋和东太平洋的差异,分析黄鳍金枪鱼性成熟的区域性差异。
此外,统计肉眼观测法较于组织切片法判断成熟等级的准确率,计算公式为:
准确率=成熟率(肉眼与切片)一致数/样本总数×100%。
|
表1 黄鳍金枪鱼样各月取样的尾数(2010-2013) Tab. 1 The sampling individual number of T. albacores by month during 2010-2013 |
性腺各发育期的显微图像见图版。1为稚龄期(Ⅰ期);2、3、4为生长期(Ⅱ期);5、6为成熟期(Ⅲ期);7、8为排卵期(Ⅳ期);9为排卵后期(Ⅴ期)。在所有的性腺显微图像中,各成熟期的细胞呈现结构不同。其中,稚龄期的细胞一致性最高,几乎每一个发育期的细胞都会出现少量之前发育期的细胞,异发育期的细胞数量按发育期的前后依次增多,排卵后期还会出现少量稚龄期细胞的情况。说明黄鳍金枪鱼的性腺成熟有一定的持续性。
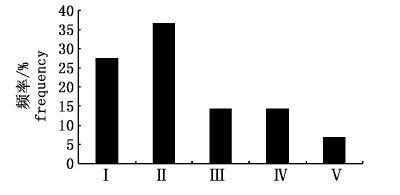
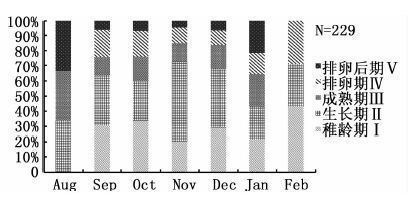
2.2 性成熟度频率分布及各月的性腺分布229尾雌性样本中,Ⅱ期的数量最多,达到样本总数的36.7%;Ⅰ期数量其次,Ⅴ期样本数量最少,仅占总量的7.0%;成熟个体(Ⅲ期以上)数量占总数的35.8%(图2)。在成熟度的月份变化中,成熟个体数量最多的是10月;其中在10月到次年1月期间,Ⅰ期的数量呈递减趋势(图3)。在产卵活动上,9月至2月均有产卵(Ⅳ期),数量比例最高出现在2月,为28.6%;最低出现在11月和12月,分别为10.6%和9.7%。
|
图2 黄鳍金枪鱼样本各成熟度的分布 Fig.2 Frequency distribution of maturity stage for T. albacores |
|
图3 黄鳍金枪鱼样本各成熟度的月份分布 Fig.3 Monthly change in maturity stage composition for T. albacores |
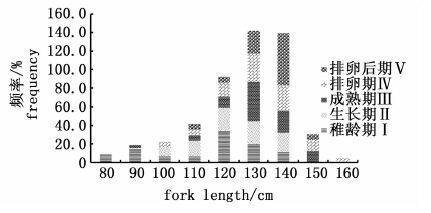
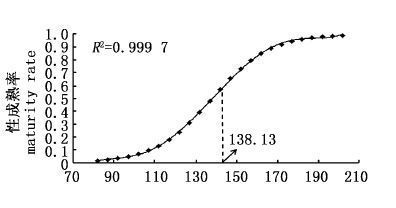
各个成熟度中(图4),成熟度为Ⅱ期的长度分布范围最大(80~16 cm),成熟度为Ⅴ期的长度分布范围最小(115~151 cm)。成熟度为Ⅰ、Ⅲ、Ⅳ期的长度分布基本在同一范围内,分别是82~147 cm、90~156 cm和107~163 cm经t检验,成熟度为Ⅱ、Ⅲ、Ⅳ期的平均长度无显著性差异(P>0.01),而Ⅰ、Ⅴ期的长度分布平均值有显著性差异(P<0.01)。不同长度组的成熟率P的Logistic曲线的方程为P=1/1+e[-0.072(LF-138.13)]对应的50%性成熟长度为138.13 cm(图5)。
|
图4 按鱼体长度组分黄鳍金枪鱼样本成熟度的分布 Fig.4 Change in maturity stage composition for T. albacores by length interval |
|
图5 不同长度组黄鳍金枪鱼性成熟率和L50(138.13 cm) Fig.5 Percentages of mature T. albacores by fork length and L50 (138.13 cm) |
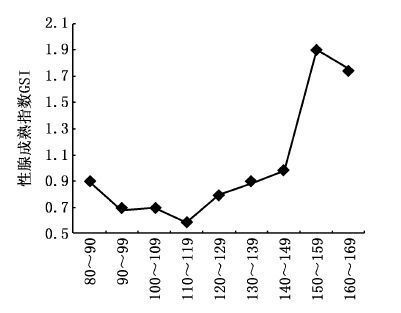
整个GSI平均值(1.06±0.07)与长度组呈波折上升的关系,其中前7个长度组的GSI平均值在1上下浮动,后两个长度组的GSI平均值相对较高,均超过了1.5(图6);9月到11月,GSI呈下降趋势,11月达到最小值,1月以后又开始逐渐上升(图7);在与各成熟度的关系中,Ⅰ、Ⅱ期的GSI均在数值1以下,在数值0.5上下徘徊;Ⅲ-Ⅴ期即性成熟期,GSI的数值均突破了数值1(图8)。
|
图6 黄鳍金枪鱼各长度组的性腺成熟指数 Fig.6 GSI in different fork length of T. albacores |

|
图7 黄鳍金枪鱼性腺成熟指数(GSI)随月份的变化 Fig.7 The variation of GSI for T. albacores by month |

|
图8 黄鳍金枪鱼各成熟期的性腺成熟指数(GSI) Fig.8 The variation of GSI for T. albacores by maturity stage |
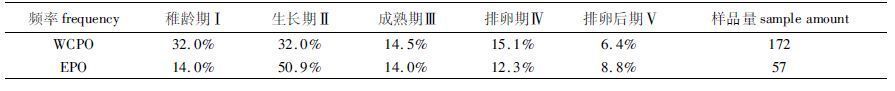
WCPO和EPO黄鳍金枪鱼的成熟度呈现一定的差异:WCPO样品的Ⅰ、Ⅱ期频率最高,Ⅴ期最低;EPO样品的II期最高,V期最低(表2)。WCPO样本性成熟率为36.0%,EPO样本性成熟率为35.1%,两者差别不大。
|
表2 东、中西太平洋黄鳍金枪鱼成熟度频率分布 Tab. 2 The maturity frequency distribution of T. albacores in EPO and WCPO |
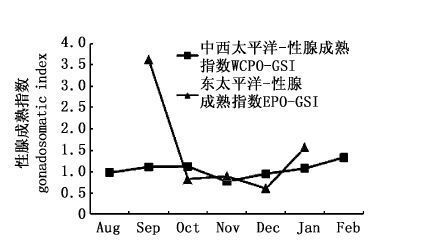
从长度上观察,EPO和WCPO的性腺成熟指数波动大,无明显规律,出现了两个峰值(1.9和2.5),表明了黄鳍金枪鱼成熟活动出现了季节性差异(图9);从月份上观察,WCPO的性腺成熟指数较为平稳,范围在0.8~1.3,无明显波动,即产卵活动无明显的季节性差异,而EPO的性腺成熟指数在10月-12月区间的数值与WCPO对应区间的数值相近,1月和9月数值偏大(图10);从各成熟度上观察,EPO和WCPO的变化规律相似:性未成熟阶段GSI的数值在数值1以下,性成熟阶段GSI数值大于1(图11)。

|
图9 东部和中西太平洋黄鳍金枪鱼性腺成熟指数随长度的变化 Fig.9 The variation of GSI for T. albacores by length interval in EPO and WCPO |
|
图10 东部和中西太平洋黄鳍金枪鱼性腺成熟指数随月份的变化 Fig.10 The variation of GSI for T. albacores by month in EPO and WCPO |

|
图11 东、中西太平洋黄鳍金枪鱼性腺成熟指数随各成熟度的变化 Fig.11 The variation of GSI for T. albacores by maturity stage in EPO and WCPO |
在南半球,纬度越高,性成熟率和性腺成熟指数越高,最大值出现在17.5°S~12.5°S区间,分别是56.5%和1.3;在北半球,性成熟率和性腺成熟指数与纬度无明显关系,最大值出现在2.5°N~7.5°N区间,分别是66.7%和0.8(图12)。

|
图12 黄鳍金枪鱼性成熟率和性腺成熟指数随经度的变化 Fig.12 The latitudinal change of sexual maturation rate and GSI of T. albacores in the tropical Pacific |
160°W以西,性成熟率呈递增趋势,性腺成熟指数基本呈递增趋势,波动不大,二者最大值均出现在160°E~170°E区间,分别为56.3%和1.4;160°W以东,性成熟率和性腺成熟指数与经度无明显关系,最大值均出现在150°W~140°W区间,分别为72.7%和1.7(图13)。

|
图13 黄鳍金枪鱼性成熟率和性腺成熟指数随经度的变化 Fig.13 The longitudinal change of sexual maturation rate and GSI of T. albacores in the tropical Pacific |
石蜡组织切片法是判断性腺成熟度的标准方法之一,肉眼观测容易出现误差。通过对两种判别方法的成熟度判定比较,发现肉眼观测法在Ⅱ、Ⅴ期的准确率较高,分别达到69.0%和75.0%;Ⅰ期和Ⅳ期的误差率较高,分别达到65.1%和63.6%,主要都是将其误判为Ⅱ期(表3)。

|
表3 黄鳍金枪鱼样本性腺成熟度两种方法误差比较 Tab. 3 The error comparison of maturity of T. albacores by sight and tissue section method respectivly |
黄鳍金枪鱼的成熟度随长度的变化表明,虽然Ⅱ、Ⅴ期的长度跨度一个最大、一个最小,但是它们的长度范围上限几乎相等,可能有两个原因:一是个体发育差异,二是个体发育的循环所致,鱼体排卵后,重新进入下一轮的发育(Ⅴ-Ⅱ期)。这也是造成肉眼观测法误判个体成熟度的主要原因。
结合性腺成熟指数的月份走势图(图7)和成熟度的月份分布(图3)来看,10-12月,性腺成熟指数呈下降趋势,稚龄期的数量也呈现出减少的趋势,都同样说明了这段时间并不是排卵旺季。性腺成熟指数的峰值表明,黄鳍金枪鱼的产卵旺季在9月和2月。SUN等对中西太平洋黄鳍金枪鱼繁殖生物学研究中得出,其产卵旺季是在2月至6月[25];而本研究中,9月和2月出现了两个性腺成熟指数高峰值,表明这两个月很可能都是产卵旺季。
本文的研究结果表明,黄鳍金枪鱼的50%成熟长度为138.13 cm,显著高于2001-2002年在中西太平洋采集的数据结果(107.77 cm)[25],这其中可能的原因是后者的采样经度范围主要覆盖在115°-125°E(菲律宾北部周边海域),纬度也不如本研究的采样区域更接近赤道。有研究学者曾推测[15],纬度越高的区域(海面温度越低),黄鳍金枪鱼的性成熟可能就会延迟,相应地,成熟期的比例也会减少。然而,根据本研究的结果,在南半球纬度越高,成熟期所占比例也越来越高,恰恰与北半球相反,是否与南、北的局部洄游有关,需要进一步研究。
从成熟度的区域性差异可以看出,EPO和WCPO的成熟比例差距不大,但是在生长期(II期)的比例上,EPO的比例要远远高于WCPO,说明东部的个体成熟进程比中西部的要快,这与SUN等的研究结果一致[25],其中可能的原因有:①种群本身的差异;②物理因素差异,研究表明黄鳍金枪鱼的繁殖不仅与稳定的海表面温度、混合层深度和温跃层深度有关[26],而且还与产卵地相对较高的生物产量和食物获取性相关[27, 28, 29];③捕捞强度差异。
EPO和WCPO黄鳍金枪鱼的性腺成熟指数也存在月份差异。本研究中,WCPO黄鳍金枪鱼的产卵活动无明显的季节性差异,EPO存在季节性差异,而SCHAEFER的研究却认为东太平洋黄鳍金枪鱼在产卵活动上并不存在明显的季节性差异[12]。可能的原因有:①采样位置不同,SCHAEFERA的采样区域多集中在北半球;②渔具不同,本研究的采样方式是延绳钓,而SCHAEFERA使用的是围网。
前人的研究表明,太平洋的黄鳍金枪鱼存在东太平洋、中太平洋和西太平洋3个种群[7]。因为样本分布的限制,本文仅比较东太平洋和中西太平洋这两个区域的个体发育是否同步。本研究的采样区域并没有完全覆盖热带太平洋区域,这主要是由于渔业生产的限制,观察员在海上收集数据时依赖于商业性渔船,而渔船总是倾向于目标鱼种集中的海域[30]。本研究未考虑捕捞方式(延绳钓和围网)对黄鳍金枪鱼样本信息的影响,这需要在今后的研究中进一步深入了解。本文仅研究雌性样品,一是因为样品限制(雄性的样品很少),二是目前资源评估中主要采用雌性金枪鱼的繁殖生物学参数。
| [1] | SUND P M, BLACKBURN M, WILLIAMS F. Tunas and their environment in the Pacific Ocean: A review[J]. Oceanography Marine Biology Annual Review, 1981, 19: 443-512. |
| [2] | SECRETARIAT OF THE PACIFIC COMMUNITY (SPC). Tuna Fishery Yearbook 2011[R].Pohnpei: Western and Central Pacific Fisheries Commission, 2012, 55-56. |
| [3] | WCPFC. WCPFC Tuna Fishery Yearbook 2013 [R]. Pohnpei, Federated States of Micronesia: WCPFC, 2014. |
| [4] | EDWARD H. Annual report to the commission part 1: Information on fisheries, research and statics 2011 solomon Islands[R]//Scientific committee 8th regular session. Pohnpei: Western and Central Pacific Fisheries Commission[C], 2012, 4-23. |
| [5] | 陈峰,郭爱,朱文斌,等.南太平洋所罗门群岛海域黄鳍金枪鱼繁殖生物学研究[J].热带海洋学报,2014,33(2):45-51. CHEN F, GUO A, ZHU W B, et al. Study on reproductive biology of yellowfin tuna Thunnus albacoresin the waters of the Solomon Islands of South Pacific Ocean[J]. Journal of tropical oceanography, 2014,33(2):45-51. |
| [6] | SUZUKI Z, TOMLINSONP K, HONMA M. Population structure of Pacific yellowfin tuna[J]. Inter-American Tropical Tuna Commission Bulletin, 1978, 17:273-441 |
| [7] | WARD R D, ELLIOTT N G, INNES B H, et al. Global population structure of yellowfin tuna, Thunnus albacores, inferred from allozyme and mitochondrial DNA variation [J]. Fish Bull,1997,95(3):566-575. |
| [8] | APPLEYARD S A, GREWE P M, INNES B H, et al. Population structure of yellowfin tuna (Thunnus albacores) in the western Pacific Ocean, inferred from microsatellite loci [J]. Marine Biology, 2001, 139(2):383-393. |
| [9] | MURPHY G I. Pattern in life history and environment[J]. AmericanNatural,1968, 102(927): 391-403. |
| [10] | STEARNS S C. Life history tactics: a review of ideas[J]. Quarterly Review Biology, 1976, 51(1): 3-47. |
| [11] | SCHAEFERKM. Spawning time, frequency, and batch fecundity of yellowfin tuna, Thunnus albacores, near Clipperton Atoll in the eastern Pacific Ocean [J]. Fish Bull, 1996, 94: 98-112. |
| [12] | SCHAEFER KM. Reproductive biology of yellowfin tuna (Thunnus albacores) in the Eastern Pacific Ocean [J]. Inter-American Tropical Tuna Commission Bulletin, 1998, 21(5): 205-272. |
| [13] | SUN CL,YEH S Z, CHANG Y J, et al. Reproductive biology of female bigeye tuna Thunnus obesus in the western Pacific Ocean [J]. Journal of Fish Biology, 2013, 83(2): 250-271. |
| [14] | 王修国.东太平洋大眼金枪鱼、黄鳍金枪鱼生殖特征研究[D].上海:上海海洋大学,2010. WANG X G. Study on the reproductive characteristics of yellowfin tuna (Thunnus albacores) and bigeye tuna (Thunnusobesus) from the east Pacific Ocean[D]. Shanghai: Shanghai Ocean University, 2010. |
| [15] | ITANO D G. The reproductive biology of yellowfin tuna(Thunnus albacores) in Hawaiian water and the western tropical Pacific Ocean: Project summary[R]. SOEST 00-01, JIMAR Contribution 00-328.2000. |
| [16] | GABEM. Histological Techniques[J]. Spring-Verlag, New York, 1976, 1106. |
| [17] | KURT M, SCHAEFER, DANIEL W, et al. Reproductive biology of bigeye tuna(Thunnus obesus) in the eastern and central Pacific Ocean[C]//Inter-American Tropical Tuna Commission. La Jolla, California.2005. |
| [18] | 魏刚,戴大临,黄林,等.大鳍鱯初级卵母细胞的超微结构[J].西南农业大学学报(自然科学版),2003,25(4):339-341. WEI G, DAI D L, HUANG L, et al. An ultrastructural study of the primary oocytes in bagridae catfish mystusmacropterus[J]. Journal of Southwest Agricultural University (Natural Science), 2003,25(4):339-341. |
| [19] | 冯俊荣著.类繁殖及消化生理研究[M].青岛:中国海洋大学出版社,2013. FENG J R. Research on reproductive and digestive physiology of fish[M]. Qingdao: China Ocean University Press, 2013. |
| [20] | WEST G. Method of assessing ovarian development in fishes: a review [J]. Australian Journal of Marine & Freshwater Research, 1990, 41: 199-222. |
| [21] | 宋利明,陈新军,徐柳雄.大西洋中部金枪鱼延绳钓渔场大眼金枪鱼的生物学特性[J].水产学报,2004,28(2):216-220. SONG L M, CHEN X J, XU L X. Biological characteristics of Thunnusobesus in longlining ground of the central Atlantic Ocean[J]. Journal of Fisheries of China, 2004,28(2):216-220. |
| [22] | OLIVEIRA P, HAZIN F H V, CARVALHO F, et al. Reproductive biology of crocodile shark Pseudocarcharias kamoharai [J]. Journal of Fish Biology, 2010,76 (7):1655-1670. |
| [23] | KIRAWA S. A study of the indomaguro (Thunnus thynnusmaccoyi) in the area south of 20. Slat. From the examination of ovary weight and maturity[R]. Rep Nankai Reg Lab, 1964(20):37-57. |
| [24] | SHINGU C. Studies relevant to distribution and migration of sourthern bluefin tuna[R]. Bul Far Seas Res Lab, 1970(3):57-113. |
| [25] | SUN C L, WANG W R, SUNZAN Y. Reproductive biology of yellowfin tuna in the central and western Pacific Ocean [C]//1st Meeting of theScientific Committee of the Western and Central Pacific Fisheries Commission. August, 2005. |
| [26] | FIEDLERPC. Seasonal climatologies and variability of eastern tropical Pacific surface waters [J]. U.S. Natural Marine Fish.Serv.Tech. Rep. 1992, 109: 1-65. |
| [27] | BLACKBURN M, LAURS RM, OWEN RW, et al. Seasonal and areal changes in standing stocks of phytoplankton, zooplankton, and micronekton in the eastern tropical pacific [J]. Marine Biology, 1970, 7(1): 14-31. |
| [28] | AHLSTORMEH. Kinds and abundance of fish larvae in the eastern tropical Pacific, based on collections made on EASTROPAC I [J]. U.S. Natural MarineFish.Serv.Fish. Bull, 1971, 69(1):3-77. |
| [29] | AHLSTROMEH. Kinds and abundance of fish larvae in the eastern tropical Pacific on the second multivessel EASTROPAC survey, and observations on the annual cycle of larval abundance [J]. U.S. Natural MarineFish.Serv. Fish. Bull., 1972, 70(4):1153-1242. |
| [30] | 高春霞,田思泉,戴小杰,等.热带中东大西洋拟锥齿鲨生物学的初步研究[J].上海海洋大学学报,2013,22(2):289-294. GAO C X, TIAN S Q, DAI X J, et al. Preliminary analysis of the biology of the crocodile shark, Pseudocarchariaskamharaiin the tropical eastern-central Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2013,22(2):289-294. |
2. The Key Laboratory of Oceanic Fisheries Resources Exploitation of Shanghai Education Commission, Shanghai 201306, China
 2016, Vol. 25
2016, Vol. 25


