2. 上海市水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 山东卫康生物医药科技有限公司, 山东临沂 276017
壳聚糖酶(EC3.2.1 .132 )是一种能作用于壳聚糖β-1,4糖苷键的水解酶,从而获得低聚合度的壳寡糖[1]。壳寡糖有良好的水溶性,具有降血糖、降血脂、抗真菌、抗细菌以及抑制肿瘤生长等功效[2, 3]。目前,生产壳寡糖主要有酸解法和酶水解法。酸水解壳聚糖反应剧烈,产物复杂,提高了后续分离提取的成本,且污染问题不可忽视。而酶水解法以高效率、低能耗等优点成为生产壳寡糖的主要方法[4]。
壳聚糖酶来源广泛,国内外学者已从自然界中分离出多株性能不同的壳聚糖酶生产菌株,并在壳聚糖酶的性质研究及其应用等方面开展了许多工作 [5, 6]。浅玫瑰色链霉菌为本课题组前期实验分离得到,具有产酶量高、发酵周期短及单一内切型酶等特点,有潜力成为工业化生产菌株[7, 8, 9]。本文旨在研究该菌种的发酵工艺,进一步提高其产酶能力,为其工业化生产的潜力释放提供理论基础。
1 材料与方法 1.1 实验菌种实验菌种为本实验室分离,经鉴定为浅玫瑰色链霉菌(Streptomyces roseolus,DH) [7]。
1.2 培养基平板分离培养基,液体种子培养基[7]。
发酵培养基组分组成(%,W/V):K2HPO4 0.07,NaCl 0.5,KH2PO4 0.03,MgSO4·7H2O 0.05,酵母粉0.5,蛋白胨0.5,胶体壳聚糖1.0,调节pH至7.2。
1.3 主要仪器主要仪器:SFY-10L 液体发酵罐,梅特勒溶氧电极Inpro 6800,T6新世纪紫外可见分光光度计,Nikon ECLIPSE 80i显微镜。
1.4 分析方法 1.4.1 菌体干重(dry cell weight,DCW)准确量取一定量的发酵液经5 000 r/min离心15 min后,取沉淀用2倍发酵液体积的稀盐酸溶液(pH=5.0)洗涤3次,最后用去离子水清洗数次后,烘干至恒重后测定菌体干重。
1.4.2 壳聚糖酶活力以胶体壳聚糖为反应底物,反应体系为:0.3 mol/L乙酸缓冲液(pH 5.6)1 mL,pH为5.6的1%胶体壳聚糖溶液0.9 mL和发酵液上清液0.1 mL。反应液60 ℃水浴15 min后,立即加入1.5 mL DNS试剂,摇匀后置于沸水浴中反应5 min,反应结束待自然冷却后补水至25 mL、混匀后再5 000 r/min离心5 min,取上清液测定OD520。对照组为加入煮沸灭活的发酵上清液[10]。
酶活力单位:以每分钟产生相当于1 μmol氨基葡萄糖的还原糖所需酶量定为1个酶活力单位(U)。每批次发酵过程中间隔4 h取样测定发酵液酶活力,所得酶活力最大值即为该批次酶活力。
相对酶活力(%)是指在发酵产酶影响试验中,某因子各水平发酵液的酶活力与该因子最高产酶水平发酵液的酶活力的比值。
1.4.3 菌体形态观察样品经染色在1 000倍显微镜下观察菌体形态。每一份取样的发酵液制作9份染色样品,共采集约50个图片,对每个图片进行观察分析获得菌丝形态典型特征,进而分析菌丝在发酵过程中的分化规律和变化趋势[11]。
1.4.4 摄氧速率和体积传氧系数采用动态法测定发酵过程中耗氧速率和体积传氧系数[12]。在发酵过程中暂停通气,同时保持发酵罐压力不变,通过溶氧电极可记录发酵罐内溶氧变化曲线,根据停止通气过程中溶氧曲线下降的斜率计算该时刻发酵罐内微生物耗氧速率(oxygen uptake rate,OUR),在已知耗氧速率的情况下,可通过重新通气过程中溶氧速率来计算体积传氧系数KLa。在发酵过程中可根据溶氧及其变化速率计算任一时刻发酵过程中的菌体摄氧速率。
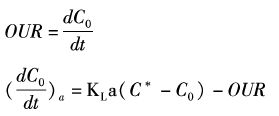
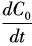 是指重新通气过程中发酵液中溶氧的变化速率;C*是指在发酵条件下的饱和氧分压。以(
是指重新通气过程中发酵液中溶氧的变化速率;C*是指在发酵条件下的饱和氧分压。以(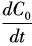 )a为纵坐标,C*-C0为横坐标作一条直线,该直线的斜率即为体积传氧系数KLa。
1.5 实验方法
1.5.1 种子液菌体形态及生长曲线
)a为纵坐标,C*-C0为横坐标作一条直线,该直线的斜率即为体积传氧系数KLa。
1.5 实验方法
1.5.1 种子液菌体形态及生长曲线从平板培养基上挑取培养3 d后新长成的单菌落接入液体种子培养基中,30 ℃、200 r/min条件下培养,待种子液中出现浑浊后每隔1 h取样观察菌体形态及测定OD600,绘制种子液生长曲线。
1.5.2 单因素试验设计发酵罐装填系数 0.6,装入发酵培养基后于121 ℃灭菌,冷却至30 ℃时接入1.5.1 节中培养的种子液发酵培养,罐压0.08 Mpa。采用单因素试验分别考察搅拌转速、通气量、接种量、种子液OD600对发酵液中菌体干重和壳聚糖酶活力的影响。
1.5.3 批次发酵根据单因素实验结果选定接种量、搅拌转速、通气量,种子液OD600。发酵罐装填系数 0.6,罐压0.08 Mpa,考察该条件下摄氧速率、菌体干重、酶活力和菌体形态。
1.5.4 补料发酵按照1.5.3方法,当发酵进入产酶期后,以摄氧速率反馈控制调节补加发酵培养基,当摄氧速率低于0.25 mmol/(L·h)时,补加发酵培养基,补料总量为400 mL。考察该条件下菌体干重、酶活力和菌体形态。
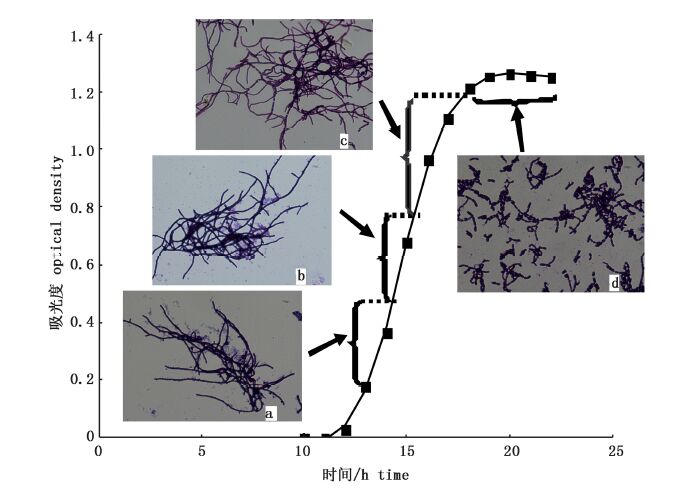
2 结果与讨论 2.1 菌株的生长曲线及形态由图1生长曲线可以看出,菌体在种子液中第11小时开始迅速生长,菌体生长进入对数生长期,到第18小时左右进入稳定期,之后菌体浓度不再随时间的延长而增加。对比菌体形态图1中a和b及种子液吸光值的关系,在对数生长期OD600达到0.8之前,菌体浓度的增长主要是营养生长,体现在菌丝的伸长和分支。在OD600>0.8之后,菌丝开始断裂,形成小的菌丝片段,由图1(c)图看出此时菌丝开始断裂。在稳定期d图中视野内主要是菌丝片段。因此,根据菌体生长曲线和生长形态规律将菌体生长分为对数生长前期(OD600:0.2~0.5),对数生长中期(OD600:0.5~0.8),对数生长后期(OD600:0.8~1.2),稳定期(OD600:1.2~1.3)。
|
图1 浅玫瑰色链霉菌生长曲线及菌体形态 Fig.1 the growth curve of Streptomyces roseolus and its mycelial morphology (a)OD600=0.2~0.5;(b)OD600=0.5~0.8;(c)OD600=0.8~1.2;(d)OD600=1.2~1.3。 |
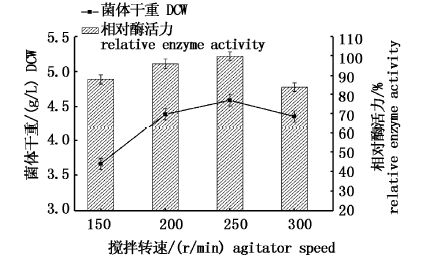
搅拌使发酵罐内形成湍流的环境,影响发酵罐内的传质传热。控制发酵其他条件不变,改变搅拌转速,考察其对发酵的影响,发酵结果见图2。
|
图2 不同搅拌转速发酵结果比较 Fig.2 comparison of fermentation results of different agitator speeds |
根据图2实验结果可以看出,搅拌转速对发酵结果影响明显。搅拌转速由150 r/min提高至200 r/min,菌体干重和酶活力均有提高,可见低搅拌转速影响发酵罐内溶氧和传质传热,从而不利于微生物生长和产酶。而菌体干重在转速由250 r/min调整至300 r/min后反而减少,这可能是高搅拌转速条件下搅拌叶片的剪切力影响菌体菌丝的生长,从而影响菌体的代谢和酶活力的积累。根据实验结果,确定搅拌转速为250 r/min。
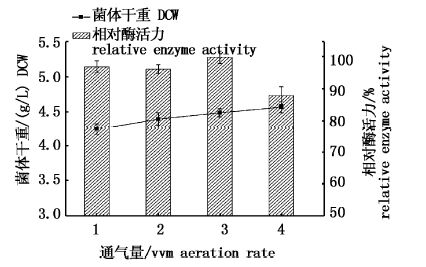
2.2.2 通气量对发酵的影响发酵过程中通气主要为发酵菌体供氧。控制发酵其余条件不变,改变通气量,考察其对发酵的影响,发酵结果见图3。
|
图3 不同通气量发酵结果比较 Fig.3 comparison of fermentation results of different aeration rates |
由表3发酵结果可知,通气量1.0、2.0、3.0 vvm这3个条件下菌体干重和酶活力相差不大,说明在实验条件下通气量满足菌体生长代谢的耗氧需求。而当通气量调整至4.0 vvm时,发酵液中酶活力下降明显,这可能是通气量过大,在发酵过程中水分蒸发过多,从而最终影响发酵产酶。考虑到发酵过程中水分的蒸发和对供气设备的维护,确定发酵通气量为2.0 vvm。
2.2.3 接种量对发酵的影响接种量的大小直接影响菌体在发酵罐内迟滞期,接种量过大或过小影响菌体在发酵罐内的生长代谢和最终产酶。控制发酵其余条件不变,改变接种量,考察其对发酵的影响(图4)。

|
图4 不同接种量发酵结果比较 Fig.4 comparison of fermentation results of different inoculation amounts |
根据表4结果可以看出,接种量由1%提高到3%,发酵液中菌体干重提高了0.71 g/L,相对酶活力提高了9%,可见发酵液中菌体量的增加能在一定程度上提高产酶能力。接种量由3%进一步提高到5%,生物量提高了0.25 g/L,相对酶活力降低了10%,这说明进一步提高接种量能增加发酵液中菌体量,但反而对产酶不利。根据发酵结果,确定发酵接种量为3%。
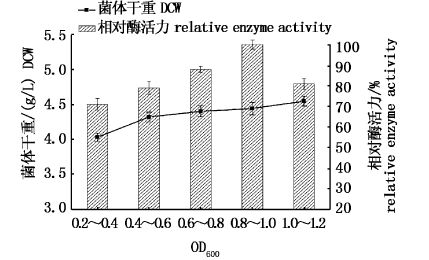
2.2.4 种子液OD600对发酵的影响控制发酵其余条件不变,分别接入不同OD600的种子液发酵,考察不同种子液OD600对发酵结果的影响(图5)。
由图5中可以看出,当接入吸光值0.8~1.0之间的种子液,发酵酶活力最高。而对比菌体干重结果,在实验范围内,增加种子液吸光值,发酵液内菌体干重相应的增加。在一定范围内(0.2~1.0),菌体干重的提高能增加最终发酵液酶活力。但是在1.0~1.2范围内,菌体干重的提高反而降低了发酵液酶活力。根据实验结果,确定种子液OD600为0.8~1.0。
|
图5 不同种子液OD600发酵结果比较 Fig.5 comparison of fermentation results of different OD600 |
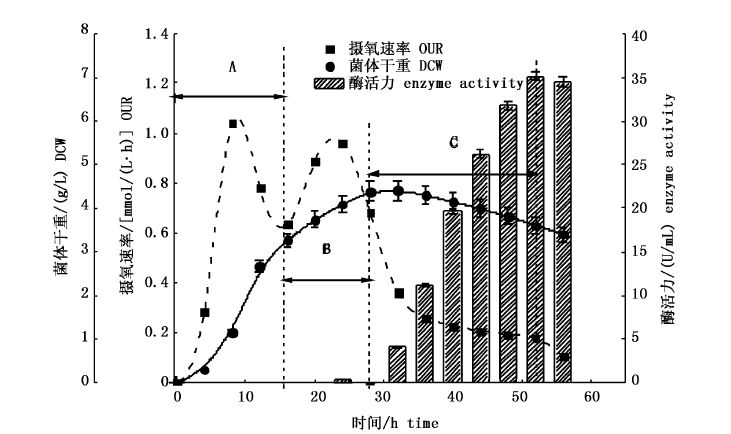
根据单因素试验结果,壳聚糖酶10 L发酵罐发酵工艺为:搅拌转速250 r/min,通气量2.0 vvm,接种量3%,种子液OD600=0.8~1.0。发酵过程曲线如图6。
根据图6,可将发酵过程分为A、B、C 3个阶段,各阶段对应的时间分别为0-16 h、16-28 h和28-52 h。A阶段:即发酵第一阶段,菌体经过迟滞期,通过发酵液中容易利用的营养成分迅速生长,进入对数生长期,出现第一次摄氧高峰,菌体干重迅速增加,此阶段称为生长期。B阶段:即发酵第二阶段,菌体在壳聚糖的诱导下产生壳聚糖酶,从而开始分解并利用壳聚糖生长,出现第二次摄氧速率高峰,菌体干重进一步增加,此阶段菌体干重达到最大并开始产酶,称诱导期。C阶段:发酵液酶活力迅速增加,菌体干重保持稳定并微微下降,发酵进入稳定期,菌体代谢较低,摄氧速率保持在0.2 mmol/(L·h),称为产酶期。
发酵过程曲线显示:浅玫瑰色链霉菌发酵生产壳聚糖酶的过程中菌体呈现二次生长现象,产酶模式为滞后合成型。
在产酶期菌体摄氧速率较低并保持稳定,此时酶活力迅速积累,当摄氧速率下降至0.1 mmol/(L·h)时,产酶期结束。发酵周期为56 h,52 h发酵液中酶活力达到最大,为(35.2±0.5)U/mL。进一步延长发酵时间,发酵液中壳聚糖酶活力开始下降,这可能是发酵液中各类营养物质消耗殆尽,菌体进入衰亡期,释放有害物质等原因。
|
图6 浅玫瑰色链霉菌分批发酵发酵过程曲线 Fig.6 Streptomyces roseolus process curve of batch fermentation |
按照1.5.4 方法实验,在发酵进入产酶期(C段)时开始补料,发酵过程如图7。补料发酵和批次发酵菌体干重相差仅为4%。这主要是补料过程是在第3阶段产酶期,此时发酵罐内的菌体进入稳定期。虽然在补料后(图7中箭头处为补料)菌体摄氧速率上升,但菌体此时利用营养物质主要用于产酶,因此菌体干重增加很少。根据图7中C段可以看出,补料工艺有效的延长了产酶期的时间,比批次发酵产酶时间延长了约33.3%,发酵周期延长至64 h,酶活力在60 h达到最大,比批次发酵酶活力增长了32%,为(46.4±0.5)U/mL。
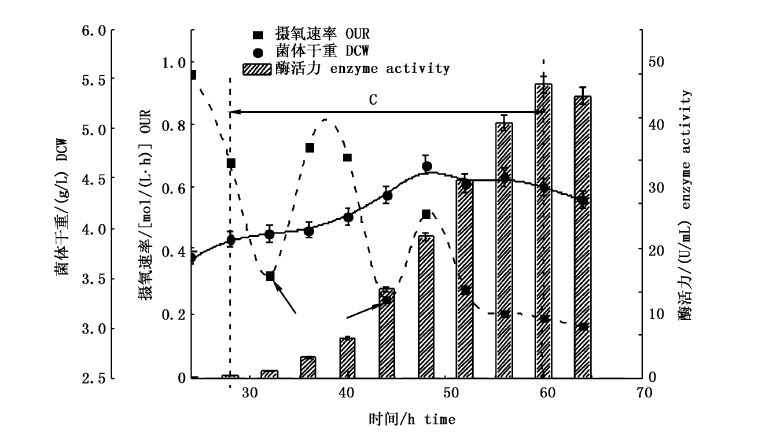
|
图7 补料发酵产酶期发酵过程曲线 Fig.7 fermentation process curve of feed batch fermentation during enzyme production period |
批次发酵进入产酶期开始时菌丝生长旺盛密集,分支发达(图版-1,3),随着产酶期结束菌丝量明显减少且变得细小(图版-2)。由图6中C段可知,在此期间酶活力迅速积累,可见,链霉菌次级代谢产物的积累一般在链霉菌特定的生长阶段[13]。
而在补料发酵过程中,菌丝在产酶期结束后虽然变细(图版-4),但相较于批次发酵产酶期结束时菌丝更加密集(图版-2,4)。产酶期补料能在一定程度上维持浅玫瑰色链霉菌菌丝的形态,这延长了产酶期时间,从而有利于产酶[14, 15]。
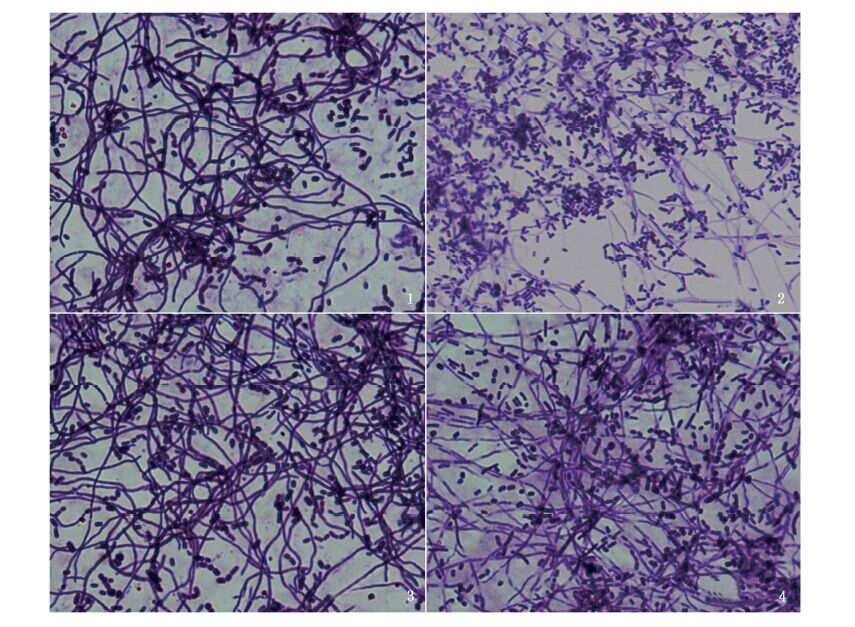
|
图版 批次发酵(1、2)和补料发酵(3、4)液中产酶初期(1,3)和末期(2,4)菌丝形态比较 Plate Morphology comparison of mycelium between initial stage(1,3) and terminal stage(2,4) of fermentation broth in batch fermentaiton and feed batch fermentation during enzyme production period |
根据单因素试验结果确定浅玫瑰色链霉菌10 L发酵罐的发酵工艺,搅拌转速250 r/min,种子液OD600=0.8~1.0,接种量3%,通气量2.0 vvm,发酵液酶活力达(35.2±0.5)U/mL。在补料工艺中,补料能延长产酶期的时间及维持产酶期菌丝的分化生长,从而提高产酶能力。补料工艺产酶期时间比批次发酵延长了33.3%,而酶活力提高了32%,最终达(46.4±0.5)U/mL。该发酵工艺为浅玫瑰色链霉菌工业化生产提供了基础。
颜日明等在研究剪切环境对南昌链霉菌形态和代谢的影响中发现,剪切环境对链霉菌的形态、生长和合成代谢有较大的影响,能极大的影响链霉菌的次级代谢产物的合成和积累[16]。本实验中发酵液壳聚糖酶活力与产酶期菌丝的形态有很大关系,这可能是浅玫瑰色链霉菌产酶与菌丝分化是同步的。在实际生产中可根据镜检观察产酶期菌体的菌丝形态及菌丝量来判断发酵产酶情况,也可通过菌丝量来判断批次发酵结束时间。这一规律是浅玫瑰色链霉菌发酵壳聚糖酶能工业化生产的优势之一。
| [1] | KIM S K, RAJAPAKSE N. Enzymatic production and biological activities of chitosan oligosaccharides (COS):A review[J]. Carbohydrate Polymers, 2005, 62(4):357-368. |
| [2] | BUSILACCHI A, GIGANTE A, BELMONTE-MATTIOLI M, et al. Chitosan stabilizes platelet growth factors and modulates stem cell differentiation toward tissue regeneration[J].Carbohydrate Polymers, 2013, 98(1):665-676. |
| [3] | KARAGOZLU M Z, KARADENIZ F, KONG C S, et al. Aminoethylated chitooligomers and their apoptotic activity on AGS human cancer cells[J]. Carbohydrate Polymers, 2012, 87(2):1383-1389. |
| [4] | NGUYEN A D, HUANG C C, LIANG T W, et al. Production and purification of a fungal chitosanase and chitooligomers from Penicillium janthinellum D4 and discovery of the enzyme activators[J]. Carbohydrate Polymers, 2014, 108:331-337. |
| [5] | THADATHIL N, VELAPPAN S P. Recent developments in chitosanase research and its biotechnological applications:A review[J]. Food chemistry, 2014, 150:392-399. |
| [6] | CRINI G, BADOT P M. Application of chitosan, a natural aminopolysaccharide, for dye removal from aqueous solutions by adsorption processes using batch studies:A review of recent literature[J]. Progress In Polymer Science, 2008, 33(4):399-447. |
| [7] | 魏福卫,蒋霞云,陈舜胜,等.壳聚糖酶高产菌的筛选、鉴定与发酵产酶初探[J].上海海洋大学学报, 2011, 20(2):296-302.WEI F W, JIANG X Y, CHEN S S, et al. Screening, identification and fermentation of a chitosanase-producing strain[J]. Journal of Shanghai Ocean University, 2011, 20(2):296-302. |
| [8] | JIANG X Y, CHEN D C, CHEN L H, et al. Purification, characterization, and action mode of a chitosanase from Streptomyces roseolus induced by chitin[J]. Carbohydrate Research, 2012, 355:40-44. |
| [9] | JIANG X Y, CHEN D C, HONG S L, et al. Identification, characterization and functional analysis of a GH-18 chitinase from Streptomyces roseolus[J]. Carbohydrate Polymers, 2012, 87(4):2409-2415. |
| [10] | 逄玉娟,韩宝芹,刘万顺,等.高产壳聚糖酶菌株的筛选和发酵产酶条件研究[J].中国海洋大学学报, 2005, 35(2):287-292.PANG Y J, HAN B Q, LIU W S, et al. Screening of chitosanase-producing strain and research on its fermentation conditions[J]. Periodical of Ocean University of China, 2005, 35(2):287-292. |
| [11] | 丁乐洪,储炬,庄英萍,等.产黄青霉形态的显微图像分析研究[J].中国抗生素杂志, 2003, 28(3):131-133.DING L H, CHU J, ZHUANG Y P, et al. Morphological characterization of Penicillium chrysogenum by image analysis[J]. Chinese Journal Of Antibiotics, 2003, 28(3):131-133. |
| [12] | RADCHENKOVA N, VASSILEV S, MARTINOV M, et al. Optimization of the aeration and agitation speed of Aeribacillus palidus 418 exopolysaccharide production and the emulsifying properties of the product[J]. Process Biochemistry, 2014, 49(4):576-582. |
| [13] | RIOSERAS B, LÓPEZ-GARCÍA M T, YAGVE P, et al. Mycelium differentiation and development of Streptomyces coelicolor in lab-scale bioreactors:Programmed cell death, differentiation, and lysis are closely linked to undecylprodigiosin and actinorhodin production[J]. Bioresource Technology, 2014, 151:191-198. |
| [14] | YIN P, WANG Y H, ZHANG S L, et al. Effect of mycelial morphology on bioreactor performance and avermectin production of Streptomyces avermitilis in submerged cultivations[J]. Journal of the Chinese Institute of Chemical Engineers, 2008, 39(6):609-615. |
| [15] | 陈凝,王永红,储炬,等.培养基成分和补料对阿维菌素发酵过程中除虫链霉菌菌丝形态的影响[J].华中农业大学学报, 2007, 26(4):496-501.CHEN N, WANG Y H, CHU J, et al. Effect of medium composition and feeding strategy on morphology of Streptomyces avermitilis in avermectin fermentation[J]. Journal of Huazhong Agricultural University, 2007, 26(4):496-501. |
| [16] | 颜日明,郑华淦,庄英萍,等.剪切环境对南昌链霉菌形态和代谢的影响[J].中国抗生素杂志, 2004, 29(9):521-525.YAN R M, ZHENG H G, ZHUANG Y P, et al. The effect of shear environment on morphology and metabolism of Streptomyces nanchangensis[J]. Chinese Journal Of Antibiotics, 2004,29(9):521-525. |
2. Shanghai Engineering Research Center of Aquatic Product Processing and Preservation, Shanghai 201306, China;
3. Shandong Weikang Biological Pharmaceutical Technology Company Limited, Linyi 276017, Shandong, China
 2015, Vol. 24
2015, Vol. 24


