2. 广东省渔业生态环境重点实验, 广东 广州 510300
茎柔鱼(Dosidicus gigas),为大洋性浅海种,广泛分布于东太平洋加利福尼亚北部至智利南部,是世界上最重要的头足类资源之一,尤其在秘鲁沿岸及外海资源丰富[1-3]。1991年,日本和韩国在秘鲁水域进行试捕与调查工作,并取得了成功。我国于2001年开始在秘鲁专属经济区以外公海海域生产,2011年产量达到25万吨,渔船超过179艘。不仅如此,茎柔鱼在海洋生态系统中也扮演着重要角色,它是许多海洋鱼类、哺乳动物以及海鸟等重要饵料[4]。近些年来,国内外学者对茎柔鱼的繁殖生物学内容展开了广泛研究,研究结果认为茎柔鱼繁殖力强,单个母体最高怀卵可达3.2亿枚;产卵周期长,全年产卵;产卵场位置及产卵高峰期随地理区域不同而不同[5]。然而研究主要集中在加利福尼亚海湾和秘鲁近岸海域[6-8],对秘鲁外海的研究报道很少[9]。本文根据我国鱿钓渔船在秘鲁外海生产期间采集的茎柔鱼样本,对其繁殖生物学进行研究,旨在弥补相关研究的空白,同时为该海域茎柔鱼资源的合理开发和利用提供基础。
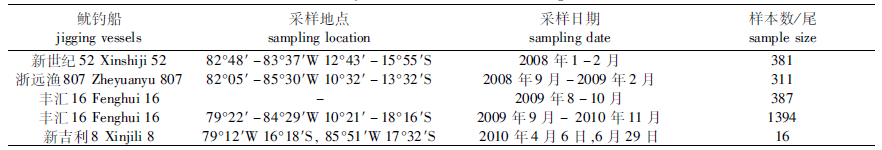
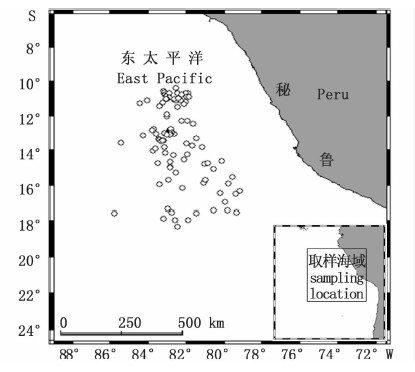
1 材料与方法 1.1 样本采集茎柔鱼样本为2008年1月至2010年10月采集于秘鲁专属经济区外79°12′~88°48′W 10°21′~18°16′S公海海域(表 1,图 1)。
|
表 1 样本信息 Tab.1 Summary information of collected squid off Peru |
|
图 1 秘鲁外海茎柔鱼样本采集站点
Fig. 1 Sampling locations of D. gigas off Peru
|
样本生物学测定内容包括胴长、性别、性腺成熟度、性腺重和雌性缠卵腺长等。胴长用量鱼板测定,精确至1 mm;雌性缠卵腺长用游标卡尺测定,精确至0.01 mm;缠卵腺重量采用电子天平称量,精确至1 mg。依据茎柔鱼性腺成熟度划分标准[10]将其划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ等5期和性未成熟(Ⅰ、Ⅱ期)、性成熟(Ⅲ、Ⅳ期)、繁殖后(雄性为交配后,雌性为产卵后,Ⅴ期)3个等级。
1.3 数据分析(1) 将样本分雌、雄,并按不同月份和胴长组统计分析性腺成熟度,对不同胴长组内性成熟个体的比例和胴长组数据采用线性回归,拟合逻辑斯蒂曲线,推算不同性别茎柔鱼的性成熟胴长[8]:
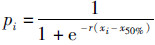 (1)
(1)
式中:pi为成熟个体占组内样本的百分比;xi为各胴长组;r为截距;x50%为性成熟胴长。
(2) 幂函数拟合缠卵腺生长:
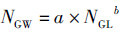 (2)
(2)
式中:NGW(nidamental gland weight)为缠卵腺重(g);NGL(nidamental gland length,NGL)为缠卵腺长(mm);a和b为参数。
(3) 缠卵腺指数(Nidamental gland index,NGI)[8]:
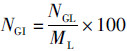 (3)
(3)
式中:NGI为缠卵腺指数;NGL为缠卵腺长(mm);ML(mantle length)为胴长(mm)。
(4) 性腺指数(Gonad somatic index,GSI)[11]:
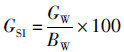 (4)
(4)
式中:GSI为性腺指数;GW(gonad weight)为性腺重(g);BW(body weight)为体重(g)。
1.4 统计分析与检验x2拟合优度检验(Chi-Square Goodness-of-Fit test)检验各月雌雄比例是否等于1:1;非参数曼-惠特尼U检验(Mann-Whitney U-test)检验不同性腺成熟度等级茎柔鱼的缠卵腺和性腺指标的差异性。以上统计检验采用SPSS 15.0统计软件进行分析。
运用F分布检验比较茎柔鱼性成熟胴长的性别差异[12]:
 (5)
(5)
式中:RSSp为整体拟合Logistic方程所得残差平方和;RSSi为每个群体分别拟合Logistic方程所得残差平方和;DFp为整体的自由度;DFi为每个群体的自由度;m为估算参数数量;k为用来比较的群体个数;ni为每个群体的样本数。
2 结果 2.1 性别比例研究共采集样本2 489尾,其中雌性1 985尾(性未成熟1 772尾,性成熟213尾),雄性497尾(性未成熟380尾,性成熟116尾,未鉴定成熟度1尾),未鉴定性别的7尾,整体雌、雄比例为3.99:1,未成熟个体雌、雄比例为4.66:1,成熟个体雌、雄比例为1.84:1。
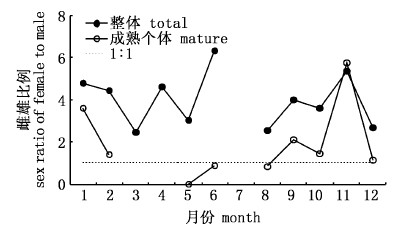
按月份分析发现: 1~12月(7月除外),各月雌、雄比例分别为4.76:1、4.42:1、2.43:1、4.63:1、3.00:1、6.31:1、2.55:1、3.97:1、3.57:1、5.35:1、2.68:1(图 2),雌性个体数量大于雄性(P < 0.05);成熟个体雌、雄比例分别为3.57:1、1.40:1、2.00:0、0:0、0:1、0.88:1、0.86:1、2.09:1、1.43:1、5.75:1、1.14:1(图 2),雌性个体数量较接近雄性。
|
图 2 秘鲁外海茎柔鱼不同月份总体和性成熟个体雌、雄性别比例
Fig. 2 Monthly sex ratios for all squids and for mature individuals of D. gigas off Peru
|
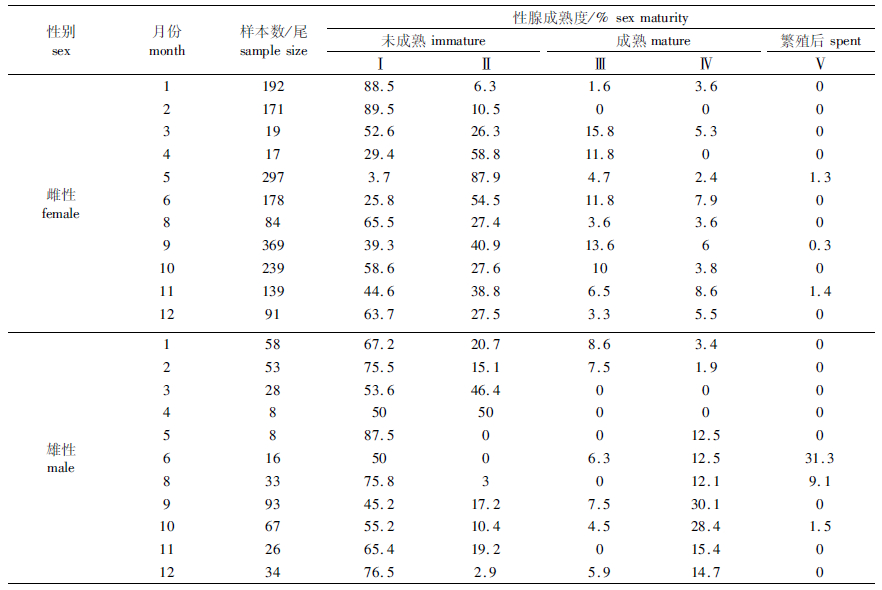
从整体上分析:样本以未成熟个体为主,成熟个体所占比例很低,雌、雄分别为10.4%和21.3%,并出现少量繁殖后个体。按不同月份分析:各月份均以未成熟个体(Ⅰ、Ⅱ期)为主,雌性除了2月和4月份以外,其他各月均有成熟个体出现,出现比例较高的为3月份(21.1%)、6月份(19.7%)、9月份(19.9%)、10月份(13.8%)和11月份(16.5%);雄性除了3月和4月份以外,其他各月也均有成熟个体出现,出现比例较高的为6月(50.0%)、9月(37.6%)和10月(34.4%),其中6月份出现较大比例的交配后Ⅴ期个体(表 2)。
|
表 2 不同月份茎柔鱼性腺成熟度组成 Tab.2 Composition of sex maturity for D. gigas in different months |
按不同性腺成熟度等级分析雌性性腺指数显示,Ⅰ~Ⅳ期茎柔鱼性腺指数随着性腺成熟度增加而不断增大(P < 0.05),Ⅴ期时随着排卵作用进行性腺指数较Ⅳ期有所下降(图 3)。性腺成熟Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期性腺指数分别为0.003~0.50(平均0.18±0.07)、0.007~1.04(平均0.26±0.16)、0.18~7.64(平均2.16±1.85)、0.66~13.32(平均5.96±3.12)、1.49~9.68(平均4.92±2.54),见表 3。

|
图 3 秘鲁外海茎柔鱼性腺指数与胴长关系
Fig. 3 Relationship between gonad somatic index and mantle length of D. gigas off Peru
|

|
表 3 秘鲁外海茎柔鱼性腺指数 Tab.3 Gonad somatic index of D. gigas off Peru |
按不同性腺成熟度等级分析雄性性腺指数发现,Ⅰ~Ⅳ茎柔鱼性腺指数随着性腺成熟度增加而不断增大(P < 0.05),Ⅴ期时随着精荚的释放性腺指数较Ⅳ期有所下降(图 3)。性腺成熟Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期性腺指数分别为0.003~0.52(平均0.07±0.07)、0.03~1.00(平均0.24±0.21)、0.48~2.87(平均1.39±0.74)、0.89~4.18(平均1.95±0.81)、1.33~2.78(平均2.31±0.46),见表 3。
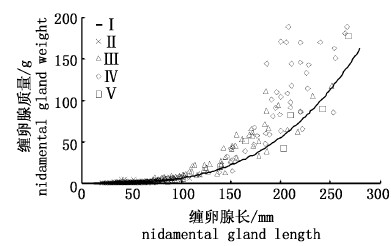
2.3 缠卵腺指标 2.3.1 缠卵腺长与质量缠卵腺质量与缠卵腺长呈明显的幂函数关系(图 4):
|
图 4 秘鲁外海缠卵腺长与缠卵腺质量关系
Fig. 4 Relationship between nidamental gland length and weight for female D. gigas off Peru
|
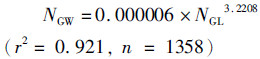 (6)
(6)
按不同性腺成熟度等级分析缠卵腺长发现,Ⅰ~Ⅳ茎柔鱼缠卵腺长随着性腺成熟度增加而不断增大(P < 0.05),Ⅴ期随着产卵事件发生,缠卵腺开始萎缩,其长度也随之减小(图 4)。在秘鲁外海,性腺成熟Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期缠卵腺长度分别为15.0~65.5(平均30.3±7.8、20.3~118(平均49.5±18.1)、65.0~252(平均128±44.0)、138~280(平均201±43.0)、139~268(平均204±47.8)mm(表 4)。

|
表 4 雌性茎柔鱼缠卵腺长和缠卵腺质量 Tab.4 Nidamental gland length and weight of female D. gigas off Peru |
按不同性腺成熟度等级分析缠卵腺重发现,Ⅰ~Ⅳ茎柔鱼缠卵腺重随着性腺成熟度增加而不断增大(P < 0.05),Ⅴ期随着产卵作用发生,缠卵腺开始萎缩,其质量也随之减小(图 4)。秘鲁外海,性腺成熟Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期缠卵腺质量分别为0.01~1.60(平均0.16±0.17)、0.03~9.25(平均0.81±1.48)、1.92~118(平均27.7±28.8)、13.5~226(平均108±57.4)、19.2~179(平均77.0±55.8)g(表 4)。
2.3.2 缠卵腺指数按不同性腺成熟度等级分析缠卵腺指数发现,Ⅰ~Ⅳ茎柔鱼缠卵腺指数随着性腺成熟度增加而不断增大(P < 0.05),Ⅴ期时随着排卵作用进行缠卵腺指数较Ⅳ期有所下降(图 5)。在秘鲁外海,性腺成熟Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期缠卵腺指数分别为5.3%~16.5%(平均10.1%±1.5%)、6.9%~32.2%(平均12.7%±3.5%)、18.8%~49.4%(平均32.2%±8.2%)、37.1%~62.2%(平均49.1%±5.6%)、44.7%~56.0%(平均51.3%±4.8%),见表 5。
|
图 5 秘鲁外海雌性茎柔鱼缠卵腺指数与胴长关系
Fig. 5 Relationship between nidamental gland index and mantle length for female D. gigas off Peru
|

|
表 5 雌性茎柔鱼缠卵腺指数 Tab.5 Nidamental gland index of female D. gigas off Peru |
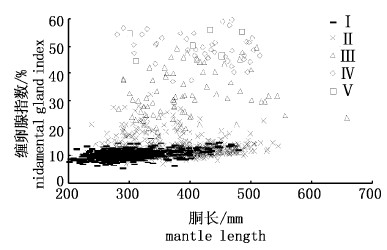
利用Logistic曲线分别拟合雌、雄性成熟个体比率与胴长关系,结果显示,雌性茎柔鱼性成熟胴长为539 mm,雄性为507 mm(图 6),拟合方程式如下:
|
图 6 秘鲁外海茎柔鱼性成熟胴长
Fig. 6 Mantle length at first maturity of D. gigas off Peru
|

F分布检验显示(表 6):茎柔鱼性成熟胴长数据拟合Logistic曲线性别差异明显,雌性茎柔鱼性成熟胴长均明显大于雄性(F3,27=3.94,P= 0.0188 < 0.05)。

|
表 6 雌雄茎柔鱼性成熟胴长数据拟Logistic曲线F分布检验 Tab.6 F-test of size at maturity data fitted to Logistic curve by sex |
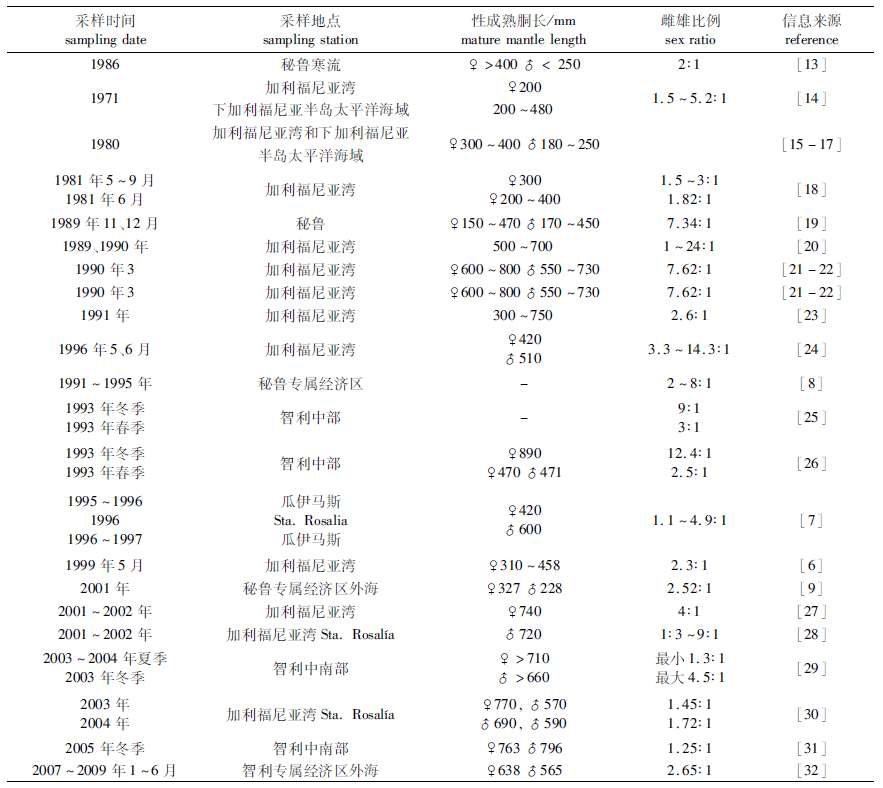
以往研究显示,在特定的时间和空间内,茎柔鱼的雌性数量通常多于雄性,但是雌、雄的性别比例随时空波动显著,从1:1至24:1(表 7)。本文研究也发现,雌性个体数量明显高于雄性,其比例为3.99:1,这一结果大于秘鲁海域的2.8:1[8]。TAFUR等 [8]认为,雄性个体先于雌性个体成熟并发生交配且交配后雄性个体先行死亡,是导致较高的雌雄性比的主要原因。
|
表 7 太平洋茎柔鱼雌雄比例及性成熟胴长 Tab.7 Sex ratio of female to male and size at maturity of D. gigas |
秘鲁外海,样本以未成熟个体为主,成熟个体所占比例较低,雌、雄分别为10.4%和21.3%,说明该海域不是茎柔鱼的主要产卵场,或者无明显的产卵高峰期,而根据耳石日龄和捕捞日期逆算得出秘鲁外海的样本存在明显的产卵高峰期[33],因此可推断秘鲁外海不是茎柔鱼的主要产卵场,其产卵场可能位于秘鲁沿岸[5]。尽管成熟雌性个体比例不高,但是除了2月、4月和7月(该月没有取样)外,其他月份均有成熟雌性个体出现,这说明茎柔鱼为全年产卵,此结论与利用耳石微结构得出的结果一致[34]。而在秘鲁海域各月也均有成熟雌性个体出现,且比例明显较高,并由此推断秘鲁沿岸海域是茎柔鱼的主要产卵场[8]。
缠卵腺和性腺是柔鱼类雌性繁殖系统的重要组织[34],缠卵腺和性腺指数是性成熟的重要指标。Ⅰ~Ⅳ期茎柔鱼缠卵腺和性腺指数随着性腺成熟度增加而不断增大(P < 0.05),成熟个体的缠卵腺指数明显大于未成熟个体。秘鲁外海成熟个体缠卵腺和性腺指数分布分散,说明可能存在2个体型群。RICARDO等 [35]通过缠卵腺指数分析认为,1991和1993年秘鲁外海茎柔鱼存在两个产卵群体。
茎柔鱼的性成熟胴长随其栖息的物理和生物环境的变化而变化[13, 36-37]并与遗传因素有关[13, 36],因此,过去的研究显示茎柔鱼的性成熟胴长随时间和空间变化波动(表 7)。NESIS认为,在其分布范围内存在3种不同性成熟胴长的体型群体:小型群位于热带海域,中型群在整个分布范围内都有,而大型群则分布在南北半球茎柔鱼分布的边缘处。在南半球秘鲁海域,20世纪90年代以性成熟早的小型群为主,而21世纪初则以性成熟晚的大型群为主[38]。在北半球,茎柔鱼性成熟胴长通常较大,而只有在1997/1998年厄尔尼诺事件发生时,性成熟胴长才减小至秘鲁海域20世纪90年代水平[6, 30]。然而,有报道称墨西哥海域20世纪70和80年代也出现性成熟早的小型群。KEYL等 [37]根据性成熟大小将秘鲁寒流海域茎柔鱼划分为大小2个群。而加利福尼亚湾茎柔鱼则被划分为1个大型雌性群和2个中型雄性群[7]。
本文研究结果显示秘鲁外海雌雄茎柔鱼性成熟胴长分别为539 mm和507 mm,当属中型群。因此,结合秘鲁的地理位置,推测中型群的分布符合NESIS提出的分布特点。然而在秘鲁外海,根据性成熟胴长推测的1个中型群与缠卵腺和性腺指数分布推测的2个群体似乎不符,其实不然,因为鱿钓作业的选择性强,捕获的大型成熟个体较少,不足以拟合逻辑斯蒂曲线,因此进一步分析认为,秘鲁外海存在1个中型群和1个大型群。雌雄对比研究发现,雌性茎柔鱼性成熟胴长明显高于雄性,这符合头足类雄性生长快的特性。例如,北太平洋柔鱼(Ommastrephes bartramii)雌雄性成熟胴长分别为332 mm和299 mm[39],西南大西洋阿根廷滑柔鱼雌雄性成熟胴长分别为265 mm和209 mm[40]。
| [1] | TAIPE A, YAMASHIRO C, MARIATEGUI L, et al.Distribution and concentrations of jumbo flying squid (Dosidicus gigas) off the Peruvian coast between 1991 and 1999[J]. Fisheries Research, 2001, 54(1): 21–32. |
| [2] | WALUDA C M, YAMASHIRO C, ELVIDGE C D, et al.Quantifying light-fishing for Dosidicus gigas in the Eastern Pacific using satellite remote sensing[J]. Remote Sensing of Environment, 2004, 91(2): 129–133. |
| [3] | 陈新军, 赵小虎.秘鲁外海茎柔鱼产量分布及其与表温关系的初步研究[J]. 上海水产大学学报, 2006, 15(1): 65–70. CHEN X J, ZHAO X H.Preliminary study on the catch distribution of Dosidicus gigas and its relationship with sea surface temperature[J]. Journal of Shanghai Fisheries University, 2006, 15(1): 65–70. |
| [4] | ROSAS-LUIS R, SALINAS-ZAVALA C A, KOCH V, et al.Importance of jumbo squid Dosidicus gigas (Orbigny, 1835) in the pelagic ecosystem of the central Gulf of California[J]. Ecological Modelling, 2008, 218(1/2): 149–161. |
| [5] | NIGMATULLIN C M, NESIS K N, ARKHIPKIN A I.A review of the biology of the jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae)[J]. Fisheries Research, 2001, 54(1): 9–19. |
| [6] | MARKAIDA U.Population structure and reproductive biology of jumbo squid Dosidicus gigas from the Gulf of California after the 1997-1998 El Niño event[J]. Fisheries Research, 2006, 79(1/2): 28–37. |
| [7] | MARKAIDA U, SOSA-NISHIZAKI O.Reproductive biology of jumbo squid Dosidicus gigas in the gulf of California, 1995-1997[J]. Fisheries Research, 2001, 54(1): 63–82. |
| [8] | TAFUR R, VILLEGAS P, RABÍ M, et al.Dynamics of maturation, seasonality of reproduction and spawning grounds of the jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae) in Peruvian waters[J]. Fisheries Research, 2001, 54(1): 33–50. |
| [9] | 叶旭昌, 陈新军.秘鲁外海茎柔鱼胴长组成及性成熟初步研究[J]. 上海水产大学学报, 2007, 16(4): 347–350. YE X C, CHEN X J.Study of mantle length composition and sex maturity of jumbo flying squid (Dosidicus gigas) in fishing ground off Peru[J]. Journal of Shanghai Fisheries University, 2007, 16(4): 347–350. |
| [10] | LIPINSKI M R, UNDERHILL L G.Sexual maturation in squid:quantum or continuum?[J]. South African Journal of Marine Science, 1995, 15(1): 207–223. |
| [11] | 陈新军.渔业资源与渔场学[M].北京: 海洋出版社, 2004: 1-382. CHEN X J.Fisheries resource and fishing ground[M].Beijing: Ocean Press, 2004: 1-382. |
| [12] | ARKHIPKIN A I, JEREB P, RAGONESE S.Growth and maturation in two successive groups of the short-finned squid, Illex coindetii from the Strait of Sicily(Central Mediterranean)[J]. ICES Journal of Marine Science, 2000, 57(1): 31–41. |
| [13] | NESIS K N.The biology of the giant squid of Peru and Chile, Dosidicus gigas[J]. Oceanology, 1970, 10(1): 108–118. |
| [14] | SATO T. Results of exploratory fishing for Dosidicus gigas (D'Orbigny) off California and Mexico[R]. Washington D.C.:FAO Fisheries Reports, 1976, 170:61-67. |
| [15] | EHRHARDT N M, JACQUEMIN P S, SOLÍS N A, et al.Crecimiento del calamar gigante Dosidicus gigas en el Golfo de California, Mexico, Durante 1980[J]. Ciencia Pesquera, 1982, 3: 33–39. |
| [16] | EHRHARDT N M, SOLÍS N A, JACQUEMIN P S, et al.Análisis de la biología y condiciones del stock del calamar gigante Dosidicus gigas en el Golfo de California, México, durante 1980[J]. Ciencia Pesquera, 1986, 5: 63–76. |
| [17] | EHRHARDT N M, JACQUEMIN P S, GARCÍSA B F, et al. On the fishery and biology of the giant squid Dosidicus gigas in the Gulf of California, Mexico[M]//CADDY J F. Advances in Assessment of World Cephalopod Resources. Washington, D.C.:FAO Fisheries Technical Paper, 1983, 231:306-339. |
| [18] | RAMÍREZ M, KLETT-TRAULSEN A.Composición de tallas de la captura de calamar gigante en el Golfo de California durante 1981[J]. Transactions CIBCASIO, 1985, 10: 123–137. |
| [19] | RUBIO R J, SALAZAR C C.Prospección pesquera del calamar gigante (Dosidicus gigas) a bordo del buque japonés'Shinko Maru 2'[J]. Information IMARPE, 1992, 103: 3–32. |
| [20] | MORÁN-ANGULO J O. Proyecto de investigación biológica pesquera de calamar gigante (Dosidicus gigas, D'Orbigny 1835) de la zona suroccidental del Golfo de California[R]. La Paz, Mexcio:CRIP La Paz, INP, 1990:1-104. |
| [21] | SÁNCHEZ P. Biologcial aspects of Dosidicus gigas in Mexican Pacific Ocean[R]. Brisbane, Brisbane, Australia:Abstract of the Tropical Cephalopods Fisheries Biology and Ecology, 1996:21-22. |
| [22] | SÁNCHEZ P.Cephalopods from off the Pacific coast of Mexico:biological aspects of the most abundant species[J]. Scientia Marina, 2003, 67(1): 81–90. |
| [23] | GUERRERO-ESCOBEDO F J, GALVÁN-MAGAÑA F, LEÓN-CARBALLO G, et al. Abundancia relativa y composición de tallas del calamar gigante Dosidicus gigas, D'Orbigny (1935), en la costa oriental de Baja California Sur, México. Unpubl. Manu. Ⅳ[R]. Ensenada, B. C., México:Congreso de la Asociación de Investigadores del Mar de Cortés, 1992:1-14. |
| [24] | HERNÁNDEZ H A, MORALES B E, NEVARES-MARTÍNEZ M O, et al.Distribución de tallas y aspectos reproductivos del calamar gigante (Dosidicus gigas, D'Orbigny, 1835) en el Golfo de California, México, en 1996[J]. Ciencia Pesquera, 1996, 12: 85–89. |
| [25] | CHONG J, OYARZU'N C, GALLEGUILLOS R, et al.Parametros biológico-pesqueros de la jibia, Dosidicus gigas (Orbigny, 1835) (Cephalopoda:Ommastrephidae), frente a la costa de Chile Central (29°S-40°S) durante 1993-1994[J]. Gayana (Zool), 2005, 69(2): 319–328. |
| [26] | GONZÁLEZ P, CHONG J.Biología reproductiva de Dosidicus gigas D'Orbigny 1835(Cephalopoda, Ommastrephidae) en la Zona Norte-Centro de Chile[J]. Gayana (Zool), 2006, 70: 237–244. |
| [27] | DIAZ-URIBE J G, HERNÁNDEZ-HERRERA A, MORALES-BOJÓRQUEZ E, et al.Histological validation of the gonadal maturation stages of female jumbo squid (Dosidicus gigas) in the Gulf of California, Mexico[J]. Ciencias Marinas, 2006, 32(1): 23–31. |
| [28] | MARTÍNEZ-AGUILAR S, MORALES-BOJÓRQUEZ E, DIAZ-URIBE J G. La pesquería del calamar gigante (Dosidicus gigas) en el Golfo de California[R]. La Paz, Mexcio:Recomendaciones de investigación y tácticas de regulación, Comisión Nacional de Acuacultura y Pesca y Instituto Nacional de la Pesca, 2004. |
| [29] | IBÁÑEZ C M, CUBILLOS L A.Seasonal variation in the length structure and reproductive condition of the jumbo squid Dosidicus gigas (d'Orbigny, 1835) off central-south Chile[J]. Scientia Marina, 2007, 71(1): 123–128. |
| [30] | BAZZINO G, GILLY W F, MARKAIDA U, et al.Horizontal movements, vertical-habitat utilization and diet of the jumbo squid (Dosidcus gigas) in the Pacific Ocean off Baja California Sur, Mexico[J]. Progress in Oceanography, 2010, 86(1/2): 59–71. |
| [31] | ULLOA P, FUENTEALBA M, RUIZ V.Feeding habits of Dosidicus gigas (D'Orbigny, 1835) (Cephalopoda:Teuthoidea) in the central-south coast off Chile[J]. Revista Chilena de Historia Natural, 2006, 79(4): 475–479. |
| [32] | 刘必林, 陈新军, 马金, 等.头足类耳石的微化学研究进展[J]. 水产学报, 2010, 34(2): 315–321. LIU B L, CHEN X J, MA J, et al.Review of studies of the microchemical structure of cephalopod statoliths[J]. Journal of Fisheries of China, 2010, 34(2): 315–321. |
| [33] | LIU B L, CHEN X J, CHEN Y, et al.Age, maturation, and population structure of the Humboldt squid Dosidicus gigas off the Peruvian Exclusive Economic Zones[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(1): 81–91. |
| [34] | 刘必林, 陈新军.头足类生殖系统及其在分类学上的应用[J]. 水产学报, 2010, 34(8): 1219–1226. LIU B L, CHEN X J.Cephalopods reproductive system and its application to taxonomy[J]. Journal of Fisheries of China, 2010, 34(8): 1219–1226. |
| [35] | RICARDO T, PIERO V, MIGUEL R, et al.Dynamics of maturation, seasonality of reproduction and spawning grounds of the jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae) in Peruvian waters[J]. Fisheries Research, 2001, 54(1): 33–50. |
| [36] | NESIS K N. Dosidicus gigas[M]//BOYLE P R. Cephalopod Life Cycles. London:Academic Press, 1983:215-231. |
| [37] | KEYL F, ARGVELLES J, MARIÁTEGUI L, et al.A hypothesis on range expansion and spatio-temporal shifts in size-at-maturity of jumbo squid (Dosidicus gigas) in the Eastern Pacific Ocean[J]. CCOFI Report, 2008, 49: 119–128. |
| [38] | ARGVELLES J, TAFUR R, TAIPE A, et al.Size increment of jumbo flying squid Dosidicus gigas mature females in Peruvian waters, 1989-2004[J]. Progress in Oceanography, 2008, 79(2/4): 308–312. |
| [39] | 李思亮, 刘必林, 陈新军, 等.西北太平洋柔鱼(Ommastrephes bartramii)繁殖生物学初步研究[J]. 海洋与湖沼, 2011, 42(2): 179–185. LI SL, LIU B L, CHEN X J, et al.Reproductive biology of neon flying squid (Ommastrephes bartramii) in Northwest Pacific Ocean[J]. Oceanologia et Limnologia Sinica, 2011, 42(2): 179–185. |
| [40] | 刘必林, 陈新军, 田思泉, 等.西南大西洋公海阿根廷滑柔鱼性成熟的初步研究[J]. 上海水产大学学报, 2008, 17(6): 721–726. LIU B L, CHEN X J, TIAN S Q, et al.Sex maturity of Illex argentinus in the high sea waters of Southwest Atlantic[J]. Journal of Shanghai Fisheries University, 2008, 17(6): 721–726. |
2. Guangdong Key Laboratory of Fishery Ecology and Environment, Guangzhou 510300, Guangdong, China
 2016,
Vol. 25
2016,
Vol. 25


