扩展功能
文章信息
- 张曼, 匡晓晖, 冯玉凡, 李发有, 王礼琳, 范洁, 张进
- ZHANG Man, KUANG Xiaohui, FENG Yufan, LI Fayou, WANG Lilin, FAN Jie, ZHANG Jin
- 一种快速起搏右心室诱导犬慢性心衰模型的新方法
- A New Method for Rapid Pacing Right Ventricular Inducing Canine Chronic Heart Failure Model
- 四川动物, 2016, 35(2): 261-265
- Sichuan Journal of Zoology, 2016, 35(2): 261-265
- 10.11984/j.issn.1000-7083.20150258
-
文章历史
- 收稿日期: 2015-08-25
- 接受日期: 2015-12-15
2. 昆明理工大学医学院, 昆明 650500;
3. 公安部昆明警犬基地, 昆明 650204
2. Medical College of Kunming University of Science and Technology, Kunming 650500, China;
3. Kunming Police Dog Base of the Ministry of Public Security, Kunming 650204, China
慢性心衰(chronic heart failure,CHF)是严重威胁人类健康的重大疾病,其5年存活率不足50%,其发病机制是目前国际和国内研究的热点和难点。建立与人类慢性心衰病理生理过程相似的大型动物模型对深入研究其发病机制尤为重要。但建立大动物模型对试验条件、操作技术要求较高,且花费较高,术后动物较容易死亡。因此,制作一个成功的CHF动物模型并不容易。目前,国内外已有许多研究者对此做了有益的探索(周淑娴等,1998;何晓雷等,2009;Dixon et al.,2009)。我们就目前犬CHF模型的制作进行改进,旨在进一步提高大型动物CHF模型的成功率。
1 材料与方法 1.1 设备和材料动物专用心脏起搏器(Qinming 8631SR,陕西秦明医学仪器股份有限公司),程控频率每分钟200~600次。人用起搏螺旋电极(Medtronic Model 4092,Medtronic Inc,USA)、程控仪(Qinming,陕西秦明医学仪器股份有限公司)、动物专用心电图机(Animal Oriented ECG EickECG-220,CARDELL Inc,USA)、便携式心脏超声仪(Terason t3000,Terason Inc,USA)、动物吸入麻醉机(Surgivet,CDS2000,USA)、X线血管造影(Integris V5000,Philips,German)。
1.2 动物与手术 1.2.1 手术前准备手术器械的准备及消毒:金属器械、纱布、缝针、手术巾等均高压灭菌消毒。随机选择雄性健康杂种犬5只,体质量约17 kg(昆明医科大学动物中心提供)。实验前禁食12 h,术前备皮,麻醉前准确称量犬体质量。以6.6 mg·kg-1丙泊酚静脉注射诱导麻醉。气管插管,呼吸机辅助呼吸,异氟烷维持吸入麻醉。心电图检查肢体导联,心电图连接固定在犬脚掌背部。术前心动超声检查了解心脏结构和功能,分别测定收缩期主动脉瓣环内径、舒张期室间隔厚度、舒张期左心室后壁厚度、左心房收缩期内径、左心房短轴缩短率、左心房内径、左心室舒张末期内径和左心室射血分数,观察心室室壁运动情况。排除心脏结构异常。静脉通道维持,准备植入右心室电极,拟行高频率右心室起搏。
1.2.2 手术步骤手术过程尽量遵从无菌操作原则。充分暴露颈外静脉。切开皮肤及分离皮下组织,分离并切开右侧颈外静脉。穿刺犬颈外静脉成功后依次送入导引钢丝、血管鞘,送入经改装的人用起搏螺旋电极(58 cm),跨越三尖瓣达右心室心尖部后,测量起搏电压、电流、脉宽、电阻等参数合适后,在犬项背部两肩胛骨之间皮下作长5~6 cm切口做囊袋,从电极到囊袋处作直线型隧道,将电极尾端与经改装的人用脉冲发生器相连。起搏器植入后用程控仪将起搏器程控为心室非同步起搏(VOO)模式,以犬能够耐受的频率进行起搏,固定频率260 次/分,输出电压5.0 V,脉宽0.5 ms,心电图及心电监护检查示起搏功能良好,随后固定电极逐层缝合皮肤。在犬麻醉苏醒前,静脉注射速尿20 mg以减轻心脏前负荷,避免犬出现急性左心衰竭。
1.3 术后处理术后3 d,每日给予青霉素400万单位肌内注射,预防感染。并且给予静安舒皮下注射以避免由于犬的躁动导致电极脱位。同时每天观察犬有无心衰临床表现(厌食、气促、活动耐量等症状明显,B超证实左心房内径、左心室舒张末期内径增大及肝淤血、浆膜腔积液)并记录。1周后拍X光胸片,确定电极固定良好。心电图观察起搏是否正常。每周听诊1次,并做心电图了解心率情况。
4周后,在犬清醒状态下作超声心动图检查,静脉注射静安舒以保持犬安静,再次进行心电图检查,确定起搏频率维持在(260±10)次/min。之后,将起搏器程控为停止状态。取仰卧位或左侧卧位(以获取心尖最佳四腔切面图像为准),超声心动仪测量房室、内径,观察心脏搏动情况,计算左心室射血分数等心功能参数。
最后将犬处死,取出心脏,沿室间隔左心室侧剪开左心室,测量最大左心室内径和最大室壁厚度。留标本送病理切片行苏木精-伊红(HE)染色。另一组正常成年杂种犬标本作为对照。
1.4 统计学方法数据采用SPSS 20进行分析,用x±s表示,起博前、后组间采用非配对t检验进行统计分析。
2 结果 2.1 起搏电极及起搏器位置手术在X影像下完成,如图 1所示,X影像下将人用起博螺旋电极植入犬右心室心尖部。

|
| 图 1 X影像下将螺旋电极植入犬右心室心尖部 Fig. 1 Embedding of spiral electrode into the right ventricular apex of dog under X ray |
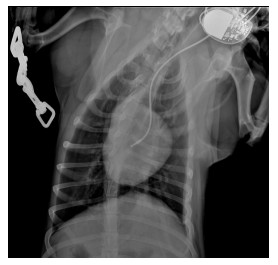
术后4周复查电极及起搏器位置,起博器无移位或电极断裂等情况(图 2)。
|
| 图 2 X线下起搏器及电极位置 Fig. 2 The position of pacemaker and electrode under X ray |
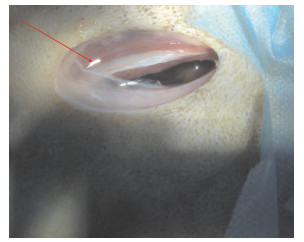
5只犬经4周起搏后,均出现饮食欠佳、活动量 明显减少、呼吸急促、浆膜腔积液等临床表现,体质量从17.2 kg±2.56 kg降至15.4 kg±2.09 kg。切开胸腔后可见大量胸腔积液(图 3箭头示),并从切口处流出。
|
| 图 3 犬胸腔切口 Fig. 3 Incision of the canine opening chest |
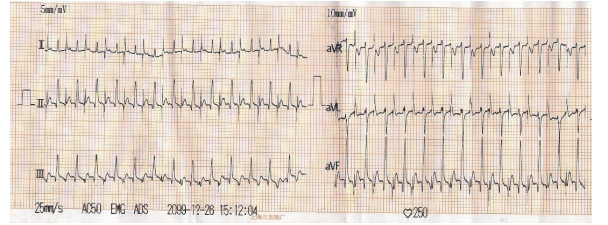
起搏前心电图(图 4)、起搏后心电图(图 5)证实5只犬4周内均为持续起搏心律,且频率保持在(260±10)次/min。

|
| 图 4 快速起博右心室前犬基础心率为129次/分 Fig. 4 The heart rate of the dog is 129 times/min before rapid right ventricular pacing |
|
| 图 5 快速起搏右心室4周后犬起搏频率为250次/分 Fig. 5 The heart rate of the dog is 250 times/min after 4 weeks of rapid right ventricular pacing |
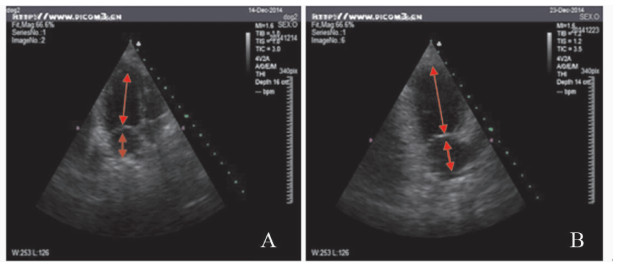
在植入起搏器前和快速起搏右心室4周后均对犬进行心脏彩色超声检查。从超声心动图可以观察到:左心房、左心室较手术前明显增大(图 6中红色箭头所示)。另外,在心脏彩色超声检查中还观察到:左心室舒张末期内径显著扩大,室壁变薄,左心室壁运动幅度明显减弱。
|
| 图 6 快速起搏右心室前、后犬的心脏彩色超声心动图变化 Fig. 6 The changes of the canine echocardiographic image before and after rapid right ventricular pacing A. 起搏前Before pacing; B. 起搏4周后 Four weeks after pacing. |
通过作心脏彩色超声检查,起博前和起搏4周后的心功能参数见表 1。与起搏前相比,起搏后射血分数、收缩期主动脉瓣环内径以及左心室短轴缩短率的值均有明显降低,而舒张期室间隔厚度、舒张期左心室后壁厚度、左心房收缩期内径和左心室舒张末期内径的值均有相应升高。
| 心功能指标Parameters of cardiac function | 起搏前Before pacing | 起搏后After pacing |
| 左心室射血分数/% | 61.50±3.36 | 38.60±2.88* |
| 舒张期室间隔厚度/cm | 0.36±0.02 | 0.47±0.05* |
| 舒张期左心室后壁厚度/cm | 0.44±0.23 | 0.56±0.22* |
| 左心房收缩期内径/cm | 1.56±0.48 | 2.37±0.32* |
| 收缩期主动脉瓣环内径/cm | 1.38±0.28 | 1.20±0.16* |
| 左心室短轴缩短率/% | 30.51±0.32 | 21.30±0.58* |
| 左心室舒张末期内径/cm | 36.28±0.62 | 45.12±0.34* |
| 注: * 与正常犬比, P < 0.05. Note: * Compared with the healthy dogs, P < 0.05. |
||
分别给正常犬和CHF模型犬做心肌组织切片,苏木精-伊红(HE)染色结果分别如图 7和图 8所示。正常犬的心肌排列整齐,心肌细胞大小相同;CHF模型犬心肌排列紊乱,心肌细胞肿胀,胞质内出现空泡,核周间隙增大。

|
| 图 7 正常犬心肌 Fig. 7 Themyocardium of healthy dogs |

|
| 图 8 CHF犬心肌 Fig. 8 Themyocardium of CHF dogs |
CHF是多种心脏疾病的最终转归。制作近似人类的CHF动物模型是研究CHF发病机制和防预治疗的重要环节。有些研究者选择用小动物如Wistar大鼠来造模,例如Cutilleta等(1978)及Anversa等(1979)采取缩窄腹主动脉的方法制造压力超负荷CHF模型。此种动物模型需时较长,有时不易产生心衰。而且通常认为在慢性心衰发病机制和治疗效果研究方面啮齿类动物与人的相似性较差,而大动物犬的心肌与人的心血管系统十分相似,心肌形态学和兴奋-收缩偶联机制与人类心肌亦非常接近(Hasenfuss,1998)。这也是我们选用犬制作CHF模型的重要原因。在犬CHF模型的研究中,郭豫涛(2001)采用开胸结扎冠状动脉(CA)复制CHF模型,或者在CA上安置闭塞夹或者定量缩窄环,亦或者穿刺CA注入栓塞剂造模。但在开胸结扎CA的动物模型中,可能出现严重的室性心率失常致动物死亡。本实验采用快速起搏心室建模的方法克服了以往开胸结扎法造成创伤大、死亡率高的缺点,手术创伤相对小、定位准确。另外,Belevych等(2011)采用改变起搏频率的方法来制作动物模型,即将起搏器置入实验犬体内后开始调节起搏器频率为180次/min,持续2周,改为200次/min持续6周,再改为180次/min维持2个月,再改为160次/min维持6个月,最后改为120次/min。不难看出,这种建模方法耗费时间太长,操作比较复杂。我们采用260次/min的起搏频率进行右心室起搏,持续4~5周,实验操作较简易,时间较短,模型制作高效,动物死亡率较低,并且建立了良好的CHF模型。
另外,本实验在前人(Wilson et al.,1987;Dibner-Dunlap & Thames,1990;Sabbah et al.,1991;Willams et al.,1994;周淑娴等,1999;付治卿,2007)的实验基础上做了一些改进。在实验条件上:(1)我们使用的是人用起博螺旋电极导线,整个植入过程也与临床操作类似。这些实验器材容易获得,技术处理简单。重要的是,由于犬麻醉清醒后容易躁动,普通起搏电极固定在心肌不牢靠而较容易脱位导致植入失败。螺旋电极固定较好,即使犬烦躁、活动幅度较大,也不容易脱位,而且手术及麻醉时间均缩短,手术成功率较高。(2)整个手术在医院导管室的影像下完成,整个植入过程也与临床操作类似,可确保电极准确地植入右心室心尖部。(3)利用专业的动物吸入麻醉机可以较精确地控制吸入麻醉剂的量,避免过度麻醉或者既往全身麻醉造成动物后期复苏困难的风险,手术安全性大大提高。所有5只犬在去除吸入麻醉剂后均可立即恢复清醒,死亡率较低。
在术后监控方面:(1)为了避免术后犬过分躁动导致电极脱位,术后3 d皮下注射静安舒,以保持犬静卧,使电极与心脏结合牢固。术后1周为犬做胸透,观察电极位置。(2)由于实验操作使犬的心率骤然从120~130次/min增至260次/min,可能会导致动物在实验初期因急性肺水肿而死亡。为了避免上述情况发生,我们预防性地给予利尿剂减轻心脏前负荷,进一步降低了模型动物的死亡率。
总之,快速起搏右心室建立犬CHF模型具有安全、高效、周期短的特点,这对于研究人类CHF的发病机制具有重要价值。
| 付治卿, 刘涛, 米亚非, 等. 2007. 超声心动图在评估慢性心力衰竭模型中的作用[J]. 心脏杂志, 19(5): 528-530. |
| 郭豫涛. 2001. 充血性心力衰竭的动物模型[J]. 上海实验动物科学, 21(2): 123-125. |
| 何晓雷, 刘玉丽, 张岩, 等. 2009. 清醒犬慢性充血性心力衰竭模型的血流动力学特征[J]. 中南大学学报, 34(6): 487. |
| 周淑娴, 张旭明, 伍卫, 等. 1998. 快速右心室起搏致心力衰竭犬模型的研制[J]. 中山医科大学学报, 19(1): 27-30. |
| 周淑娴, 张旭明, 伍卫, 等. 1999. 胺碘酮对正常犬与心力衰竭犬心室电生理效应的比较[J]. 重庆医科大学学报, 20(1): 45-49. |
| Anversa P, Olivetti G, Melissari M, et al. 1979. Morphometric study of myocardial hypertrophy induced by abdominal aorticstenosis[J]. Laboratory Investigation, 40(3): 341-349. |
| Belevych AE, Terentyev D, Terentyeva R, et al. 2011. The relationship between arrhythmogenesis and impaired contractility in heart failure: role of altered ryanodine receptor function[J]. Cardiovascular Research, 90(3): 493-502. |
| Cutilleta AF, Rudnik M, Zak R. 1978. Muscle and non-muscle cell RNA polymerase activity during the development of myocardial hypertrophy[J]. Journal of Molecular and Cell Cardiology, 10(8): 677-687. |
| Dibner-Dunlap ME, Thames MD. 1990. A simplified technique for the production of heart failure in the dog by rapid ventricular pacing[J]. The American Journal of Medicine Science, 300(5): 288-290. |
| Dixon JA, Spinale FG. 2009. Large animal models of heart failure: acritical link in the translation of basic science to clinical practice[J]. Circulation Heart Failure Journal, 2(3): 262-271. |
| Hasenfuss G. 1998. Animal models of human cardiovascular disease, heart failure and hypertrophy[J]. Cardiovascular Research, 39(1): 60-76. |
| Sabbah HN, Stein PD, Kono T, et al. 1991. A canine model of chronic heart failure produced by multiple sequential coronary microembolizations[J]. American Journal of Physiology, 260(4 Pt 2): H1379-1384. |
| Willams RE, Kass DA, Kawagoe Y, et al. 1994. Endomyocardial gene expression during development of pacing tachycardia-induced heart failure in the dog[J]. Circulation Research, 75(4): 615-623. |
| Wilson JR, Douglas P, Hickey WF, et al. 1987. Experimental congestive heart failure produced by rapid ventricular pacing in the dog: cardiac effects[J]. Circulation, 75(4): 857-867. |
 2016, Vol. 35
2016, Vol. 35




