扩展功能
文章信息
- 唐东红, 叶尤松, 李哲丽, 李司, 杨光蕊, 李桂珍, 李润萍, 彭波
- TANG Donghong, YE Yousong, LI Zheli, LI Si, YANG Guangrui, LI Guizhen, LI Runping, PENG Bo
- 不同发育阶段雄性小鼠睾丸组织mEppin基因mRNA的表达差异研究
- Expression of mEppin Gene in Different Developing Stages of Male Mice Testes
- 四川动物, 2016, 35(2): 256-260
- Sichuan Journal of Zoology, 2016, 35(2): 256-260
- 10.11984/j.issn.1000-7083.20150268
-
文章历史
- 收稿日期: 2015-09-02
- 接受日期: 2015-12-14
2. 云南中医学院, 昆明 650200
2. Yunnan University of Traditional Chinese Medicine, Kunming 650200, China
Eppin蛋白(epididymal protease inhibitor)是一种睾丸或附睾蛋白激酶抑制剂,特异性地表达于睾丸和附睾,研究表明该蛋白在精子功能以及男性生殖方面发挥重要作用,且与精子成熟和男性生殖有密切关系(王增军等,2006),近年来,作为一种极具发展潜力的男性避孕候选靶标基因引起众多关注。人类的Eppin(hEppin)(SPinlW1,附睾蛋白激酶抑制剂)基因于2001年首次被描述(Richardson et al.,2001),小鼠Eppin(mEppin)基因的功能及表达于2003年被首次描述(Sivashanmugam et al.,2003),近年来的研究(O’Rand et al.,2006,2007)已证明小鼠Eppin蛋白具有与人类Eppin蛋白相似的免疫避孕作用。精囊凝固蛋白(semenogelin,Sg)是精液的主要成分,Eppin蛋白和Sg在精子表面结合(王增军等,2006)构成了灵长类动物射精后精子的保护机制,提供给精子在胶冻状的液化过程中生存的抗菌活性,随后精浆蛋白被水解,精液液化后,受保护的精子获得自由后才能向前运动并引起受孕。体外实验研究发现来自不孕雄猴血清中的抗Eppin抗体可直接阻断Eppin蛋白在射精后精液的凝固过程中与Sg的结合,使精子很快水解,干扰精子受孕前的一些基本步骤,进而抑制生育能力(O'Rand et al.,2004)。研究者利用重组Eppin蛋白免疫雄猴获得较好的免疫性避孕效果( O'Rand et al.,2009)。动物模型的研究可促进人类Eppin基因的研究,mEppin基因在小鼠体内的表达模式受何种因素调节?Long等(2011)研究发现出生后7 d的小鼠无mEppin基因的表达,12 d时能在Sertoli细胞中检测到mEppin基因的表达,接下来的发育过程中在各级生精细胞、精子细胞、成熟精子以及附睾的各个部分相继出现mEppin基因的表达,mEppin基因在小鼠体内的这一表达模式与性成熟过程以及雄激素调节的精子生成和精子成熟过程相一致,说明mEppin基因的表达在一定程度上也受到雄激素的调节,雄激素受体基因敲除小鼠的研究证实了支持细胞上具有选择性受体的mEppin基因表达被下调(Denolet et al.,2006)。为进一步论证上述观点,本实验分别选取胚胎期、50日龄、90日龄雄性小鼠获得小鼠睾丸组织,提取总RNA后,采用实时荧光定量PCR检测mEppin基因mRNA表达水平,探究不同发育时期雄性小鼠睾丸组织mEppin基因mRNA的表达水平差异,为探究mEppin基因表达与功能提供一些基础数据。
1 材料方法 1.1 实验动物SPF级ICR小鼠来源于中国医学科学院医学生物研究所小动物实验部,实验动物生产许可证号:SCXK(滇)2010-0003。实验在中国医学科学院医学生物研究所小动物实验部进行,实验动物使用许可证号:SYXK(滇)2010-0007。动物实验由中国医学科学院医学生物学研究所动物实验伦理委员会审查通过,批准号为(2013)-008,同时按照实验动物使用的3R原则给予人道关怀。
1.2 试剂及仪器逆转录试剂盒(Transcriptor First Str and cDNA Synthesis Kit 04897030001),Roche公司;实时荧光定量PCR扩增试剂盒,SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(TaKaRa Code. DRR820A),PCR试剂(Premix TaqTM Code No. RR003A),TaKaRa生物有限公司;RNA助溶剂(RNAiso Plus Lot#AK8504),TaKaRa生物有限公司;TRizol试剂,InvitrogenTM公司。溴化乙锭(EB),美国Bio-Rad公司;西班牙Biowest琼脂糖。DNA分子量标准(DL 2 000 bp),TakaRa生物有限公司。CFX96 TouchTM荧光定量PCR仪,美国Bio-Rad公司;C1000 TouchTM PCR扩增仪,美国Bio-Rad公司;PowerPac Basic电泳仪,美国Bio-Rad公司;HITACHI CT15RE冷冻离心机,宝日医学生物技术(北京)有限公司;凝胶成像分析仪,美国Bio-Rad公司;ND-1000紫外分光光度计,美国DanoDrop公司;烘干箱,北京市光明医疗器械厂;超低温保存箱,中国海尔集团;SS-325高压蒸气灭菌箱,日本Tomy公司。
1.3 引物设计与合成引物设计根据NCBI提供的小鼠GAPDH基因的核苷酸序列(NM_008084)和mEppin基因的核苷酸序列(NM_029325.2),利用Primer 5.0软件设计实时荧光定量PCR引物(表 1),由宝生物工程(大连)有限公司合成。
| 基因Gene | 引物序列Primer sequence(5’-3’) | 扩增产物大小Product size/bp |
| m GAPDH | F:TGTGTCCGTCGTGGATCTGA | 150 |
| R:TTGCTGTTGAAGTCGCAGGAG | ||
| m Eppin | F:CTGCCCGAAGAAAGAGAAGTG | 127 |
| R:AAACCACCAACGACGAAAGTAAG |
分别取胚胎期、50日龄、90日龄雄性ICR小鼠各6只,共18只,按照不同发育时期分为3组,依次为胚胎组、50日龄组、90日龄组。其中,50日龄组、90日龄组小鼠分别于脱臼处死后立即取其两侧睾丸组织迅速放入液氮中冻存待用。胚胎期小鼠性别判定及胎鼠的获得:胚胎临产期小鼠雌雄不易区分,本实验采用随机统计方法随机统计怀孕雌鼠5只,统计雌鼠产下的小鼠雌雄比例,得到一组简单的实验数据,小鼠雌雄比例约为3∶ 4。取健康成年怀孕待产雌鼠,处死后剖开腹腔取出胚胎小鼠6只,选取各只胚胎小鼠后半段生殖器部位,迅速放入液氮冻存待用。
1.5 总RNA提取、浓度测定 1.5.1 总RNA提取将液氮中各发育阶段小鼠的睾丸组织0.1 g分别置于高压洁净的研钵中边加液氮边研磨成粉状,加入1 mL Trizol静置5 min,再继续充分研磨至液体澄清,取研磨后液体于1.5 mL离心管中,将离心管依次标号为胚胎组A1、A2、A3、A4、A5、A6,50日龄组B1、B2、B3、B4、B5、B6,90日龄组C1、C2、C3、C4、C5、C6,室温静置10 min。13 500 rmp、4 ℃离心10 min,取出离心管,取上清液,将上清液转移到另一洁净离心管中。再向各管中加入1 mL氯仿,上下颠倒震摇20次,静置15 min,13 500 rmp、4 ℃离心30 min,离心后取上清液于另一洁净的EP管中,等体积加入异丙醇,将管 中液体轻轻混匀,室温静置10 min,随后13 500 rmp、4 ℃离心10 min,弃上清液,得到RNA沉淀物,向得到的沉淀物中加入1 mL 75%乙醇,用枪头轻轻反复冲洗RNA沉淀,13 500 rmp、4 ℃离心5 min,弃上清液得到RNA沉淀,洗涤2次,适当晾干后加入DEPC处理水溶解得到的RNA提取物。
1.5.2 总RNA浓度测定及完整性检测分别取1 μL提取的RNA于核酸微量检测仪(ND-1000)测定总RNA的浓度。RNA在260 nm波长处有最大的吸收峰,利用260 nm波长分光测定RNA浓度,根据OD260/OD280的比值可以估计RNA的纯度。若比值低于1.8,说明有残余蛋白质存在,比值高于2.0,则提示RNA降解。将所提取的RNA于65 ℃预变性5 min,与6×loading buffer混匀,进行1.5%琼脂糖凝胶电泳,EB染色,电泳35 min后进行总RNA的完整性检测。
1.6 逆转录获得cDNA的第一链、PCR扩增、目的片段基因的序列测定及鉴定将各组小鼠睾丸组织总RNA浓度统一稀释为1 000 ng·μL-1。根据Roche第一链cDNA合成试剂盒Transcriptor First Str and cDNA Synthesis Kit说明书操作,制备cDNA第一链。以逆转录所获得的cDNA为模板进行各组mEppin基因及内参基因GAPDH的PCR扩增:反应体系为25 μL,分别加上、下游引物各1 μL(10 μM)、模板cDNA 2 μL、灭菌去离子水8.5 μL、Premix Ex Tag 12.5 μL。反应条件为:94 ℃预变性5 min;93 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,33个循环;72 ℃延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳后,在凝胶影像分析仪下观察所扩增的目的片段。将PCR产物送百泰克生物科技公司测序,测序结果使用ChromasPro软件进行碱基序列拼接,利用DNAMAN软件对目的基因核苷酸进行分析及鉴定。
1.7 实时荧光定量PCR反应检测体系的建立采用SYBR-Green法,以逆转录所获得的cDNA作为模板分别以mEppin基因上、下游引物及内参基因mGAPDH上、下游引物进行实时荧光定量PCR,同时以非逆转RNA、无模板作为对照。反应参数如下:在25 μL体系中加入下列试剂:上、下游引物各1 μL(10 μM),Nase Free dH 8.5 μL,SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)12.5 μL,模板cDNA 2 μL。阴性对照加入RNase free dH2O,阳性对照做2个重复。在CFX96 TouchTM荧光定量PCR仪上进行反应,反应条件为:95.0 ℃预变性30 s;95.0 ℃ 5 s,60.0 ℃退火30 s,40个循环;插入熔解曲线,荧光采集55.0 ℃~95.0 ℃,0.5 ℃0.05 s。
1.8 实时荧光定量PCR标准曲线及扩增效率将逆转录后得到的模板cDNA稀释。稀释因子为10,进行10倍倍比稀释,将模板稀释为100~10-4倍cDNA原液,即相当于1 000 ng·μL-1、 100 ng·μL-1、10 ng·μL-1、1 ng·μL-1、0.1 ng·μL-1 的稀释液,各取2 μL作为反应模板分别以mEppin基因引物及内参基因mGAPDH引物进行实时荧光定量PCR检测,建立标准曲线,以判断扩增效率,同时以RNA为反应模板,作为阴性实验对照,以验证有无基因组DNA。反应参数同上。
1.9 荧光定量PCR检测小鼠不同发育时期mEppin基因的表达差异及数据处理取不同发育时期睾丸组织的cDNA,通过上述检测体系进行实时荧光定量PCR检测,程序同上,每管重复2次,根据熔解曲线判断产物特异性。反应结束后通过CFX Manager软件自带公式计算出相关数据,导出各只小鼠mEppin基因和内参基因GAPDH、非逆转录对照、无模板对照的阈值循环C(t)、C(t)平均值、C(t)标准偏差值,以零点作为数据处理的相对对照,CFX Manager软件测定均一化后的mEppin基因倍数表达△△C(t),分析胚胎期小鼠、50日龄组和90日龄组小鼠mEppin基因表达差异,得出校正的相对定量值及标准偏差数据,GraphPad 6软件进行组间非配对t-检验分析。
2 实验结果 2.1 小鼠总RNA提取提取的总RNA样品经Nanodrop-1000超微量核酸测定仪测定,A260 nm/A280 nm值为1.8~2.0,说明纯度较高。从小鼠睾丸组织提取的总RNA进行电泳,结果可观察到见28S、18S、5S条带(图 1),表明所提取的总RNA无降解,可用于后续实验。
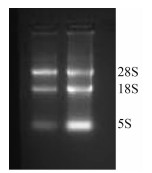
|
| 图 1 小鼠睾丸组织总RNA电泳图 Fig. 1 The electrophoresis of total RNA from the testis tissue of mice |
扩增出的PCR条带与预期片段大小一致。扩增PCR产物送生工(上海)生物工程有限公司进行单向测序,测序结果 与已报道的小鼠mEppin基因及 mGAPDH基因序列进行比对,鉴定为小鼠mEppin基因和mGAPDH基因。
2.3 实时荧光定量PCR扩增检测体系的建立通过实时荧光定量PCR反应,绘制出的熔解峰如图 2。mEppin基因及内参基因mGAPDH扩增特异性好,熔解峰单一。
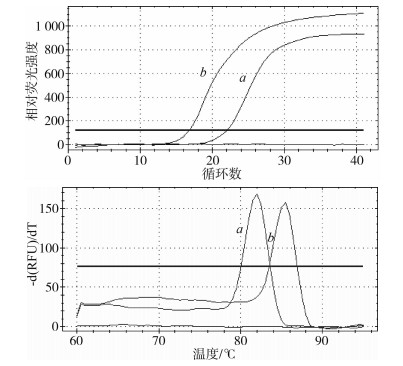
|
|
图 2 mEppim基因及mGAPDH基因实时荧光定量PCR反应
扩增曲线(上)及熔解曲线(下)
Fig. 2 The amplification curve (top) and melting curve (bottom) of
mEppim gene and mGAPDH gene in real-time fluorescent quantitative PCR
a. mEppin基因,b. mGAPDH基因。 a. mEppin gene,b. mGAPDH gene. |
反应结束后根据各稀释浓度的C(t)值,CFX Manager软件绘制出扩增曲线及标准曲线(图 3),结果显示mEppin基因扩增效率为95.6%,斜率接近-3.432,R2为0.993,mGAPDH基因扩增效率为111.5%,斜率为-3.073,R2为0.996,目的基因及内参基因扩增效率为80%~120%,扩增效率理想,同时,R2接近1,结果可信度较高,符合实时荧光定量PCR要求。

|
| 图 3 mEppim基因实时荧光定量PCR反应扩增曲线及标准曲线 Fig. 3 The amplication curve and standard curve of mEppim gene in real-time fluorescent quantitative PCR |
研究结果表明mEppin基因表达在小鼠睾丸组织中具有阶段特异性。实时荧光定量PCR结果显示:胚胎组小鼠(n=6)平均C(t)为30.21±0.09,50日龄组(n=6)的平均C(t)为23.63±0.23,90日龄组(n=6)的平均C(t)为23.75±0.19,内参基因在不同发育阶段表达恒定,胚胎组(n=6)、90日龄组(n=6)、50日龄组(n=6)的平均C(t)分别为19.33±0.08,22.17±0.40,20.76±0.18。CFX Manager软件分析测定 均一化后的mEppin基因倍数 表达△△C(t),软件内部公式计算得出校正的相对定量值及标准偏差数据显示:以零点作为对照,50日龄组的mEppin基因相对表达值为239.99±49.70,90日龄组的mEppin基因相对表达值为636.95±109.60,胚胎组小鼠中没有检测到mEppin基因表达,50日龄组和90日龄组中均检测到较高mEppin基因表达,90日龄组的相对表达值是50日龄组的2.65倍。GraphPad 6软件进行组间非配对t检验分析,结果表明,90日龄组与50日龄组相比,50日龄组与胚胎组相比,90日龄组与胚胎组相比差异均有统计学意义(P<0.05,图 4)。

|
|
图 4 mEppin基因在不同发育阶段小鼠的
睾丸组织中的相对表达量(n=6,x±s)
Fig. 4 The relative mRNA expression of mEppin gene in mice testis
tissues from different stages (n=6, x±s)
与胚胎组比, * P < 0.05; 与50日龄组比, # P<0.05。 Compared with the embryo group, * P < 0.05; compared with the 50 d-old group, # P < 0.05. |
本实验利用实时荧光定量PCR技术,检测不同发育阶段小鼠mEppin基因mRNA表达差异,为今后研究人类Eppin基因表达及开发Eppin蛋白作为男性避孕疫苗提供参考。引物设计参照NCBI的GenBank库的小鼠mEppin基因序列及mGAPDH基因序列,所扩增出的目的基因片段与设计的一致,经过直接测序及软件比对,鉴定得出所扩增片段为目的基因,为实时荧光定量PCR进行定量分析奠定基础。实验中通过加入内参基因GAPDH和非逆转RNA、无模板作为对照,使实验数据更具可靠性。样本数量每组6只,实时荧光定量PCR对实验中的每只小鼠都做了2个重复扩增,增加了结果的可靠性及可重复性。且通过CFX Manager软件对结果进行处理分析,获得基因相对表达水平。结果表明,90日龄组与50日龄组相比,50日龄组与胚胎组相比,90日龄组与胚胎组相比,mEppin基因的表达水平差异有统计学意义(P < 0.05)。
小鼠生长周期短、性成熟早、繁殖力强,雄性性成熟为45~60日龄,适配时期为65~90日龄,生育期为1年,本实验取材的各组小鼠处于不同发育阶段。由于取材限制,老年鼠没有获得,关于老年鼠的mEppin基因mRNA 表达还有待研究。本实验结果显示:不同发育阶段小鼠mEppin基因的mRNA表达水平差异明显,胚胎组小鼠中没有检测到mEppin基因的mRNA表达,50 日龄组和90日龄组中均检测到mEppin基因有较高表达,90日龄相对表达值是50 日龄的2.65倍。Long等(2011)的研究发现,出生后7 d的小鼠无mEppin基因的表达,12 d时能在Sertoli细胞检测到mEppin基因的表达,接下来发育过程中在各级生精细胞、精子细胞、成熟精子以及附睾的各个部分相继出现mEppin基因的表达。为了明确Eppin的表达与雄激素的关系,Willems等(2010)利用器官培养技术,将小鼠睾丸体外培养并给予酮康唑刺激,在发现雄激素分泌减少的同时,也检测到Eppin水平的下降;Lim等(2009)敲除 Sertoli细胞的雄激素受体DNA结合区域后也发现Eppin基因表达量的减少;Denolet等(2006)和Willems等(2010)将小鼠Sertoli 细胞特异性的雄激素受体敲除后均发现Eppin基因的转录水平明显下降;然而Schauwaers等(2007)在小鼠体内将雄激素选择性作用元件敲除的同时并使雄激素受体的表达量上调,此时Eppin基因的表达量无显著性改变。这些现象说明雄激素能在一定程度上调Eppin基因的表达,但是二者间的明确关系还有待进一步的验证。Eppin蛋白是雄性动物的一种精子活力蛋白,随着年龄增长,小鼠进入生殖期,Eppin基因mRNA表达增加。本实验的研究结果表明:随着雄性小鼠的性成熟,雄激素分泌进一步提升,mEppin基因mRNA表达进一步增强,提示小鼠睾丸组织的mEppin基因表达或在一定程度上受到雄激素的调节。
| 王增军, 吴宏飞, 钱立新, 等. 2006. 人类精子表面附睾蛋白激酶抑制剂Eppin和精囊凝固蛋白Semenogelin的相互作用研究[J]. 中华男科学杂志, 12(5): 428-431, 434. |
| Denolet E, De Gendt K, Allemeersch J, et al. 2006. The effect of a sertoli cell-selective knockout of the androgen receptor on testicular gene expression in prepubertal mice[J]. Molecular Endocrinology, 20(2): 321-334. |
| Lim P, Robson M, Spaliviero J, et al. 2009. Sertoli cell androgen receptor DNA binding domain is essential for the completion of spermatogenesis[J]. Endocrinology, 150(10): 4755-4765. |
| Long Y, Gu A, Yang H, et al. 2011. Distribution of Eppin in mouse and human testis[J]. Molecular Medicine Reports, 4(1): 71-75. |
| O'Rand MG, Widgren EE, Beyler S, et al. 2009. Inhibition of human sperm motility by contraceptive anti-eppin antibodies from infertile male monkeys: effect on cyclic adenosine monophosphate[J]. Biology of Reproduction, 80(2): 279-285. |
| O'Rand MG, Widgren EE, Sivashanmugam P, et al. 2004. Reversible immunocontraception in male monkeys immunized with eppin[J]. Science, 306(5699): 1189-1190. |
| O'Rand MG, Widgren EE, Wang Z, et al. 2006. Eppin: an effective target for male contraception[J]. Molecular and Cellular Endocrinology, 250(1-2): 157-162. |
| O'Rand MG, Widgren EE, Wang Z, et al. 2007. Eppin: an epididymal protease inhibitor and a target for male contraception[J]. Society of Reproduction and Fertility Supplement, 63: 445-453. |
| Richardson RT, Sivashanmugam P, Hall SH, et al. 2001. Cloning and sequencing of human Eppin: a novel family of protease inhibitors expressed in the epididymis and testis[J]. Gene, 270(1-2): 93-102. |
| Schauwaers K, De Gendt K, Saunders PT, et al. 2007. Loss of androgen receptor binding to selective androgen response elements causes a reproductive phenotype in a knockin mouse model[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(12): 4961-4966. |
| Sivashanmugam P, Hall SH, Hamil KG, et al. 2003. Characterization of mouse Eppin and a gene cluster of similar protease inhibitors on mouse chromosome 2[J]. Gene, 312: 125-134. |
| Willems A, De Gendt K, Allemeersch J, et al. 2010. Early effects of Sertoli cell-selective androgen receptor ablation on testicular gene expression[J]. International Journal of Andrology, 33(3): 507-517. |
 2016, Vol. 35
2016, Vol. 35



