扩展功能
文章信息
- 陈围, 杨承忠, 赵元莙
- CHEN Wei, YANG Chengzhong, ZHAO Yuanjun
- 碘泡虫属粘孢子虫分子进化及其与宿主协同关系的研究
- Molecular Evolution of Myxobolus (Myxosporea) and Coevolution with their Hosts
- 四川动物, 2016, 35(2): 183-189
- Sichuan Journal of Zoology, 2016, 35(2): 183-189
- 10.11984/j.issn.1000-7083.20150322
-
文章历史
- 收稿日期: 2015-10-16
- 接受日期: 2016-01-08
粘孢子虫Myxosporea是一类主要寄生于鱼类的寄生虫,迄今描述的种类已经超过2 200种(Kent et al.,2001;Canning & Okamura,2003;Lom & Dyková,2006;Whipps & Zhao,2015)。碘泡科Myxobolidae Bütschli,1882是粘孢子虫纲中最大的一科,碘泡虫属Myxobolus又是碘泡科中最大的一属,此属被报道的物种已有800多种(Eiras et al.,2005;Lom & Dyková,2006;Zhao et al.,2013)。该属的大多数物种拥有极为相似的形态结构,且宿主亲缘关系较近。以往仅依据形态结构鉴别物种,很容易造成物种鉴定上的误差和混乱。近年来分子系统学研究方法的引入对粘孢子虫分类学的发展起到了极为重要的促进作用。
现今,越来越多的学者将寄生虫与宿主种系发生趋势对照分析,构建宿主-寄生虫进化模式,从协同进化(coevolution)的角度来推测寄生虫的进化规律(Klimpel et al.,2007;Cavallero et al.,2011;Cecilia & Graciela,2015)。协同进化是宿主和寄生虫进化过程中共同存在的历史相关关系。二者通过2种可能的机制相互作用,即共物种形成(宏进化过程)和共适应(微进化过程)(Hoberg & Brooks,2008)。一些学者以DNA为分子标记研究寄生虫-宿主的种系发生(Nadler & Hudspeth,2000;Presa et al.,2002;Nadler et al.,2005;Klimpel et al.,2007;Cavallero et al.,2011;D’ Amelio et al.,2012;Cecilia & Graciela,2015),认为线粒体COⅠ基因构建的宿主系统树拓扑结构与寄生虫ITS基因构建的系统树拓扑结构 呈现一定的协同进化趋势(Cecilia & Graciela,2015)。
目前,用于粘孢子虫系统学研究的分子标记有18S rDNA,ITS-1,ITS-2,HSP70,28S rDNA(Andree et al.,1999;Whipps et al.,2004;Fiala,2006;Zhao et al.,2008)。粘孢子虫18S rDNA序列是至今为止GenBank中信息最为丰富的分子标记,因此在粘孢子虫种、属级阶元以及更高级阶元研究领域仍广泛应用。以18S rDNA为分子标记,学者们已对不同粘孢子虫的起源和系统进化问题进行了研究,解决了一些悬疑问题(Kent et al.,2001;Fiala,2006;Nesnidal et al.,2013;Zhao et al.,2013)。但是,以往学者们主要基于相关数据研究粘孢子虫类群本身的分类和进化,从粘孢子虫与其宿主协同进化的审视角度研究粘孢子虫的分子进化,则国内外尚未见报道。
基于上述研究现状,本研究整理了GenBank中碘泡虫属57个物种18S rDNA和相应宿主COⅠ基因序列,结合孢子形态特征、宿主、寄生部位、栖息地详细探讨了碘泡虫属物种间的分子进化规律,以期为粘孢子虫的分类学与发生学研究提供新的思路。
1 材料和方法1.1 数据收集在GenBank中获得129个碘泡虫属不同物种的18S rDNA序列,除去较短序列,剩余57个物种,序列信息见表 1;依据碘泡虫的相关数据获取寄生宿主COⅠ基因序列,序列信息见表 2。
| 编号 | 碘泡虫物种名 | GenBank 登录号 |
| 1 | 印纹碘泡虫 M. impressus | AF507970 |
| 2 | 小型碘泡虫 M. parviformis | AY836151 |
| 3 | 异囊碘泡虫 M. diversicapsularis | GU968199 |
| 4 | 盖尔碘泡虫 M. gayerae | DQ439809 |
| 5 | 似环碘泡虫 M. cycloids | DQ439810 |
| 6 | 基础碘泡虫 M. fundamentalis | KF515725 |
| 7 | 伍顿碘泡虫 M. wootteni | DQ231157 |
| 8 | 欧鲌碘泡虫 M. alburni | EU567313 |
| 9 | 红鲌碘泡虫 M. erythrophthalmi | KF515727 |
| 10 | 巨囊碘泡虫 M. macrocapsularis | AF507969 |
| 11 | 菲斯特碘泡虫 M. feisti | JN252487 |
| 12 | 穆勒碘泡虫 M. muelleri | AY325284 |
| 13 | 异型碘泡虫 M. dispar | AF507972 |
| 14 | 鲤肠碘泡虫 M. cyprinicola | DQ439805 |
| 15 | 鳃基碘泡虫 M. basilamellaris | AF507971 |
| 16 | 贝壳碘泡虫 M. musseliusae | FJ710801 |
| 17 | 住心碘泡虫 M. hearti | GU574808 |
| 18 | 倪李碘泡虫 M. nielii | JQ690358 |
| 19 | 产生碘泡虫 M. ticto | KJ476887 |
| 20 | 优雅碘泡虫 M. elegans | AF448445 |
| 21 | 丸本碘泡虫 M. marumotoi | AB873006 |
| 22 | 洪湖碘泡虫 M. honghuensis | KJ725074 |
| 23 | 瓶囊碘泡虫 M. ampullicapsulatus | KC425224 |
| 24 | 吴李碘泡虫 M. wulii | HQ613412 |
| 25 | 塔形碘泡虫 M. pyramidis | HQ613411 |
| 26 | 长孢碘泡虫 M. longisporus | AY364637 |
| 27 | 野鲤碘泡虫 M. koi | FJ841887 |
| 28 | 杂交鲮碘泡虫 M. mrigalhitae | KJ476879 |
| 29 | 孟加拉碘泡虫 M. bengalensis | KJ476883 |
| 30 | 罗卡特碘泡虫 M. rocatlae | KJ476878 |
| 31 | 匈牙利碘泡虫 M. hungaricus | AF448444 |
| 32 | 肥满碘泡虫 M. obesus | AY325286 |
| 33 | 斯特加碘泡虫 M. sitjae | JF311898 |
| 34 | 内膜碘泡虫 M. intimus | JN252486 |
| 35 | 杜氏碘泡虫 M. dujardini | DQ439804 |
| 36 | 阿瓦罗碘泡虫 M. alvarezae | FJ716097 |
| 37 | 似野结碘泡虫 M. tambroides | JX028236 |
| 38 | 伪异型碘泡虫 M. pseudodispar | AF380142 |
| 39 | 斯坦利碘泡虫 M. stanlii | DQ779996 |
| 40 | 肌肉碘泡虫 M. musculi | JQ388891 |
| 41 | 阿拉巴哈德碘泡虫 M. bhadrensis | KM029972 |
| 42 | 脑碘泡虫 M. cerebralis | EF370479 |
| 43 | 比萨塔碘泡虫 M. bizerti | AY129318 |
| 44 | 鳞上碘泡虫 M. episquamalis | KC733437 |
| 45 | 细微碘泡虫 M. exiguus | AY129317 |
| 46 | 町田碘泡虫 M. machidai | AB693054 |
| 47 | 素色碘泡虫 M. inornatus | JN896706 |
| 48 | 潘塔拉尔碘泡虫 M. pantanalis | KF296349 |
| 49 | 楔形碘泡虫(相似种) M. cf. cuneus | KP981637 |
| 50 | 丝状碘泡虫 M. filamentum | KJ849240 |
| 51 | 嗜神经碘泡虫 M. neurophilus | KF588564 |
| 52 | 培养碘泡虫 M. cultus | AB121146 |
| 53 | 透镜碘泡虫 M. lentisuturalis | AY119688 |
| 54 | 金色碘泡虫 M. aureus | KF296348 |
| 55 | 北方碘泡虫 M. arcticus | AB469993 |
| 56 | 转神经碘泡虫 M. neurotropus | DQ846661 |
| 57 | 神经碘泡虫 M. neurobius | AB469987 |
| 鱼类宿主物种名 | GenBank 登录号 |
| 鲤 Cyprinus carpio | JF442035 |
| 鲤 Cyprinus carpio | KJ553198 |
| 鲤 Cyprinus carpio | KF929811 |
| 东方欧鳊 Abramis brama | KM286419 |
| 欧白鱼 Alburnus alburnus | KM373683 |
| 赤梢鱼 Aspius aspius | KM286729 |
| 粗鳞鳊 Blicca bjoerkna | KJ553065 |
| 直纹石脂鲤 Brycon orthotaenia | HQ600814 |
| 稀鳞曲口鱼 Campostoma oligolepis | JN024833 |
| 鲫 Carassius auratus auratus | JQ319107 |
| 银鲫 Carassius gibelio | JQ319113 |
| 卡特拉鲃 Catla catla | JX887594 |
| 圆腹雅罗鱼 Leuciscus idus | KM286733 |
| 伊比利亚触须 Luciobarbus bocagei | KJ554052 |
| 小口黑鲈 Micropterus dolomieu | HQ557268 |
| 鲻鱼 Mugil cephalus | HQ024980 |
| 暗色沙塘鳢 Odontobutis obscura | JX679046 |
| 虹鳟 Oncorhynchus mykiss | FJ999165 |
| 斑石鲷 Oplegnathus punctatus | AP011066 |
| 河鲈 Perca flavescens | JX517165 |
| 异斑小鲃 Puntius ticto | JX181888 |
| 拟鲤 Rutilus rutilus | KM287069 |
| 巴西红点鲑 Salminus brasiliensis | GU701886 |
| 褐鳟 Salmo trutta | AM910409 |
| 赤睛鱼 Scardinius erythrophthalmus | KM287130 |
| 似野结鱼 Tor tambroides | KF240785 |
对57个碘泡虫属物种18S rDNA序列进行同源性比对,通过Clustal W程序按照缺省参数进行。序列经过比对和排列后,利用MEGA 4.0软件(Tamura et al.,2007)进行分析,计算碱基组成、变异位点、简约信息位点、转换数与颠换数的比值R(TS/TV),使用K2P模型计算遗传距离;利用BioEdit 7.0(Hall,1999)计算序列保守区。
1.3 碘泡虫属物种18S rDNA和宿主COⅠ基因的分子系统发育分析采用最大似然法(ML)和贝叶斯法(BI)对碘泡虫属物种构建18S rDNA系统发育树,以软孢子虫Tetracapsuloides bryosalmonae (KF731712)为外群;基于K2P模型对宿主物种COⅠ基因构建邻接(NJ)树。用Modeltest 3.7(Posada & Crandall,1998)计算获得序列最佳进化模型GTR+I+G。BI树在MrBayes 3.1.2软件(Ronquist & Huelsenbeck,2003)中构建,位点变异设置为invgamma分布,同时建立4条马尔科夫链,以随机树为起始树,共运行3 000 000代,每200代抽样一次。在舍弃老化样本后,根据剩余样本构建一致树。ML树在PAUP 4.0软件 中进行,选择100次重复抽样进行Bootstrap检验。NJ树在MEGA 4.0软件(Tamura et al.,2007)中进行。
2 结果 2.1 碘泡虫属物种18S rDNA序列特征57个碘泡虫属物种的18S rDNA对位分析获得比对位点共1 706个,变异位点(1 008)占59.1%,简约信息位点(857)占50.2%,自裔位点(149)占8.73%。平均碱基组成为A 26.3%,T 26.9%,C 19.1%,G 27.7%,AT含量(53.2%)高于GC含量(46.8%),表现出一定的AT组成偏向性。18S rDNA的R值为1.148,转换率稍大于颠换率。转换数(16.9)最高发生在T-C之间,颠换数(6.16)最高发生在G-C之间。
基于K2P模型计算碘泡虫属物种种间遗传距离矩阵显示,57个物种种间遗传距离在0.00~0.35(图 1),其平均遗传距离为0.16,淡水物种间遗传距离集中于0.01~0.20,广盐性物种间遗传距离集中于0.10~0.30,广盐性物种与淡水物种之间的遗传距离集中于0.15~0.35,大部分物种彼此间的遗传距离集中于0.10~0.15(26.4%)与0.20~0.25(34.0%)2个范围(图 1)。
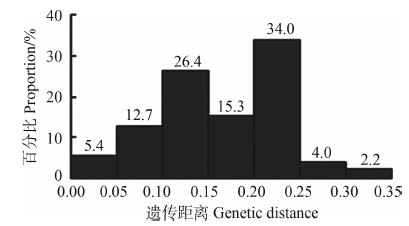
|
| 图 1 57个碘泡虫属物种基于18S rDNA的种间遗传距离分布 Fig. 1 The distribution of pairwise K2P genetic distance of inter-species based on 18S rDNA of fifty-seven species of Myxobolus spp. |
获得31个保守区,相比于淡水物种,广盐性物种的序列差异较大(图 2)。其中,脑碘泡虫M. cerebralis的碱基变异介于淡水物种与广盐性物种之间。相比于淡水物种,广盐性物种碱基变异非常集中且变异位点很大。
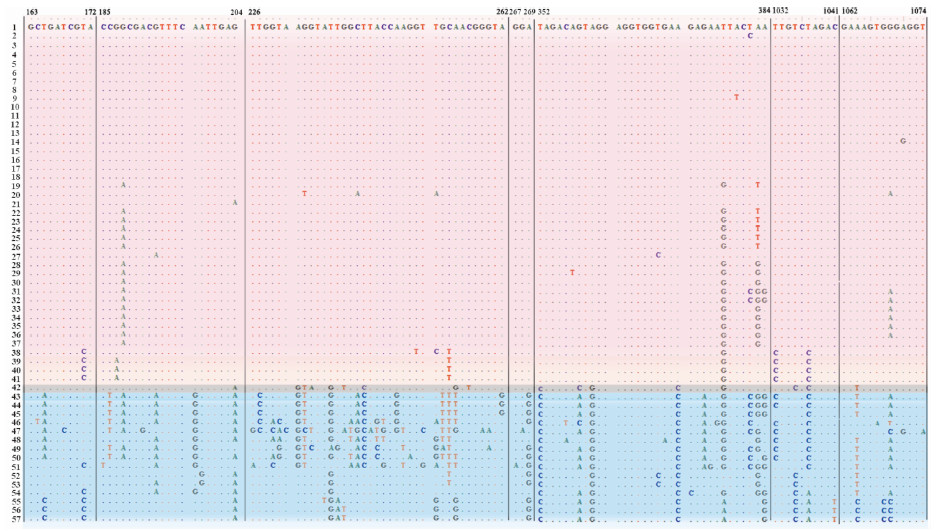
|
|
图 2 57个碘泡虫属物种18S rDNA保守区域变异位点
Fig. 2 Variable sites in conserved regions of 18S rDNA in fifty-seven species of Myxobolus spp.
小圆点代表相同位点,淡紫色、淡蓝色和灰色背景分别表示淡水物种、广盐性物种和脑碘泡虫; 数字编号代表与表 1对应的碘泡虫物种。 Matched siteswere represented by dots,the background of lavender,calamine blue and gray showed the species in freshwater,euryhaline waters and Myxobolus cerebralis,respectively; numbers indicated the corresponding Myxobolus spp. in table 1. |
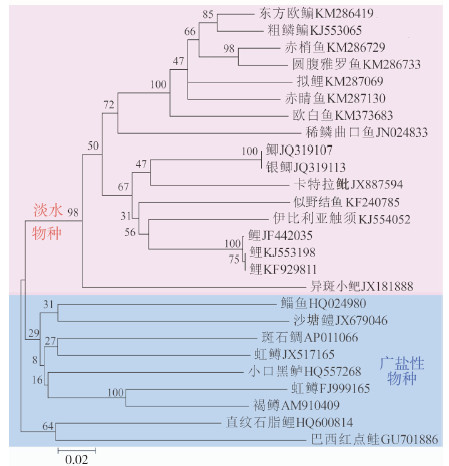
所构建的57个碘泡虫属物种18S rDNA的ML树和BI树均得到了较高的支持率,二者拓扑结构基本一致(图 3)。广盐性物种位于支序树的基部,与淡水物种分开且主要形成两大枝系。淡水物种主要分为A枝与B枝,脑碘泡虫独立成一小枝,A枝与B枝为姐妹枝。A枝中物种主要寄生于鳃和肠壁,该枝中大部分物种的孢子壳面观与极囊均似椭圆形,极囊前端突起很尖。其中巨囊碘泡虫M. diversicapsularis、异型 碘泡虫M. dispar、鳃基碘泡虫M. basilamellaris、贝壳碘泡虫M. musseliusae的两极囊表现为一大一小,产生碘泡虫M. ticto和优雅碘泡虫M. elegans孢子壳面观呈葵瓜子形,前端稍尖,极囊呈茄形。B枝中大多数物种寄生于鳃部,少部分物种寄生于肌肉,且大部分物种的孢子壳面观呈水滴状,前端稍尖,极囊细长且宽度较小。塔形碘泡虫M. pyramidis和肥满碘泡虫M. obesus孢子壳面观近圆形,前者前端稍盾,后者前端突起稍尖;杂交鲮碘泡虫M. mrigalhitae孢子壳面观呈不规则瓜子形且极囊一大一小;内膜碘泡虫M. intimus和似野结碘泡虫M. tambroides孢子壳面观饱满且呈椭圆形,前端突起稍尖。A+B枝中41个淡水物种对应的寄生宿主中绝大多数隶属于鲤科(体型较小)。广盐性水域的碘泡虫物种位于C枝与D枝中,其寄生部位较广泛,大多数物种孢子壳面观似葵瓜子形,前端稍盾,极囊宽大,约占整个孢子体积的2/3,其中比萨塔碘泡虫M. bizerti孢子壳面观近圆形,楔形碘泡虫(相似种)M. cf. cuneus和转神经碘泡虫M. neurotropus壳面观似瓜子形且宽度较小,神经碘泡虫M. neurobius孢子壳面观近椭圆形。

|
|
图 3 利用ML和BI法构建57个碘泡虫属物种18SrDNA支序列
Fig. 3 Phylogenetic tree based on the 18SrDNA sequences of fifty seven species of Myxobolus spp.
节点处数据值分别是ML/BI树的靴攀值,“_”号表明2种方法在此节点不一致,以BI为准;支序列前面选择的3个袍子壳面观标示每个支系大部分碘泡虫物种的形态,箭头指向的物种与该支系其他物种的袍子壳面观不一致;淡紫色和淡蓝色北京分别表示的是淡水物种和广盐性物种。 Numbers at the nodes were bootstrap confidence values resulting from ML/BI, "_"redlects minor differences between ML and BI ; The three frontal views of spores in the left of the tree showed the general morphology of Myxobolus in each branch, arrows pointed to the species were inconsistend with the other species of the same braches in frontal views; the background of leavender and calamine blue showed the species in freshwater and euryhaline water, respectively |
基于宿主COⅠ基因构建的NJ树(图 4)显示,广盐性物种首先从支序树中分化出来,聚于树的基部,淡水物种后分化并聚为一大枝,与碘泡虫的分子系统树所反映的进化趋势整体一致。差别在于虹鳟Oncorhynchus mykiss聚于广盐性物种枝系,与褐鳟Salmo trutta聚为一小枝,且淡水物种暗色沙塘鳢Odontobutis obscura也与广盐性物种聚为一枝。直纹石脂鲤Brycon orthotaenia与巴西红点鲑Salminus brasiliensis位于树的基部(图 4)。
|
|
图 4 基于K2P模型构建的碘泡虫宿主COⅠ支序树
Fig. 4 Neighbor-joining (NJ) analysis of Kimura 2-parameter (K2P) distance based on COⅠ sequences of the hosts of Myxobolus spp.
淡紫色和淡蓝色背景分别表示的是淡水物种和广盐性物种。 The background of lavender and calamine blue showed the species in freshwater and euryhaline waters, respectively. |
Stoeckle和Hebert(2008)认为,基因序列之间的分歧程度与物种的形成过程密切相关。本研究通过对57种碘泡虫的序列分析发现碘泡虫物种间的基因差异较明显,变异位点占序列组的59.1%,而简约信息位点占50.2%,显示碘泡虫各物种在相同的位点均可能发生过相同或不同程度的碱基替换。基于K2P模型计算的遗传距离值中约90%的遗传距离值在董江丽等(2011)报道的种间遗传距离(0.083~0.242)范围值之内。遗传距离值在0.00~0.05、0.25~0.35出现的频率只有6.2%,这种正态分布型的遗传距离分布与少数物种间亲缘关系较近或较远有关。广盐性物种与其他物种的遗传距离值相对较大,但淡水物种与广盐性物种之间在遗传距离上并不存在绝对的界限。
保守区内变异位点的不同显示淡水物种和广盐性物种的序列出现不同程度的变异(图 2)。除脑碘泡虫的变异介于淡水物种和广盐性物种间外,淡水物种与广盐性物种之间有较为明显的碱基差异,表明碘泡虫属物种在这两大生境中已产生了不同的适应性。
3.2 碘泡虫-宿主的系统发生与协同进化本研究显示碘泡虫属广盐性物种均先从支序树中分化出来,且与淡水物种分布于不同枝系,这与以往的研究基本一致(Fiala,2006;索栋,赵元莙,2010)。ML/BI树(图 3)中,碘泡虫属各物种表现为形态相似则聚枝的现象,即:孢子壳面观呈椭圆形的物种聚为A枝,孢子壳面观呈水滴状的物种聚为B枝,孢子壳面观似葵瓜子形的物种聚为C枝与D枝(图 3),呈3种不同的进化趋势。巨囊碘泡虫、异型碘泡虫、鳃基碘泡虫、贝壳碘泡虫、杂交鲮碘泡虫的孢子极囊一大一小,但孢子壳面观与对应的同一枝系的其他物种的形态一致;产生碘泡虫、优雅碘泡虫、塔形碘泡虫、肥满碘泡虫、内膜碘泡虫和似野结碘泡虫的孢子形态虽然与同一枝系的其他物种不太一致,但仍然聚为一枝,这可能与环境差异引起的近缘种的趋异进化有关。以往的工作已经显示碘泡虫属粘孢子虫具有一定的寄生特性与组织向性(Zhao et al.,2008)。虽然上述物种在支序树上出现一定程度不一致的现象,但均来自于淡水,大生境一致,聚为一大枝。
关于虹鳟的起源曾存在较大争议(刘澧津,1996)。新近的研究表明,虹鳟是一种发源于北太平洋的鲑科鱼类,现今已在全世界淡水中广泛养殖,历史上虹鳟应属于海水鱼类(Olsen et al.,2015)。本研究中宿主鱼类的系统发育分析也印证了这一点(图 4)。同时,寄生于虹鳟上的转神经碘泡虫在碘泡虫属18S rDNA构建的支序树中聚于广盐性枝系(图 3),这进一步证实了虹鳟起源于海水。但是,同是寄生于虹鳟的脑碘泡虫却聚在淡水枝系中。有研究表明,在宿主和寄生虫的协同关系中,宿主对寄生虫基因的影响是不容忽视的,且环境的改变对宿主-寄生虫系统的多样化和持久性是相当重要的(Brooks,1981;Brooks & McLennan,1993;Mattiucci,2006;Hoberg & Brooks,2008;Kuusela et al.,2009;Okamura et al.,2015)。由此,结合前述的保守区变异分析所显示的脑碘泡虫碱基变异界于淡水物种和广盐性物种之间的事实支持:海水起源的虹鳟在适应淡水过程中被脑碘泡虫寄生,两者经过长期的演化最终适应淡水环境。
本研究结果显示,淡水生活的暗色沙塘鳢聚于广盐性枝系(图 4),而其上寄生的丸本碘泡虫却聚在淡水枝系(图 3)。虽然有研究表明,鲈形目Perciformes鱼类绝大多数起源于海水(Cardenas et al.,2005;Giovannotti et al.,2007),但对于暗色沙塘鳢的 起源问题却未见报道。因此,暗色沙塘鳢及其寄生虫丸本碘泡虫在进化上的协同关系有待进一步研究。
综上,碘泡虫属物种与其宿主在进化中存在协同关系,这种关系主要体现在寄生虫和宿主基因组发生的适应性变化,且与寄生的时间起点、环境、寄生虫-宿主的进化模式具有相关性。粘孢子虫与宿主在长期的相互适应或双向的容纳和共存过程中,已经形成了特殊的关系,如宿主特异性和组织向性则是这种关系的具体表现,而这种关系即为协同进化关系,这在粘孢子虫纲动物类群中应是普遍存在的。
| 董江丽, 赵元莙, 唐发辉, 等. 2011. 黄颡单尾虫(粘体门,双壳目)的重描述及基于28S rDNA和ITS-5.8S序列的系统地位分析[J]. 动物分类学报, 36(1): 84-92. |
| 刘澧津. 1996. 虹鳟[J]. 水产学杂志, 9(1): 73-75. |
| 索栋, 赵元莙. 2010. 尼氏单极虫(粘体门, 双壳目)的重描述及基于18S rDNA的系统地位分析[J]. 动物分类学报, 35(1): 90-95. |
| Andree KB, EL-Matbouli M, Hoffman RW,et al. 1999. Comparison of 18S and ITS-1 rDNA sequences of selected geographic isolates of Myxobolus cerebralis[J]. International Journal for Parasitology, 29(5): 771-775. |
| Brooks DR, McLennan DA. 1991. Parascript: parasites and the language of evolution[M]. Washington: Smithsonian Institution Press: 57-69. |
| Brooks DR. 1981. Hennig's parasitological method: a proposed solution[J]. Systematic Zoology, 30: 229-249. |
| Canning EU, Okamura B. 2003. Biodiversity and evolution of the Myxozoa[J]. Advances in Parasitology, 56: 43-131. |
| Cardenas L, Hernandez CE, Poulin E, et al. 2005. Origin, diversification, and historical biogeography of the genus Trachurus (Perciformes: Carangidae)[J]. Molecular Phylogenetics and Evolution, 35(2): 496-507. |
| Cavallero S, Nadler SA, Paggi L, et al. 2011. Molecular characterization and phylogeny of anisakid nematodes from cetaceans from southeastern Atlantic coasts of USA, Gulf of Mexico, and Caribbean Sea[J]. Parasitology Research, 108(4): 781-792. |
| Cecilia D, Graciela G. 2015. Coevolution between Contracaecum (Nematoda, Anisakidae) and Austrolebias (Cyprinodontiformes,Rivulidae) host-parasite complex from SW Atlantic coastal basins[J]. Parasitology Research, 114(3): 913-927. |
| D' Amelio S, Cavallero S, Dronen NO, et al. 2012. Two new species of Contracaecum Railliet & Henry, 1912 (Nematoda: Anisakidae), C. fagerholmi n. sp. and C. rudolphii F from the brown pelican Pelecanus occidentalis in the northern Gulf of Mexico[J]. Systematic Parasitology, 81(1): 1-16. |
| Eiras JC, Molnár K, Lu YS. 2005. Synopsis of the species of Myxobolus Büchli, 1882 (Myxozoa: Myxosporea: Myxobolidae)[J]. Systematic Parasitology, 61(1): 1-46. |
| Fiala I. 2006. The phylogeny of Myxosporea (Myxozoa) based on small subunit ribosomal RNA gene analysis[J]. International Journal for Parasitology, 36(14): 1521-1534. |
| Giovannotti M, Cerioni PN, La Mesa M, et al. 2007. Molecular phylogeny of the three paedomorphic Mediterranean gobies (Perciformes: Gobiidae)[J]. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 308(6): 722-729. |
| Hall TA. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for windows 95/98/NT[J]. Nucleic Acids Symposium Series, 41: 95-98. |
| Hoberg EP, Brooks DR. 2008. A macroevolutionary mosaic: episodic host-switching, geographical colonization and diversification in complex host-parasite systems[J]. Journal of Biogeography, 35(9): 1533-1550. |
| Kent ML, Andree KB, Bartholomew JL, et al. 2001. Recent advances in our knowledge of the Myxozoa[J]. Journal of Eukaryotic Microbiology, 48(4): 395-413. |
| Klimpel S, Kleinertz S, Reinhold H, et al. 2007. Genetic variability in Hysterothylacium aduncum, a raphidascarid nematode isolated from sprat (Sprattus sprattus) of different geographical areas of the northeastern Atlantic[J]. Parasitology Research, 101(5): 1425-1430. |
| Kuusela J, Holopainen R, Meinila M,et al. 2009. Clonal structure of salmon parasite Gyrodactylus salaris on a coevolutionary gradient on Fennoscandian salmon (Salmo salar)[J]. Annales Zoologici Fennici, 46(1): 21-33. |
| Lom J, Dyková I. 2006. Myxozoan genera: definition and notes on taxonomy, life-cycle terminology and pathogenic species[J]. Folia Parasitologica, 53(1): 1-36. |
| Mattiucci S. 2006. Parasites as biological tags in population studies of demersal and pelagic fish species[J]. Parasitologia, 48: 23-25. |
| Nadler S, D'Amelio S, Murray D, et al. 2005. Molecular phylogenetics and diagnosis of Anisakis, Pseudoterranova, and Contracaecum from Northern Pacific marine mammals[J]. Journal of Parasitology, 91: 1413-1429. |
| Nadler S, Hudspeth DSS. 2000. Phylogeny of the ascaridoidea (Nematoda: Ascaridida) based on three genes and morphology: hypotheses of structural and sequence evolution[J]. Journal of Parasitology, 86(2): 380-393. |
| Nesnidal MP, Helmkampf M, Bruchhaus I, et al. 2013. Agent of whirling disease meets orphan worm: phylogenomic analyses firmly place Myxozoa in Cnidaria[J]. PLoS ONE, 8(1): e54576. |
| Okamura B, Gruhl A, Bartholomew JL. 2015. Myxozoan evolution, ecology and development[M]. Cham: Springer International Publishing. |
| Olsen AB, Hjortaas M, Tengs T, et al. 2015. First description of a new disease in rainbow trout Oncorhynchus mykiss (Walbaum) similar to heart and skeletal muscle inflammation (HSMI) and detection of a gene sequence related to Piscine Orthoreovirus (PRV)[J]. PLoS ONE, 10(7): e0131638. |
| Posada D, Crandall KA. 1998. Modeltest: testing the model of DNA substitution[J]. Bioinformatics, 14(9): 817-818. |
| Presa P, Pardo B, Martínez P, et al. 2002. Phylogeographic congruence between mtDNA and rDNA ITS markers in brown trout[J]. Molecular Biology and Evolution, 19(12): 2161-2175. |
| Ronquist F, Huelsenbeck JP. 2003. MrBayes 3: Bayesian phylogenetic inference under mixed models[J]. Bioniformatics, 9(12): 1572-1574. |
| Stoeckle MY, Hebert PDN. 2008. Barcode of life[J]. Scientific American, 299(4): 82-88. |
| Tamura K, Dudley J, Nei K, et al. 2007. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 24(8): 1596-1599. |
| Whipps CM, El-Matbouli M, Hedrick RP, et al. 2004. Myxobolus cerebralis internal transcribed spacer 1(ITS-1) sequences support recent spread of the parasite to north America and within Europe[J]. Diseases of Aquatic Organisms, 60: 105-108. |
| Whipps CM, Zhao YJ. 2015. Synopsis of the species of the genus Sphaeromyxa Thélohan, 1892 (Myxosporea: Bivalvulida: Variisporina: Sphaeromyxidae)[J]. Systematic Parasitology, 92(2): 81-99. |
| Zhao YJ, Li NN, Tang FH, et al. 2013. Remarks on the validity of Myxobolus ampullicapsulatus and Myxobolus honghuensis (Myxozoa: Myxosporea) based on SSU rDNA sequences[J]. Parasitology Research, 112(11): 3817-3823. |
| Zhao YJ, Sun CY, Kent ML, et al. 2008. Description of a new species of Myxobolus (Myxozoa: Myxobolidae) based on morphological and molecular data[J]. Journal of Parasitology, 94(3): 737-742. |
 2016, Vol. 35
2016, Vol. 35




