扩展功能
文章信息
- 陈敏, 王龙舞, 杨灿朝, 梁伟
- CHEN Min, WANG Longwu, YANG Canchao, LIANG Wei
- 广西弄岗家燕种群的卵胚胎心率
- Embryonic Heart Rate of Hirundo rustica in Nonggang, Guangxi
- 四川动物, 2016, 35(1): 93-96
- Sichuan Journal of Zoology, 2016, 35(1): 93-96
- 10.11984/j.issn.1000-7083.20150211
-
文章历史
- 收稿日期: 2015-06-17
- 接受日期: 2015-09-14
2. 贵州师范大学生命科学学院, 贵阳 550001
2. School of Life Sciences, Guizhou Normal University, Guiyang 550001, China
鸟类的卵胚胎心率随新陈代谢的增加而呈上升趋势(Pearson & Tazawa,1999)。一般认为温度、湿度和氧气是影响鸟类胚胎发育的重要因素(Romanoff & Romanoff,1967)。卵质量小的种类具有相 对较高的胚胎心率(Tazawa et al.,2001)。对种内的研究表明,在同等孵化条件下,相对于较小的卵,较大的卵的孵化进程减缓,孵化率降低(L and auer,1967)。
传统的鸟类卵胚胎心率的测量方法按是否对胚胎造成创伤分为侵入式和非侵入式两大类。侵入式测量法有在家鸡Gallus gallus的研究中使用过的心电描记法(electrocardiography)(Hiroshi & Hermann,1986),在崖沙燕Riparia riparia的研究中使用过的阻抗矫正器法(impedance-cardiography)(Tazawa et al.,1994);非侵入式测量法有在家鸽Columba domestica的研究中使用的心冲击描记图法(ballistocardiography)(Tazawa et al. ,1994)和在鸸鹋Dromaius novaeholl and iae研究中使用过的声音心电图法(acoustocardiography)(Tazawa et al.,2000)。近年发展起来的红外线胚胎心率测量仪是一种非侵入、 无创伤且能测量到胚胎发育早期心率的新技术,已在两栖爬行类和鸟类的胚胎发育研究中应用(Lierz et al.,2006;Aubret et al.,2013)。但国内有关鸟类卵胚胎心率的研究尚未见报道。为此,2014年4—7月,在广西弄岗地区我们利用红外胚胎心率测量仪对该地区家燕Hirundo rustica种群的卵胚胎心率进行了测量。
1 研究地区与研究方法 1.1 研究区概况野外研究地在广西壮族自治区弄岗地区(106°42′~107°04′E,22°13′~22°39′N),地跨龙州和宁明两县,由弄岗、陇呼和陇山相互隔离的3片林地组成,总面积10 077.5 hm2。属北热带季风气候,年均气温22 ℃,年降雨量1150~1550 mm,干、湿季明显,80%的降雨量集中在5—9月(杨岗等,2012)。
该区域以石灰岩山地居多,地形复杂,山峰林立。地带性植被为常绿阔叶林,另有农耕地、灌草丛、竹林和人工林等类型(黄俞淞等,2013)。
1.2 研究方法 1.2.1 鸟卵获取家燕在广西弄岗地区为当地常见的夏候鸟,每年3—7月为其繁殖期(周放,2011)。2014年4—7月,在该地区的居民区内寻找家燕巢。从发现巢开始进行跟踪观测其繁殖进展,观测到窝卵数不再增加的当天,从巢中随机选取1枚带回室内(n=15),测量后放入人工孵化器内孵化,待雏鸟孵出后将其放回原巢内由亲鸟喂养。所使用的小型孵化器为英国Brinsea公司生产,型号为Mini EX Digital Incubator。孵化条件按照多数小型雀形目鸟类设定,孵化温度为37.5 ℃±0.5 ℃,相对湿度为55%±5%,翻卵时间为45 min/r(Deeming,2002)。
1.2.2 卵胚胎心率测量对家燕在不同胚龄的卵分别进行心率测量,所使用的仪器为红外线胚胎心率测定仪(Buddy Digital Egg Monitor,Avitronics Inc.,Cornwall,Engl and ),单位为每分钟的心跳次数,记为BPM(beats per minute)(Edgar,2011)。胚胎心率测量从卵放入孵化器开始,为统一测量时间间隔(24 h)(Deeming,2002),同时为方便操作,我们将固定测量时间定在每天12∶ 00。将卵从孵化器取出,横向放置在心率仪的半球形凹槽上,待波形稳定后进行读数。心率测量后同时测量并记录该卵的质量。测量至卵孵出雏鸟为止。卵胚胎心率测量过程中,由于个体差异,个别胚胎在发育过程中有时会出现暂时无法测出胚胎心率的情况,因此样本量在整个测量过程中会出现波动(如第6天仅测出11枚卵)。由于工作地区供电不稳定,第11天有5枚卵因孵化器断电而导致胚胎死亡,孵化中断。
1.3 数据分析数据统计与分析在SPSS 16.0上进行。卵容量计算采用Hoyt(1979)的公式,即卵容量=卵长径×卵宽径2×0.52。个体的胚胎日均增长心率(daily growth of embryonic heart rate)以个体的逐日心率增长值之和除以孵卵天数来表示。卵胚胎心率和胚胎日均增长心率的单位为BPM(Edgar,2011)。数据均以平均值±标准差(Mean±SD)表示,采用Kolmogorov-Smirnov Test对数据的正态性进行检验,当数据符合正态分布时用Independent Sample T-Test和Pearson相关分析数据;当不符合正态分布时,则用Mann-Whitney U Test和Spearman相关。P<0.05表示差异有统计学意义,P<0.01表示差异有高度统计学意义,所有检验均为双尾(2-tailed)。
2 结果与分析共对15枚家燕的卵进行孵化,其中13枚发育,2枚未发育(未受精),样本量n=13。在孵化的第11天,由于工作地区供电不稳定,5枚卵因孵化器断电而导致胚胎死亡。弄岗地区的家燕卵胚胎心率第1~3天均为0,从第4天开始记录到卵胚胎心率。卵胚胎心率随孵化天数呈上升趋势,并在第13天达到最高值(280.5 BPM±23.0 BPM,t=3.855,P<0.01)。通过比较相邻2 d的卵胚胎心率均值(Day 2∶ Day 1,Day 3∶ Day 2,以此类推),家燕的卵胚胎心率在第6天和第13天时增长显著(Day 6∶ z=2.12,P=0.034;Day 13:z=3.855,P=0.002),第14天的 卵胚胎心率降低显著(t=-2.671,P=0.018)(表 1)。
| Day | n | Mean±SD/BPM | t/z | P |
| 1 | 13 | 0 | — | — |
| 2 | 13 | 0 | — | — |
| 3 | 13 | 0 | — | — |
| 4 | 13 | 56.0±92.0 | 2.123 | 0.034* |
| 5 | 13 | 120.7±90.6 | 1.507 | 0.132 |
| 6 | 11 | 195.2±38.6 | 2.12 | 0.034* |
| 7 | 13 | 201.3±53.0 | 0.696 | 0.487 |
| 8 | 13 | 212.1±59.9 | 1.309 | 0.191 |
| 9 | 11 | 223.5±32.0 | 0.145 | 0.885 |
| 10 | 11 | 230.3±26.4 | 0.395 | 0.693 |
| 11 | 8 | 260.3±55.8 | 1.408 | 0.192 |
| 12 | 8 | 226.3±32.5 | -1.489 | 0.164 |
| 13 | 8 | 280.5±23.0 | 3.855 | 0.002** |
| 14 | 8 | 252.0±19.6 | -2.671 | 0.018* |
| 15 | 8 | 243.4±19.7 | -0.878 | 0.395 |
| 注: * P<0.05, ** P<0.01; n为测量的卵数, t为Independent Sample T-test 检验结果,z为Mann-Whitney U Test检验结果。
Notes: * P<0.05, ** P<0.01; n was number of eggs measured, t was the result of Independent Sample T-test, z was the result of Mann-Whitney U Test. | ||||
家燕的卵胚胎心率日均增长为16.1 BPM±3.4 BPM,但与其卵容量和卵质量均不存在相关性(卵容量:1.74 cm3±0.08 cm3,Pearson相关:r=0.093,P=0.827;卵质量:1.51 g±0.09 g,Pearson相关:r=0.043,P=0.920)(图 1)。
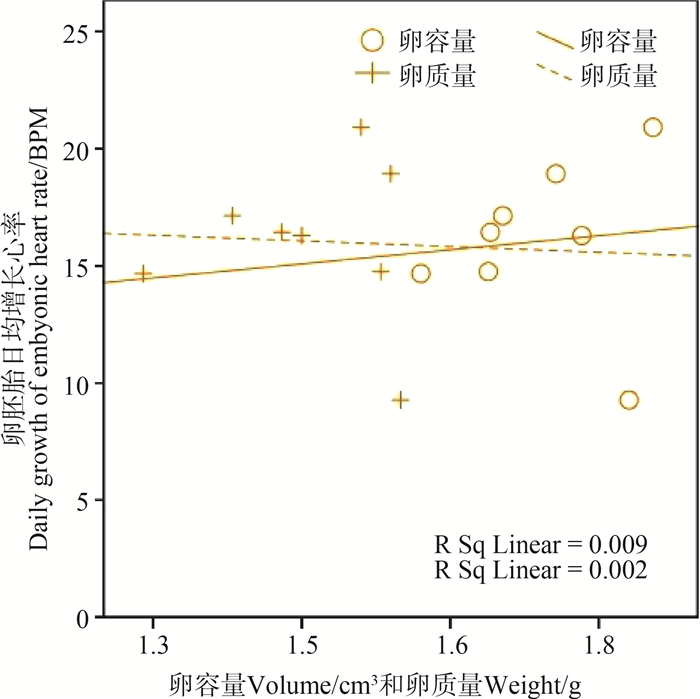
|
| 图 1 家燕卵胚胎日均增长心率与卵容量和卵质量的相关性 Fig. 1 Correlation between daily growth of embryonic heart rate and egg volume and weight in Hirundo rustica |
研究表明,广西弄岗地区家燕种群的卵胚胎心率第1~3天均为0,从第4天开始才出现胚胎心率。其胚胎心率总体随孵化期的增加呈上升趋势,并在第13天达到最高值。
有研究表明,鸟类的卵胚胎心率在前期和后期均出现高峰,而在两者的间期发育反而趋于平缓(Pearson et al. ,1999)。本研究对弄岗地区家燕卵胚胎心率的监测证实了这一点,其胚胎心率在前期与后期均出现增长高峰。家鸡的孵化期约为21 d,在第12天副交感神经开始作用于心脏(Leg and e et al.,1966;Pappano,1975;Kirby & Stewart,1986),其对心脏的抑制作用导致心率降低(Höchel et al.,1998;Moriya et al.,2000)。家燕的孵化期约为15 d,在孵化中后期心率的波动也许与此类似。
鸟类身体大小和卵容量正相关,和心率负相关,体型小的鸟类具有相对较高的心率(郑光美,2012),胚胎阶段的研究也是类似状况(Tazawa et al. ,2001)。但种内研究却表明卵胚胎心率的改变与胚胎质量增加不存在显著相关(Tazawa et al.,1988,1998,2000)。胚胎质量与卵质量、卵容量显著正相关(Shanawany,1987;Mortola & Awama,2010),而胚胎心率改变与卵质量、卵容量不存在显著相关。本研究结果再次验证了这一点,即家燕的卵胚胎心率与其卵质量、卵容量无相关性。
致谢: 广西大学周放教授、蒋爱伍博士对本研究提供大力支持和帮助;弄岗村农建酬一家为野外工作提供生活条件和方便;黄秋丽、胡运高协助野外工作,谨致谢意!| 黄俞淞, 吴望辉, 蒋日红, 等. 2013. 广西弄岗国家级自然保护区植物物种多样性初步研究[J]. 广西植物, 33(3): 346-355. |
| 杨岗, 陆舟, 余辰星, 等. 2012. 广西弄岗穂鹛不同季节的觅食地选择[J]. 动物学研究, 33(5): 433-438. |
| 郑光美. 2012. 鸟类学[M]. 北京: 北京师范大学出版社. |
| 周放. 2011. 广西陆生脊椎动物分布名录[M]. 北京: 中国林业出版社. |
| Aubret F. 2013. Rates increase after hatching in two species of Natricinae snakes[J]. Scientific Reports, 3: 3384. |
| Deeming DC. 2002. Avian incubation: behaviour, environment, and evolution[J]. The Auk, 119(4): 1210-1211. |
| Edgar JL, Lowe JC, Paul ES, et al. 2011. Avian maternal response to chick distress[J]. Proceedings of the Royal Society B: Biological Sciences, 278(1721): 3129-3134. |
| Hiroshi T, Hermann R. 1986. Tolerance of chick embryos to low temperatures in reference to the heart rate[J]. Comparative Biochemistry and Physiology Part A: Physiology, 85(3): 531-534. |
| Hoyt DF. 1979. Practical methods of estimating volume and fresh weight of bird eggs[J]. The Auk, 96(1): 73-77. |
| Höchel J, Akiyama R, Masuko T, et al. 1998. Development of heart rate irregularities in chick embryos[J]. American Journal of Physiology-Heart and Circulatory Physiology, 275(2): H527-H533. |
| Kirby ML, Stewart DE.1986. Development of ANS innervation to the avian heart[M]// Gootman PM. Developmental Neurobiology of the Autonomic Nervous System. NY: Humana Press: 135-158. |
| Landauer W. 1967. The hatchability of chicken eggs as influenced by environment and heredity[R]. Storrs Agricultural Experiment Station. |
| Legande MC, Paff GH, Boucek RJ.1966. Initiation of vagal control of heart rate in the embryonic chick[J]. The Anatomical Record, 155(2): 163-166. |
| Lierz M, Gooss O, Hafez HM. 2006. Noninvasive heart rate measurement using a digital egg monitor in chicken and turkey embryos[J]. Journal of Avian Medicine and Surgery, 20(3): 141-146. |
| Moriya K, Pearson JT, Burggren WW, et al. 2000. Continuous measurements of instantaneous heart rate and its fluctuations before and after hatching in chickens[J]. Journal of Experimental Biology, 203(5): 895-903. |
| Mortola JP, Awama KA. 2010. Growth of the chicken embryo: implications of egg size[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 156(4): 373-379. |
| Pappano AJ.1975. Development of autonomic neuroeffector transmission in the chick embryo heart[M].// Lieberman M, Sano T. Developmental and physiological correlates of cardiac muscle. New York: Raven Press: 235-248. |
| Pearson JT, Tazawa H. 1999. Ontogeny of heart rate in embryonic and nestling crows (Corvus corone and Corvus macrorhynchos)[J]. Journal of Comparative Physiology B, 169(4-5): 256-262. |
| Pearson JT, Noma Y, Tazawa H. 1999. Developmental patterns of heart rate in altricial avian embryos and hatchlings[J]. Journal of Experimental Biology, 202(11): 1545-1550. |
| Romanoff AL, Romanoff AJ. 1967. Biochemistry of the avian embryo: a quantitative analysis of prenatal development[M]. New York: Interscience Publishers. |
| Shanawany MM. 1987. Hatching weight in relation to egg weight in domestic birds[J]. World's Poultry Science Journal, 43(2): 107-115. |
| Tazawa H, Ar A, Gefen E, et al. 1998. Effects of incubator humidity on embryonic heart rate in the ostrich[C]. Jerusalem: In Proceedings of the 10th European Poultry Conference: 843-847. |
| Tazawa H, Ar A, Moriya K, et al. 2000. Embryonic heart rate measurements during artificial incubation of emu eggs[J]. British Poultry Science, 41(1): 89-93. |
| Tazawa H, Nakazawa S, Okuda A, et al. 1988. Short-term effects of altered shell conductance on oxygen uptake and hematological variables of late chicken embryos[J]. Respiratory Physiology, 74(2): 199-209. |
| Tazawa H, Pearson JT, Komoro T, et al. 2001. Allometric relationships between embryonic heart rate and fresh egg mass in birds[J]. Journal of Experimental Biology, 204(1): 165-174. |
| Tazawa H, Watanabe W, Burggren WW. 1994. Embryonic heart rate in altricial birds, the pigeon (Columba domestica) and the bank swallow (Riparia riparia)[J]. Physiological Zoology, 67(6): 1448-1460. |
 2016, Vol. 35
2016, Vol. 35




