扩展功能
文章信息
- 胡媛媛, 莫春横, 王亚军, 李娟
- HU Yuanyuan, MO Chunheng, WANG Yajun, LI Juan
- 家鸡G蛋白偶联受体78基因的克隆与组织表达图谱分析
- Molecular Cloning and Tissue Expression of Chicken GPR78 Gene
- 四川动物, 2016, 35(1): 52-57
- Sichuan Journal of Zoology, 2016, 35(1): 52-57
- 10.11984/j.issn.1000-7083.20150178
-
文章历史
- 收稿日期: 2015-05-12
- 接受日期: 2015-09-14
G蛋白偶联受体(G protein-coupled receptor,GPCR)是一大类膜受体的统称,是指和GTP结合蛋白偶联,存在于细胞表面,由单条多肽链经过7次跨膜而形成的受体(Marchese et al., 1998;徐雪等,2014),在信号传导过程中起关键的调控作用(Fredriksson & Schioth,2005)。目前在人类基因组中,有超过2%的基因可用来编码G蛋白偶联受体(Marchese et al., 1998)。GPCR是目前已知的细胞表面最大的受体超家族。根据其序列相似性以及与配基的结合情况,共分为5 个亚家族。它们分别是:A族——似视紫红质(rhodopsin-like)受体、B族——似胰泌素(secretin-like)受体、C族——亲代谢性谷氨酸盐和信息素(metabotropic glutamate/ pheromone)受体、D族——真菌信息素(fungal pheromone)受体和E族——cAMP受体(cAMP receptor)(Schertler et al., 1993;Unger et al., 1997;Palczewski et al., 2000;Kobilka,2007;Kobilka & Deupi,2007)。这些GPCR受体的共同点是在其高级结构中,均具有7个跨膜α螺旋、C末端、3个胞外环(ECL1~ECL3)以及3个胞内环(ICL1~ICL3)。N末端在胞外,常被糖基化。C末端在胞内,多表现为磷酸化。7个跨膜的α螺旋反复穿过细胞膜脂双层。在受体肽链的C端和连接第5个和第6个跨膜螺旋的胞内环上都有G蛋白结合位点。
GPCR的7个跨膜疏水区有很高的保守性,而N端、C端和跨膜结构域之间的连接区保守性相对较低。不同种类的配体在GPCR上的结合位点也不相同。小分子配体主要结合在GPCR的7个α螺旋跨膜结构围成的疏水区;肽段和GPCR受体蛋白质结合的区域则位于N端结构域和胞外的亲水环(Rohrer & Kobilka,1998;Kobilka,2007)。GPCR能与细胞外的多种配体相结合,激活细胞内一系列信号通路,从而调控多种生理反应;GPCR信号通路是多种药物的作用靶点(Tautermann et al., 2015),尤其是许多癌症与肿瘤的治疗途径(Xing et al., 2011)。目前,与GPCR结合的配体,包括核酸、生物胺、多肽、激素、神经递质、趋化因子等(Marchese et al., 1998)。这些配体可以是糖类、脂质、多肽等小分子,也可以是蛋白质大分子。一些特殊的GPCR也可被非化学性的刺激源激活,例如在感光细胞中的视紫红质可以被光所激活。虽然不同类型GPCR受体间的基因序列没有高的同源性,但所有GPCR均具有类似的结构和信号转导机制(Brown et al., 2003)。
GPR78是GPCR受体超家族中的孤儿型受体。目前,对于GPR78的信号通路及其配体的研究几属空白(Lee et al., 2000,2001)。在哺乳动物中,针对GPR78的结构以及组织表达已做初步研究。据报道,人GPR 78 cDNA全长1092 bp,编码具363个氨基酸的受体蛋白(Lee et al., 2000,2001;Underwood et al., 2006;Jones et al., 2007)。GPR 78 的mRNA主要在脑和垂体中表达。同时,亦有研究结果提示GPR 78 可能参与下丘脑-垂体-肾上腺轴的调节、孕期调控(Herman et al., 1996;Underwood et al., 2006)、情感控制(Altamura et al., 1999;Rybakowski & Twardowska,1999;Pariante & Miller,2001)、脑发育调节等(Jones et al., 2007)。
鉴于GPR 78 基因在非哺乳类脊椎动物中的研究尚属空白,因此,本研究克隆了家鸡GPR 78 基因的编码序列,解析了该基因的结构;同时,亦对GPR 78 基因在家鸡各组织中的表达情况进行了探究。
1 材料与方法1.1 材料与试剂1.1.1 材料分别取8月龄性成熟的公鸡/母鸡的各组织放入液氮中速冻,并保存于-80 ℃超低温冰箱。
1.1.2 试剂与耗材高保真PCR扩增所用的KOD-Fx DNA聚合酶、pTA2连接的10×A-attachment Mix购自TOYOBO公司;引物合成由成都华大基因公司提供;各种限制性内切酶、T4 DNA 连接酶、Eazy-Taq DNA聚合酶、dNTP、反转录酶等购自TaKaRa公司;总RNA提取用TRIzol Reagent购自Invitrogen公司;宿主菌Eschericha coli DH5α由本实验室制备保存;测序工作由北京华大六和股份有限公司完成;DNA纯化胶回收试剂盒购自上海生工有限公司。
1.2 组织RNA提取取家鸡全脑、垂体、心脏、肝脏、精巢、脾脏、肾脏、肺、小肠、胰腺、卵巢和肌肉共12种组织,迅速放入液氮中速冻,并在液氮中充分研磨;将磨碎组织加入到TRIzol-reagent中混合均匀,然后用氯仿提取,4 ℃冷冻离心(10 000 r/min,15 min),吸取上清液,再加入异丙醇,混匀后4 ℃冷冻离心(10 000 r/min,8 min),弃上清;用70%乙醇漂洗沉淀2次,弃上清,最后用DEPC-H2O溶解RNA沉淀。
1.3 RNA反转录以家鸡组织总RNA为模板,按逆转录试剂盒操作说明进行cDNA第一条链合成。反转录总体积10 μL,RNA模板2 μg,Oligo-dT 1 μL(终浓度0.5 μg·μL-1),加DEPC-H2O补足至5 μL,70 ℃加热10 min,取出后冰浴2 min,然后加入5×第一条链合成缓冲液2 μL,dNTPs 0.5 μL(终浓度2 mM),MMLV逆转录酶(200 U·μL-1)0.5 μL,放入PCR仪中42 ℃孵育1.5 h,70 ℃加热10 min。反应产物用DEPC-H2O稀释至40 μL作为cDNA模板使用。
1.4 引物设计依据预测的家鸡GPR 78 基因序列和已知β-actin基因序列,设计特异性引物,扩增cDNA序列或检测其组织表达(表 1)。
| 基因 Gene | 引物名称 Primer name | 上游引物/下游引物 Sense/Antisense | 序列5’-3’ Sequences | 序列长度Length/bp |
| GPR78 | GPR78rU1
GPR78rL1 | Sense
Antisense | CGCTAAGAGATGGACTTGGCA
CTTGAAGGGGAGTGCTTGTCA | 1055 |
| GPR78(RT-PCR) | GPR78U1
GPR78L1 | Sense
Antisense | TCACTCCACCAGTTTCATGCT
GTGTCAAGAGAGCTGTTGTAC | 459 |
| β-actin | Actin-F1
Actin-R1 | Sense
Antisense | TGTGCTACGTCGCACTGGAT
GCTGATCCACATCTGCTGGA | 401 |
以2 μL脑组织cDNA为模板进行PCR扩增,具体方法参照本实验室已有体系(何夏萍等,2013;张彦等,2014)。PCR反应体系为10 μL,其中:2×KOD缓冲液5 μL,DNA模板1 μL,dNTPs 2 μL(终浓度2 mM),上下游引物(GPR78rU1/rL1)各0.1 μL(终浓度20 μM),KOD-Fx聚合酶(1 U·μL-1)0.5 μL,DMSO 0.6 μL,用MilliQ-H2O补足10 μL。反应条件:94 ℃预变性2 min;98 ℃10 s,56 ℃退火30 s,68 ℃延伸80 s,33个循环;最后72 ℃延伸20 min。取3 μL产物用1%琼脂糖凝胶电泳跑胶检测PCR反应结果。
由于KOD-Fx聚合酶所扩增的PCR产物为平末端,因此将PCR扩增产物进行3’末端加A,然后与pTA2载体进行4 ℃过夜连接。连接体系为5 μL:加A产物1.5 μL,pTA2载体0.5 μL,连接酶0.5 μL,10×连接缓冲液0.5 μL。按常规方法转化感受态细胞,再涂于含氨苄青霉素、IPTG和X-Gal的LB培养基上37 ℃过夜培养。分别进行菌落PCR筛选、重组质粒的提取及酶切鉴定。挑选3个阳性克隆进行序列测定(由北京华大生物科技发展有限公司完成)以确定每个基因的cDNA序列。
1.6 家鸡GPR 78 基因的组织表达图谱分析采用GPR 78 基因的RT-PCR引物U1/L1来检测GPR 78 基因在家鸡12种组织中的特异性表达(表 1)。PCR反应总体系为10 μL:组织cDNA模板2 μL;10×Easy-Taq缓冲液1 μL;dNTPs 0.2 μL(终浓度2 mM);上下游引物各0.1 μL(终浓度 20 μM);Easy-Taq聚合反应条件:94 ℃预变性2 min; 94 ℃30 s,56 ℃退火30 s,72 ℃延伸30 s,33个扩增循环;最后72 ℃延伸10 min。PCR反应结束后,取3 μL PCR产物用2%的琼脂糖凝胶进行电泳检测。
2 结果与分析2.1 家鸡GPR 78 基因cDNA的克隆与序列分析以家鸡脑组织cDNA为模板,采用引物(GPR78rU1+rL1)进行PCR扩增,得到长度大小约为1000 bp的条带(图 1),与预期大小一致。
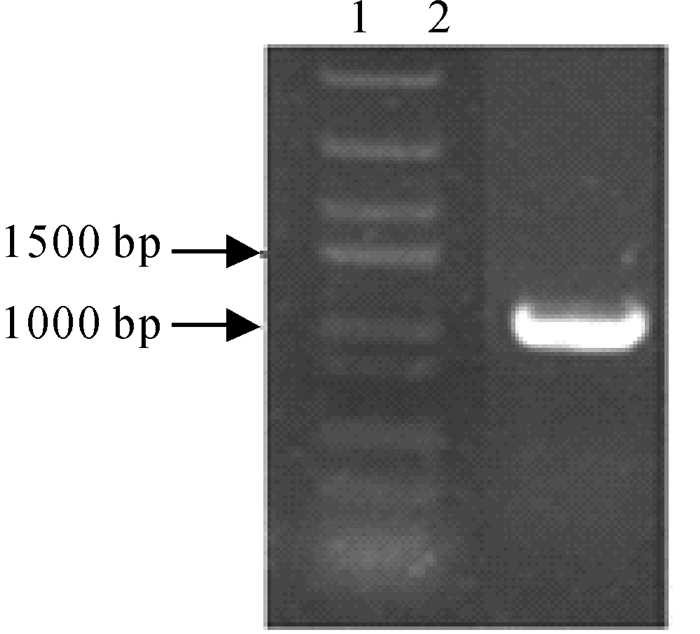 |
| 图 1 家鸡GPR 78 基因PCR扩增 Fig. 1 PCR amplification of chicken GPR 78 gene1. DNA Marker,2. GPR 78 的PCR扩增产物。 1. DNA Marker,2. PCR amplification product of chicken GPR 78. |
通过克隆得到家鸡GPR 78 基因的完整编码序列。该序列长1020 bp,含3个外显子,可编码339个氨基酸(图 2);与其他GPCR一样,家鸡GPR 78 也含7次跨膜区(图 2)。胞外N端的氨基酸残基数目少,且缺乏糖基化位点。通过与家鸡基因组序列比对发现,GPR 78 位于家鸡4号染色体上。此外,家鸡GPR78与火鸡(Accession No.:XM_010710491)、夜鹰(Accession No.:XM_010163602)和人(Accession No.:AY359107)的GPR78在氨基酸水平上分别享有99.41%,97.94%和51.79%的序列一致性(图 3)。此结果表明:GPR78在鸟类中具有高保守性;而鸟类与人GPR78的同源性则较低。
 |
| 图 2 家鸡GPR 78 基因的核苷酸和氨基酸序列 Fig. 2 The nucleotide and amino acid sequence of chicken GPR 78方框为受体7次跨膜区。
The putative 7 transmembrane domains were boxed. |
 |
| 图 3 家鸡GPR78(cGPR78)与火鸡(tGPR78)、夜鹰(nGPR78)、人(hGPR78)GPR78的氨基酸序列比对 Fig. 3 Amino acid sequence alignment of chicken GPR78(cGPR78)with that of turkey(tGPR78),nighthawk(nGPR78) and human(hGPR78) |
采用RT-PCR方法初步检测了GPR 78 基因在家鸡组织中的表达情况:其在脑组织中的表达量最高,在垂体中也有表达,并且目的条带的大小为459 bp,与预期的一致;而在其他外周组织中,均未检测到PCR信号(图 4)。
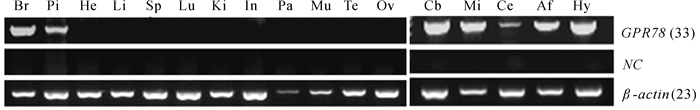 |
| 图 4 RT-PCR检测GPR 78 在家鸡组织中的表达情况 Fig. 4 RT-PCR detection of GPR 78 expression in chicken tissuesBr. 大脑,Pi. 垂体,He. 心脏,Li. 肝脏,Sp. 脾脏,Lu. 肺,Ki. 肾,In. 小肠,Pa. 胰腺,Mu. 肌肉,Te. 精巢,Ov. 卵巢,Cb. 大脑,Mi.中脑,Ce. 小脑,Af. 后脑,Hy. 下丘脑; NC. 负对照; 括号内数字示PCR循环数。
Br. brain,Pi. pituitary,He. heart,Li. liver,Sp. spleen,Lu. lung,Ki. kidney,In. small intestine,Pa. pancreas,Mu. muscle,Te. testis,Ov. ovary,Cb. cerebrum,Mi. midbrain,Ce. cerebellum,Af. afterbrain,Hy. hypothalamus; NC,negative control; number in bracket indicated the PCR cycle number. |
此外,GPR 78 基因也在家鸡脑各功能区域(包括大脑、中脑、小脑、后脑和下丘脑)均有表达。其中,在大脑、中脑、后脑和下丘脑中,检测到较强的PCR信号,暗示GPR 78 在这些区域具较高表达水平;而在小脑中,仅检测到微弱的PCR信号,提示GPR 78 在小脑中的表达水平相对较低(图 4)。
3 讨论GPR78作为GPCR的成员之一,也属7次跨膜受体。但目前对GPR78的配体、信号通路及功能报道极少(Lee et al., 2000,2001)。本研究成功从家鸡中克隆了GPR 78 基因编码区cDNA序列,它可编码1个具有339个氨基酸残基的7次跨膜受体。家鸡GPR78分别与火鸡、夜鹰和人的GPR78享有99.41%,97.94%和51.79%的同源性。此结果说明GPR78在鸟类中具高保守性。
最初,GPR78被鉴定出来是因为它是GPR26的旁系同源物(Paralog)。GPR26受体在人和大鼠中都得到了初步解析(Lee et al., 2000,2001;Underwood et al., 2006)。哺乳动物GPR78与GPR26具有高达49%的序列一致性,且两者在跨膜区(TM区)的一致性甚至高达56%(Lee et al., 2000;Underwood et al., 2006); GPR78与GPR26具有相同的内含子-外显子结构,它们胞外N端氨基数目都很少且缺乏糖基化位点,在它们的第6和第7个跨膜区,也均具有精氨酸和赖氨酸残基位点(Lee et al., 2000;Underwood et al., 2006)。与哺乳动物中类似,家鸡GPR78与GPR26也具有较高同源性和相似结构特征(图 5)。此外,已有报道显示GPR78与GPR26均能引起胞内cAMP的上调(Lee et al., 2001;Jones et al., 2007)。这些相似结构与功能特征均暗示GPR78与GPR26可能具有相同的配体(Lee et al., 2000;Underwood et al., 2006)以及相似的胞内信号通路(Underwood et al., 2006),但该假设尚待证实。
 |
| 图 5 家鸡GPR 78 与GPR 26 基因的氨基酸序列比对 Fig. 5 Amino acid sequence alignment of chicken GPR 78(cGPR78) and GPR 26(cGPR26)横线为7次跨膜结构域。
The seven transmembrane domains were indicated by horizontal lines. |
此外,本研究亦发现GPR 78 mRNA主要在家鸡脑和垂体中表达。该结果与哺乳动物GPR78的表达图谱相似(Lee et al., 2000;Jones et al., 2007)。GPR 78 在鸡垂体和下丘脑中表达(图 4)也暗示,与哺乳动物类似,GPR78可在家鸡下丘脑-垂体轴上发挥功能(Herman et al., 1996;Altamura et al., 1999;Rybakowski & Twardowska,1999;Pariante & Miller,2001),或参与脑的发育与功能调节。然而该推论尚待验证。家鸡GPR 78 基因的克隆与组织表达图谱分析为后续探究其在脊椎动物中的生理功能奠定基础。
| 何夏萍, 周彦妮, 阎振鑫, 等. 2013. 猪黑皮质素受体3和4基因克隆及分析[J]. 四川大学学报 (自然科学版), 50(4): 899-907. |
| 徐雪, 张剑南, 张耀荣, 等. 2014. 猪GPR84基因克隆和组织表达图谱分析[J]. 四川大学学报 (自然科学版), 51(5): 1079-1084. |
| 张彦, 于晓婕, 李娟, 等. 2014. 家鸡卵清蛋白基因调控序列克隆与分析[J]. 四川大学学报 (自然科学版), 51(3): 609-614. |
| Altamura AC, Boin F, Maes M. 1999. HPA axis and cytokines dysregulation in schizophrenia: potential implications for the antipsychotic treatment[J]. European Neuropsychopharmacology, 10(1): 1-4. |
| Brown AJ, Goldsworthy SM, Barnes AA, et al. 2003. The Orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids[J]. The Journal of Biological Chemistry, 278 (13): 11312-11319. |
| Fredriksson R, Schioth HB. 2005. The repertoire of G-protein-coupled receptors in fully sequenced genomes[J]. Molecular Pharmacology, 67(5): 1414-1425. |
| Herman JP, Prewitt CM, Cullinan WE. 1996. Neuronal circuit regulation of the hypothalamo-pituitary-adrenocortical stress axis[J]. Critical Reviews in Neurobiology, 10: 371-394. |
| Jones PG, Nawoschik SP, Sreekumar K, et al. 2007. Tissue distribution and functional analyses of the constitutively active orphan G protein coupled receptors, GPR26 and GPR78[J]. Biochimica et Biophysica Acta, 1770(6): 890-901. |
| Kobilka BK. 2007. G protein coupled receptor structure and activation[J]. Biochimica et Biophysica Acta, 1768 (4): 794-807. |
| Kobilka BK, Deupi X. 2007. Conformational complexity of G-protein-coupled receptors[J]. Trends in Pharmacological Sciences, 28(8): 397-406. |
| Lee DK, Nguyen T, Lynch KR, et al. 2001. Discovery and mapping of ten novel G protein-coupled receptor genes[J]. Gene, 275: 83-91. |
| Lee DK, Lynch KR, Nguyen T, et al. 2000. Cloning and characterization of additional members of the G protein-coupled receptor family[J]. Biochimica et Biophysica Acta, 1490(3): 311-323. |
| Marchese A, George SR, O'Dowd BF. 1998. Cloning of G protein-coupled receptor genes: the use of homology screening and the polymerase chain reaction[J]. New York: Wiley-Liss. |
| Palczewski K, Kumasaka T, Hori T, et al. 2000. Crystal structure of rhodopsin: a G protein-coupled receptor[J]. Science, 289(5480): 739-745. |
| Pariante CM, Miller AH. 2001. Glucocorticoid receptors in major depression: relevance to pathophysiology and treatment[J]. Biological Psychiatry, 49: 391-404. |
| Rybakowski JK, Twardowska K. 1999. The dexamethasone/corticotropin-releasing hormone test in depression in bipolar and unipolar affective illness[J]. Journal of Psychiatric Research, 33(5): 363-370. |
| Rohrer DK, Kobilka BK. 1998. G protein-coupled receptors: functional and mechanistic insights through altered gene expression[J]. Physiological Reviews, 78(1): 35-52. |
| Schertler GF, Villa C, Henderson R. 1993. Projection structure of rhodopsin[J]. Nature, 362 (6422): 770-772. |
| Tautermann CS, Seeliger D, Kriegl JM. 2015. What can we learn from molecular dynamics simulations for GPCR drug design?[J]. Computational and Structural Biotechnology Journal, 13: 112-121. |
| Underwood SL, Christoforou A, Thomson PA, et al. 2006. Association analysis of the chromosome 4p-located G protein-coupled receptor 78 (GPR78) gene in bipolar affective disorder and schizophrenia[J]. Molecular Psychiatry, 11(4): 384-394. |
| Unger VM, Hargrave PA, Baldwin JM, et al. 1997. Arrangement of rhodopsin transmembrane alpha-helices[J]. Nature, 399(6647): 203-206. |
| Xing X, Li Y, Liu H, et al. 2011. Glucose regulated protein 78 (GRP78) is overexpressed in colorectal carcinoma and regulates colorectal carcinoma cell growth and apoptosis[J]. Acta Histochemica, 113(8): 777-782. |
 2016, Vol. 35
2016, Vol. 35




