扩展功能
文章信息
- 刘海纯, 杨冬梅, 陶双伦, 谢文华, 梁静, 李俊年
- LIU Haichun, YANG Dongmei, TAO Shuanglun, XIE Wenhua, LIANG Jing, LI Junnian
- 植物氰化物对宝石上华蜗牛食物选择的影响
- Effects of Plant Cyanide on Food Selection of Cathaica (Pliocathaica) orithyia
- 四川动物, 2015, 34 (6): 910-915
- Sichuan Journal of Zoology, 2015, 34 (6): 910-915
- 10.11984/j.issn.1000-7083.20150118
-
文章历史
- 收稿日期: 2015-03-31
- 接受日期: 2015-06-08
植物与植食性动物在长期进化过程中形成了复杂的互作关系。植食性动物对植物的消耗量(consumption)超过了温带和热带生态系统产生生物量的15%,因此该类动物成为能量进入食物网的主要通道(Cyr & Pace,1993;Agrawal,2011)。为响应生产力受到的威胁和损失,植物进化出有效的化学防御对策,降低植食性动物对其的危害。植物化学防御主要通过植物产生的次生代谢物(plant secondary metabolites,PSMs)降低植食性动物的消化吸收或增加其代谢负荷,从而达到阻遏动物采食的目的;同时,植食性动物对此做出相应的行为(如趋避取食与调节食物摄入量)和生理(如解毒机制)适应以提高自身适合度(Heil,2008;Rasmann & Agrawal,2008;Wink,2008;Johnson,2011;Eskelinen et al.,2012)。因此,研究PSMs对植食性动物食物选择的影响对进一步理解和认识植物-动物系统协同进化具有重要的理论意义。
氰化物(cyanide)是广布于植物界中的一种PSMs,存在于植物叶片中,植食性动物的采食及咀嚼使叶片破碎后释放出有毒的氢氰酸(HCN)即生氰作用。CN-会抑制细胞内多种酶的活性,引起动物低血压、癫痫、昏迷、呼吸抑制、心血管虚脱和心肺衰竭等生理反应(Dart & Bogdan,2004;Gracia & Shepherd,2004;Morocco,2005),进而影响其觅食行为。羔羊会选择采食营养价值高而氰化物或单宁等PSMs含量低的食物(Villalba et al,2002)。这表明植物氰化物与植食性动物的趋避取食有关。但氰化物的合成是否源于植食性动物采食诱导所致,尚未获得一致认识。有研究认为植物中氰化物的含量在植食性动物摄食后被诱导而增加(Karban & Myers,1989;Gershenzon,1994)。但也有研究表明,植物中的氰化物不是一种诱导性防御化合物(Hayden & Parker,2002;Majumdar et al.,2004)。因而,有必要进一步检验植食性动物的采食能诱导植物合成氰化物的假设。
宝石上华蜗牛Cathaica(Pliocathaica) orithyia是湘西地区常见物种,食谱单一,易于观察,且便于室内饲养,因此将其作为研究植食性动物食物选择的材料。三叶草属Trifolium是该蜗牛食谱中常见的植物种类。三叶草是一种生氰植物(Dirzo & Harper,1982),主要有白三叶草T. repens和红三叶草T. pratense 2种类型,白三叶草叶片中氰化物含量大于120 μg·g-1(Jones,1966;Crush & Caradus,1995),红三叶草与白三叶草形态相似,营养成分相近,但叶片中的氰化物含量相对较低(Antoun et al.,1998)。本研究在野外围栏和实验室内分别测定宝石上华蜗牛对2种三叶草的选择性,以及宝石上华蜗牛的采食对2种三叶草再生叶片氰化物含量的诱导,并分析此氰化物含量的变化对实验个体采食量的影响,旨在验证植物氰化物能影响植食性动物的食物选择,以及植食性动物的采食能诱导植物合成氰化物的假设,以期丰富动植物间协同进化理论的内容。
1 材料与方法 1.1 实验材料宝石上华蜗牛2011年3月5日捕获于吉首大学生态研究所附近草丛,带回室内,置于木箱(50 cm× 30 cm×20 cm)内饲养。木箱底层铺2 cm厚,经阳光曝晒过的细沙,室温20 ℃±2 ℃,细沙湿度60%~75%,空气相对湿度75%~95%,模拟宝石上华蜗牛潮湿、黑暗的生活环境。每天供给新鲜的白菜叶和黄瓜块。
选择直径21.0 cm、深度17.2 cm的花盆40个,有机肥拌土装满盆,将其平均分成2组,每组20盆。分别播种红三叶草和白三叶草种子(贵州贵大神龙科技有限责任公司),每天18∶ 00浇水至泥土浸湿为止,待三叶草植株长至7~10 cm时用于实验。在吉首大学生态研究所实验地整理2块实验地(5 m × 5 m)种植2种三叶草,进行浇水和除草,并施以一定量有机肥,以供测定宝石上华蜗牛食物摄入量所需的三叶草。
1.2 食物选择的测定 1.2.1 野外围栏下氰化物对宝石上华蜗牛食物选择的影响野外围栏食物选择试验在吉首大学生态研究所实验地进行,观测样地5 m×5 m,清除地表植物,周围用尼龙纱网围起来。将20盆种植有红三叶草和白三叶草的花盆(各10盆)随机摆放于观测样地,样地阳光充足,通风良好。将50只体质量3.00 g左右的健康宝石上华蜗牛放入观测样地,每 日07∶ 30—08∶ 30观测蜗牛对2种三叶草的采食情况,持续3 d。三叶草植株按被取食和未被取食进行记录: 若叶片表面有咬痕,则确定该植株被取食;若叶片无咬痕,则确定该植株未被取食。将实验中被蜗牛取食后的三叶草植株花盆移出,更换以新的同种三叶草植株花盆。定义取食强度为:该种植物中被取食植株占总植株的百分比,即取食强度=被取食植株数/总植株数×100%。
将第1次被蜗牛取食后的三叶草植株花盆移于实验支架平台,每天浇水,平台周围用尼龙纱网围起来,确保蜗牛和其他动物无法采食。7 d后待三叶草植株重新长出新叶片,将花盆再次移入观测样区。每日07∶ 30—08∶ 30观测蜗牛对三叶草植株叶片的第2次采食情况,持续3 d,记录蜗牛对2种三叶草的采食情况。
1.2.2 氰化物对宝石上华蜗牛采食量的影响选取10只健康的宝石上华蜗牛,直径(2.0±0.3)cm,体质量(3.00±0.50)g,随机单个放入10个饲养箱中。采摘未经蜗牛采食的红三叶草和白三叶草完整叶片进行第1次采食量测定。将叶片表面清洗并擦拭干净,分别投入上述饲养箱,每个饲养箱同时投放红三叶草和白三叶草各0.30 g±0.01 g。实验期间保持蜗牛生活环境的阴暗潮湿。每天08∶ 30—09∶ 30更换三叶草叶片,将剩下未被取食的三叶草叶片用干净纱布轻轻擦去表面附着物或用水清洗干净并用滤纸吸干水分,称量蜗牛取食后剩余叶片质量,持续3 d。同时,将采集的新鲜红三叶草和白三叶草完整叶片各0.30 g±0.01 g放入无蜗牛的饲养箱内作为对照实验,1 d后称量箱内剩余的2种三叶草的质量,以计算每种三叶草的自然失水率。另外采摘自然条件下蜗牛第1次采食后的三叶草进行第2次采食量测定,测定方法同上。宝石上华蜗牛对三叶草的采食量=(A-B)/(1-C),其中,A为当日三叶草的投放量,B为三叶草的剩余量,C为失水率。C=(D-E)/D×100%,其中,D为对照实验中三叶草的投放量,E为对照实验中三叶草的剩余量。
1.3 三叶草叶片中氰化物的测定分别采集自然条件下蜗牛第1次采食三叶草前、采食后,以及第2次采食后的三叶草叶片6.00~7.00 g,立即放入自封袋中,于冰盒中保存并带回实验室,置于-20 ℃冰箱保存,供以后测试分析。
准确称取红三叶草和白三叶草叶片各0.50 g,用干净纱布轻轻擦去样本表面的附着物或用水清洗干净并用滤纸吸干水分,剪碎,放入5 mL PE离心管,加入1.5 mL磷酸缓冲液(pH5.6),使用内切式匀浆机匀浆40 s。4 ℃,5000 r/min离心15 min,取上清液1 mL。按照中华人民共和国国家标准GB/T 7486—1987(国家环境保护局,1990)测定三叶草中氰化物含量。
1.4 数据分析采用SPSS 17.0进行数据统计和分析。用χ2检验分析野外围栏条件下三叶草中氰化物对宝石上华蜗牛食物选择的影响。用独立样本t检验分析实验室条件下三叶草中氰化物对蜗牛采食量的影响以及蜗牛取食前后白三叶草和红三叶草叶片中氰化物的差异。数据均以平均值±标准差(Mean±SD)表示,统计显著水平为0.05。
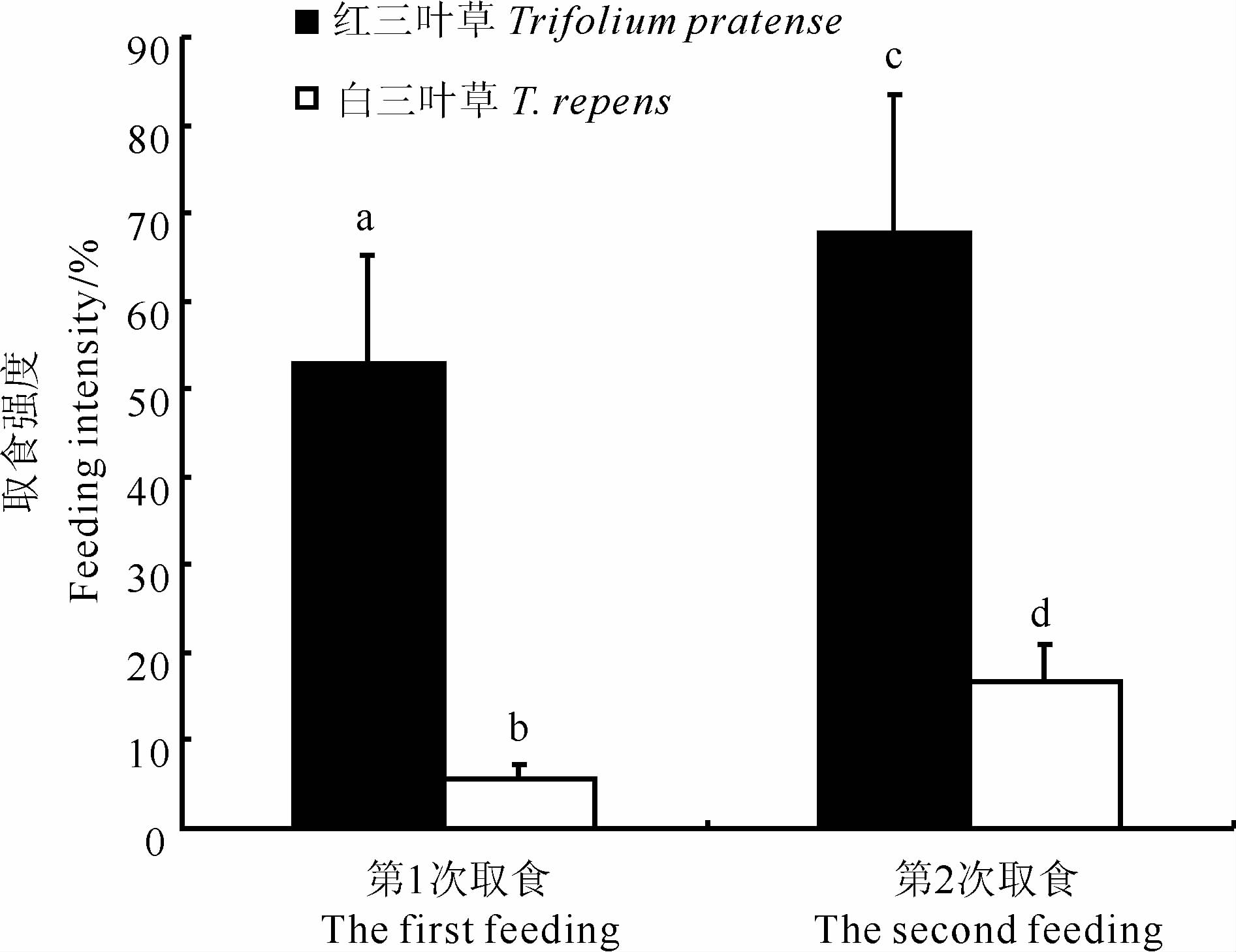
2 结果 2.1 野外围栏下氰化物对宝石上华蜗牛食物选择的影响野外围栏条件下,宝石上华蜗牛在2次取食中对红三叶草植株的取食比例均显著高于白三叶草植株(第1次取食:χ2=53.11,P < 0.001;第2次取食:χ2=54.80,P < 0.001)。相比第1次取食,蜗牛第2次取食的红三叶草植株和白三叶草植株比例均显著增加(红三叶草:χ2=4.70,P=0.03;白三叶草:χ2=5.94,P=0.015),分别升高28.43%和197.67%(图 1)。
|
|
图 1 野外围栏下宝石上华蜗牛取食三叶草植株情况
Fig. 1 Clovers were eaten by Cathaica (Pliocathaica) orithyia under field enclosures
图中不同字母表示差异有统计学意义(P<0.05),下图同。 Different letters mean there is significant difference (P < 0.05), the same below. |
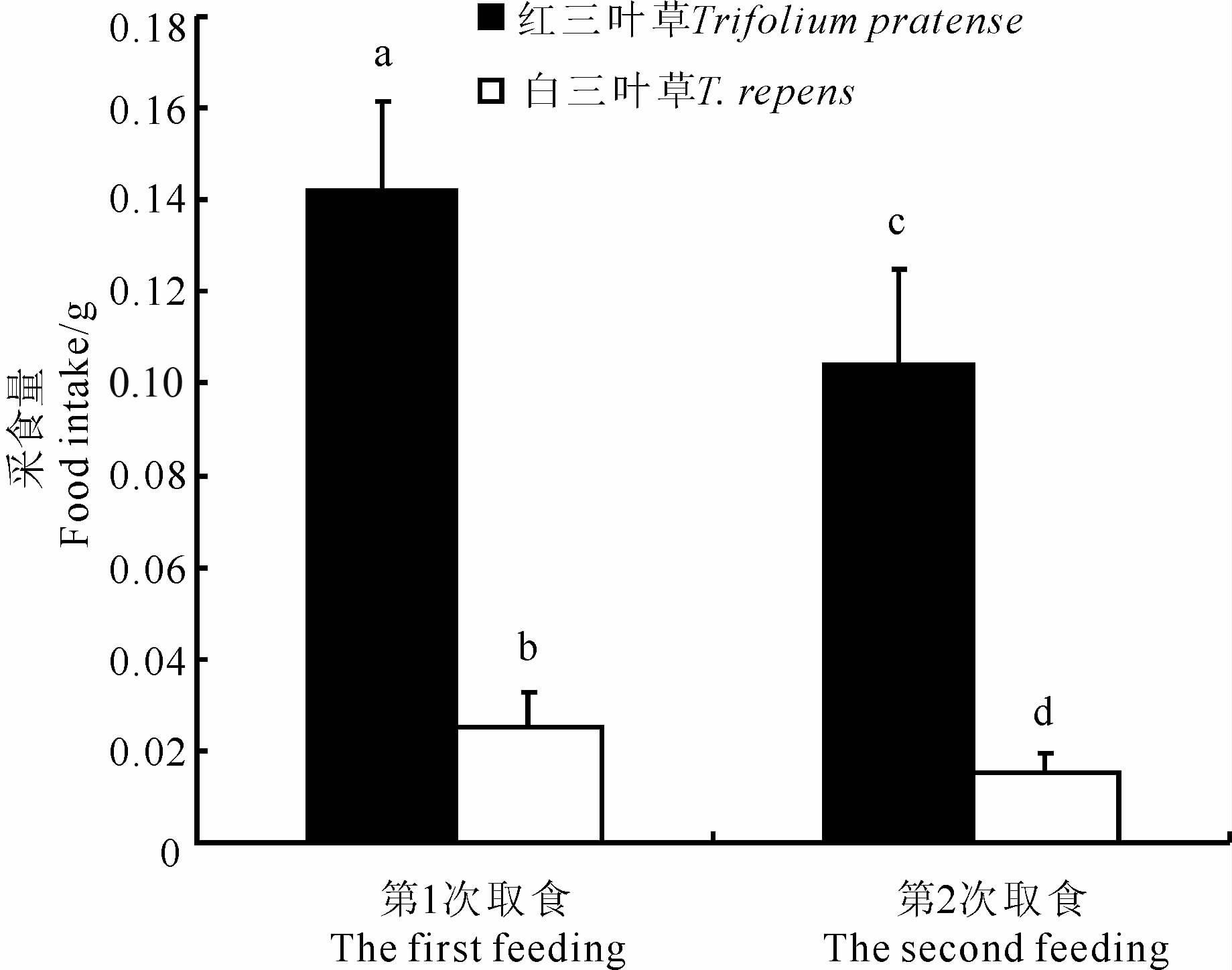
实验室条件下,宝石上华蜗牛在2次取食中,对红三叶草的采食量均显著高于白三叶草(第1次取食:t=17.63,P<0.001;第2次取食:t=13.17,P<0.001)。同时,宝石上华蜗牛对红三叶草和白三叶草的第2次采食量均比第1次显著下降(红三叶草:t=4.19,P=0.001;白三叶草:t=3.70,P=0.002)分别减少36.54%和65.36%(图 2)。
|
| 图 2 实验室条件下宝石上华蜗牛对三叶草的采食量 Fig. 2 Food intake of Cathaica (Pliocathaica) orithyia on clover leaves under lab conditions |
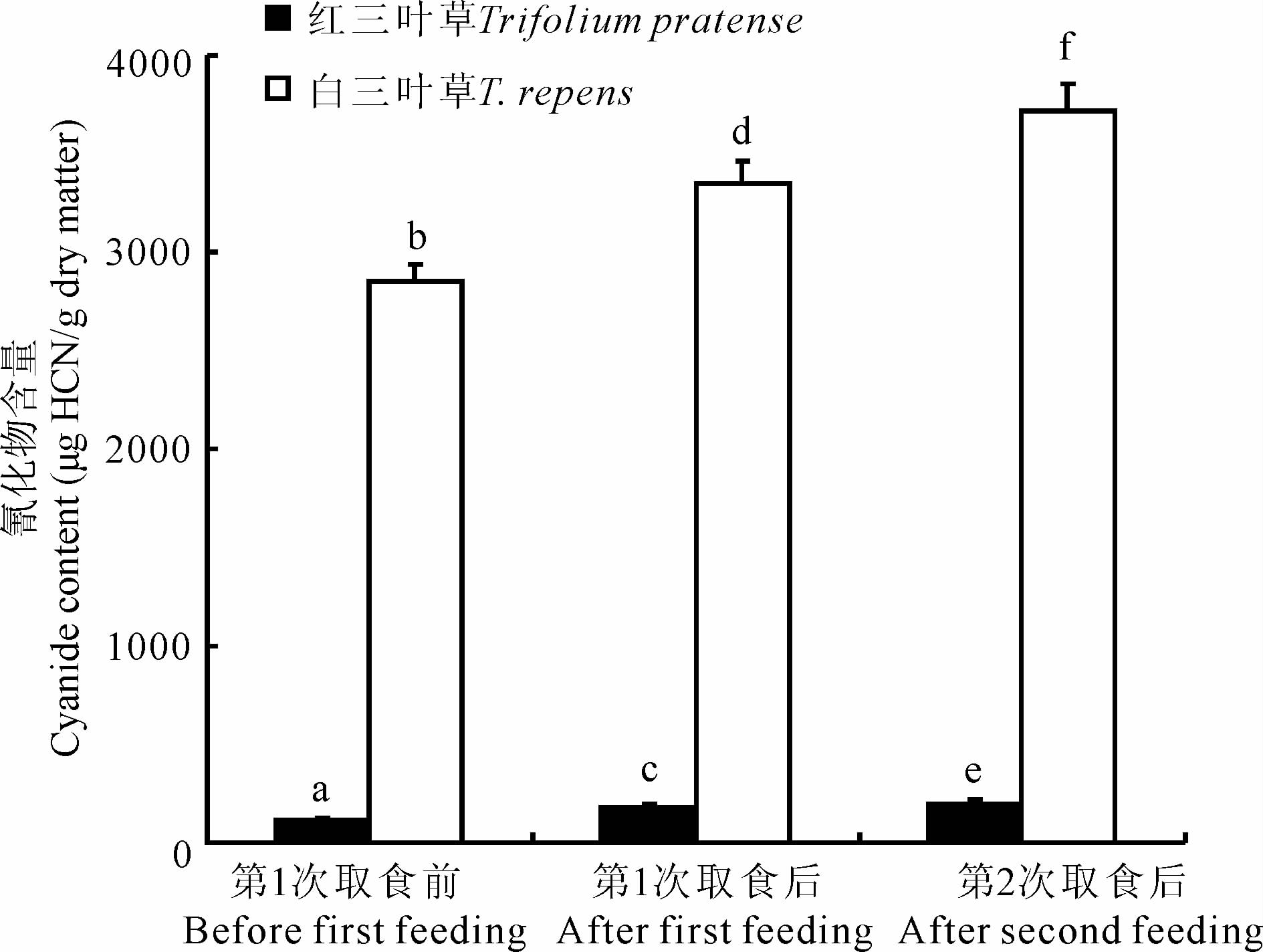
第1次取食前白三叶草叶片中氰化物含量显著高于红三叶草(t=99.33,P<0.001)。相比于第1次取食前,取食后红三叶草和白三叶草叶片中氰化物含量分别升高61.17%和17.48%(红三叶草:t=8.60,P<0.001;白三叶草:t=10.88,P<0.001)。相比于第1次取食后,第2次取食后红三叶草叶片和白三叶草叶片中氰化物含量分别升高11.39%和11.21%(红三叶草:t=2.25,P=0.036;白三叶草:t=6.95,P<0.001)(图 3)。
|
| 图 3 三叶草叶片中氰化物含量 Fig. 3 The contents of cyanide in clover leaves |
氰化物为典型的质量性防御化合物,在植物中含量甚微,但能严重损害动物的生理功能甚至致死(Provenza & Balph,1990)。植食性动物采食生氰植物后则立即做出响应,以防止过多采食而中毒。本研究结果表明,无论在野外围栏还是在实验室条件下,同时供给宝石上华蜗牛2种三叶草时,该蜗牛均较多采食氰化物含量较低的红三叶草,而避食氰化物含量较高的白三叶草(图 1,图 2),该结果与Jones(1966)对大蜗牛Helix aspersa和小蜗牛Arianta arbustorum等的研究结果相似,他们以氰化物含量不同的百脉根Lotus corniculatus为实验材料,观察到不同种类的蜗牛均偏爱取食氰化物含量较少的百脉根。根据条件性气味回避假说(conditioned flavor aversion),植食性动物能通过食物滋味(气味与味道)与其摄入后反馈的联系识别植物毒素(Sahley et al.,1981;Provenza et al.,1998)。许多PSMs有着独特的滋味,其中含氰化物的植物具有苦味(Jones,1998),含酚类化合物的植物具有涩味(Sorensen et al.,2005)。植食性动物可依据PSMs的毒性和滋味选择食物,调整其摄食量。蛞蝓Arion hortensis通过尝食,减少摄食含PSMs的植物(Horrill & Richards,1986)。本研究发现,宝石上华蜗牛对三叶草的第2次采食量显著降低(图 2)。Saucy等(1999)和Viette等(2000)研究结果表明,水 Arvicola terrestris偏爱取食非生氰品种的三叶草,而避食生氰品种的三叶草,仅供给生氰食物时其食物摄入量显著下降,同时体质量也明显降低;并且Saucy等(1999)以黑蛞蝓Arion ater为补充实验,得到类似的结果。因此,生氰植物中的氰化物能有效阻遏植食性动物对其的采食,也进一步说明动物可通过趋避取食和减少摄食量的行为机制调节植物毒素的摄入。
当同时提供白三叶草和红三叶草时,在第2次测定中,宝石上华蜗牛并没有单一摄食氰化物含量低的红三叶草,而对2种三叶草均有不同程度的摄食(图 1,图 2)。我们的研究结果与其他类似研究(Whitman,1973;Charlton,1978;Dirzo & Harper,1982)结果相符,说明虽然生氰植物通常比非生氰植物被植食性动物采食的频率低,但生氰作用并不能完全阻遏蜗牛对三叶草的采食。植物氰化物的毒性取决于动物摄入体内的CNˉ量及其对CNˉ解毒速率的平衡(Makkar et al.,2007)。然而,在自然界中并非所有的生氰植物在受到植食性动物采食时均能释放足够的CNˉ使动物中毒身亡(Gleadow & Woodrow,2002)。例如,白三叶草中氰化物的量能造成羊的甲状腺肿大,生长发育迟缓,但不会引起急性中毒(Provenza et al.,1992)。同时,一些植食性动物在长期进化过程中已形成了对氰化物的解毒酶(β-氰丙氨酸合酶或硫氰酸酶),能将吸收入体内的CNˉ降解为丝氨酸、半胱氨酸或硫氰酸盐(Baumeister et al.,1975;Urbańska et al.,2002;Ballhorn et al.,2009),从而获得对氰化物的耐受性和适应性。由此可见,植物氰化物对蜗牛摄食的防御作用是相对的,宝石上华蜗牛可能也相应地通过调节觅食行为对策避食氰化物含量高的植物,同时结合机体的解毒作用降低氰化物对其的生理毒害,有关其生理解毒机制需进一步研究。
诱导性防御是植物对植食性动物的一种重要防御策略,在植物-植食性动物协同进化中起着重要的作用(Agrawal et al.,1999;Johnson,2011)。植物被植食性动物采食后,可通过增加有毒PSMs的含量,影响动物的消化、代谢、生殖及免疫等生理机制,从而阻遏动物的摄食(Karban & Myers,1989;王燕等,2001)。在本研究中,实验个体取食三叶草后,2种三叶草叶片中氰化物的含量均显著升高(图 3),说明植食性动物的采食能诱导植物合成氰化物(这可能是导致蜗牛第2次采食量降低的原因)。但Hayden和Parker(2002)发现,大蜗牛摄食白三叶草后,受损叶片中的氰化物含量并没有增加。此类研究结果不一致可能与植食性动物的种间差异有关。此外,植物防御性化合物的诱导通常需特定的化学信号(Raffa,1991),植物中的氰化物含量易受干旱、温度、纬度、土壤含盐度等外界因子的影响(Hayden & Parker,2002;Ballhorn & Elias,2014),因此,不同外界条件刺激也可能会影响防御特性的表达及其幅度。我们还发现,自然条件下宝石上华蜗牛第2次取食红三叶草或白三叶草植株比例均显著高于第1次取食比例(图 1),可能是其摄食三叶草叶片后,叶片中氰化物含量增加导致适口性下降,而通过持续品尝以找到适口的叶片,满足其能量需求。
综上所述,三叶草中的氰化物能有效阻遏宝石上华蜗牛对其采食,同时蜗牛的采食能诱导三叶草中氰化物的合成。本实验还表明了宝石上华蜗牛通过趋避取食和减少摄食量的行为反馈机制以提高个体适合度,而其体质量和内脏器官是否会受氰化物的影响需要进一步研究,以便探索氰化物对植食性动物生理生态特征的作用机制,为深入研究动植物间协同进化提供理论依据。
| 国家环境保护局. 1990. 水质 氰化物的测定, GB/T 7486-1987, GB/T 7487-1987[C]// 环境保护国家标准汇编. 北京: 中国标准出版社. |
| 王燕, 戈峰, 李镇宇. 2001. 马尾松诱导化学物质变化的时空动态[J]. 生态学报, 21(8): 1256-1261. |
| Agrawal AA. 2011. Current trends in the evolutionary ecology of plant defence[J]. Functional Ecology, 25(2): 420-432. |
| Agrawal AA, Tuzun S, Bent E. 1999. Induced plant defenses against pathogens and herbivores: biochemistry, ecology, and agriculture[M]. Saint Paul: APS Press. |
| Antoun H, Beauchamp CJ, Goussard N, et al. 1998. Potential of Rhizobium and Bradyrhizobium species as plant growth promoting rhizobacteria on non-legumes: effect on radishes (Raphanus sativus L.)[J]. Plant and Soil, 204(1): 57-67. |
| Ballhorn DJ, Elias JD. 2014. Salinity-mediated cyanogenesis in white clover (Trifolium repens) affects trophic interactions[J]. Annals of Botany, 114(2): 357-366. |
| Ballhorn DJ, Kautz S, Rakotoarivelo FP. 2009. Quantitative variability of cyanogenesis in Cathariostachys madagascariensis-the main food plant of bamboo lemurs in southeastern Madagascar[J]. American Journal of Primatology, 71(4): 305-315. |
| Baumeister R, Schievelbein H, Zickgraf-Rüdel G. 1975. Toxicological and clinical aspects of cyanide metabolism[J]. Arzneimittel-forschung, 25(7): 1056-1064. |
| Charlton JFL. 1978. Slugs as a possible cause of establishment failure in pasture legumes oversown in boxes[J]. New Zealand Journal of Experimental Agriculture, 6(4): 313-317. |
| Collins T. 2000. Inducible plant defenses against pathogens and herbivores: biochemistry, ecology, and agriculture[J]. Ecological Entomology, 25(4): 497. |
| Crush JR, Caradus JR. 1995. Cyanogenesis potential and iodine concentration in white clover (Trifolium repens L.) cultivars[J]. New Zealand Journal of Agricultural Research, 38(3): 309-316. |
| Cyr H, Pace ML. 1993. Magnitude and patterns of herbivory in aquatic and terrestrial ecosystems[J]. Nature, 361(6408): 148-150. |
| Dart RC, Bogdan GM. 2004. Acute cyanide poisoning: causes, consequences, recognition and management[J]. Frontline First Responder, 2(3): 19-22. |
| Dirzo R, Harper JL. 1982. Experimental studies on slug-plant interactions: III. Differences in the acceptability of individual plants of Trifolium repens to slugs and snails[J]. The Journal of Ecology, 70(1): 101-117. |
| Eskelinen A, Harrison S, Tuomi M. 2012. Plant traits mediate consumer and nutrient control on plant community productivity and diversity[J]. Ecology, 93(12): 2705-2718. |
| Gershenzon J. 1994. Metabolic costs of terpenoid accumulation in higher plants[J]. Journal of Chemical Ecology, 20(6): 1281-1328. |
| Gleadow RM, Woodrow IE. 2002. Mini-review: constraints on effectiveness of cyanogenic glycosides in herbivore defense[J]. Journal of Chemical Ecology, 28(7): 1301-1313. |
| Gracia R, Shepherd G. 2004. Cyanide poisoning and its treatment[J]. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy, 24(10): 1358-1365. |
| Hayden KJ, Parker IM. 2002. Plasticity in cyanogenesis of Trifolium repens L.: inducibility, fitness costs and variable expression[J]. Evolutionary Ecology Research, 4(2): 155-168. |
| Heil M. 2008. Indirect defence via tritrophic interactions[J]. New Phytologist, 178(1): 41-61. |
| Horrill JC, Richards AJ. 1986. Differential grazing by the mollusc Arion hortensis Fer. on cyanogenic and acyanogenic seedlings of white clover, Trifolium repens L.[J]. Heredity, 56(2): 277-281. |
| Johnson MTJ. 2011. Evolutionary ecology of plant defences against herbivores[J]. Functional Ecology, 25(2): 305-311. |
| Jones DA. 1966. On the polymorphism of cyanogenesis in Lotus corniculatus. I. selection by animals[J]. Canadian Journal of Genetics and Cytology, 8(3): 556-567. |
| Jones DA. 1998. Why are so many food plants cyanogenic?[J]. Phytochemistry, 47(2): 155-162. |
| Karban R, Myers JH. 1989. Induced plant responses to herbivory[J]. Annual Review of Ecology and Systematics, 20(1): 331-348. |
| Majumdar S, De KK, Banerjee S. 2004. Influence of two selective factors on cyanogenesis polymorphism of Trifolium repens L. in Darjeeling Himalaya[J]. Journal of Plant Biology, 47(2): 124-128. |
| Makkar HPS, Siddhuraju P, Becker K. 2007. Cyanogenic Glucosides/Cyanogens[M].// Makkar HPS, Siddhuraju P, Becker K. Plant secondary metabolites. New York: Humana Press: 61-65. |
| Morocco AP. 2005. Cyanides[J]. Crit Care Clin, 21(4): 691-705. |
| Provenza FD, Balph DF. 1990. Applicability of five diet-selection models to various foraging challenges ruminants encounter[M]// Hughes RN. Behavioural mechanisms of food selection. Berlin Heidelberg: Springer: 423-460. |
| Provenza FD, Pfister JA, Cheney CD. 1992. Mechanisms of learning in diet selection with reference to phytotoxicosis in herbivores[J]. Journal of Range Management, 45(1): 36-45. |
| Provenza FD, Villalba JJ, Cheney CD, et al. 1998. Self-organization of foraging behaviour: from simplicity to complexity without goals[J]. Nutrition Research Reviews, 11(2): 199-222. |
| Raffa KF. 1991. Induced defensive reactions in conifer-bark beetle systems[M]// Douglas W Tallamy & Michael J Raupp. Phytochemical Induction by Herbivores John Wileg & Sons Inc: 245-276. |
| Rasmann S, Agrawal AA. 2008. In defense of roots: a research agenda for studying plant resistance to belowground herbivory[J]. Plant Physiology, 146(3): 875-880. |
| Sahley C, Rudy JW, Gelperin A. 1981. An analysis of associative learning in a terrestrial mollusc[J]. Journal of Comparative Physiology, 144(1): 1-8. |
| Saucy F, Studer J, Aerni V, et al. 1999. Preference for acyanogenic white clover (Trifolium repens) in the vole Arvicola terrestris: I. Experiments with two varieties[J]. Journal of Chemical Ecology, 25(6): 1441-1454. |
| Sorensen JS, Heward E, Dearing MD. 2005. Plant secondary metabolites alter the feeding patterns of a mammalian herbivore (Neotoma lepida)[J]. Oecologia, 146(3): 415-422. |
| Urbańska A, Leszczyński B, Matok H, et al. 2002. Cyanide detoxifying enzymes of bird cherry-oat aphid[J]. Electronic Journal of Polish Agricultural Universities, Biology, 5(2): 1-4. |
| Viette M, Tettamanti C, Saucy F. 2000. Preference for acyanogenic white clover (Trifolium repens) in the vole Arvicola terrestris. II. Generalization and futher incestigations[J]. Chemical Ecology, 26(1): 101-122. |
| Villalba JJ, Provenza FD, Bryant JP. 2002. Consequences of the interaction between nutrients and plant secondary metabolites on herbivore selectivity: benefits or detriments for plants?[J]. Oikos, 97(2): 282-292. |
| Whitman RJ. 1973. Herbivore feeding and cyanogenesis in Trifolium repens L.[J]. Heredity, 30(2): 241-244. |
| Wink M. 2008. Plant secondary metabolism: diversity, function and its evolution[J]. Natural Product Communications, 3(8): 1205-1216. |
 2015, Vol.
2015, Vol. 




